携带Rep1风险位点的帕金森病患者血液mRNA表达差异研究
夏 欢, 罗 琴, 杨新玲
(新疆医科大学附属肿瘤医院1核医学科, 2综合内科一病区, 乌鲁木齐 830011; 3新疆医科大学第二附属医院神经内科, 乌鲁木齐 830000)
携带Rep1风险位点的帕金森病患者血液mRNA表达差异研究
夏 欢1, 罗 琴2, 杨新玲3
(新疆医科大学附属肿瘤医院1核医学科,2综合内科一病区, 乌鲁木齐 830011;3新疆医科大学第二附属医院神经内科, 乌鲁木齐 830000)
目的 探索携带SNCA基因(synuclein alpha)Rep1风险位点的帕金森病(Parkinson’s disease,PD)患者外周血基因表达差异。方法 采用聚合酶链反应(Polymerase Chain Reaction,PCR)结合直接测序法检测128例维吾尔族帕金森病人(PD组)及160例维吾尔族健康体检者(对照组)SNCA启动子区Repl多态性,并按照PD患者年龄差异进行分组比较,年龄≤50岁为EOPD组,年龄>50岁为LOPD组。进一步筛选携带Rep1风险位点的3例PD患者及3例非携带健康体检者,用Trizol提取外周血总RNA,分别与Illumina表达谱芯片进行杂交实验。结果 EOPD组与年龄相匹配的对照组比较,Rep1位点CA碱基重复12次(2型等位基因)的频率分别为21.4%、6.9%,差异具有统计学意义(χ2=12.67,P=0.00)。与对照组比较,EOPD患者外周血中差异表达2倍以上的基因有359条,包括SNCA基因在内的122条表达上调2倍以上。其中与SNCA基因表达异常有关的多巴胺代谢和胆碱能突触信号通路改变最显著(FE=3.64,P=0.046;FE=5.57,P=0.005)。结论 Repl位点2型等位基因与EOPD的发生有关,携带该位点2型等位基因患者外周血SNCA表达异常升高。
帕金森病; α突触核蛋白基因; Rep1多态性
帕金森病(Parkinson’s disease,PD)属于一种常见的神经变性疾病[1],以黑质纹状体通路的多巴胺神经元选择性变性、缺失、嗜酸性包涵体(Lewy小体)形成为病理特征[2-3]。α突触核蛋白基因(SNCA,synuclein alpha)表达增高引起α-synuclein蛋白的异常聚集是该嗜酸性包涵体形成的主要机制。既往研究提示该基因Rep1位点的长度多态性与欧洲人群SNCA基因表达差异有关[4-5]。Rep1位点位于基因的启动子区,其长度的变异可通过调节SNCA启动子转录活性而影响PD的患病风险[6]。相关研究探讨了Repl多态性与散发性PD患病风险的关系,但结果也不完全一致[7-9]。因此本研究探讨研究SNCA基因Rep1位点多态性与PD发病的相关性,并为进一步利用基因芯片技术探索Repl风险位点携带者外周血基因表达的差异提供依据。
1 对象与方法
1.1 一般资料及分组 以新疆医科大学第二附属医院2013年6月-2015年4月经神经内科专家确诊的维吾尔族PD患者128例(PD组)为研究对象,以英国脑库制定的方案作为PD诊断的标准[10],PD组患者发病年龄为45~85岁,平均(63.5±12.2)岁,其中年龄≤50岁为早发型帕金森病组(Early-onset Parkinson’s Disease,EOPD组),年龄>50岁即晚发型帕金森病组(Late-onset Parkinson’s Disease,LOPD组)。对照组为该地区年龄、性别、民族相匹配的160例无PD临床表现及PD家族史的健康体检者,年龄49~ 82岁,平均(64.0±10.5)岁。
1.2 DNA提取及PCR扩增 抽取外周静脉血2 mL,利用DNA提取试剂盒(非离心柱型,上海天根生物有限公司),按照说明书提取静脉血中有核细胞的全基因组DNA。SNCA基因上下游引物的序列分别为F:5′-CCTGGCATATTTGATTGCAA-3′,R:5′-GACTGGCCCAAGATTAACCA-3′。20 μL体积的PCR扩增反应体系包括100 ng/μL的上下游引物(各为0.5 μL,上海天根生物有限公司合成)、10 μL 的2×Power Taqman masterMix(北京百泰克生物技术有限公司)、2.0 μL的50 ng/μL DNA,剩余7.0 μL体积由ddH2O补充,PCR扩增反应的退火温度为58.7℃。所有PCR产物被送至上海生工股份有限公司直接测序检测。
1.3 总RNA的提取和纯化 为进一步研究EOPD组2型等位基因对SNCA基因表达的影响,随机抽取3例含2型等位基因的EOPD患者,基因型分别为2/2、1/2、1/2,3例≤50岁不含2型等位基因的对照组患者,基因型分别为0/0、0/0、0/1。6例受试者取清晨空腹外周静脉血8.0 mL,使用美国Sigma-Aldrich公司的淋巴细胞分离液Histopaque®-1077,于4.0 h 内分离标本中的单核淋巴细胞。用Trizol(Invitrogen, Carlsbad, CA)裂解外周血单核细胞,然后氯仿洗涤,使用异丙醇沉淀混合液中的RNA,70%乙醇洗涤2次,最后以无RNase水溶解沉淀。用美国2100-Bioanalyzer芯片分析软件(Agilent Technologies, California, USA)对总RNA进行定量检测,要求A260/280(吸光度) nm≥1.8,28 S/18 S≥1.0,保存于-80℃的恒温冰箱中。
1.4 芯片的杂交和洗涤 取RNA逆转录的cDNA(1.5 μg)混合于无RNARase的20 μL杂交液GEX-HBY中(美国,Illumina公司,California),取上述混合液分别上样于基因芯片Human Expression Bead Chip中(美国,Illumina公司,California),58.0℃的杂交槽中反应16~20 h。取Illumina芯片配套试剂液E1BC溶液250 mL(美国,Illumina公司,California),依次在55.0℃条件下充分洗涤10 min,室温20℃环境下洗涤5 min,然后利用Illumina Bead Chip Reader软件(美国,Illumina公司,California)读取芯片数据并捕捉图像,该实验过程由上海晶能生物技术有限公司完成。
1.5 统计学处理 采用SPSS19.0软件对数据进行处理分析,各组间基因型及等位基因频率差异比较运用卡方检验,连续性变量比较运用t检验或方差分析。利用R软件(http://www.r-project.org)进行t检验,计算基因芯片结果的P值和各基因的表达倍数值(Fold change,FC)及所有差异基因的富集指数(Fold enrichment,FE),并统计具有差异的KEGG pathway(P<0.05)。基因芯片数据分析由上海晶能生物技术有限公司完成。
2 结果
2.1 遗传平衡检验 经Hardy-Weinberg定律检验,对照组和PD组Rep1位点基因型分布差异无统计学意义(χ2=0.67,P=0.48;χ2=1.16,P=0.36),两组数据的吻合度良好,具有可比性。
2.2 PCR琼脂糖凝胶结果 PCR 扩增产物的理论值为267 bp,电泳显示结果如图1所示,随机6个DNA样品PCR 扩增片段均在200~300 bp的范围内。
2.3 基因型和等位基因频率的差异 根据既往研究的命名方法将SNCA基因Rep1位点CA重复次数10、11、12次的等位基因分别命名为等位基因0、1、2[11-12]。PD组与对照组各基因型及等位基因频率差异无统计学意义(χ2=2.43,P=0.30;χ2=4.28,P=0.51);EOPD组和年龄≤50岁对照组2型等位基因频率分别为21.4%、6.9%,EOPD组2型等位基因频率高于年龄≤50岁对照组,两组比较差异具有统计学意义(χ2=12.67,P=0.00); LOPD组与年龄相匹配对照组比较,等位基因分布差异无统计学意义(χ2=2.23,P=0.41),结果见表1、2。
M: Marker; 1~6: PCR扩增产物

组别例数等位基因0等位基因1等位基因2χ2值P值对照组16099(30.9)200(62.5)21(6.6)2.430.30PD组12868(26.6)164(64.1)24(9.4)≤50岁对照组3622(30.6)45(60.5)5(6.9)12.670.00EOPD组2812(21.4)32(57.1)12(21.4)>50岁对照组12477(31.0)155(62.5)16(6.5)2.230.41LOPD组10056(28.2)132(66.7)12(5.1)
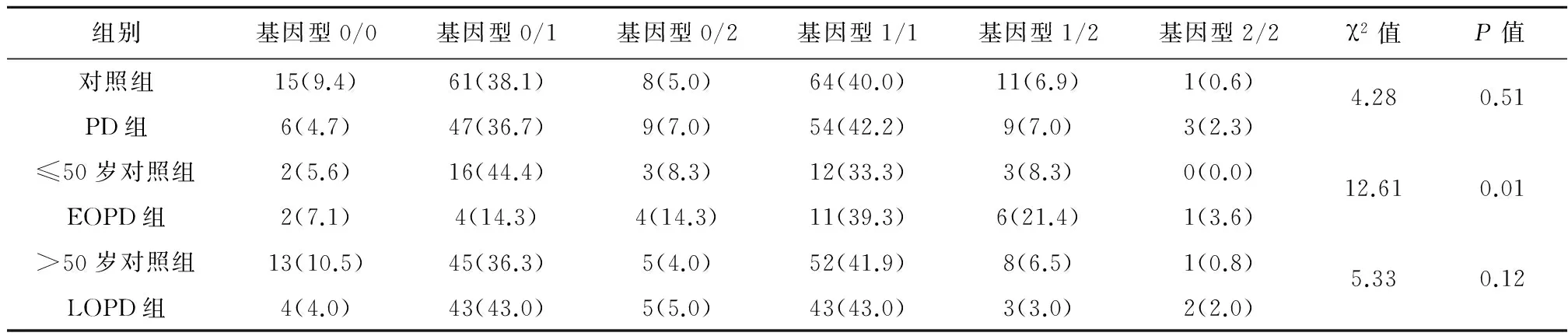
表2 Rep1位点各基因型频率差异的比较/例(%)
2.4 表达差异的基因 基因芯片结果显示17 684条基因(47.3%)有表达差异,其中359条基因表达差异的倍数FC达到2.0倍以上,该差异基因结果显示122条表达上调(36.6%),237条表达下调(63.4%),EOPD与对照组SNCA比较差异有统计学意义(P=0.02,FC=2.59)(图2),EOPD组中SNCA基因显示为红色,对照组为绿色,红色代表基因表达上调2倍以上,差异具有统计学意义(P<0.05)(图3)。
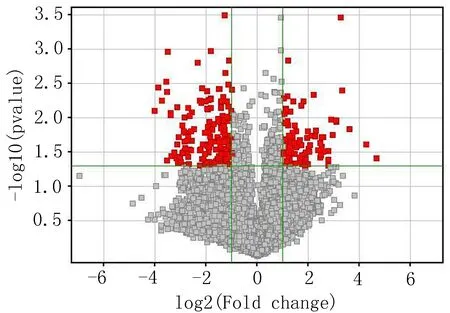
注:红色代表有统计学差异的基因区域
2.6 KEGG pathway富集度分析 与对照组比较,EOPD组多巴胺突触通路、胆碱能突触通路、GABA能突触通路及谷氨酸能突触通路的差异有统计学意义(FE=3.64,P=0.046;FE=5.57,P=0.005;FE=4.06,P=0.035;FE=5.19,P=0.019),上述4个生物学通路均涉及神经系统多个代谢类别,与增加PD的发病风险有关(图4)。
3 讨论
PD是第二大中枢神经系统变性疾病,主要病理改变是SNCA基因编码的a-synuclein异常聚集在黑质DA能神经元导致后者变性缺失。Repl为SNCA基因启动子区的双核苷酸重复变异,在该研究中,维吾尔族PD组及对照组的2型等位基因的携带率分别为9.4%、6.6%,差异无统计学意义(χ2=2.43,P=0.30)。按年龄分层比较显示,EOPD组等位基因2频率(21.4%)显著高于年龄≤50岁对照组的6.9%(χ2=12.67,P=0.00),与Mellick等[12]的结果基本一致。同时Gatto等[13]和Wang等[14]以亚洲人群为研究对象也得出相似的研究结果,即该基因的2型等位基因携带者患PD的风险显著增加。

注:1~3为EOPD组;4~6为对照组。基因表达上调显示为红色,反之为绿色,其中SNCA基因在EOPD组中表达上调差异达到2倍以上。
图3 表达差异基因的聚类分析图
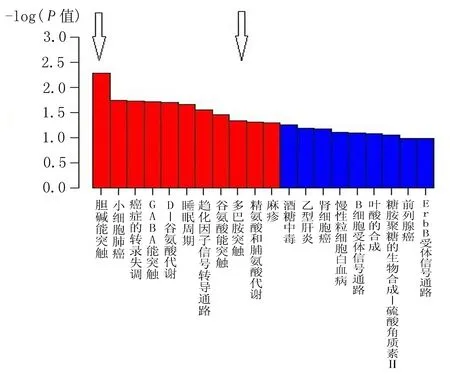
注:红色柱对应显著的 Pathway 通路,蓝色柱为不显著的 pathway 通路
图4 KEGG pathway 富集分析图
Rep1位点2型等位基因较其它等位基因长度增加,该变异可产生一个新的转录结合位点,提高转录因子与SNCA基因启动子的结合能力[7],导致内源性a-synuclein蛋白的含量增加,为该蛋白进一步聚集提供基础,因此2/2型携带者患PD的风险显著增加[15],这也与本研究结果相一致。
为进一步探索年龄≤50岁人群2型等位基因与PD患病的相关性,本课题组利用基因芯片技术,筛选3例维吾尔族PD患者和3例维吾尔族对照比较,结果显示359条表达差异具有统计学意义的基因,122条基因表达上调(36.6%),有237条表达下调(63.4%)。同时这些表达上调的基因中包含与PD发生密切相关的SNCA基因(FC=2.59,P=0.02)。既往研究结果表明,a-synuclein蛋白广泛存在于外周血及脑脊液中,且可能与PD的病情进展相关,但结论尚不完全一致[16]。本研究证实了SNCA基因在PD患者外周血中存在异常表达,这与Kim等[16]研究的结果相一致。进一步说明SNCA基因的异常表达可能与本地区维族EOPD 的发生有关。
EOPD患者不仅发病早,且临床症状发展较快,随着病情的进展,部分患者出现非运动症状,如抑郁、焦虑、幻觉、认知功能下降等。故本研究对基因芯片结果中的差异基因进行KEGG生物学通路富集分析后提示多巴胺突触通路、胆碱能突触通路、谷氨酸能突触通路及GABA能突触通路均与疾病的发生有关,其中SNCA基因表达差异涉及多巴胺突触和胆碱能突触通路,而多巴胺突触通路异常导致多巴胺代谢紊乱是PD发生的病理基础,因为多巴胺突触功能下降不仅降低中脑黑质区多巴胺的分泌及摄取,同时海马旁回、额叶的记忆力、注意力和执行功能均会受损[8-9]。本研究中胆碱能突触相关信号通路也显示异常。既往研究显示胆碱能突触a-synuclein蛋白的高聚集可诱导海马旁回胆碱能细胞的凋亡从而影响患者认知功能[17-18]。其他信号通路研究方面,GABA及谷氨酸能通路的异常可能与黑质纹状体区多巴胺含量减少的代偿效应相关[19]。而癌症转录失调及小细胞肺癌通路的异常可能与PD患者多巴胺神经元存在共同的凋亡机制有关[20]。
本研究结果表明胆碱能突触、谷氨酸突触、GABA能突触、多巴胺突触功能异常均与EOPD的发生有关,但SNCA基因异常表达与上述信号通路失调机制的关联性尚有待于进一步深入研究。
[1] Gaki GS, Papavassiliou AG. Oxidative stress-induced signaling pathways implicated in the pathogenesis of Parkinson′s disease[J]. Neuromolecular Med, 2014, 16(2): 217-230.
[2] und Halbach OB, Schober A, Krieglstein K. Genes, proteins, and neurotoxins involved in Parkinson′s disease[J]. Prog Neurobiol, 2004, 73(3):151-177.
[3] Atik A, Stewart T, Zhang J. Alpha-Synuclein as a biomarker for Parkinson′s disease[J]. Brain Pathol, 2016, 26(3):410-418.
[4] Mellick GD, Maraganore DM, Silbum PA. Australian data and meta-analysis lend support for alpha-synuclein(NACP-Rep1)as a risk factor for Parkinson′s disease[J]. Neurosci Lett, 2005, 375(2):112-116.
[5] Mizuta I, Nishimura M, Mizuta E, et al. Meta-analysis of α synuclein/NACP polymorphism in Parkinson′s disease in Japan[J]. J Neurol Neurosurg Psychiatry, 2002, 73(3): 350-350.
[6] Chiba-Falek O, Touchman JW, ′Nussbaum RL. Functional analysis of intra-allelic variation at NACP-Rep l in the alpha-synuclein gene[J]. Hum Genet, 2003, 113(5):426-431.
[7] Janeczek P, MacKay RK, Lea RA, et a1. Reduced expression of α-synuclein in alcoholic brain: influence of SNCA-Rep1 genotype[J]. Addict Biol, 2014,19(3):509-515.
[8] Chung SJ, Biernacka JM, Armasu SM, et a1. Alpha-synuclein repeat variants and survival in Parkinson′s disease[J]. Mov Disord, 2014,29(8):1053-1057.
[9] Goldman SM, Kamel F, Ross GW, et al. Head injury, α-synuclein Rep1, and Parkinson′s disease[J]. Ann Neurol, 2012,71(1):40-48.
[10] Hughes AJ, Daniel SE, Kilford L,et al. Accuracy of clinical diagnosis of idiopathic Parkinson′s disease: a clinicopathological study of 100 cases[J]. J Neurol Neurosurg Psychiatry, 1992,55(3):181-184.
[11] Xia Y, Rohan de Silva HA, Rosi BL, et a1. Genetic studies in Alzheimer′s disease with an NACP/alpha-synuclein polymorphism[J]. Ann Neurol, 1996, 40(2):207-215.
[12] Mellick GD, Maraganore DM, Silbum PA. Australian data and meta-analysis lend support for alpha-synuclein (NACP-Rep 1) as a risk factor for Parkinson′s disease[J]. Neurosci Lett, 2005, 375(2):112-116.
[13] Gatto NM, Rhodes SL, Manthripragada AD, et a1. α-Synuclein gene may interact with environmental factors in increasing risk of Parkinson′s disease[J]. Neuroepidemiology,2010,35(3):191-195.
[14] Wang XM, Wang DQ, Wang XY. Function study advances of Parkinson disease related genes[J]. Yi Chuan, 2010,32(8):779-784.
[15] Fuchs J, Tichopad A, Golub Y, et a1. Genetic variability in the SNCA gene influences alpha-synuclein levels in the blood and brain[J]. FASEB J,2008, 22(5):1327-1334.
[16] Kim HJ. Alpha-Synuclein Expression in Patients with Parkinson′s Disease:A Clinician′s Perspective[J]. Exp Neurobiol, 2013, 22(2):77-83.
[17] Hilker R, Thomas AV, Klein JC, et al. Dementia in Parkinson disease Functional imaging of cholinergic and dopaminergic pathways[J]. Neurology, 2005, 65(11):1716-1722.
[18] Hanganu A, Bedetti C, Jubault T, et al. Mild cognitive impairment in patients with Parkinson′s disease is associated with increased cortical degeneration[J]. Mov Disord, 2013, 28(10):1360-1369.
[19] Coune PG, Craveiro M, Gaugler MN, et al. An in vivo ultrahigh field 14. 1 T1H-MRS study on 6-OHDA and α-synuclein-based rat models of Parkinson′s disease:GABA as an early disease marker[J]. NMR Biomed, 2013, 26(1):43-50.
[20] Lai SW, Liao KF, Lin CH, et al. Parkinson′s disease and lung cancer:A population-based case-control study in Taiwan[J]. Geriatr Gerontol Int, 2013, 13(1):238-240.
(本文编辑 杨晨晨)
Study on the differential expression of mRNA in blood of patients with Parkinson′s disease carrying the Rep1 risk locus
XIA Huan1, LUO Qin2, YANG Xinling3
(1DepartmentofNuclearMedicine,2DepartmentofCadreWards,theAffiliatedTumorHospitalofXinjiangMedicalUniversity,Urumqi830011,China;3DepartmentofInternalMedicine-Neurology,theSecondAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830000,China)
Objective To explore the differences of gene expression in peripheral blood of patients with Parkinson′s disease (PD) carrying the synuclein alpha gene Rep1 risk locus. Methods Rep1 polymorphism of SNCA in promoter region was detected in 128 patients (PD group) and 160 healthy volunteers (control group) at the Repl promoter region of the Uyghur healthy volunteers (control group) in cases, with the methods of Polymerase Chain Reaction (PCR) and Direct Sequencing. Group comparison was based on age differences that the patients less than 50 years as the EOPD group and the patients older than 50 years as LOPD group. Screening of 3 PD patients with Rep1 risk loci and 3 healthy controls, the total RNA was extracted from peripheral blood by Trizol, and the Illumina expression profile microarray was used for hybridization experiment. Results 2 allele frequency of 21.4% in EOPD group was significantly higher than that in the control group under 50 years old of 6.9%, which the difference was statistically significant (χ2=12.67, P=0.00). By using this DNA microarray technology, 359 candidate genes in patients with PD were found. 122 genes expressions correlating to PD were found with twice fold over-expression differences, compared with the control group. In which the changes that were involving in the dopaminergic and cholinergic synaptic signaling pathways were most significant (FC=3.64, P=0.046; FC=5.57, P=0.005). Conclusion The allele of Repl locus 2 was related to the occurrence of EOPD, and SNCA gene expression was abnormally increased in peripheral blood of patients with type 2 alleles.
Parkinson′s disease; Synuclein alpha; Rep1
新疆医科大学科研创新基金(XYDCX201470)
夏 欢(1987-),男,硕士,住院医师,研究方向:帕金森病的诊断与治疗。
杨新玲,女,教授,博士生导师,研究方向,帕金森病发病机制的研究,E-mail: poplar862@sohu.com。
R742.5
A
1009-5551(2016)12-1554-05
10.3969/j.issn.1009-5551.2016.12.017
2016-07-06]

