高产过氧化氢酶菌株的鉴定与产酶条件
田燕丹,贾宪波,林新坚,邱宏端,陈济琛*
(1.福州大学生物科学与工程学院,福建 福州 350108;2.福建省农业科学院土壤肥料研究所,福建 福州 350003)
高产过氧化氢酶菌株的鉴定与产酶条件
田燕丹1,贾宪波2,林新坚2,邱宏端1,陈济琛2*
(1.福州大学生物科学与工程学院,福建 福州 350108;2.福建省农业科学院土壤肥料研究所,福建 福州 350003)
为解决过氧化氢废水对环境的污染,从稻田土中筛选到1株高产过氧化氢酶菌株。经形态学观察和分子生物学鉴定,确认该菌属于黏质沙雷氏菌,命名为SerratiamarcescensFZSF02。通过培养基碳源、氮源、无机盐类型及产过氧化-氢酶条件优化。在培养条件为:1% 大豆蛋白胨、0.5% 麦芽糖、 0.2% NaCl 、31℃、180 r·min-1、发酵时间48 h,菌株产过氧化氢酶总酶活最高达6 380 U·mL-1,比优化前提高了7.4倍。粗酶液最适反应温度为60℃,最适反应pH为8.0。该菌在过氧化氢废水无害化处理和其他工农业过程中有很好的应用潜力。
黏质沙雷氏菌;过氧化氢酶;产酶条件
过氧化氢也是日常生产生活中一种常见的强氧化物质,广泛用于医疗消毒、纺织物漂白和食品防腐等领域,但是过氧化氢大量应用后的残留对健康、环境和生产工艺等是有害的。过氧化氢酶广泛存在于植物、动物和微生物中,它可以清除生物细胞中的活性氧是一种重要的保护酶类,其作用原理是将生物体产生的强氧化剂过氧化氢分解为无害的水和氧气[1]。因此过氧化氢酶也广泛应用于临床、食品、纺织印染和造纸等多个领域[2]中过氧化氢的清除。最初生产应用中过氧化氢酶的来源主要是动物肝脏,但是动物源过氧化氢酶原料来源有限且酶性质单一实际应用中难以满足各种要求,微生物来源的过氧化氢酶种类丰富、性质多样且易于大规模制备,因此近年来引起越来越多的关注[3]。国内微生物过氧化氢酶研究存在的主要问题是高酶活微生物较少,市售过氧化氢酶活力单位一般在50 000 U·mL-1以上,多数菌株难以达到。因此,筛选高产过氧化氢酶生产菌株对于过氧化氢酶的产业化利用极为重要。
本研究在稻田土壤微生物资源收集过程中,筛选到1株高产过氧化氢酶菌株,经鉴定及产酶条件优化,使其产酶量得到显著提高,为后续过氧化氢酶酶制剂的制备以及开发利用该酶进行环境污染无害化处理奠定了基础。
1 材料与方法
1.1 试验材料
1.1.1 菌株 分离自福建省福州市稻田土壤中,由福建省农业科学院土壤肥料研究所土壤微生物室保存。

1.1.3 培养基与试剂 种子液培养基为:大豆蛋白胨10 g·L-1,牛肉浸膏5 g·L-1,NaCl 1 g·L-1,pH 7.0。固体培养基在种子液培养基的基础上添加15 g·L-1的琼脂粉。培养基成分及各类化学试剂均为国药集团试剂。
1.2 试验方法
1.2.1 菌种的培养与活化 取一环菌株FZSF02斜面菌种在琼脂平板培养基上四区划线得到单菌落,挑取1环单菌落接种于盛有50 mL 种子培养基的250 mL的三角瓶中,将摇瓶在37℃、180 r·min-1下培养12 h即为种子液。
1.2.2 菌种形态学观察 挑取1环菌株FZSF02在固体琼脂平板四区划线,将平板在30℃ 恒温培养箱中倒置培养48 h,观察菌落形态。取适量菌体涂布在载玻片上,自然风干后于酒精灯火焰上固定,番红简单染色后在油镜下观察菌体形态。
1.2.3 菌株的16S rRNA鉴定 基因组提取应用天根生化科技有限公司生产的细菌基因组提取试剂盒 (DP302)。16S rRNA扩增引物为通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′- TACGGCTACCTTGTTACGACTT-3′)[4]。扩增体系为:25 μL高保真DNA聚合酶(Takara),引物27F(10 μmol·L-1) 和1492R(10 μmol·L-1)各1 μL,模板1 μL,用22 μL ddH2O将体系补足到50 μL。PCR扩增条件为95℃ 预变性5 min;然后94℃ 变性1 min,55℃退火1 min,72℃ 延伸2 min,扩增35个循环;最后72℃ 后延伸5 min。扩增产物经琼脂糖凝胶切胶回收后送博尚生物公司测序。测序结果经Chromas和DNAMAN软件编辑去除首尾两端不可信序列后应用BLAST程序比对GenBank中该菌相似序列,并将该序列提交GenBank。选取与该菌16S rRNA序列高度相似的若干序列构建基于16S rRNA序列的系统发育树。发育树的构建应用MEGA软件,方法采用Neighbor-Joining,Bootstrap次数为1 000次,模型选取Nucleotide: Kimura 2-parameter。
1.2.4 过氧化氢酶活性测定 取3 mL发酵液于10 mL离心管中,冰浴超声破碎直至澄清,超速离心后上清即为粗酶液。酶活测定参考文献[5]。将2.9 mL 50 mmol·L-1PBS(pH 7.0,含30 mmol·L-1H2O2)迅速加入100 μL适当稀释的过氧化氢酶酶液。在紫外分光光度计下测定反应体系在240 nm下吸光度的变化,每隔10 s读数1次直至1 min。H2O2在240 nm下的摩尔消光系数为43.6 mol·cm-1,根据吸光度的变化计算H2O2的分解量,每分钟分解1 μmol·L-1过氧化氢所需的酶量定义为1个酶活力单位。
1.2.5 产酶培养基的优化 分别以1% 的大豆蛋白胨、胰蛋白胨、酵母浸粉、牛肉膏和玉米浸粉为氮源发酵产酶,比较氮源对菌株产过氧化氢酶的影响。然后在最佳氮源基础上向培养基中添加 0.5% 的葡萄糖、麦芽糖、蔗糖、甘油、乳糖、果糖和柠檬酸为碳源发酵产酶,比较不同碳源对产酶的影响。在最适碳源和最适氮源条件下分别添加0.1% 的不同无机盐,比较无机盐对菌株发酵产过氧化氢酶的影响。碳源优化以最佳氮源为唯一营养成分作为对照,无机盐的优化以最佳碳源和最佳氮源不添加任何无机盐作为对照。以上发酵过程中摇床温度控制在30℃,转速设定为180 r·min-1,发酵时间为24 h。菌体生长量通过OD600反映,酶活的测定按照前述方法。
1.2.6 发酵条件的优化 2% 的接种量接种于优化过的培养基成分的培养基中,分别置于25、28、31、34、37℃ 条件下培养24 h,摇床转速为180 r·min-1。按照前述粗酶液制备方法制备粗酶液,测定不同温度培养条件下发酵液过氧化氢酶活性。在相同培养基、接种量,温度和发酵时间等条件下将摇床转速分别设为160、180、200、220 r·min-1,比较摇床转速对发酵产酶的影响。在最优培养基和最适发酵条件下发酵菌株FZSF02,每隔6 h取样测定菌体浓度和发酵液过氧化氢酶活性,绘制菌体生长曲线和产酶曲线。
1.2.7 过氧化氢酶性质测定 最适反应温度测定,用50 mmol·L-1,pH 7.0的PBS配置20 mmol·L-1H2O2。将H2O2分别置于10、20、30、40、50、60、70、80、90℃ 条件下水浴。取2.95 mL上述H2O2溶液迅速加入到盛有50 μL酶液的比色杯中,在240 nmol·L-1波长下测定不同反应温度下的酶活力。最适反应pH的测定,分别用50 mmol·L-1的柠檬酸-磷酸缓冲液 (pH 3~6), 50 mmol·L-1NaH2PO4-Na2HPO4缓冲液 (pH 7.0~8.0)和50 mmol·L-1甘氨酸缓冲液(9~11)配置20 mmol·L-1的H2O2溶液。取不同pH的上述H2O2溶液分别与50 μL的过氧化氢酶反应,比较不同pH反应体系中过氧化氢酶的活性。
1.3 数据处理
试验数据采用统计软件SPSS 17.0 处理,对数据进行方差分析,用Duncan法进行显著性分析。
2 结果与分析
2.1 菌株FZSF02的鉴定
2.1.1 菌株FZSF02形态特征 在25℃ 条件下琼脂平板培养48 h后菌落呈红色、圆形、表面湿润、易于挑起(图1-a);100℃ 光学显微镜镜下观察菌体呈圆形(图1-b)。以上菌落和菌体特征符合黏质沙雷氏菌的描述。
2.1.2 菌株FZSF02的16S rRNA鉴定 针对菌株FZSF02 16S rRNA PCR扩增和测序得到长度为1 416 bp的序列。将序列在NCBI及ezbiocloud(http://www.ezbiocloud.net)比对后显示该菌与标准菌株黏质沙雷氏菌Serratiamarcescenssubsp.marcescens同源性最高(99.65%)。从ezbiocloud中选择与其亲缘关系最近的11株标准菌株的16S rRNA序列构建该菌的系统发育树(图2),结合表性特征确定该菌为黏质沙雷氏菌Serratiamarcescens,命名为SerratiamarcescensFZSF02。将该序列提交GenBank后获得收录号KU145144。
2.2 产酶培养基的初步优化
2.2.1 氮源对菌株FZSF02产过氧化氢酶的影响 以1%的不同氮源作为唯一营养成分发酵菌株FZSF02产酶,结果如图3所示。以大豆蛋白胨、牛肉膏和酵母浸粉为氮源发酵均能获得较高的生物量。但是过氧化氢酶活性却差异很大,其中大豆蛋白胨为氮源产酶量最高,每毫升发酵液的过氧化氢酶量为(1472±42)U·mL-1;其次为酵母浸粉,每毫升发酵液的过氧化氢酶含量为(1101±64)U·mL-1。其他氮源产酶量均低于1 000 U·mL-1。可见氮源对过氧化氢酶产量的影响是通过促进细胞过氧化氢酶的表达而实现的,而不仅仅通过增加生物量增加过氧化氢酶产量。
2.2.2 碳源对菌株FZSF02产过氧化氢酶的影响 以1% 的大豆蛋白胨为氮源的基础上,研究添加1% 的不同碳源对菌株FZSF02发酵产过氧化氢酶的影响,结果如图4。发酵24 h后蔗糖、麦芽糖和果糖的酶产量均达到4 000 U·mL-1以上,其中以麦芽糖产量最高,为(4431±348.6)U·mL-1。
2.2.3 无机盐种类对菌株FZSF02产酶的影响 在前述最佳碳氮源的基础上,考查了无机盐种类对发酵产酶的影响,结果如表1。当添加不同种类0.2% 的各种无机盐后,只有NaCl促进了菌株产酶,与对照组比提高了约39%。
表1 无机盐对菌株FZSF02过氧化氢酶产量的影响
Table 1 Effect of mineral salts on catalase production of FZSF02
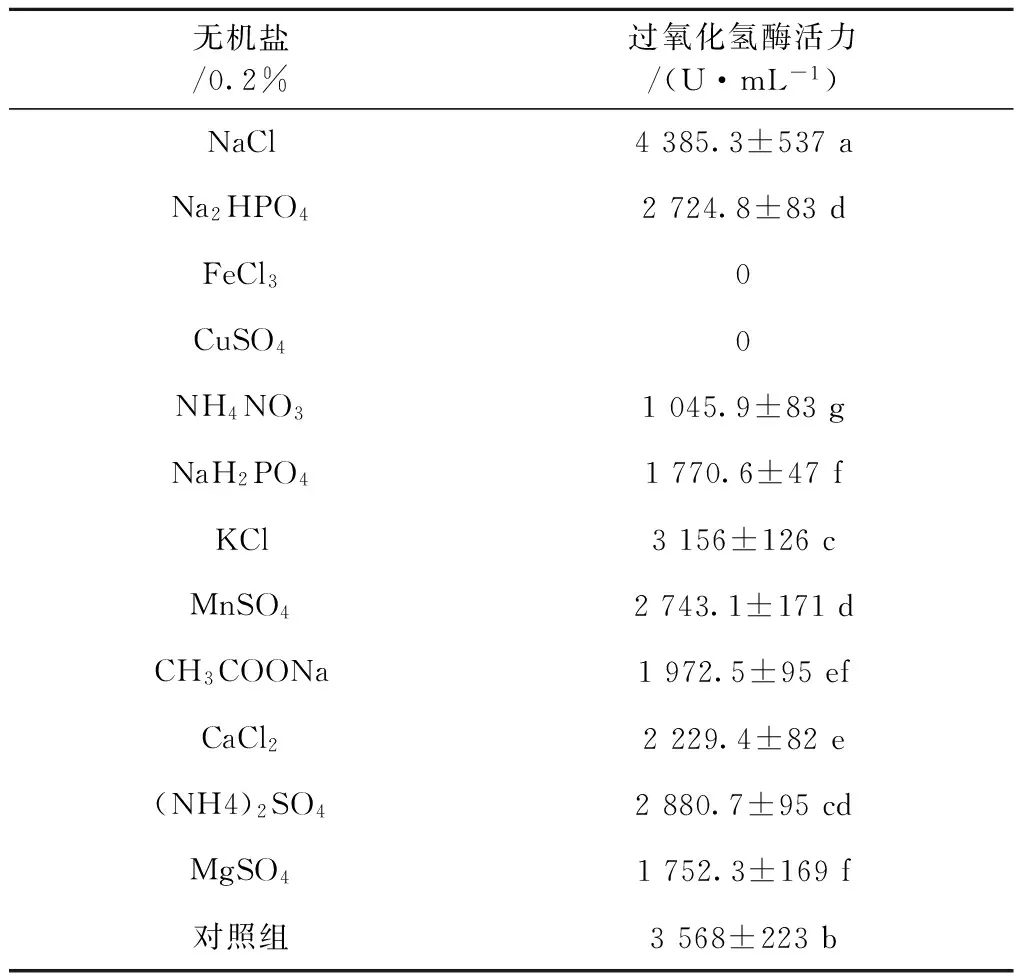
无机盐/0.2%过氧化氢酶活力/(U·mL-1)NaCl4385.3±537aNa2HPO42724.8±83dFeCl30CuSO40NH4NO31045.9±83gNaH2PO41770.6±47fKCl3156±126cMnSO42743.1±171dCH3COONa1972.5±95efCaCl22229.4±82e(NH4)2SO42880.7±95cdMgSO41752.3±169f对照组3568±223b
2.2.4 培养基组分的正交试验优化 针对影响产酶的主要因素大豆蛋白胨、麦芽糖和NaCl设计了L9(33)正交试验(表2)。结果(表2~3)表明正交试验显示最佳组合为大豆蛋白胨10 g,麦芽糖15 g和NaCl 1 g。通过分析极差值(R)可以看出3个因素对发酵产酶的影响存在显著性顺序,其主次关系为NaCl>麦芽糖>大豆蛋白胨。

表2 正交试验因素水平
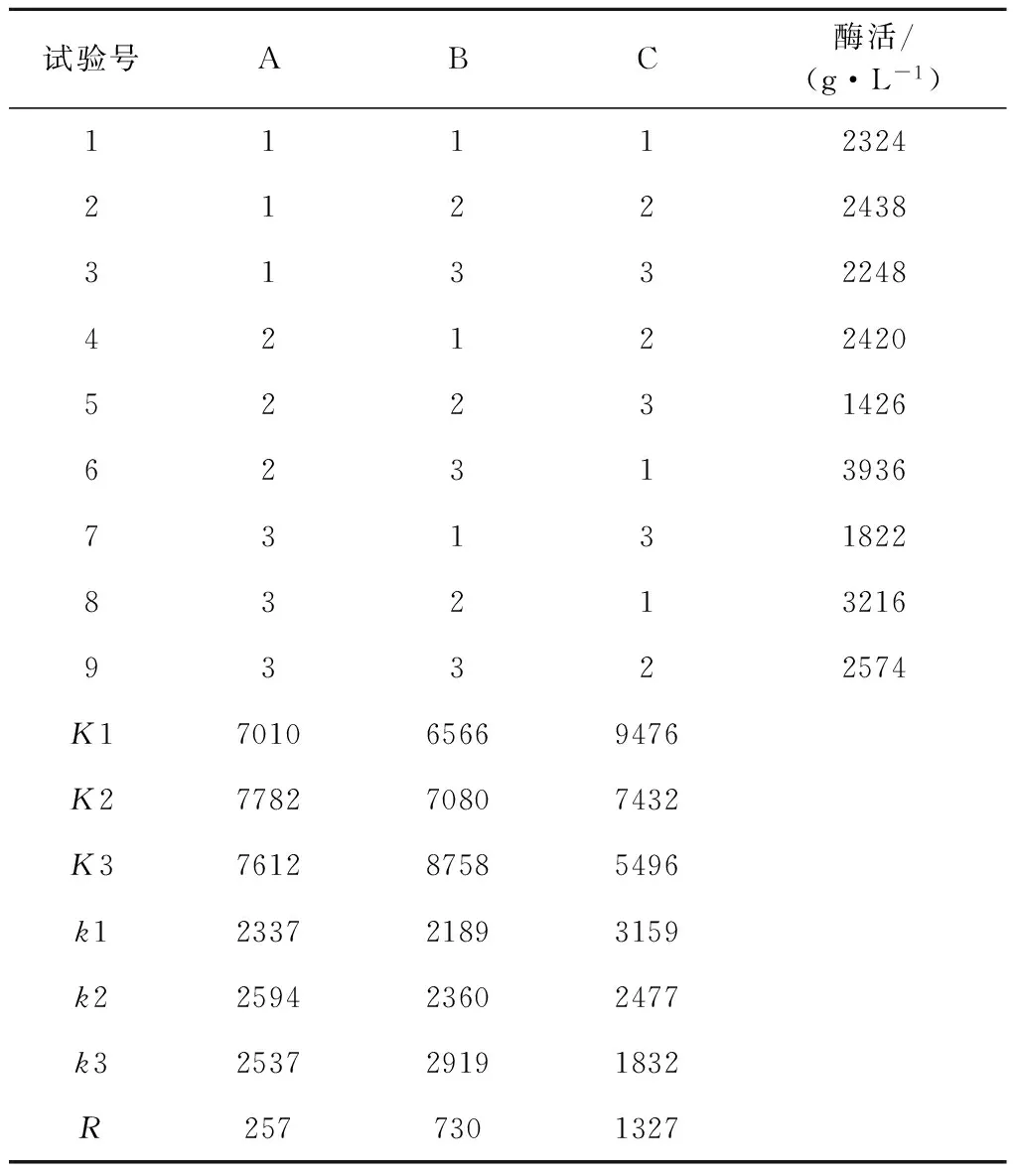
表3 正交试验结果
2.3 发酵条件对菌株产过氧化氢酶的影响
2.3.1 发酵温度对产酶的影响 在最佳产酶培养基条件下考查发酵温度对菌株产酶的影响,结果(图5-a)表明,在25~37℃ 范围内随着发酵温度的升高生物量逐渐提高,37℃ 发酵得到最大生物量。且随着发酵温度的升高发酵液红色越来越浅,30℃ 以下发酵液呈红色,高于30℃ 不呈红色。温度对该菌的生长和产酶均有较大影响,31℃发酵时得到最大的产酶量,低于28℃ 或者高于34℃ 产酶量均严重降低。
2.3.2 摇床转速对发酵产酶的影响 比较摇床转速对摇瓶发酵产酶的影响,结果(图5-b)表明当摇床转速设定为180、200 、220 r·min-1时均能达到4 000 U·mL-1以上,其中转速为180 r·min-1时产酶略高。
2.3.3 发酵时间对产酶的影响 在最适发酵培养基和最适培养条件下测定了菌株随时间的产酶曲线,结果如图6。发酵12 h以后开始大量产酶,直至48 h时产酶量达到稳定,最高产量达到6 380 U·mL-1。
2.4 温度和pH对FZSF02所产过氧化氢酶活性的影响
在20~90℃不同温度反应体系下测量该过氧化氢酶活性,结果如图7-a所示。该酶最适反应温度为60℃,且在20~80℃相对酶活高于80%。测量了不同pH反应体系中该酶的相对酶活,结果见图7-b。该酶的最适反应pH为8,在pH 6~10相对酶活高于80%。
3 讨论与结论
3.1 过氧化氢酶产酶菌株FZSF02的鉴定
黏质沙雷氏菌是一种环境中广泛分布的微生物,虽然其中某些菌株具有致病性,但由于其发酵产灵菌红素[6]、丁二醇[7]等代谢产物以及多种生物酶类而成为很有潜力的发酵工程目的菌。已报道菌株SerratiamarcescensSYBC-01[8]和SerratiamarcescensSYBC-08[9]高产过氧化氢酶,FZSF02的16S rRNA序列与菌株SYBC-01和SYBC-08的同源性分别为99.43% 和99.72%。在菌落形态方面FZSF02与SYBC-01菌落均产生红色色素,而SYBC-08菌落不产色素。FZSF02在产酶能力和产酶条件上与SYBC-01和SYBC-08均有明显区别。
3.2 培养基成分和发酵条件对产酶的影响
与其他氮源相比大豆蛋白胨能够明显提高菌株FZSF02菌体生长和过氧化氢酶合成,而对于SYBC01[10]和SYBC-08[11]菌株酵母浸出物促进菌株产酶的能力要优于蛋白胨等其他氮源,在氮源的利用方面菌株FZSF02与SYBC-01和SYBC-08明显不同。另外过氧化氢酶产生菌菌株气单胞茵属茵株CE-2-A[12]和Bcillussp.SHT2[13]的最佳氮源为牛肉膏,BcillussubitilEIM-70[14]的最佳产酶碳源为NaNO3和麦芽汁。可见最佳产过氧化氢酶氮源与菌株种类有关。碳源对FZSF02菌株产过氧化氢酶影响最明显,与对照组比蔗糖、麦芽糖和果糖的添加均可以使该菌的过氧化氢酶产量提高2倍以上,其中以果糖为最佳。菌株SYBC-01[10]中甘油为碳源的产酶能力优于果糖;而菌株SYBC-08[11]的最优碳源为柠檬酸,菌株FZSF02不能利用柠檬酸,这与SYBC-08差别较大。
培养条件是微生物发酵产酶过程中的关键因素。研究显示菌株FZSF02在31℃左右产酶能力最强,这与已报道的SerratiamarcescensSYBC-01[10](30℃)和SerratiamarcescensSYBC-08[9](30℃)类似,BacillussubtilisWSHDZ-01[15]的发酵产酶温度为37℃,单胞菌属菌株CE-2-A[12]的产酶温度为25℃,或许30℃温度左右是黏质沙雷氏菌产过氧化氢酶共同的最佳温度。在摇瓶发酵过程中摇床的转速直接影响发酵液的通气量和菌体的生长。摇床转速试验结果显示转速对菌体产酶影响不大,转速为180 r·min-1时产酶量最高且略优于其他转速,SerratiamarcescensSYBC-01[10]的发酵转速也为180 r·min-1,SerratiamarcescensSYBC-08[11]应用7 L发酵罐发酵产酶时转速为200 r·min-1。
据文献报道,目前已筛选到多种可产过氧化氢酶的微生物[17-22],包括沙雷氏菌、芽孢杆菌、嗜热子囊菌,溶壁微球菌等,其中多数菌株产酶能力较低,2013年,奥杰等[17]筛选到1株液化沙雷氏菌,其产酶量为107.8 U·mL-1;陈欣等[19]筛选到1株枯草芽孢杆菌,产酶量为211.84 U·mL-1;洪海军等[3]对1株溶壁微球菌的产酶条件进行优化,使酶活从980 U·mL-1提高到1 100 U·mL-1;2014年,陈世健等[21]筛选到1株不动杆菌,经发酵优化后产酶量为2 469 U·mL-1。2011年,曾化伟等[11]对1株黏质沙雷氏菌进行摇瓶水平的发酵优化,使产酶量达到了较高水平,酶活为9 553 U·mL-1;2015年,曹汶龙等[22]对1株基因工程菌进行了工业优化,最终使产酶量达到了23 190 U·mL-1。本研究通过对菌株FZSF02发酵条件的优化,使最高酶活达到 6 380 U·mL-1,与已报道的产过氧化氢酶菌株相比,FZSF02的产酶量优于许多菌株,有很强的应用潜力。
3.3 FZSF02的资源价值和应用潜力
已报道的过氧化氢酶产酶菌株往往分离自纺织厂污水[16,18],纺织厂漂白车间[11]和含过氧化氢的鱼子处理厂[23]等富含过氧化氢的环境中。FZSF02分离自不含高浓度过氧化氢的稻田中,却也表现出很强的过氧化氢酶产酶能力,相信稻田等农田土壤是许多有益微生物资源的栖息环境,在微生物资源的发掘过程中应得到更多重视。
纺织、造纸和皮革等工业的漂白过程会产生大量含过氧化氢的废水,其直接排放将对环境中的生物和人类健康造成严重危害。微生物发酵过氧化氢酶可以快速高效分解水体中过氧化氢为氧气和水,且对环境无二次污染,是理想的含过氧化氢工业废水的处理方法。FZSF02过氧化氢酶产量高,温度和pH适应范围广,可以直接应用于水体过氧化氢的清除,有良好的应用前景。
本研究报道了1株高产过氧化氢酶菌株FZSF02,通过表型和16S rRNA序列鉴定为黏质沙雷氏菌,命名为SerratiamarcescensFZSF02。对培养基成分进行了简单优化,确定了大豆蛋白胨、果糖和NaCl分别为最佳产酶氮源、碳源和无机盐。在摇瓶水平进一步优化了发酵条件,在31℃、180 r·min-1条件下发酵48 h产酶量达到6 380 U·mL-1,是优化前的7.4倍。
[1]FARR S B, KOGOMA T. Oxidative stress responses in Escherichia coli and Salmonella typhimurium[J]. Microbiological Reviews, 1991, 55(4): 561-585.
[2]刘灵芝,钟广蓉,熊莲,等. 过氧化氢酶的研究与应用新进展[J]. 化学与生物工程, 2009, 26(3): 15-18.
[3]洪海军,许赣荣. 产过氧化氢酶菌株培养条件的优化[J]. 无锡轻工大学学报:食品与生物技术, 2004, (6): 85-89.
[4]ERKO STACKEBRANDT,GOODFELLOW M. Nucleic acid techniques in bacterial systematics[M]. Stackebrandt E Goodfellow M Nucleic Acid Techniques in Bacterial Systematics, 1991.
[5]FU X,WANG W,HAO J,et al. Purification and characterization of catalase from marine bacteriumAcinetobactersp. YS0810[J]. Biomed Research International,2014, 2014(1): 409626.
[6]阿布都热合曼·阿布力米提,布佐日古丽·喀迪尔,吾甫尔·米吉提. 灵菌红素及其应用的研究进展[J]. 安徽农业科学, 2015, (9): 102-106.
[7]郝英利,张燎原,孙建安,等. 黏质沙雷氏菌G1利用玉米浆干粉和磷酸氢二铵生产2,3-丁二醇的研究[J]. 化学与生物工程, 2013, (6): 34-38.
[8]钱斯亮,蔡宇杰,廖祥儒,等. 热稳定性过氧化氢酶高产菌的筛选、鉴定及酶学性质研究[J]. 西北农业学报, 2008, 17(2): 238-242.
[9]曾化伟.SerratiamarcescensSYBC 08的筛选、鉴定及其发酵产过氧化氢酶的研究[D]. 无锡:江南大学, 2011.
[10]HUA W Z,YU J C,XIANG R L,et al. Optimization of catalase production and purification and characterization of a novel cold-adapted Cat-2 from mesophilic bacteriumSerratiamarcescensSYBC-01[J]. Annals of Microbiology, 2010, 60(4): 701-708.
[11]曾化伟,张峰,蔡宇杰,等. 菌株SerratiamarcescensSYBC08产过氧化氢酶液态发酵工艺的优化及酶性质研究[J]. 食品与生物技术学报, 2011, 30(3): 410-416.
[12]张增祥,王伟,王芳,等. 过氧化氢酶高产菌株CE-2-A的发酵条件优化[J]. 渔业科学进展, 2010, (6): 95-103.
[13]刘灵芝,常雁红,罗炜,等. 产耐热过氧化氢酶菌株的筛选和培养[J]. 科学技术与工程, 2010, (4): 868-873.
[14]杨鹤,蔡少丽,李力,等. 过氧化氢酶高产菌株EIM-70的鉴定及产酶培养基的优化[J]. 安徽农业科学, 2013, (1): 33-36.
[15]邓宇.BacillussubtilisWSHDZ-01发酵生产过氧化氢酶条件优化[D]. 无锡:江南大学, 2008.
[16]邓宇,华兆哲,赵志军,等. 氮源对枯草芽孢杆菌WSHDZ-01合成过氧化氢酶的影响[J]. 应用与环境生物学报, 2008, (4): 544-547.
[17]奥杰,窦少华,迟乃玉,等. 响应面法优化CZA1202产低温过氧化氢酶发酵条件[J]. 安徽农业科学, 2013, (2): 508-511.
[18]刘冬,季石美,汪成富. 过氧化氢酶优良基因菌株的筛选及其酶学性质研究[J]. 安徽农业科学, 2011, 38(35): 19949-19950.
[19]陈欣,甘国斌,孙敬冉,等. 一株产过氧化氢酶细菌的筛选及发酵条件的优化[J]. 江苏科技大学学报:自然科学版, 2012, (2): 199-204.
[20]王明星,李寅,方芳,等. 添加甲萘醌促进嗜热子囊菌合成过氧化氢酶[J]. 过程工程学报, 2005, (3): 337-340.
[21]陈世建,王伟,孙谧. 一株海洋过氧化氢酶高产菌的鉴定及产酶条件优化[J]. 渔业科学进展, 2014, (4): 103-109.
[22]曹汶龙,郭娅琼,康振,等. 枯草芽孢杆菌产过氧化氢酶的优化与工业化[J]. 食品与生物技术学报, 2015, (5): 482-486.
[23]KIMOTO H, YOSHIMUNE K, MATSUYMA H, et al. Characterization of catalase from psychrotolerantPsychrobacterpiscatoriiT-3 exhibiting high catalase activity[J]. International journal of molecular sciences, 2012, 13(2): 1733-1746.
(责任编辑:林海清)
Identification and Optimized Fermentation of High Catalase-producingSerratiamarcescens, FZSF02
TIAN Yan-dan1,JIA Xian-bo2,LIN Xin-jian2,QIU Hong-duan1,CHEN Ji-cheng2*
(1.CollegeofBiologicalScienceandEngineering,FuzhouUniversity,Fuzhou,Fujian350108,China;2.SoilandFertilizerInstitute,FujianAcademyofAgriculturalSciences,Fuzhou,Fujian350003,China)
To search for a high catalase-producing bacteria strain, field samples and lab collections were screened. FZSF02 was initially selected and subjected to morphological examinations and 16S rRNA sequencing.It was identified to be a strain ofSerratiamarcescens. Subsequently, various carbon and nitrogen sources, mineral salts, and fermentation conditions to maximize the catalase production of the bacteria were experimented and optimized. It was found that a medium consisting of 1% soy peptone, 0.5% lactose, and 0.2% NaCl applied for the fermentation at 31℃ with a constant shaking at 180rpm for 48 h could yield the enzyme at the highest level of 6 380 U·mL-1among all tested conditions. The yield was 7.4 times of what was without the optimization. The peak activity of the obtained crude catalase was determined to reach at 60℃ and pH 8.0.The enzyme could potentially be applied for treating hydrogen peroxide pollutionin waste water effluent.
Serratiamarcescens; catalase; fermentation conditions
2016-02-29初稿;2016-05-29修改稿
田燕丹(1990-),女,硕士生,研究方向:应用微生物学
*通讯作者:陈济琛(1964-),男,研究员,研究方向:农业微生物和食用菌(E-mail:chenjichen2001@163.com)
国家公益性农业科研专项(201303094-05);福建省财政厅社会公益研究项目(2060302);福建省科技计划项目——省属公益类科研院所基本科研专项(2009R10002-2);星火计划重点项目(2014S0068)
Q 936
A
1008-0384(2016)08-869-07
田燕丹,贾宪波,林新坚,等.高产过氧化氢酶菌株的鉴定与产酶条件[J].福建农业学报,2016,31(8):869-975.
TIAN Y-D,JIA X-B,LIN X-J,et al. Identification and Optimized Fermentation of High Catalase-producingSerratiamarcescens, FZSF02[J].FujianJournalofAgriculturalSciences,2016,31(8):869-975.

