扁穗牛鞭草对红三叶化感作用研究
(成都农业科技职业学院现代农业分院, 四川 成都 611130)
扁穗牛鞭草对红三叶化感作用研究
李春龙
(成都农业科技职业学院现代农业分院, 四川 成都 611130)
以红三叶种子为受体,对比研究了扁穗牛鞭草根、茎和叶水浸液,不同处理浓度的化感作用。结果表明:扁穗牛鞭草根、茎和叶水浸液对红三叶种子萌发和幼苗生长较对照均表现出相同的趋势,即随着水浸液浓度的增加,4 个所测指标所受的抑制作用均有所增强,而在相同的处理浓度下,红三叶种子萌发及幼苗生长对扁穗牛鞭草不同部位水浸液的敏感程度为叶最敏感,茎次之,根最不敏感。与对照相比,所有部位的扁穗牛鞭草水浸液对红三叶幼苗根系相对电导率和丙二醛含量均呈递增趋势,而对抗氧化酶(POD、SOD、ASA-POD)活性均呈递减趋势,并且在同一浓度下,扁穗牛鞭草水浸液对红三叶幼苗根系生理指标的影响强度顺序也为叶gt;茎gt;根。
扁穗牛鞭草; 化感作用; 红三叶; 种子萌发; 幼苗生长; 生理指标
physiological index
扁穗牛鞭草(Hemarthriacompressa)为禾本科牛鞭草属多年生草本植物。扁穗牛鞭草产量高、叶片多、草质柔嫩、营养丰富、适口性好,牛、羊、鱼十分喜食[1]。既可放牧利用,又可调制干草、青贮[1]。作为禾本科牧草,其蛋白含量低,不能为家畜提供均衡的营养。把豆科牧草引入扁穗牛鞭草草地,不仅能提高牧草的营养价值,而且可增加草地的生产能力与利用水平[2]。
扁穗牛鞭草在生长过程中要分泌苯酚类等物质,对豆科牧草的生长具有化感作用[3]。化感作用是指一种植物通过向环境释放某些化学物质,在其周围形成一个微环境区域,从而抑制或促进该区域内其他植物(或其他微生物)生长的现象[4]。
表1 扁穗牛鞭草水浸液对红三叶种子萌发率的影响
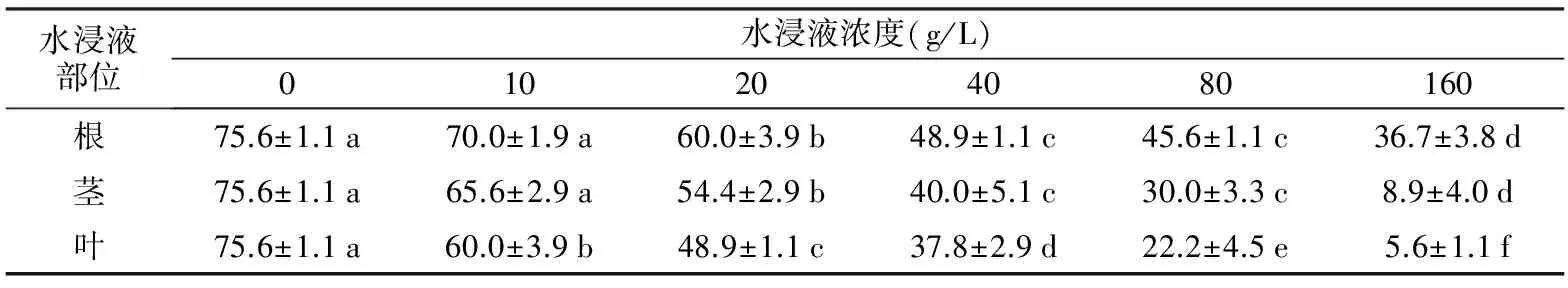
水浸液部位水浸液浓度(g/L)010204080160根75.6±1.1a70.0±1.9a60.0±3.9b48.9±1.1c45.6±1.1c36.7±3.8d茎75.6±1.1a65.6±2.9a54.4±2.9b40.0±5.1c30.0±3.3c8.9±4.0d叶75.6±1.1a60.0±3.9b48.9±1.1c37.8±2.9d22.2±4.5e5.6±1.1f
表2 扁穗牛鞭草水浸液对红三叶根长和苗长的影响
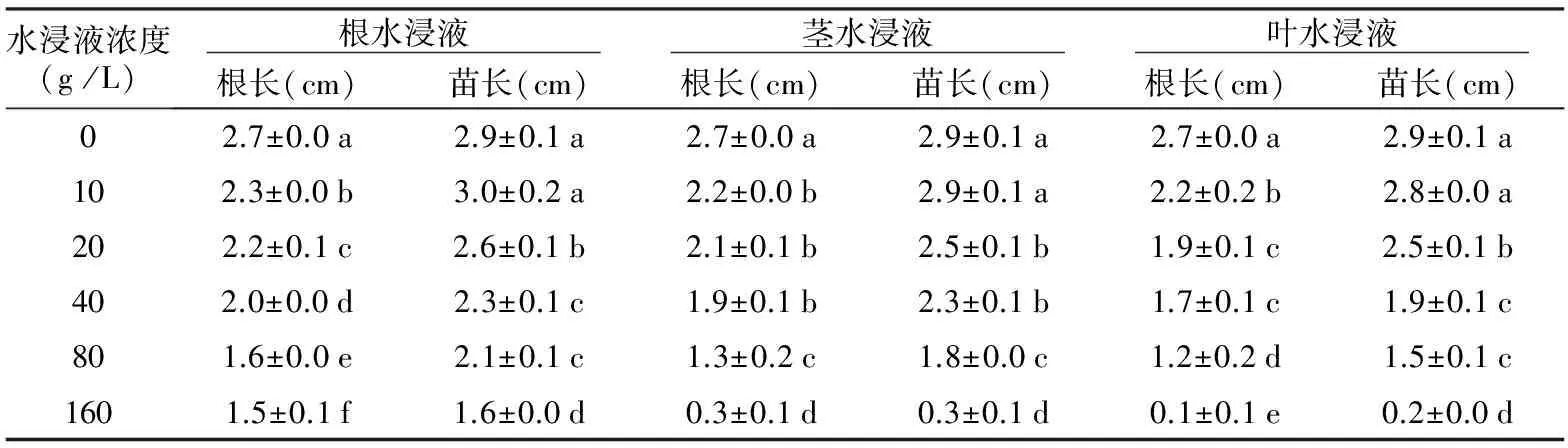
水浸液浓度(g/L) 根水浸液 茎水浸液 叶水浸液 根长(cm)苗长(cm)根长(cm)苗长(cm)根长(cm)苗长(cm)02.7±0.0a2.9±0.1a2.7±0.0a2.9±0.1a2.7±0.0a2.9±0.1a102.3±0.0b3.0±0.2a2.2±0.0b2.9±0.1a2.2±0.2b2.8±0.0a202.2±0.1c2.6±0.1b2.1±0.1b2.5±0.1b1.9±0.1c2.5±0.1b402.0±0.0d2.3±0.1c1.9±0.1b2.3±0.1b1.7±0.1c1.9±0.1c801.6±0.0e2.1±0.1c1.3±0.2c1.8±0.0c1.2±0.2d1.5±0.1c1601.5±0.1f1.6±0.0d0.3±0.1d0.3±0.1d0.1±0.1e0.2±0.0d
本试验主要研究了扁穗牛鞭草对其混播牧草红三叶的化感作用,以期为减弱扁穗牛鞭草对其间作牧草红三叶的化感效应提供理论依据,从而实现扁穗牛鞭草草地的可持续利用。
1 材料与方法
1.1 材 料
参试的红三叶种子购于四川省农科院。
1.2 方 法
1.2.1 扁穗牛鞭草植物体收集及水浸液制备
本实验所用的扁穗牛鞭草为野生扁穗牛鞭草,采自雅安,由四川农业大学张新全教授提供。扁穗牛鞭草植物体的收集及水浸液制备参照李春龙[5]的方法。
1.2.2 室内生物检测
于2013年6月14日在成都农业科技职业学院农学园艺分院七教四楼农业综合实训室实施该实验。红三叶种子经盐水浮选后,选取粒大、饱满、大小一致的种子用蒸馏水清洗,晾干后备用。先用5.25 g/L的NaClO溶液对受试红三叶种子进行消毒,时间为15 min,然后用蒸馏水清洗4 次,每次清洗1 min;将红三叶种子放置在直径为9 cm的皮氏培养皿中,内垫2层滤纸,每个培养皿内放30 粒种子,分别将根、茎、叶(处理浓度分别为0,10,20,40,80,160 g/L)的水浸液7 mL注入培养皿中,对照为蒸馏水,每个处理3 次重复[6]。共设2组,一组用于测定红三叶幼苗发芽率、幼苗根长、苗长、干重,另一组用于测定红三叶幼苗根系的生理指标;然后将培养皿放置在恒温恒湿培养箱[(25±1)℃,黑暗]中进行种子萌发实验。待红三叶种子萌芽3 d 后记录萌发的种子数,记录完测定所有萌发幼苗的根长和苗长[7],最后将所有的幼苗自然风干、称重。另一组待红三叶种子萌发7 d后,测定红三叶幼苗根系的丙二醛(MDA)含量,采用硫代巴比妥酸法测定[8];细胞膜透性即相对电导率用DDS-11 A型电导率仪测定[9];同时测定超氧化物歧化酶(SOD)、过氧化物酶(POD)、抗坏血酸过氧化物酶(ASA-POD)活性,均采用陈建勋等[10]的方法。
1.3 数据统计
采用SPSS 15.0统计软件进行单因素方差和多重比较分析(plt;0.05)。
2 结果与分析
2.1 扁穗牛鞭草水浸液对红三叶种子萌发率的影响
与对照相比,所有部位的扁穗牛鞭草水浸液对红三叶种子的萌发率均表现出抑制作用,并且随着浓度的增加,抑制效应增强(见表1)。根、茎水浸液在浓度达到20 g/L时,较对照显著抑制了红三叶种子的萌发,分别降低了20.6%和28.0%;而10 g/L的叶水浸液较对照显著抑制了红三叶种子的萌发率,降低了20.6%。而在相同的处理浓度下,红三叶种子萌发率对扁穗牛鞭草不同部位水浸液的敏感程度为叶最敏感,茎次之,根最不敏感,此研究结果与李春龙[11]和骆跃[12]的研究结果一致。
2.2 扁穗牛鞭草水浸液对红三叶幼苗生长的影响
扁穗牛鞭草根、茎、叶水浸液对红三叶幼苗的生长较对照均表现出抑制作用,并且随着水浸液浓度的增加,其抑制效应也有所增强,此研究结果与韩春梅[13]、陈志国[14]和李春龙[15]的研究结果相一致。
当根、茎和叶水浸液浓度达到20 g/L时,显著抑制了红三叶幼苗的根长,分别较对照抑制了14.8%、18.5%和18.5%;低浓度(10 g/L)的根水浸液促进了红三叶幼苗的苗长(较对照促进了3.5%),但与对照差异不显著,而当根、茎和叶水浸液浓度达到20 g /L时,显著抑制了红三叶幼苗的苗长,分别较对照抑制了10.3%、13.8%和13.8%(见表2)。在相同的处理浓度下,红三叶幼苗生长对扁穗牛鞭草不同部位水浸液的敏感程度也有所不同,叶最敏感,茎次之,根最不敏感。
表3 扁穗牛鞭草水浸液对红三叶幼苗根系生理指标的影响

部位浓度(mg/kg)相对电导率(%)MDA(nmol/g)(FW)POD(U/mg)SOD(U/g)(FW)ASA⁃POD(U/mg)根011.13±2.47d13.52±0.24e1016±96a245±12a21.6±3.1a1015.30±2.11d16.29±0.22de871±22a197±13b12.2±0.8b2019.05±2.55d24.21±0.89d700±24b172±8b11.7±0.3bc4029.91±1.75c36.66±4.25c573±48bc137±8c9.4±0.5bc8041.02±3.37b50.81±1.89b478±56c120±8c8.6±1.3bc16056.89±4.52a62.03±4.50a413±35c87±5d6.3±2.1c茎011.13±2.47d13.52±0.24e1016±96a245±12a21.6±3.1a1016.61±2.73d17.59±1.41de838±21b186±13b11.7±0.4b2021.77±2.17d25.42±0.35d669±23c163±7b10.8±0.2b4033.12±1.92c38.10±4.44c533±50cd127±8c8.9±0.1bc8043.87±4.17b56.24±1.39b449±58d111±8c7.7±0.5bc16059.46±5.32a67.31±4.81a380±41d80±5d5.5±1.7c叶011.13±2.47e13.52±0.24e1016±96a245±12a21.6±3.1a1018.48±3.12de22.10±1.58de805±21b167±13b9.0±0.8b2025.49±3.48d30.98±1.49d638±23bc147±6b8.5±0.5b4044.84±2.20c46.13±6.74c493±52cd112±7c7.9±1.0b8065.19±3.39b63.64±2.06b419±60d97±7c6.4±0.4b16080.38±3.49a80.19±4.80a346±47d67±4d4.6±1.3b
2.3 扁穗牛鞭草水浸液对红三叶幼苗干重的影响
扁穗牛鞭草根、茎和叶水浸液对红三叶幼苗干重较对照均表现为抑制作用,并且随着水浸液浓度的增加,其抑制效应也有所增强(见图1),此结果与Han等[16]的研究结果相一致。

图1 不同部位、不同浓度扁穗牛鞭草水浸液对红三叶幼苗干重的影响
40 g/L的根和茎水浸液较对照显著抑制了红三叶幼苗的干重,分别为7.9%和12.9%;而10 g/L的叶水浸液较对照显著抑制了红三叶幼苗的干重(15.8%)。在相同的处理浓度下,红三叶幼苗干重对扁穗牛鞭草根、茎、叶水浸液的敏感程度也有所不同,叶最敏感,茎次之,根最不敏感。
2.4 扁穗牛鞭草水浸液对红三叶幼苗根系生理指标的影响
与对照相比,随着水浸液浓度的增加,所有部位的扁穗牛鞭草水浸液对红三叶幼苗根系的相对电导率、丙二醛含量均呈递增的趋势(见表3)。根和茎水浸液浓度达到40 g/L时,相对电导率较对照显著增加,分别为对照的2.69倍和2.98倍;而叶水浸液浓度达到20 g /L时与对照形成显著性差异,为对照的2.29倍;当根、茎、叶水浸液浓度达到20 g /L时,丙二醛含量均与对照形成显著性差异,分别为对照的1.79倍、1.88倍和2.29倍。
与对照相比,随着水浸液浓度的增加,所有部位的扁穗牛鞭草水浸液对红三叶幼苗根系的抗氧化酶活性(POD、SOD、ASA-POD)均呈递减的趋势(见表3)。根水浸液浓度达到20 g/L时,红三叶幼苗根系POD活性较对照显著降低,降低了31.10%,而茎和叶水浸液浓度达到10 g/L时,显著降低了POD活性,分别较对照降低了17.52%和20.77%;而SOD活性均在根、茎、叶水浸液浓度达到10 g/L时显著降低,分别较对照降低了19.59%、24.08%和31.84%;ASA-POD活性也是在根、茎、叶水浸液浓度达到10 g/L时显著降低,分别较对照降低了43.52%、45.83%和58.33%。
3 讨论与结论
3.1扁穗牛鞭草对豆科牧草红三叶种子萌发具有化感作用,表现在发芽率、幼苗根长、苗长、幼苗干重等的差异上。但受试植物种子萌发及幼苗生长对扁穗牛鞭草根、茎、叶水浸液的敏感程度不同(叶最敏感,茎次之,根最不敏感),同一部位水浸液在不同处理浓度下的作用也不同。为了减轻扁穗牛鞭草茎和叶通过雨水淋溶对其间作牧草红三叶造成的化感抑制作用,建议在收获扁穗牛鞭草时,将其残留在混播草地的扁穗牛鞭草(主要是茎和叶)处理掉。此结果与刘金平等[2]的研究结果一致。
3.2随着所有部位扁穗牛鞭草水浸液浓度的增加,红三叶幼苗根系相对电导率和丙二醛含量均呈递增趋势,而抗氧化酶(POD、SOD、ASA-POD)活性均呈递减趋势,并且在同一浓度下,扁穗牛鞭草水浸液对红三叶幼苗根系生理指标的影响强度顺序也为叶gt;茎gt;根。由此可见,扁穗牛鞭草水浸液不仅对红三叶种子萌发及幼苗生长具有抑制作用,而且对红三叶幼苗根系生理指标也具有明显的抑制作用。此结果与Han等[17]的研究结果一致。
[1]杨菲,黄乾明,杨春华,等.扁穗牛鞭草水浸液化感作用及化学成分分析[J].四川农业大学学报,2008,26(3):232-236.
[2]刘金平,张新全,罗波,等.扁穗牛鞭草浸出液对豆科牧草种子萌发及幼苗生长的影响[J].种子,2005,24(7):5-8.
[3]Tang C S,Young C C.Collection and identification of allelopathic compounds from the undisturbed root system of bigalta limopgrass[J].Plant Physiology,1982,69(1):155-160.
[4]Rice E.L.Allelopathy.Academic press,Orlando,FL.1984.
[5]李春龙.大豆不同部位水浸液对白菜种子萌发的影响[J].湖北农业科学,2010(1):104-105.
[6]李龙秀.水花生不同部位水浸液对草坪草高羊茅种子萌发的影响[J].种子,2012,31(12):85-86.
[7]李春龙.水花生不同部位水浸液对豇豆种子萌发的影响[J].种子,2013,32(7):72-73.
[8]汤章城.现代埴物生理学实验指南[M].北京:科学出版社,1990.
[9]王韶唐.植物生理学实验指导[M].西安:陕西科学技术出版社,1986:35-151.
[10]陈建勋,王晓峰主编.植物生理学实验指导[M].广州:华南理工大学出版社,2002:119-124.
[11]李春龙.水花生不同部位水浸液对苜蓿种子萌发的影响[J].种子,2011,30(8):65-66.
[12]骆跃.辣子草不同部位水浸液对萝卜种子萌发的影响[J].蔬菜,2013(10):19-20.
[13]韩春梅.菊叶鱼眼草水浸液对白菜种子萌发和生长的影响[J].蔬菜,2014(1):13-14.
[14]陈志国.辣子草不同部位水浸液对白菜种子萌发的影响[J].园艺与种苗,2012(4):1-2.
[15]李春龙.大豆不同部位水浸液对萝卜种子萌发的影响[J].农技服务,2012(11):1 202-1 203.
[16]Han Chun-mei,Pan Kai-wen,Wu Ning et al.Allelopathic effect of ginger on seed germination and seedling growth of soybean and chive[J].Scientia Horticulturae,2008(116):330-336.
[17]Han Chun-mei,Li Chun-long,Ye Shaoping et al.Autotoxic effects of aqueous extracts of ginger on growth of ginger seedings and on antioxidant enzymes,membrane permeability and lipid peroxidation in leaves[J].Allelopathy Journal,2012,30(2):259-270.
Allelopathic Study ofHemarthriacompressaon Red Clover
LIChunlong
(Chengdu Agricultural College,Department of Modern Agriculture,Chengdu Sichuan 611130,China)
Allelopathy ofHemarthriacompressawith different parts (root,stem and leaf) aqueous extracts at different concentrations (0,10,20,40,80 g/L and 160 g/L) was studied and Red clover seeds were as the accepted bodies.The results showed that compared with the control,effects of aqueous extracts with all parts ofHemarthriacompressaon seed germination rate,seedling growth (root length and shoot length) and dry weight of Red clover seedling tended to the same tendency.Namely inhibition by 4 measured index increased with the increase in concentration ofHemarthriacompressaaqueous extracts.While under the same concentration,the order of effect ofHemarthriacompressaaqueous extracts on seed germination and seedling growth of red clover was leafgt;stemgt;root.Compared with the control,relative electrical conductivity and MDA content of red clover seedling root tended to increase under the treatment of all parts ofHemarthriacompressaaqueous extracts while antioxidant enzyme namely POD,SOD,ASA-POD activities tended to decrease.At the same concentration,the order of effect ofHemarthriacompressaaqueous extracts on of physiological indexes of red clover seedling root was leafgt;stemgt;root.
Hemarthriacompressa; allelopathy; red clover; seed germination; seedling growth;
2015-12-20
四川省重点专业(作物生产技术专业)建设项目。
李春龙(1976—),男,内蒙古通辽人;硕士,副教授,高级农艺师,主要从事特种经济作物栽培、设施农业等教学工作;E-mail:460826686@qq.com。
10.16590/j.cnki.1001-4705.2016.07.034
S 543
A
1001-4705(2016)07-0034-04

