口香糖中多种色淀类色素的检测方法
房英杰,颜显辉,于军强
(荣成出入境检验检疫局,山东 荣成 264300)
口香糖中多种色淀类色素的检测方法
房英杰,颜显辉,于军强
(荣成出入境检验检疫局,山东 荣成 264300)
建立口香糖中的柠檬黄、靛蓝、日落黄、诱惑红、亮蓝和赤藓红的液相色谱分析方法。该方法利用二极管阵列检测器中的多波长检测模式,对色素进行有效分离,实验结果表明,质量浓度在0.2~10.0 mg/kg时,各组分校准曲线的相关系数均大于0.999,方法的检出限(S/N=3)为0.01~0.04 mg/kg,样品加标回收率均在70%~87%,相对标准偏差(RSD)为3.1%~6.6%,方法的灵敏度和精密度均符合相关要求,该方法具有快速、准确、操作简单等特点,适用于口香糖中色淀类色素的检测。
口香糖;高效液相色谱;二极管阵列检测器
随着食品工业的发展,色素由于可有效改善食品的色泽,被广泛应用于食品加工业中[1]。食用色素是以食品着色为目的的一类食品添加剂[2],我国对色素的使用范围及使用量在GB 2760-2014中有明确规定[3]。色素在口香糖中的使用通常以色淀的方式添加,色淀由于水溶性差,检测时提取困难。因此,研究一种可行的口香糖色素(含色淀)的检测方法,可有效地控制色素的含量,保障消费者的安全。本研究在参考各种文献[4-6]的基础上,建立了一种适合于口香糖中色素的测定方法。
1 试验材料
1.1仪器
超声波清洗仪,HSC-12A;半自动固相萃取仪,美国supelco公司;Agilent 1260液相色谱仪,美国Agilent公司;ODS色谱柱,ZORBAX SB-C18,5 μm,150 mm×4.6 mm;漩涡混合器,IKA MS3;纯水仪,密理博;电子天平,MELLTER AB204-S;离心机,日立;冰箱。
1.2试剂及溶液
柠檬黄标准品、日落黄标准品、亮蓝标准品、靛蓝标准品、诱惑红标准品和柠檬黄铝色淀,浓度36%~39%;日落黄铝色淀,浓度38%~42%;亮蓝铝色淀,浓度28%~31%;靛蓝铝色淀,浓度30%~~36%;诱惑红铝色淀,浓度38%~42%;赤藓红铝色淀,浓度38%~42%。以上各试剂均购自美国卡乐康公司。
甲醇,色谱纯;乙腈,色谱纯;乙酸铵,优级纯;氢氧化钠,分析纯;PEP-plus 500 mg/6 mL固相萃取小柱,艾杰尔;C18固相萃取小柱500 mg/6 mL;乙酸铵,分析纯;氢氧化钠,分析纯;氮气。
2 试验方法
2.1样品提取
称取2.0 g样品于50 mL离心管中,加入15 mL 60 ℃0.02 moL/L氢氧化钠溶液,再加入5 g海砂,涡旋混匀1 min,再以3 500 r/min离心10 min,取上清。残渣加入10 mL提取液重复提取一次,以3 500 r/min离心10min,取上清与第一次提取液合并混匀。将上清液转移至125 mL的容量瓶中,加入30 mL正己烷,振荡混合1 min,静置分层后弃去正己烷层。下层液体加入30 mL的正己烷,振荡混合1 min,静置分层后取下层12.5 mL液体作净化处理。
2.2样品的净化
采用PEP-plus 500 mg/6 mL固相萃取小柱净化,固相萃取小柱分别用5 mL甲醇,5 mL水淋洗,12.5 mL提取液过柱,再用2 mL水淋洗柱子,吹干固相萃取小柱内的液体,用3 mL 5%氨水甲醇洗脱。洗脱液置40 ℃水浴中氮吹至1~2 mL,加水定容至5 mL,取1.5 mL溶液置1.5 mL离心管中,10 000 r/min转离心5 min,取上清液上机测定。
2.3仪器条件
流速:1.5 mL/min;柱温:25℃;色谱柱:ZORBAX SB-C18,5 μm,150 mm×4.6 mm;进样量:20 μL;流动相:A为pH7.5的1%的乙酸铵溶液,B为甲醇∶乙腈=80∶20(体积比);梯度洗脱程序为:0~2.0 min,100% A;2.0~22.0 min,100%~48%A;22.0~40.0 min,48%~10%A;40.0~43.0 min,10%~100%A。二极管阵列检测器检测波长变化程序为:0~8.5 min,427~610 nm;11.0~14.0 min,485~505 nm;18~23 min,630~530 nm。
3 结果与讨论
3.1标准曲线
在0.2、0.4、1.0、4.0 mg/kg和10.0 mg/kg 5个浓度范围内,柠檬黄、靛蓝、日落黄、诱惑红、亮蓝和赤藓红6种色素均具有较好的线性,相关系数均为0.9998。
3.2分离条件
本研究中采用梯度洗脱的方式对色素进行分离,从图1可看出,柠檬黄、靛蓝、日落黄、诱惑红、亮蓝和赤藓红6种色素基线完全分离,峰形尖锐对称。

图1 6种色素液相色谱图
3.3检测波长的选择
目前国家标《食品中合成着色剂的测定》(GB/T 5009.35-2003)采用的检测波长为254 nm,检验检疫行业标准《食品中的诱惑红、酸性红、亮蓝、日落黄的含量检测 高效液相色谱法》(SN/T 1743-2006)也采用这一检测波长。本实验中,采用DAD检测器对目标色素的最大吸收波长进行扫描,从扫描的结果可看出,柠檬黄、靛蓝、日落黄、诱惑红、亮蓝和赤藓红的紫外区外最大吸收波长分别为:427、610、485、505、630 nm和530 nm。
3.4回收率
从表1中可看出,在0.5、1.0、5.0 mg/kg 3个浓度下,柠檬黄的回收率在73.2%~77.0%,靛蓝的回收率在78.6%~82.4%,日落黄回收率在78.6%~82.4%,诱惑红回收率在80.5%~86.3%,亮蓝回收率在70.8%~74.1%,赤藓红回收率在72.6%~74.3%,6种色素均具有较好的回收率。
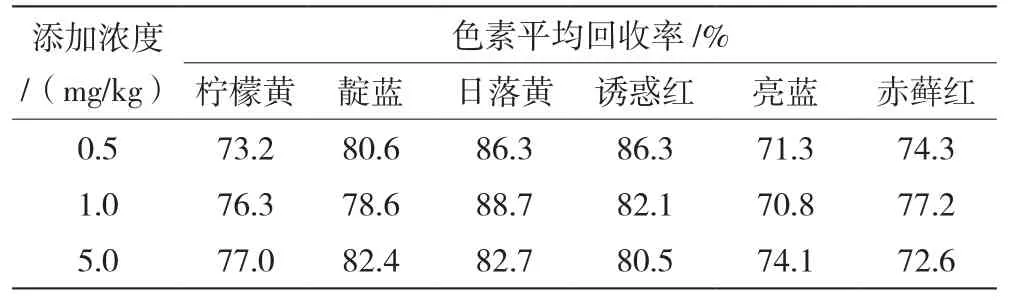
表1 不同添加浓度下6种色素的回收率表
3.5精密度
从表2中可看出,在0.5、1.0、5.0 mg/kg 3个浓度下,柠檬黄精密度在4.0%~5.6%,靛蓝精密度在5.0%~6.3%,日落黄精密度在3.1%~4.8%,诱惑红精密度在5.5%~6.6%,亮蓝精密度在3.5%~5.3%,赤藓红精密度在4.6%~5.1%,6种色素均具有较好的精密度。

表2 不同添加浓度下6种色素的精密度表
3.6检出限
以1.0 mg/kg的色素标准品添加空白样品,根据3倍信噪比计算检出限,柠檬黄、靛蓝、日落黄、诱惑红、亮蓝和赤藓红的检出限分别为0.01、0.04、0.01、0.02、0.01 mg/kg和0.02 mg/kg。
4 结语
口香糖中的柠檬黄、靛蓝、日落黄、诱惑红、亮蓝和赤藓红6种色素在0.2~10.0 mg/kg内均具有良好的线性,加标回收率在70%~87%,本方法具有灵敏度高、重复性好等特点,适用于口香糖中色素的测定。
[1]霍艳敏,王 骏,张 卉,等.高效液相色谱法同时测定冰淇淋中的10种合成色素[J].分析测试学报,2011(6):670-673.
[2]顾宇翔,葛 宇,印 杰,等.饮料和糖果中32种水溶性色素的HPLC筛选性检测[J].食品工业,2012(8):142-145.
[3]中华人民共和国国家卫生和计划生育委员会. GB 2760-2014 食品安全国家标准 食品添加剂使用标准[S].北京:中国标准出版社,2014.
[4]张国华,孙磊龙,杨志华.高效液相色谱测定雪糕中色素[J].中国卫生检验杂志,2013(9):2043-2045.
[5]李 伟,穆永娟,吴 凡,等.饮料中色素含量的高效液相色谱-二极管阵列测定法[J].职业与健康,2015(12):1618-1621.
[6]王 妍,于忠飞,王丽丽.高效液相色谱法测定山楂糕中色素的方法探讨[J].分析与测试,2012(5):45-47.
Detection Method of Multiple Lake Pigments in Chewing Gum
Fang Yingjie, Yan Xianhui, Yu Junqiang
(Rongcheng Entry-Exit Inspection and Quarantine Bureau, Rongcheng 264300, China)
Liquid Chromatography analysis method for tartrazine、indigo blue、sunset yellow、temptation red、brilliant blue and erythrosine in chewing gum is established. This method uses multi wavelength detection mode in diode array detector and the pigments is separated effectively. The experimental result shows that the concentration between 0.2~10.0 mg/kg, the correlation coefcient of standard curve is greater than 0.999.The detection limits(S/N=3)for the method is 0.01~0.04 mg/kg. The rate of recovery for samples is 70%~87%; RSD is 3.1%~6.6%. The sensitivity and precision of the method met the relevant requirements. With rapidly, accurately, simple operation, this method is applicable to detection of multiple lake pigments in chewing gum .
Chewing gum; HPLC; Diode array detector

TS207.3
10.16736/j.cnki.cn41-1434/ts.2016.18.043

