鸡胸肉冷藏过程中腐败菌分析及其品质变化研究
梁慧,于立梅,陈秀兰,赵宇鹏,曾晓房,卜坚珍
1(仲恺农业工程学院 轻工食品学院,广东 广州,510225) 2(广州市畜牧科学研究所,广东 广州,510095) 3(广东第二师范学院,广东 广州,510303)
鸡胸肉冷藏过程中腐败菌分析及其品质变化研究
梁慧3,于立梅1*,陈秀兰2,赵宇鹏1,曾晓房1,卜坚珍1
1(仲恺农业工程学院 轻工食品学院,广东 广州,510225) 2(广州市畜牧科学研究所,广东 广州,510095) 3(广东第二师范学院,广东 广州,510303)
为了探讨冷鲜鸡肉的主要腐败菌及其冷藏过程中菌相的变化,以鸡胸肉为原料, 采用传统微生物培养方法和16S rDNA测序相结合方法对冷鲜鸡肉腐败菌进行了分离鉴定。研究腐败菌在冷藏过程中动态变化及冷藏对鸡肉品质的影响。结果表明:乳酸菌、葡萄球菌、肠杆菌、假单胞菌是冷鲜鸡鸡胸肉中的主要腐败菌。初始菌相构成中,乳酸菌和葡萄球菌所占比例最大,为35%,肠道杆菌占29%,假单胞菌占最少,仅为1%。冷藏末期,冷鲜鸡中主要腐败菌菌相构成发生了显著变化。葡萄球菌生长较慢占1%,假单胞菌占2%,乳酸菌占18%,肠道杆菌占79%。随着冷藏时间的延长各类腐败菌均呈现增长趋势,但增长速率不同。葡萄球菌初期增长较快,末期较慢,肠杆菌及乳酸菌反之,并逐渐成为优势菌群,假单胞菌则一直保持较慢的增长速度。质构和感官评价表明:随着冷藏时间的递增,冷鲜鸡胸肉弹性下降,黏度增加,9天后鸡肉开始腐败变味,感官品质明显变差。
鸡胸肉; 腐败菌;分离; 消长
鸡肉中富含很多人体所需的蛋白质,且相对其他品种的肉,其脂肪和胆固醇含量低,目前是我国主要肉类品种之一,备受消费者喜欢。我国主要存在种类是以艾维茵为代表的快大型白羽肉鸡和以我国地方品种为代表的优质黄羽肉鸡。三黄鸡的商品经济价值位于家禽养殖之首。 惠阳胡须鸡有1 700年的养殖历史,早在1983年,龙门鸡、龙岗鸡、惠阳鸡就被归为一类,命名为三黄胡须鸡,此鸡外貌特征比较明显,通常胸比其他鸡种宽、鸡脚相对短些,毛、脚、嘴都是黄色、下颌还有一撮胡须, “三黄一胡”特征是三黄胡须鸡独有的特色。作为中国优良地方肉用鸡种,此鸡主要表现为肉质细嫩、皮薄、肌间脂肪适量,肉味鲜美等[1-2]。广东省三大出口名产鸡为肇庆市封开县的杏花鸡、惠阳胡须鸡和清远市的麻鸡。2014年广东省农业厅已牵头拟订了《广东省推行家禽“集中屠宰、冷链配送、冰鲜上市”工作实施方案》,冷鲜禽肉的安全成为人们最关心的话题。冷鲜鸡是指在兽医检验检疫安全的基础上,将屠宰后的鸡胴体温度迅速冷却至0~4 ℃,并在整个食品供应链始终保持0~4℃范围内的生鲜鸡肉[3]。冷鲜鸡肉在低温贮藏条件下,有部分致腐微生物存在并生长繁殖,其代谢过程产生的某些物质会引起腐败变质,因此微生物的数量与冷鲜鸡肉的品质密切相关。本文以鸡胸肉为研究对象,采用传统微生物培养方法和16S rDNA测序相结合方法对冷鲜鸡肉腐败菌进行分离鉴定。研究鸡肉冷藏过程中腐败菌的消长规律及鸡肉感官品质变化,将有利于收集冷鲜鸡肉中微生物的信息,以便对产品的质量进行控制。
1 材料与方法
1.1 实验材料
供试鸡肉品种为纯种三黄胡须鸡,冷鲜胡须鸡取自广州市畜牧研究所养殖基地,并由广州市畜牧所加工厂定点屠宰。取4 ℃下贮运40 min的新鲜鸡胸肉,冲洗表面血污,将其切分成约25 g的块状,置于4 ℃下进行24 h排酸后备用。各类腐败菌(葡萄球菌、肠道菌、乳酸菌、假单胞菌)的选择培养基购于北京奥博星公司。DNA 快速抽提试剂盒、琼脂糖、PCR扩增的全套试剂及合成的扩增引物,由上海美吉生物医药科技有限公司提供; 1%盐酸二甲基对本二胺、1% α-萘酚-乙醇溶液、革兰氏染色试剂盒、氢氧化钾、磷酸氢二钾购于广州硕玛仪器科技有限公司。
1.2 仪器
DU-730型紫外可见分光光度计,日本岛津分析仪器厂;高压灭菌锅BXM-30R,上海博讯实业有限公司;电热恒温培养箱,上海索谱仪器有限公司;旋转蒸发器RE-52AA,上海亚荣生化仪器厂;超净工作台SW-CJ-1F,苏州净化设备有限公司;PCR仪TL988-IV,西安天隆科技有限公司。
1.3 实验方法
1.3.1 腐败菌的分离纯化
剪刀消毒后,无菌环境下剪25 g鸡胸肉放入无菌培养皿,剪碎后置于三角瓶中,倒入225 mL无菌生理盐水,把三角瓶振荡后放在摇床中振荡10 min后取出。取2 mL上清液于试管中,再加入18 mL无菌生理盐水,按照预试验选择3个合适稀释度菌液1 mL加入无菌培养皿中,每个样品平行3次,加入平板计数琼脂培养基,待凝结后于30 ℃下倒置培养48 h;然后挑取典型生长菌落在营养琼脂平板上进行划线培养2~3次,得到纯化的单菌落,用于菌种的初步鉴定[4-5]。其中,肠道菌计数琼脂培养基和葡萄球菌计数琼脂培养基均于37 ℃培养48 h,乳酸菌选择性培养基、假单胞菌选择性培养基和热死环丝菌选择性培养基分别在30 ℃培养48 h,25 ℃培养48 h, 23 ℃培养48 h。
1.3.2 腐败菌的初步鉴定
腐败菌的初步鉴定根据《常见细菌系统鉴定手册》和Brown推荐的肉制品中微生物鉴定图谱,对分离纯化的7株菌进行菌落和个体形态、染色反应及酶反应(接触酶、氧化酶)、葡萄糖发酵、精氨酸双水解酶和V-P等生理生化指标的检测[6-7]。
1.3.3 腐败菌的16S rDNA测序
挑取重新培养18~24 h的单菌落至液体培养基中过夜培养,采用细菌基因组 DNA 快速抽提试剂盒直接提取 DNA,提取的 DNA 作为该菌株的扩增模板,于-20 ℃保存待下一步实验。16S rDNA 的 PCR扩增以提取的 DNA 作为模板,采用通用引物 27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-AAGGAGGTGATCCAGCCGCA-3’)来扩增目的片段的基因[8-9],测序由上海美吉生物医药科技有限公司完成。
1.3.4 鸡肉冷藏过程中腐败菌菌数的测定[10]
取排酸后的鸡胸肉,按纹理关系切割,尺寸为5 mm×4 mm×1 mm。将鸡胸肉装入保鲜袋里放入冷藏箱(冰箱)中4 ℃冷藏,样品取样时间分为0,3,6,9 d,按GB/T4789.2—2010《食品微生物学检验菌落总数测定》对冷鲜肉鸡肉进行菌落总数、肠道菌群、乳酸菌群、葡萄球菌群、假单胞菌群测定,测定数据制作各类微生物生长曲线。
1.3.5 鸡肉在冷藏过程中感官评价
由经过培训的感官人员10人组成感官评价小组,总分为10分,评价的指标分别为冷鲜鸡肉的色泽、黏度、 弹性、气味以及肉汤,将各个指标得分加权后相加所得到的总分即为最终得分。

表1 鸡肉在贮藏期间感官评定指标标准
1.3.6 冷鲜鸡肉质构测定
采用美国 Brookfield 公司的CT3质构仪测定冷鲜鸡胸肉,在进行测试时,初步选用鸡胸肉,按纹理关系切割为尺寸50 mm×40 mm×10 mm。将鸡胸肉装入保鲜袋里放入冷藏箱中4 ℃冷藏,在室内(室温15 ℃,相对湿度 38%)条件下进行测试。采用圆柱型探头,探头的直径为12.7 mm、预压力为0.07 N、可恢复时间为6 s、速度为4 mm/s、压缩形变量为5 mm。
1.3.7 数据分析
每个试验均重复3次。结果表示为平均值±标准偏差, 应用SPSS11.5软件(SPSS Inc., Chicago, IL, USA)进行方差和差异显著性分析,P<0.05表示显著,P<0.01表示极显著。
2 结果与分析
2.1 菌种的个体形态、菌落形态及生理生化鉴定
通过传统微生物分离方法,从不同培养基上分离各类菌,在显微镜下观察前,单菌落要经革兰氏染色,记录显微镜观察其形态结构及其在固体培养基上的菌落特征,菌落的特征见表1。由表1可以看出,7株菌落中3株为革兰氏阴性菌,4株革兰氏阳性菌。颜色由奶白、浅土黄、乳白3种颜色组成,分为半透明和不透明,呈现三角形,圆形,杆状、乳头状。根据表2的结果,结合Brown推荐的肉品中微生物鉴定图谱以及《常见细菌系统鉴定手册》,通过各菌株在显微镜下的菌体形态、革兰氏染色情况,结合各菌的菌落特征及生理生化特征,葡萄球菌为圆形、球状、白色革兰氏阳性菌,肠道杆菌为杆状、浅黄色革兰氏阴性菌,乳酸菌为圆形、透明或半透明、杆状革兰氏阳性菌,假单胞菌为圆形、半透明、杆状革兰氏阴性菌,初步鉴定结果为:1为假单胞菌2、4为乳酸菌3、6为杆菌5、7为球菌。

表1 菌落特征及菌株形态
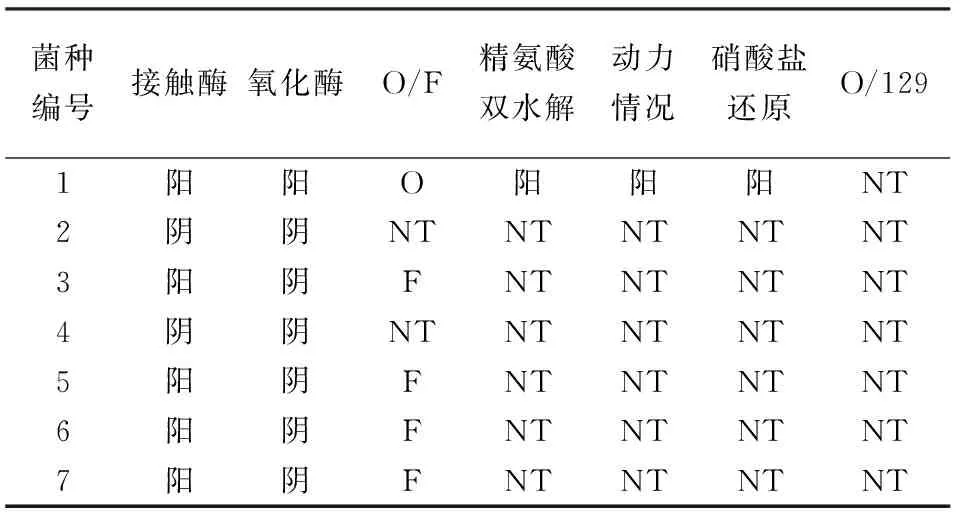
表2 生理生化试验结果
注:F代表发酵型;O代表氧化型;NT表示未检测。
2.2 16S rDNA测序结果
对冷鲜鸡中分离纯化的7株菌进行16SrDNA测序,根据PCR扩增的DNA序列对比结果表明,1为假单胞菌P.Fluorescens,2、4为乳酸菌,3为肠道杆菌、5、7为葡萄球菌,6为克氏库克菌。与传统理化鉴定结果有较多共同菌,综合判断结果为,冷鲜鸡中主要腐败菌为葡萄球菌、肠杆菌、乳酸菌及假单胞菌。

表3 各样品测序的种属关系
2.3 冷鲜鸡冷藏过程中腐败菌菌相构成变化
对冷鲜鸡冷藏初期的菌相构成进行分析,并绘制各类主要腐败菌比例图,图1中的数值指的是各种腐败菌占所检腐败菌总数的比例。由图1中可以看出,初始菌相构成中,乳酸菌和葡萄球菌所占比例最大,为35%,其次为肠道杆菌,占了主要腐败菌总数的29%,假单胞菌占最少,仅为1% 。说明早期菌相构成中,主要为乳酸菌、葡萄球菌及肠道杆菌,假单胞菌较少。假单胞是严格好氧菌,冷鲜肉用保鲜膜包装,不利于氧气的流通,初期不同菌相微生物之间也会因拮抗和共生有影响。葡萄球菌在自然界中分布很广,是常见的腐败菌,该菌主要起源于禽类本身[11]。
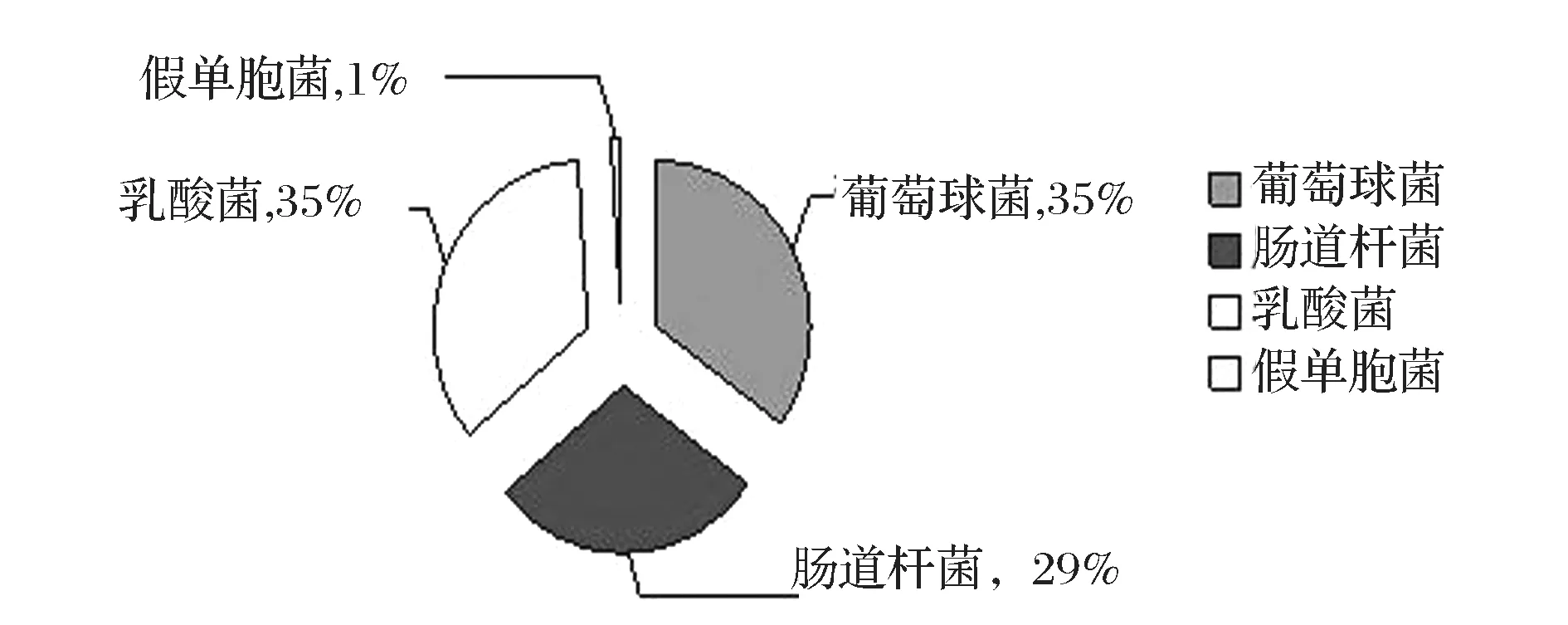
图1 冷鲜鸡冷藏初期菌相构成变化Fig.1 Construction of bacterial flora for initial period

图2 冷鲜鸡冷藏末期菌相构成变化Fig.2 Construction of bacterial flora for final period
图2显示,在冷藏末期(9d),冷鲜鸡中主要腐败菌菌相构成发生了显著变化,葡萄球菌受低温影响,生长较慢占1%,假单胞菌占2%,乳酸菌从初期到末期虽然有减少,但速度较慢,末期占18%,杆菌从初期的29%,快速增长到占总数的79%,从数据上看,贮藏末期肠杆菌占绝对优势。在冷藏温度和高湿度下有利于其生长。鸡肉因为大量杆菌在表面生长繁殖,会产生黏液。同时杆菌也能分解鸡中的某些脂肪而加速脂肪的氧化作用,引起肉类酸败[12]。乳酸菌末期占18%,成为腐败的优势菌。葡萄球菌较早期比例降低很多,可能是乳酸菌在生长繁殖的过程中产生酸,导致各菌株生长区域pH值降低,形成反馈抑制。假单胞菌比例基本不变说明对环境不敏感。
2.4 冷鲜鸡冷藏过程中的菌相消长变化
图3为冷藏过程中腐败菌的动态变化。图3显示,在贮藏过程中,各类主要腐败菌均呈增长趋势,初期1~3 d葡萄球菌群数、肠道杆菌数、乳酸菌数远远高于假单胞菌,中期时乳酸菌占主要优势,末期时肠杆菌和乳酸菌显著高于其他2种,其中6~9 d范围内葡萄菌属反而稍微下降,这可能是菌种之间的协同和拮抗作用。从繁殖速率来看,葡萄球菌增长速度由快变慢,肠杆菌和假单胞菌则由慢变快,乳酸菌则是由慢变快再变慢。冷鲜肉新鲜度指标细菌总数临界值为106CFU/g,此线为为警戒线,超过达到107CFU/g 时冷鲜肉会出现腐败状况,细菌总数达到108CFU/g时,由于微生物的大量繁殖,鸡肉表面会形成粘液,这个形态的冷鲜肉已经不适合食用。肠杆菌与乳酸菌在冷藏过程的第9天,数量值接近菌落总数的临界值。
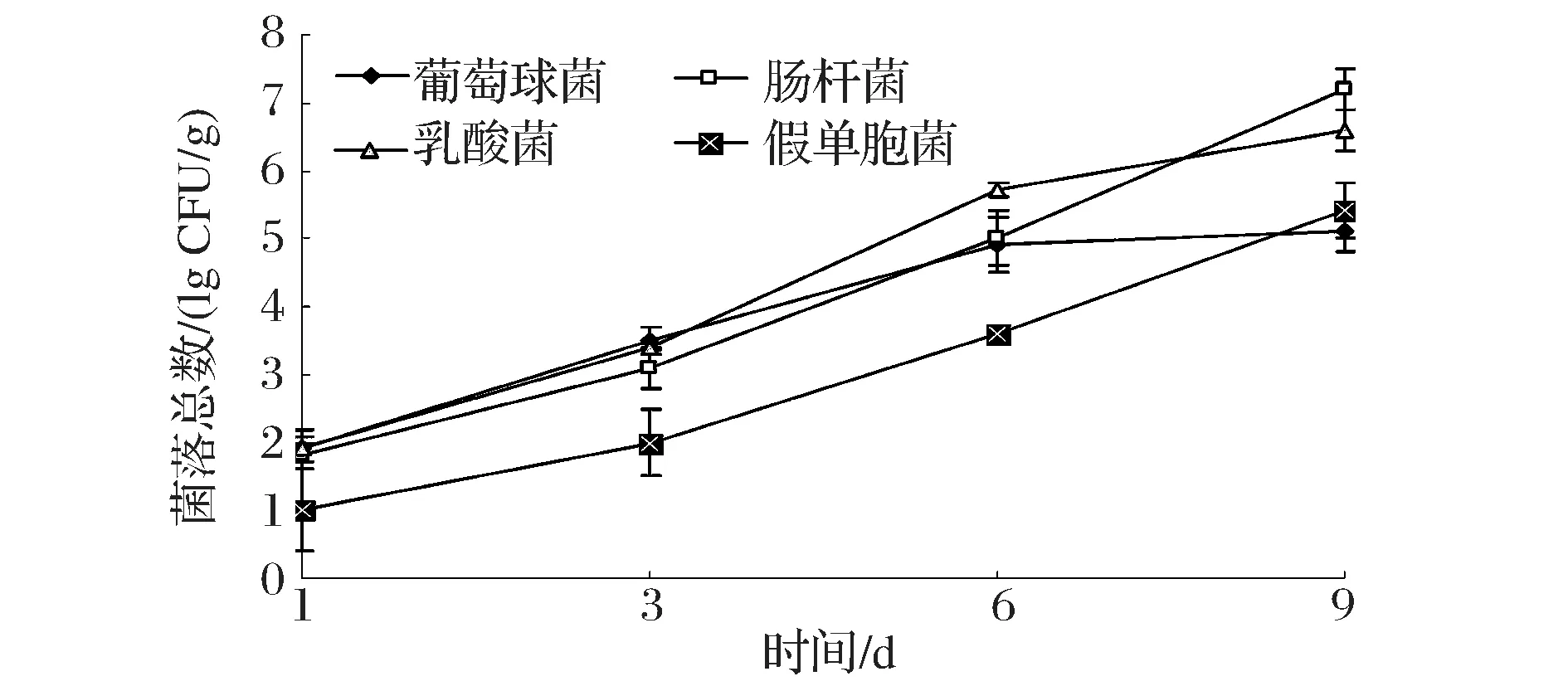
图3 冷鲜鸡冷藏过程中的菌相消长变化Fig.3 The bacteria growth change of chicken during the process of cold storage
2.5 冷鲜鸡冷藏过程中质构变化
由图4可知,鸡胸肉硬度随着时间的增大表现出下降的趋势,1~3 d变化趋势下降趋势较明显,鸡胸硬度由6.13 N至4.89 N,下降了1.24 N,鸡胸由第3~5 d显示出上升的趋势,可能是由于鸡屠宰后肉样持水力下降,内部结构组织被破坏,弹性下降出现紧实感,使底部效应加强致使硬度值变大。可恢复形变随着时间的增长同样表现出下降的趋势,说明肉样恢复自身形变的程度逐步下降,恢复自身结构的能力降低。鸡胸弹性在1~5 d内变化不明显,波动性下降又回升,第5~7 d以后逐步升高,上升趋势可能是由于肉样变质,表面粘性增大,探头返回时回拉扯肉样上升,使测得的数据偏离真实弹性值。鸡胸的胶黏性随着时间的增大均逐步下降,说明组成样品结构的内部键力逐渐减小,产生不可恢复形变所需要的功也逐渐减小。感官评价表明:冷鲜鸡肉在冷藏过程中弹性、黏性、味道有较大变化,结合菌落总数分析,贮藏初期,腐败菌总数较少,鸡肉虽然弹性较低,但色泽、气味较好,贮藏中期,微生物总数增加,对鸡肉气味及色泽产生一定影响,贮藏末期,微生物总数较多,肠杆菌占据总菌数一半以上,导致鸡肉出现异味,色泽变暗,肉汤较差。
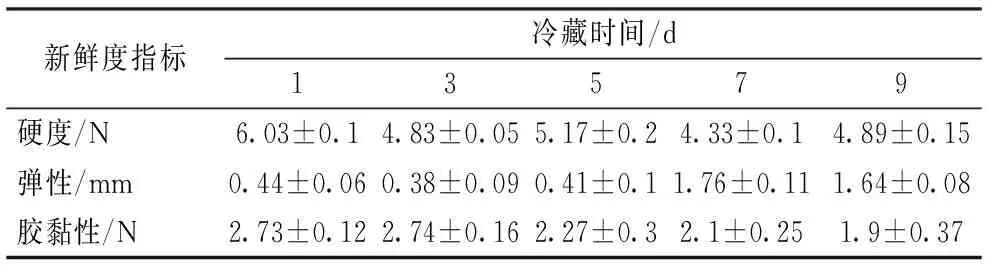
表4 冷鲜鸡冷藏过程中新鲜度指标的变化
3 结论
传统生理生化试验鉴定冷鲜鸡中腐败微生物结果表明,冷鲜鸡中腐败微生物有肠杆菌、葡萄球菌、乳酸菌及假单胞菌, 16S rDNA检测结果表明,冷鲜鸡中腐败微生物含有肠杆菌、葡萄球菌、乳酸菌、节杆菌、克氏库克菌及假单胞菌等,两者相对比有较多相符合。
应用选择性培养基对冷鲜鸡中肠杆菌、葡萄球菌、乳酸菌及假单胞菌生长特性研究表明,初始菌相构成中,乳酸菌和葡萄球菌所占比例最大,为35%,其次为肠道杆菌,占了主要腐败菌总数的29%,假单胞菌占最少,仅为1% 。冷藏末期,也就是冷鲜鸡微生物指标超过国家标准的第9天,冷鲜鸡中主要腐败菌菌相构成发生了显著变化,葡萄球菌受低温影响,生长较慢占1%,假单胞菌因初期含量较低占2%,乳酸菌虽有增长,但速度较慢,占18%,肠道杆菌快速增长,占79%,为绝对优势。因此,冷鲜鸡主要腐败菌中肠杆菌和乳酸菌占大多数,为优势菌群,葡萄球菌及假单胞菌较少。随着冷藏时间的增加,鸡肉弹性下降,粘度增加,9天鸡肉开始腐败变味,感官品质明显变差。
[1] 李长明,王博善,张耀文,等.饲养三黄鸡注意事项[J].当代畜牧,2013(3):5-6.
[2] 马发顺,王聪.三黄鸡的生长发育规律研究[J].中国动物保健,2010(3):37-40.
[3] 蒋爱民,南庆贤.畜产食品工艺学(第二版)[M].北京:中国农业出版社,2008.
[4] LUND B M,Baird-Parker T C,GOULD G W.The Microbiological Safety and Quality of Food[M]. Gaithersburg Maryland, USA: Aspen Publishers Incorporation,2000:472-506.
[5] 万萍.食品微生物基础与实验技术[M].北京:科学出版社,2004:172.
[6] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:66:242.
[7] Brown M H. Meat Microbiology[M].New York: Applied Science Publishers Ltd,1982:474-475.
[8] 刘梦茵,刘芳,诸永志,等.草鸡煲中腐败菌的分离鉴定[J].食品科学,2011,32(9):156-158.
[9] EFRON B, HALLORAN E,HOLMES S.Bootstrap confidence levels for phylogenetic trees[J].Proceedings of the National Academy of Sciences, 1996,93(14):7 085-7 090.
[10] 刘秀梅.GB/T 4789. 2—2010.食品卫生微生物学检验菌落总数测定[S].辽宁出入境检验检疫局
[11] SHALEA K,LUES J F R,VENTER P,et al.The distribution ofStaphylococcussp. on bovine meat from abattoir deboning Rooms[J].Food Microbiology, 2005, 22(5): 433-438.
[12] RUSSO F,ERCOLINI D,MAURIELLO G,et al.Behaviour ofBrochothrixthermosphactain presence of other meat spoilage microbial groups[J].International Journal of Food Microbiology,2006,23(8):797-78.
Analysis on spoilage strains in chicken breast and quality change during its cold storage
LIANG Hui1, YU Li-mei1*, CHEN Xiu-lan2, ZHAO Yu-peng1, ZENG Xiao-fang1, WU Jie3
1(College of Light Industry and Food Technology, Zhongkai University of Agriculture and Engineering, Guangzhou 510225, China) 2(Guangzhou science institute of animal husbandry,Guangzhou 510095, China) 3(National Engineering Research Center of Corn Deep Processing,Changchun 130033, China)
In order to investigate the spoilage bacteria in chill fresh chicken and its quality change during the process of cold storage, the chicken breast was chosen as raw material, and the microorganisms in chicken breast were separated and identified by the traditional microbial cultivation combined with 16S rDNA sequencing method. The changes of these microorganisms and sensory evaluation also were studied during the process of cold storage. The results showed that Lactic acid bacteria,Staphylococcusaureus,E.coli, andPseudomonaswere major spoilage bacteria in chicken breast. Lactic acid bacteria andStaphylococcusaureusaccounted for the largest proportion of 35%,Enterobacteriaceaefor 29%,Pseudomonasaccountsfor only 1% in initial bacteria phase. The constitution of major spoilage bacteria changed dramatically at the end of cold storage. TheStaphylococcusgrew more slowly, and accounted for 1%,Pseudomonasaccounted for 2%, lactic acid bacteria accounted for 18%, intestinal bacteria accounted for 79%. The change of each kind of spoilage bacteria during the process of storage showed a growing trend with the extension of storage time. But the growth rate was different. TheStaphylococcus,Enterobacteriaceaeand lactic acid bacteria had the same number in early storage, andPseudomonasnumber was less. LateStaphylococcusgrew fast at first and then slow, on the contrary, intestinal bacteria and lactic acid bacteria grew fast at late stage and became the predominant bacterium group.Pseudomonasalways kept slow growth rate. Combined with the texture and the sensory evaluation, as the cold storage time increasing, chicken elasticity decreased, viscosity increased, the sour chicken began to be spoilage, sensory quality obviously changed.
chicken breast;spoilage bacterial;separate;change
10.13995/j.cnki.11-1802/ts.201610030
硕士研究生(于立梅副教授为通讯作者,E-mail:biyingwang2003@163.com)。
广州市科信局(2014Y2-00187);国家级大学生创新项目(201411347020)
以:2015-10-19,改回日期:2016-03-28

