猪溶菌酶在大肠杆菌中的表达及其复性
朱德伟,蔡国林,陆健
(江南大学 工业生物技术教育部重点实验室,粮食发酵工艺与技术国家工程实验室,生物工程学院,江苏 无锡,214122)
猪溶菌酶在大肠杆菌中的表达及其复性
朱德伟,蔡国林,陆健*
(江南大学 工业生物技术教育部重点实验室,粮食发酵工艺与技术国家工程实验室,生物工程学院,江苏 无锡,214122)
作为C型溶菌酶的一种,猪溶菌酶(Susscrofalysozyme,SSL)是猪体内抵抗外源性疾病的一道重要屏障。鉴于猪在畜牧行业中的重要地位,尤其是在饲用抗生素的使用严重受限的今天,SSL的生产显得尤为迫切。化学合成得到了SSL的编码基因,通过BamHⅠ和HindⅢ双酶切之后与载体pET-28a(+)连接,转化至大肠杆菌BL21(DE3)中诱导表达。在25 ℃、200 r/min条件下,利用0.1 mmol/L的 IPTG诱导8 h,离心发酵液获得菌体。对其进行超声破碎获得重组蛋白包涵体,然后对包涵体进行复性,最终获得了具有生物活性的目的蛋白,并对其酶学性质以及抗菌活性进行了研究。超声破碎后获得了181. 05 mg/L的重组蛋白包涵体,对包涵体进行复性后,比酶活力可达8 032. 78 U/mg,其最适温度为35 ℃,最适pH为6.0,与其理论值基本一致,而其抗菌活性与标准品溶菌酶的作用效果也比较类似,为其规模化生产与进一步应用奠定了理论基础。
猪溶菌酶;大肠杆菌;包涵体;复性
随着健康养殖理念的倡导以及人们对食品安全要求的日益提高,饲用抗生素的使用受到了越来越严格的限制,寻求安全高效的抗生素替代品已经刻不容缓。作为一种天然盐基碱性蛋白质,溶菌酶被广泛应用于食品、医药、生物工程以及饲料等领域[1]。作为C型溶菌酶的一种,猪溶菌酶(Susscrofalysozyme,SSL)是猪体内抵抗外源性疾病的一道重要屏障[2-3]。而鉴于猪在畜牧行业中的重要地位,尤其是在饲用抗生素的使用严重受限的今天,SSL必然存在极为广阔的市场前景。
然而由于来源受限,目前SSL应用的报道还不多见。溶菌酶的生产可分为3类:直接从动植物组织器官提取[4-5],转基因动植物生产[6-7]以及微生物发酵[8-10]。天然提取虽然简便易行,但是效率较低,且不易规模化生产;转基因动植物虽然可以把溶菌酶的提取与高附加值产品的生产有机结合,但是后续分离成本较高,且不能连续化生产;发酵生产不仅可以克服原材料限制的缺陷,且能够规模化连续生产,将成为未来溶菌酶生产的主要方式。
本研究化学合成了SSL的编码基因,通过BamHⅠ和HindⅢ双酶切之后与载体pET-28a(+)连接,转化至大肠杆菌BL21(DE3)中诱导表达。由于大肠杆菌表达系统对蛋白质的翻译后修饰能力较差,一般表达产物以包涵体的形式存在。因此,本研究对得到的溶菌酶产品进行了进一步的复性,以获得具有生物活性的SSL产品。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒
克隆宿主E.coliJM109,由本实验室保藏;克隆载体pPICZA和pMD19-T,购自生工生物工程(上海)股份有限公司;表达载体pET-28a(+),由本实验室保藏;表达宿主BL21(DE3),由本实验室保藏。测试菌种E.coli(ATCC 25922),Staphylococcusaureus(ATCC 25923),Klebsiellapneumoniae(CMCC(B) 46117),Pseudomonasaeruginosa(ATCC 15442) 以及Salmonellaenteritidis(CMCC(B) 50335),购自无锡赛维贸易有限公司;Micrococcusluteus,购自南京建成生物科技有限公司;Bacillussubtilis(Wild Strain, WS),Bacillusamyloliquefaciens(Wild Strain, WS)由本实验室保藏。
1.1.2 试剂与培养基
溶菌酶标准品购自生工生物工程(上海)股份有限公司;BamH Ⅰ和Hind Ⅲ内切酶,T4DNA连接酶,ExTaqDNA聚合酶,购自大连宝生物公司(Takara);PCR试剂,质粒抽提试剂盒,胶回收试剂盒,购自上海生工生物工程有限公司;酵母提取物与胰蛋白胨,购自Oxiod公司;其他试剂均为分析纯,购自国药集团有限公司。LB培养基(g/L),酵母提取物 5,胰蛋白胨 10, NaCl 10,琼脂 20(固体培养基),自然pH,121 ℃灭菌20 min。TSB培养基(g/L),胰蛋白胨 15,大豆蛋白胨 5,NaCl 5,pH为7.2 ± 0.2,121 ℃灭菌20 min。
1.1.3 仪器、设备
SW-CJ-IFD超净工作台,苏州安泰空气技术有限公司;Mastercycler pro PCR仪,德国Eppendorf公司;琼脂糖凝胶电泳仪,美国Bio-Rad公司;H1850R离心机,长沙湘仪离心机仪器有限公司;JY 92-11超声波细胞粉碎仪,宁波新芝生物科技股份有限公司;XB70制冰机,宁波格兰特制冷设备制造有限公司;BCD-265CMX 冰箱,合肥美的荣事达冰箱有限公司;小型垂直电泳仪,美国Bio-Rad公司;JD-801凝胶成像仪,江苏省捷达科技发展有限公司;XMTD-8222恒温水浴锅,上海精宏实验设备有限公司;GI54DWS自动高压蒸汽灭菌锅,致微(厦门)仪器有限公司;FE20精密pH计,Mettler Toledo公司;EL204 电子分析天平,Mettler Toledo公司;UV-2100紫外-可见分光光度计,龙尼柯(上海)仪器有限公司。
1.2 方法
1.2.1 目的基因的合成
根据NCBI的报道,将SSL的原始编码基因(NCBI-ID: 1174173)序列交由生工生物工程(上海)股份有限公司合成。在该片段两端分别加有KpnⅠ&NotⅠ内切酶的酶切位点,经双酶切后与克隆载体pPICZA连接,重组质粒标记为pPICZA-SSL。
1.2.2 目的基因片段的扩增与验证
根据pPICZA-SSL的基因序列设计并合成了扩增引物(见表1),用于目的基因的扩增,在引物的两端引入了BamHⅠ和HindⅢ内切酶的酶切位点。以重组质粒为模板,PCR反应参数为:95 ℃ 10 min,94 ℃ 30 s,52 ℃ 30 s,72 ℃ 30 s,重复30个循环后72 ℃继续延伸10 min。用1%的琼脂糖凝胶电泳鉴定PCR产物并割胶回收。胶回收具体操作参照试剂盒说明。将回收产物与pMD19-T载体连接,送样至生工生物工程(上海)股份有限公司测序。
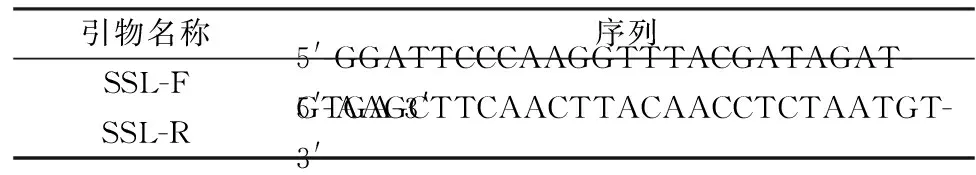
表1 引物序列
1.2.3 表达载体的构建及转化
将含有质粒pMD19-T-SSL的重组大肠杆菌液接种于LB培养基中,37 ℃、200 r/min培养过夜,用抽提试剂盒提取质粒,具体操作按试剂盒说明进行。质粒pET-28a(+)和质粒pMD19-T-SSL用BamHⅠ和HindⅢ内切酶处理之后于16 ℃连接过夜。将连接产物分别转化至E.coliJM109感受态细胞中,菌液涂布于含50 μg/mL Kan的LB固体培养基。阳性克隆经菌落PCR鉴定后,提取重组菌中的质粒,热激法转化至BL21(DE3)的感受态细胞中,将细胞重悬后涂布于含50 μg/mL Kan的LB固体培养基。提取阳性转化子基因组进行PCR鉴定,之后将PCR产物送样至生工生物工程(上海)股份有限公司测序。并对阳性转化子进行BamHⅠ和HindⅢ的双酶切鉴定。
1.2.4 重组蛋白的诱导表达
挑选阳性克隆于LB(含50 μg/mL Kan)固体培养基上划线培养24 h,挑选单菌落接种至含3 mL LB培养基的小试管中37 ℃ 200 r/min中,培养过夜(约16 h)。取300 μL培养液(1%接种量)于30 mL含卡那霉素(加15 μL,终质量浓度为50 μg/mL)的LB培养基中,37 ℃,200 r/min振荡培养,生长过程中无菌条件下测OD600值至0.6(约2.5 h)。然后在培养物中添加IPTG(终浓度为0.1 mmol/L,即30 mL样品中加入30 μL、100 mmol/L的IPTG),25 ℃、200 r/min继续诱导表达8 h。
1.2.5 包涵体复性
将发酵液在10 000 r/min条件下离心5 min,弃上清,用50 mmol/L Tris-HCl(pH 8.0)重悬洗涤菌体,之后进行超声波破碎(300 W工作20 min,2 s/2 s)。12 000 r/min离心10 min后弃上清,得到的沉淀即为重组蛋白的包涵体。
包涵体的洗涤、裂解与复性过程参照文献的方法[11]。用洗涤液(50 mmol/L Tris-HCl,0.15 mol/L NaCl,5 mmol/L EDTA,2 mol/L尿素,pH 8.0)洗涤,加入适量裂解液50 mmol/L Tris-HCl,0.15 mol/L NaCl,5 mmol/L EDTA,8 mol/L尿素,pH 8.0)裂解。用复性缓冲液(50 mmol/L Tris-HCl,0.15 mol/L NaCl,5 mmol/L EDTA,1 mol/L尿素,0.5 mol/L L-Arg,2 mmol/L GSH,0.5 mmol/L GSSG,pH 8.0)复性后透析(50 mmol/L Tris-HCl,0.15 mol/L NaCl,pH 8.0)。利用截留分子质量为30 000 Da的超滤管对蛋白液进行进一步纯化,然后对纯化后的溶液进行SDS-PAGE电泳,利用捷达凝胶成像系统软件对SDS-PAGE的条带进行分析;并用BRADFORD[12]法测定纯化后的蛋白浓度。
1.2.6 SSL的酶活力的测定
SSL活力的测定参考MINAGAWAET[13]的方法,原理是溶菌酶降解细胞壁之后菌液的浊度会下降,根据单位时间内浊度的降低程度来表征酶活力的大小。1 mL的测试菌液M.lysodeikticus(0.2 mg/mL溶于50 mmol/L的磷酸盐缓冲液中,pH 6.2)与0.2 mL的酶液混匀,25 ℃条件下分别测定0.5 min和4.5 min时450 nm处的吸光度。酶活力定义为:单位时间内(1 min)使得溶壁微球菌溶液的吸光度降低0.001所需要的酶量。测定进行3次,结果以平均值 ± 标准差的形式表示。
1.2.7 SSL的酶学性质
根据1.2.6中的酶活力测定方法,SSL的最适作用温度测定时其他条件不变,把测定温度分别设为15、20、25、30、35、40、45、50、60、70和80 ℃,而热稳定性的测定则是分别将溶菌酶溶液在以上温度条件下保温30 min后测定其保留的酶活力占初始酶活力的百分比。而最适作用pH则是在最适作用温度条件下,将磷酸盐缓冲液换成同浓度下的不同pH缓冲液,而pH稳定性则是将溶菌酶在不同的pH缓冲液中处理30 min后测定其保留的酶活力占初始酶活力的百分比。其中用到的缓冲液有:乙酸钠缓冲液(pH 3.5~5.5),磷酸盐缓冲液(pH 6.0~8.0),Tris-HCl缓冲液(pH 8.5~9.0)。
1.2.8 SSL的抑菌活性测定
重组SSL的抑菌活性测定参照文献[14]的方法进行。测试菌经过二级活化之后,以1%的接种量接种至含30 mL TSB培养基的三角瓶中培养至OD600为0.6,取0.2 mL菌液与0.4 mL TSB培养基混合后加入0.2 mL含有SSL(溶菌酶标准品作对照)的PBS(0.05 mol/L,pH 7.0)缓冲液混匀,使SSL(或标准品)的终浓度为8.3×10-7mol/L。混合体系于37 ℃、200 r/min条件下培养2 h后,稀释涂布至TSB平板上,待长出菌落后进行计数。计算抑菌系数lgN0/N1,其中N0是指空白组的菌落数,即只加PBS溶液;N1是实验组(或对照组)的菌落数。测定时设3组平行,结果以平均值 ± 标准差的形式表示。对实验组与对照组的结果进行T检验,分析实验结果的差异显著性。
2 结果与分析
2.1 SSL目的基因与重组表达载体的双酶切验证
以SSL-F和SSL-R为引物,质粒pPICZA-SSL为模板进行PCR反应。得到的PCR产物条带大小约为400 bp,与实际基因片段大小(414 bp)相符。割胶回收后,与pMD19-T载体连接,送样测序(生工生物工程(上海)股份有限公司)后证明目的基因正确合成,且酶切位点引入正确。质粒pET-28a(+)和质粒pMD19-T-SSL用BamHⅠ和HindⅢ内切酶处理之后进行连接,对含有Kan的培养基中长出的菌落进行PCR验证。提取阳性克隆菌株的质粒DNA,进行BamH Ⅰ和Hind Ⅲ的双酶切验证,结果如图1所示。pET-28a(+)和目的基因的大小与理论值一致,且经过测序后确认,重组表达载体pET-28a(+)-SSL构建成功。将表达载体pET-28a(+)-SSL热激法转化至宿主BL21(DE3)中,经PCR鉴定及测序验证,表达宿主构建成功,命名为BL21(DE3)-pET28a(+)-SSL。
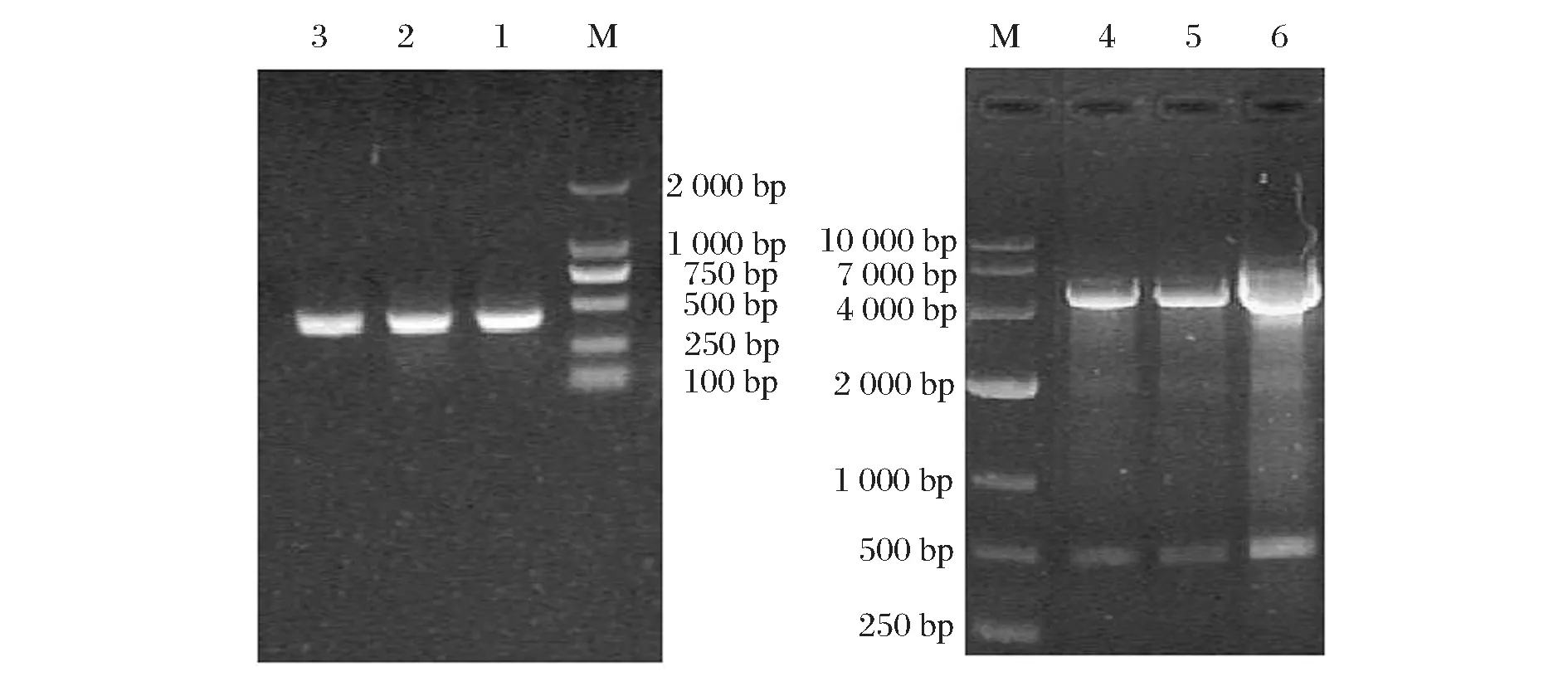
M-Marker;1,2,3-阳性重组子的菌落PCR结果;4,5,6-重组表达载体pET-28a(+)-SSL的双酶切图谱图1 目的基因SSL的PCR鉴定及表达载体pET-28a(+)-SSL的双酶切(BamHⅠ和HindⅢ)验证Fig.1 The PCR identification of target gene SSL and the double enzyme (BamHⅠ and HindⅢ) digestion of expression vector pET-28a(+)-SSL
2.2 重组宿主BL21(DE3)-pET28a(+)-SSL的诱导表达
对得到的宿主BL21(DE3)-pET28a(+)-SSL进行诱导表达,发现0.1 mmol/L的IPTG诱导时得到的表达产物浓度与高浓度的IPTG诱导时差别不大,而明显高于更低浓度的IPTG获得的产物浓度。在25 ℃条件下诱导较30 ℃或37 ℃条件下可以获得更高的表达量,低温条件下(20 ℃)尽管可以获得同样浓度的表达产物(181. 05 mg/L),但是耗时更长(16 h),而且破碎液的上清中也存在部分的蛋白,但是没有酶活力,同样需要复性(数据未显示)。为了简化复性的过程,最终选择的诱导条件是在0.1 mmol/L的IPTG条件下25 ℃诱导8 h。
从图2中可以看到,细胞破碎后的上清中基本都是杂蛋白,没有目的蛋白的条带。而在破碎后的沉淀中大部分的蛋白都是目的蛋白,只有少量的杂质。目的蛋白是以包涵体的形式存在,这是因为目的蛋白合成速度太快,而由于宿主细胞缺乏必要的酶系,来不及也没有办法对重组蛋白进行正确折叠,才会造成在细胞中大量的积累[15]。本研究中得到的重组表达蛋白包涵体的质量浓度为181. 05 mg/L(如图2泳道2所示)。图2中得到的目的蛋白分子量在18 kDa左右,较理论值14.7 kDa高了约3 kDa,主要原因是在HindⅢ酶切位点之后还有NotⅠ、XhoⅠ以及His-tag的组氨酸标签。His-tag的存在会增加重组蛋白的大小,此外它还会对天然蛋白在SDS-PAGE中的迁移造成阻碍,从而影响最终呈现的条带位置[16]。

Marker-Marker;1-0.1 mmol/L的IPTG诱导8 h后的菌体破碎液上清;2-0.1 mmol/L的IPTG诱导8 h后的菌体破碎后的沉淀;3-复性后的蛋白液;4-超滤纯化后的复性蛋白液图2 BL21(DE3)-pET28a(+)-SSL诱导表达产物及其复性后的SDS-PAGEFig.2 SDS-PAGE of the expression product of BL21(DE3)-pET28a(+)-SSL and its renatured protein
2.3 表达蛋白包涵体的复性
对蛋白包涵体进行洗涤、溶解、透析和浓缩等复性步骤后,进行SDS-PAGE(图2)实验。利用捷达凝胶成像系统软件分析发现,表达产物中杂蛋白基本得到全部去除,最终获得的与发酵液相同体积的复性液蛋白浓度为61. 10 mg/L,回收率为33. 75%。复性液的酶活力为(490. 80 ± 12. 70) U/mL,在复性完成后进行一步超滤管的分离即可达到目的蛋白90%以上纯度的纯化效果(泳道4所示),比酶活力可达8 832.78 U/mg。
His-tag的组氨酸标签可用于重组蛋白的亲和纯化。然而本文复性后的蛋白中只有极少量的杂蛋白存在,复性完成后进行一步超滤管的分离即可达到较好的纯化效果,亲和纯化并没有进行的必要。尽管His-tag标签的存在并不影响本文中的SSL酶活性,但是在后续实验中可以在Hind Ⅲ酶切位点之前引入终止密码子提前终止转录,以获得没有His-tag标签的SSL产品。
2.4 SSL的酶学性质
2.4.1 最适作用温度与热稳定性
如图3所示,重组SSL的最适作用温度为35 ℃,这与天然SSL的最适作用温度基本一致[17]。随着温度的升高或降低,SSL的酶活性均有不同程度的降低。在30~40 ℃范围内,SSL可保持80%以上的酶活力。温度过低,SSL与反应底物的接触机率下降,导致其反应活力下降;而温度升高时,SSL分子结构可能会发生改变,从而逐渐失去酶活性。
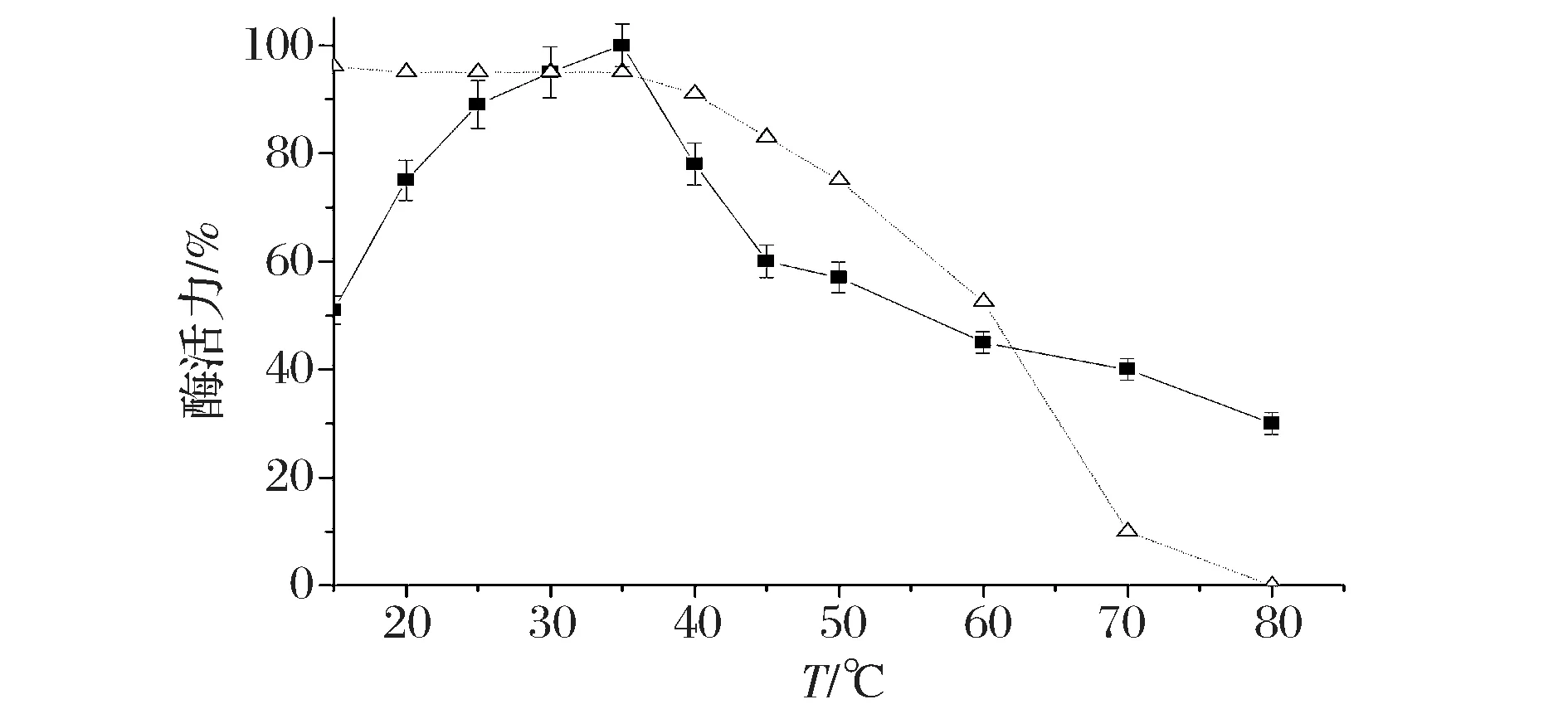
■-最适作用温度;△-温度稳定性图3 温度对SSL酶活力的影响Fig.3 Effects of temperature on the enzyme activities of SSL
而在热稳定性方面,SSL在10~50 ℃范围内酶活力相对稳定,不同温度下保温30 min均能保持70%以上的酶活力;而在60 ℃和70 ℃条件下保温30 min之后,SSL的相对酶活力只保留了初始值的50%和8.5%;当SSL在80 ℃条件下保温30 min之后,SSL将会彻底失活。
2.4.2 最适作用pH与pH稳定性
如图4所示,SSL的最适反应pH为6.0,与天然SSL的特性基本一致[17]。在pH5.5~6.5的范围内,SSL的酶活力相对稳定,都能保持其最适作用pH条件下酶活的80%以上。pH过高或过低都会影响其酶活力。SSL的pH稳定性较好,在pH4.0~9.0范围内酶活力都相对稳定,不同pH条件下处理30 min,均能保持其初始酶活力的90%以上。
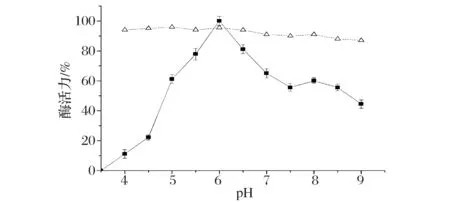
■-最适作用pH;△-pH稳定性图4 pH对SSL酶活力的影响Fig.4 Effects of pH on the enzyme activities of SSL
2.5 SSL的抑菌效果测定
如表2所示,与标准品溶菌酶的抗菌活性类似,SSL的抗菌谱主要集中在革兰氏阳性菌,而对革兰氏阴性菌的作用效果较差。而在杀菌效果方面,SSL除了对Bacillusamyloliquefaciens(+)和Pseudomonasaeruginosa(-)的作用效果与标准品有显著性差异之外,对其他微生物的杀灭效果并无明显差异。
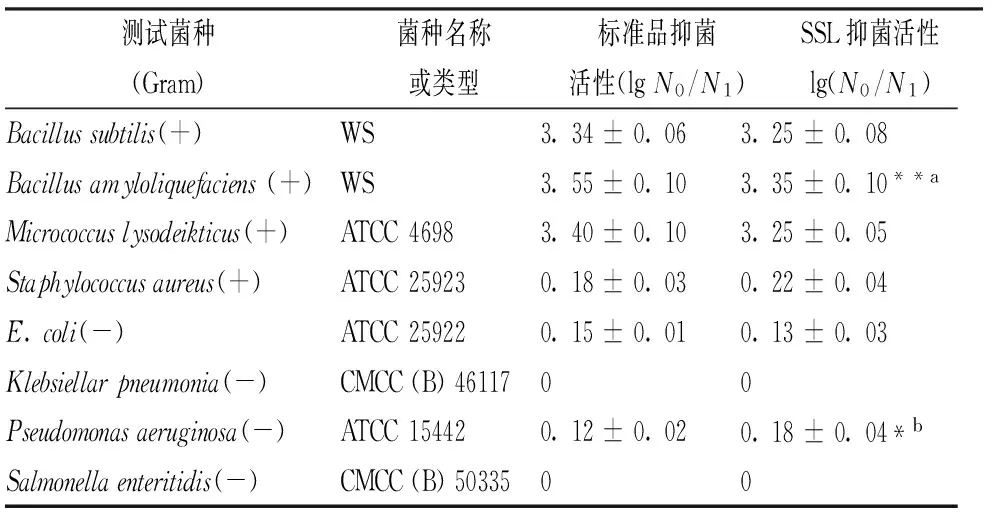
表2 SSL的抗菌活性
注:a:P<0.01; b:P<0.05。
SSL属于C型溶菌酶的一种,其杀菌作用机制是作用于微生物细胞壁肽聚糖中的N-乙酰胞壁酸和N-乙酰葡萄糖胺之间的β-1,4-糖苷键。革兰氏阳性菌的细胞壁组成比较简单,且肽聚糖直接暴露在最外层,有利于SSL的结合与作用;而革兰氏阴性菌的细胞壁中肽聚糖含量较少,且外层还有保护性的脂多糖,所以SSL对其作用效果较差。后续可以通过脂肪酸酯化脂多糖、插入疏水性多肽、部分变性以及分离抗菌肽等方式来提高其对革兰氏阴性菌的作用效果[18]。
3 结论
根据NCBI网站的数据,化学合成了SSL的编码基因,通过BamHⅠ和HindⅢ双酶切之后与载体pET-28a(+)连接,转化至大肠杆菌BL21(DE3)中成功得到了诱导表达。在25 ℃、200 r/min条件下,利用0.1 mmol/L的 IPTG诱导8 h,离心发酵液获得菌体,超声破碎后,获得了181.05 mg/L的重组蛋白包涵体。通过对包涵体的洗涤、溶解、透析以及浓缩,最终获得了有生物活性的SSL产品,其复性液蛋白浓度为61.10 mg/L,比酶活力可达8 032.78 U/mg。
本研究中,目的蛋白的复性过程与其纯化过程耦合程度较高,只需结合截留分子量为30 000 kDa超滤管的超滤步骤,不需要亲和柱的纯化即可达到90%以上的纯度。因此,后续可以通过在HindⅢ酶切位点之前添加终止子,使目的基因的转录提前终止,从而获得不含His-tag标签的重组蛋白。用大肠杆菌来表达SSL与利用毕赤酵母表达系统相比,一方面产物以包涵体的形式存在,可以减少或降低宿主产生的蛋白酶对目的蛋白的降解,这是在毕赤酵母表达系统中经常会出现的一个缺陷[19];另一方面,可以获得纯度和活性更高的蛋白产品SSL(毕赤酵母X-33表达系统中经过纯化的SSL比酶活力最高只有2 845.38 U/mg[1]),有利于其后续的酶学性质或抗菌活性的研究。
此外,对复性得到的SSL进行酶学性质和抗菌活性进行了研究,发现其最适作用温度为35 ℃,最适作用pH为6.0,与理论值基本一致,且抗菌活性与标准品溶菌酶的作用效果基本一致,为SSL的规模化生产及其应用奠定了基础。
[1] ZHU De-wei, CAI Guo-lin, WU Dian-hui, et al. Comparison of two codon optimization strategies enhancing recombinantSusscrofalysozyme production inPichiapastoris[J]. Cellular & Molecular Biology, 2015, 61(2): 43-49.
[2] YU Mei, IRWIN D M. Evolution of stomach lysozyme: the pig lysozyme gene [J]. Molecular Phylogenetics and Evolution, 1996, 5(2): 298-308.
[3] PALMIERI C, BRUNETTI M, SALDA L D. Immunohistochemical characterization of Kisselev nodules (ectopic lymphoid follicles) in wild boar (SusscrofaL.) [J]. Research in Veterinary Science, 2007, 83(1): 109-115.
[4] ZHANG Chen-ming, LILLIE R, COTTER J, et al. Lysozyme purification from tobacco extract by polyelectrolyte precipitation [J]. Journal of Chromatography A, 2005, 1 069(1): 107-112.
[5] BARROS G O F, BALLEN M A T, WOODARD S L, et al. Recovery of bovine lysozyme from transgenic sugarcane stalks: extraction, membrane filtration, and purification [J]. Bioprocess and Biosystems Engineering, 2013, 36(10): 1 407-1 416.
[6] YU Hui-qing, CHEN Jian-quan, LIU Si-guo, et al. Large-scale production of functional human lysozyme in transgeniccloned goats [J]. Journal of Biotechnology, 2013, 168(4): 676-683.
[7] XU Na, PAN Jun-li, LIU Shou-sheng, et al. Three in one: Identification, expression and enzymatic activity of lysozymes in amphioxus [J]. Developmental and Comparative Immunology, 2014, 46(2): 508-517.
[8] GAO Yu, ZHAO Hong-lei, FENG Xin, et al. Expression of recombinant human lysozyme-tachyplesin I (hLYZ-TP I) inPichiapastorisand analysis of antibacterial activity [J]. Biomedical and Environmental Sciences, 2013, 26(4): 319-322.
[9] LI Jian-bo, JIANG Ming-feng, WANG Yong. Expression, purification, and characteristic of tibetan sheep breast lysozyme usingPichiapastorisexpression system [J]. Asian-Australasian Journal of Animal Sciences, 2014, 27(4): 574-579.
[10] KIM J W, PARK S I, YOE J, et al. Cloning and overexpression of lysozyme fromSpodopteraliturain prokaryotic system [J]. Animal Cells and Systems, 2011, 15(1): 29-36.
[11] 王俊雄, 关怡新, 姚善泾. 重组瑞替普酶包涵体制备及其体外复性 [J]. 化工学报, 2015, 66(2): 709-716.
[12] BRADFORD, M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976, 72:248-254.
[13] MINAGAWAET S, HIKIMA J I, HIRONO I, et al. Expression of Japanese-ounder c-type lysozyme cDNA in insect cells [J]. Developmental and Comparative Immunology, 2001, 25(5/6): 439-445.
[14] PELLEGRINI A, THOMAS U, BRAMAZ N, et al. Identification and isolation of a bacterial domain in chicken egg white lysozyme [J]. Journal of Applied Microbiology, 1996, 82(3): 372-378.
[15] LIOVIC M, OZIR M, ZAVEC A B, et al. Inclusion bodies as potential vehicles for recombinant protein delivery into epithelial cells [J]. Microbial Cell Factories, 2012, 11(67): 1-5.
[16] 唐威华, 张景六, 王宗阳, 等. SDS-PAGE法测定His-tag融合蛋白分子量产生偏差的原因 [J]. 植物生理学报, 2000, 26(1): 64-68.
[17] JOLLRS J, JOLLRS P, BOWMAN B H, et al. Episodic evolution in the stomach lysozymes of ruminants [J]. Journal of Molecular Evolution, 1989, 28(6): 528-535.
[18] MINE Y, MA Fu-peng, LAURIAN S. Antimicrobial peptides released by enzymatic hydrolysis of hen egg white lysozyme [J]. Journal of Agricultural and Food Chemistry, 2004, 52(5): 1 088-1 094.
[19] TENG Da, FAN Ying, YANG Ya-lin, et al. Codon optimization ofBacilluslicheniformisβ-1,3-1,4-glucanase gene and its expression inPichiapastoris[J]. Applied Microbiology and Biotechnology, 2007, 74(5): 1 074-1 083.
The expression of Sus scrofa lysozyme in E. coli and its refolding
ZHU De-wei, CAI Guo-lin, LU Jian*
(The Key Laboratory of Industrial Biotechnology, Ministry of Education, National Engineering Laboratory for Cereal Fermentation Technology, School of Biotechnology, Jiangnan University, Wuxi 214122, China)
As a kind of C-type lysozyme,Susscrofalysozyme (SSL) plays an important role in anti-exterior microorganisms. Considering the important role of pig in stock farming, especially that the feed antibiotic is severely limited, the production of SSL is urgently demanded. The CDS of SSL gene was synthesized and inserted into vector pET-28a(+) after digestion withBamHⅠandHindⅢ. Then the recombinant plasmid was transformed into BL21 (DE3). Under the condition of 25 ℃, 200 r/min, 0.1 mmol/L IPTG was added for 8 h induction. With the process of refolding, SSL with natural activity was obtained. Furthermore, the characterization of the recombinant protein was carried out. After centrifugation and ultrasonic disruption, 181.05 mg/L inclusion body of recombinant protein was harvested. After refolding, SSL with the specific enzyme activity of 8032.78 U/mg was obtained. In the study of enzymatic property, the optimal temperature and pH was 35 ℃ and 6, respectively, which were the same as their theoretical values. In the antimicrobial activity analysis, recombinant SSL had a similar result to standard lysozyme. The results will lay the foundation for the industrial production of SSL and its further applications.
Susscrofalysozyme(SSL);E.coli; including body; refolding
10.13995/j.cnki.11-1802/ts.201610004
博士研究生(陆健教授为通讯作者,E-mail:jlu@jiangnan.edu.cn)。
973项目(2013CB733602);中央高校基本科研业务费专项资金资助(JUSRP51302A);江苏高校优势学科建设工程资助项目
2016-03-10,改回日期:2016-04-05

