生物转化共轭亚麻酸植物乳杆菌的筛选及特性研究
杨芹,杨波,刘李至,陶瑞,陈永泉,陈卫,陈海琴
(江南大学 食品科学与工程学院,江苏 无锡,214122)
生物转化共轭亚麻酸植物乳杆菌的筛选及特性研究
杨芹,杨波,刘李至,陶瑞,陈永泉,陈卫,陈海琴
(江南大学 食品科学与工程学院,江苏 无锡,214122)
共轭亚麻酸(conjugated linolenic acid,CLNA)是一类具有抗癌、降脂减肥、抗炎等生理功能的活性物质,为了得到高产或具有生物转化CLNA性能的生物合成体系,采用GC-MS分析方法检测了31株不同来源的植物乳杆菌的脂肪酸组成,筛选得到8种可以高效转化亚麻酸至共轭亚麻酸的菌株。基于GC-MS分析结果,对其中1株高产共轭亚麻酸的植物乳杆菌CCFM261的转化特性进行了研究。结果表明,植物乳杆菌CCFM261对亚麻酸的转化率高于50%,所得产物存在3种异构体(CLNA1,CLNA2,CLNA3),大部分以游离脂肪酸的形式存在于发酵液中,总含量可达到0.186 0 mg/mL。菌体中也积累了一定量的结合状态的CLNA。产物以CLNA1和CLNA2为主,比例约为2∶1,占总共轭亚麻酸含量的90%以上。经质谱数据分析,确定CLNA1和CLNA2分别为生物活性较高的c9,t11,c15-CLNA和t9,t11,c15-CLNA。
亚麻酸;共轭亚麻酸;GC-MS;植物乳杆菌;生物转化
共轭亚麻酸(conjugated linolenic acid,CLNA)是亚麻酸(linolenic acid,LNA)衍生而来具有共轭双键的十八碳三烯酸多种位置与构型异构体的总称,它具有多种营养和保健功能,能够抗癌、抗糖尿病、抗动脉粥样硬化、降低体脂含量、胰岛素抵抗、调节机体免疫等,已成为医学、化学、营养学等领域的研究热点[1-2]。在共轭亚麻酸的各种异构体中,c9,t11,c15-CLNA(CLNA1)、t9,t11,c15-CLNA(CLNA2)、t10,c12,c15-CLNA和c6,c9,t11-CLNA等是被认为最具生物活性的异构体。
自然界的一些植物种子诸如石榴籽、油桐籽、苦瓜籽、金盏花籽、栝楼和蓝花楹籽等均富含共轭亚麻酸[3-4],但仅栝楼籽可直接食用,且由于植物种籽中的油脂成分很复杂,实现共轭亚麻酸的分离与纯化十分困难。目前可通过碱处理亚麻酸异构化而成,但产率较低,以6.6%的氢氧化钾/乙二醇作催化剂时,CLNA的产率仅为17.0%,且有溶剂残留[5-6]。目前国外有一些学者报道微生物转化CLNA的能力,HENNESSY等[7]和GORISSEN等[8]研究表明双歧杆菌、乳杆菌、丙酸杆菌等多种菌株可生物转化合成共轭亚麻酸,最高转化率可达80%,其中c9,t11,c15-CLNA,t9,t11,c15-CLNA两种活性异构体在乳酸菌转化的CLNA中所占比例达90%以上[9]。
乳酸菌转化所产的共轭亚麻酸,单体较唯一,转化率高,且产物绝大多数都在发酵液,易于实现后期的分离纯化,因此,生物法与化学法相比具有选择性合成生物活性CLNA的优点,更适合后期的综合利用。
本研究通过对一系列不同来源的植物乳杆菌进行GC-MS脂肪酸分析,筛选能够生物转化共轭亚麻酸的菌株,并对高产共轭亚麻酸的菌株转化共轭亚麻酸的特性进行初步探讨。
1 材料与方法
1.1 主要试剂与仪器
主要试剂:α-亚麻酸(LNA)购自Sigma-Aldrich,三甲基硅烷化重氮甲烷购自上海百灵威科技有限公司,其他试剂均为普通分析纯或色谱纯,购自国药集团。
主要仪器:GCMS-QP2010 Ultra SYSTEM气质联用仪,岛津;ND100-2氮吹仪,四川汇巨仪器设备有限公司;GRP-9080隔水式恒温培养箱,上海森信实验仪器有限公司;ST40R型冷冻离心机,Thermo Scientific。
1.2 样品准备与取样
实验所使用的菌株来自江南大学食品生物技术中心菌种库,MRS培养基购自青岛海博生物技术有限公司。
将植物乳杆菌划线于MRS固体培养基上,37 ℃培养48 h,挑单菌落接种于MRS液体培养基中,37 ℃培养48 h,连续转接活化3代。将活化好的菌液按照1%接种量接种至含LNA(30 mg/mL,含2% Tween-20)的10 mL MRS液体培养基中,37 ℃培养72 h。分别取其发酵液及菌体检测其脂肪酸组成,以筛选具有转化生成LCNA性能的菌株。
另以植物乳杆菌CCFM261为对象,在与上述相同条件下活化,添加不同浓度的LNA (0.1,0.3,0.5,1.0 mg/mL)于MRS培养基,在37 ℃下分别培养0,12,24,48,72 h,分析发酵液和菌体的脂肪酸,监测共轭亚麻酸在该菌生长历程中的最佳转化时间。
1.3 样品处理
将培养后的菌液转移至离心管,5 000 r/min,离心5 min;取发酵液1.5 mL四份及对应5 mL发酵液的菌体4份用于脂肪酸的提取分析。菌体分别用2 mL 盐溶液(0.137 mol/L NaCl; 7.0 mmol/L K2HPO4; 2.5 mmoL/L KH2PO4)洗涤,4 000 r/min离心5 min;重复2次。
1.3.1 游离脂肪酸提取及甲酯化处理
发酵液:取2份发酵液,加入35 μL全氘代十八碳酸(d35C18∶0,2.058 mg/mL)作为内标,后添加2 mL异丙醇,充分振荡;再添加3 mL正己烷,充分振荡;5 000 r/min,离心3 min,取正己烷层,用氮气吹干。
菌体:将菌体重悬于2 mL 盐溶液中,加入d35C18∶0作为内标,按上发酵液相同的方法进行脂肪酸提取及氮气吹干。
甲酯化:将上述脂肪酸提取物用400 μL甲醇复溶,添加适量重氮甲烷进行甲酯化,氮气吹干后用500 μL正己烷溶解,13 000 r/min离心10 min取上清,进行GC/MS分析。
1.3.2 总脂肪酸提取及甲酯化处理
取发酵液和菌体各2份,加入d35C18∶0作为内标,冻干。残渣加入1 mL 0.5 mol/L NaOH-MeOH于100 ℃加热5 min,冷却后加入1 mL 14% BF3-MeOH仍置于100 ℃加热5 min。冷却,加入1 mL饱和NaCl溶液,分别以1 mL正己烷萃取2次,氮气吹干后用500 μL正己烷溶解,13 000 r/min离心10 min取上清,进行GC/MS分析。
1.4 GC-MS检测
岛津气相色谱仪(GC 2010 plus),气相柱Rtx-Wax(30 m × 0.25 mm × 0.25 μm),质谱仪(岛津Ultra QP2010)。程序升温条件:初始150 ℃,以5 ℃/min的速率升温至200 ℃,保持10 min,后以4 ℃/min升温至240 ℃,保持10 min。采用分流进样,进样量为1 μL,分流比10∶1,氦气为载气。进样器温度和检测器温度均为240 ℃。离子源220 ℃,强度为70 eV。
2 结果与讨论
2.1 植物乳杆菌转化共轭亚麻酸的情况
实验分析评估了31株植物乳杆菌转化共轭亚麻酸的能力,具体菌株信息见表1。在确定底物LNA的添加量时,考虑到较高浓度的游离脂肪酸对细菌的生长具有一定的毒害或抑制作用,而且COAKLEY等人[10]也发现短双歧杆菌(B.breve)对亚油酸的耐受量为0.2~1.5 mg/mL,我们比较了目标菌株CCFM261在分别添加0.1,0.3,0.5和1.0 mg/mL亚麻酸的培养基中的生长状态以及底物的消耗量与产物的生成量的关系。结果表明,随着底物LNA浓度的升高,目标产物CLNA的含量呈上升趋势,但在底物添加量大于0.3 mg/mL时,产物的生成渐趋平缓且菌体对底物的利用率显著降低(图1),综合考虑高浓度游离脂肪酸对菌体生长的影响,本实验中底物的添加量确定为0.3 mg/mL。

图1 底物添加量对CCFM261生物转化CLNA能力的影响Fig.1 Effect of the substrate concentration on the fatty acid conversion of CCFM261
发酵液的脂肪酸GC-MS分析结果显示,植物乳杆菌CCFM78、CCFM174、CCFM177、CCFM179、CCFM181、CCFM183、CCFM240、CCFM261可将10%以上的底物转化为共轭亚麻酸,可认为具有生物转化共轭亚麻酸的潜力,其中植物乳杆菌CCFM78、CCFM240、CCFM261可将超过30%的亚麻酸转化为共轭亚麻酸,为高产菌株。但在CCFM166、CCFM169、CCFM170、CCFM188、CCFM307中未检测到任何CLNA的异构体,认定这几株菌不具备转化共轭亚麻酸的能力(表1)。
从菌株的来源上看,源自泡菜的植物乳杆菌普遍具备转化共轭亚麻酸的潜力。而来源于酸粥的植物乳杆菌转化共轭亚麻酸的能力较弱,这可能与这些菌株的生活史中接触到底物的可能性有关联。
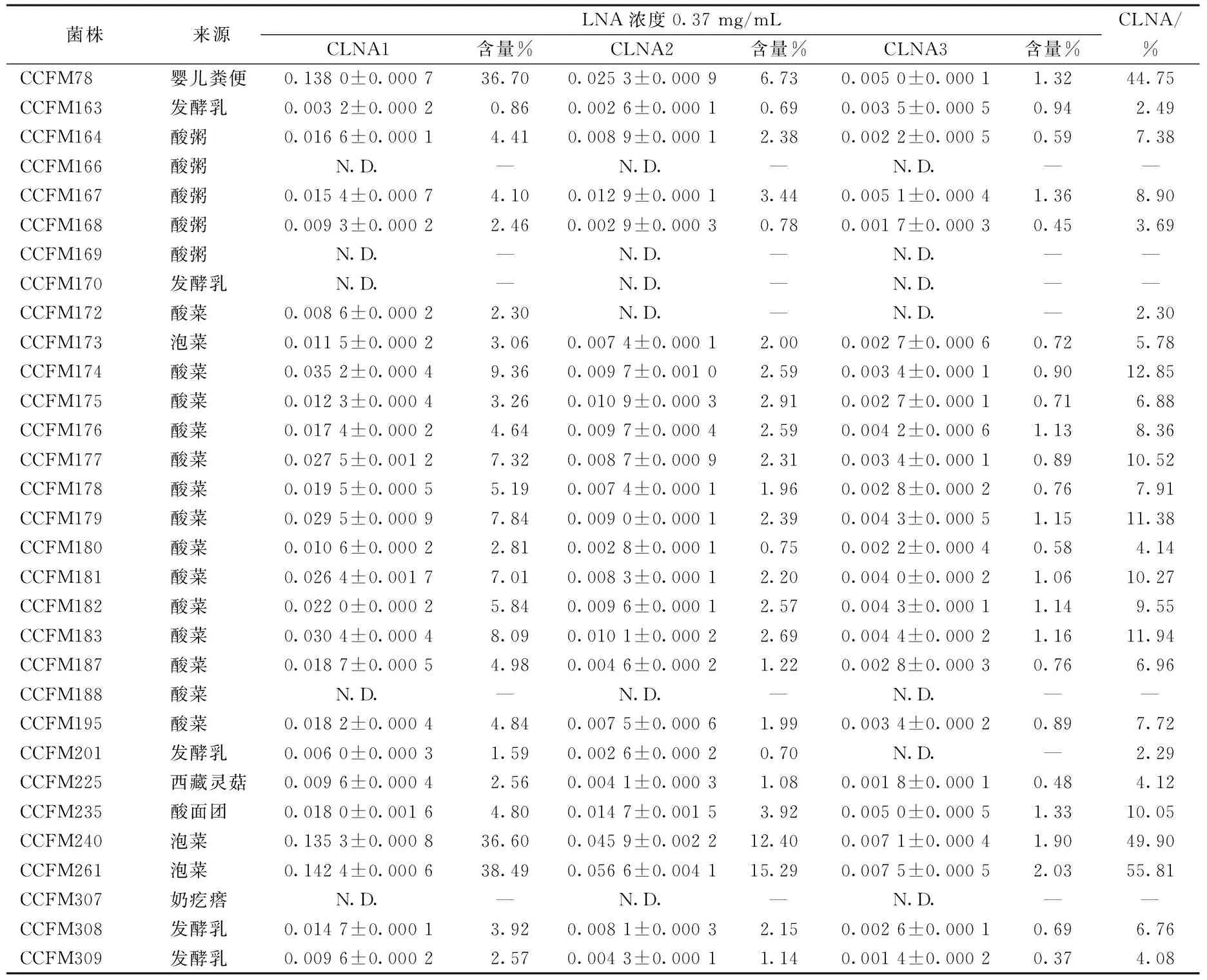
表1 在含LNA的培养基中培养后发酵液的脂肪酸组成
注:CCFM:江南大学食品生物技术中心菌种库;CLNA1:c9,t11,c15-CLNA;CLNA2:t9, t11,c15-CLNA;N.D.:未检出。
2.2 植物乳杆菌CCFM261转化共轭亚麻酸
所有的实验菌株中,植物乳杆菌CCFM261属于高产共轭亚麻酸的优良菌株,在本实验中被选作后续工作的研究对象,进一步探讨植物乳杆菌转化共轭亚麻酸菌株的一些相关共性问题。由图2(a)可知,植物乳杆菌CCFM261在含有α-LNA的MRS中生长时主要的代谢产物为CLNA1, 2, 3。图2(b)表明,植物乳杆菌CCFM261对α-LNA的代谢始于菌体培养12 h后,随着菌体生长共轭亚麻酸的含量逐渐增加 (24 h、36 h),在48 h左右达到最高值,此时CLNA的总含量约为0.186 0 mg/mL。植物乳杆菌CCFM261转化α-LNA的主要产物是CLNA1 和CLNA2,二者约占总CLNA的90%,以前者为主,且二者在菌体生长达稳态时的比例约为2∶1。

图2 植物乳杆菌CCFM261在添加LNA的MRS中生长0 h和72 h的色谱图 (a)及发酵液中CLNA各异构体随时间的变化(b)Fig.2 GCMS chromatograms CCFM261 in LNA spiked MRS at 0 h and 72h (a), and contents of CLNAs in CCFM261 ferment at different fermentation time (b)
从图2(b)我们还可以看出,植物乳杆菌CCFM261对CLNA1, 2, 3三个异构体的积累也存在先后秩序,分别是含量最高的CLNA1最先达到平衡,其次是含量次之的CLNA2和CLNA3。此外,图2(b)也表明在植物乳杆菌CCFM261培养36 h后,CLNA各异构体之间存在着转化,即 CLNA1含量逐渐减少,而CLNA2和CLNA3的含量增加。
从培养72 h后植物乳杆菌CCFM261发酵液及菌体脂肪酸组成可以发现,菌株内仍有部分LNA尚未被转化,而所转化的CLNA绝大多数在发酵液,但菌体内仍留有少量的CLNA异构体,3种异构体在发酵液与菌体内的分布情况基本一致(图3)。为了推断植物乳杆菌CCFM261生成的CLNA在菌体内的分布情况以及存在形式,我们采用了两种脂肪酸甲酯化方法同时分析发酵液及菌体的脂肪酸组成。采用皂化-酸催化甲酯化的方法用NaOH-MeOH及BF3-MeOH对发酵液和菌体中的游离以及结合的脂肪酸进行衍生(图3:FA in Pellets/Supernatant),然后取平行样品采用只能对游离脂肪酸进行甲酯化的重氮甲烷的方法分析菌体及发酵液中的游离脂肪酸(图3:FFA in Pellets/Supernatant)。结果表明,就整体而言,发酵液中的CLNA含量最高,以游离的形式存在,该结果与植物乳杆菌产共轭亚油酸类似,即绝大多数的产物均不在胞内积累,而是被转运至胞外。其次,菌体中也积累了一定量的CLNA,主要以结合脂质的形式存在。CLNA在植物乳杆菌CCFM261体系中的这种分布模式一方面符合常规情况下脂质在生物体内的存在状态,另一方面也为最终的产物分离纯化工作提供了便利,是采用生物技术制备共轭亚麻酸的又一优势。

图3 植物乳杆菌CCFM261发酵体系中各脂肪酸的分布:FA in Supernatant/Pellets:发酵液和菌体中结合形式和游离形式的各脂肪酸含量;FFA in Supernatant/Pellets:发酵液和菌体中游离形式的各脂肪酸含量Fig.3 Distribution of FAs in CCFM261: FA in Supernatant/Pellets: content of both incorporated and free fatty acids in ferment or pellet; FFA in Supernatant/Pellets: content of free fatty acids in ferment or pellet
从植物乳杆菌CCFM261培养液与菌体中的共轭亚麻酸总量来看植物乳杆菌CCFM261的转化率为56%,为高产菌株。根据GC-MS所得碎片及共轭亚麻酸可能的异构体结构,与文献中[9]进行比对可以确定,本工作中的CLNA1即为c9,t11,c15-CLNA,CLNA2为t9,t11,c15-CLNA,但CLNA3中双键位置及顺反异构等尚待确定。从植物乳杆菌CCFM261所转化的各异构体含量来看,主要产物是c9,t11,c15-CLNA和t9,t11,c15-CLNA两种异构体,其中以c9,t11,c15-CLNA为主体,约占总CLNA含量的60%。从植物乳杆菌CCFM261的培养液与菌体的脂肪酸组成来看,所产生的共轭亚麻酸异构体绝大部分都在发酵液中。
3 结论
本研究从不同来源的31株植物乳杆菌中成功筛选到8株具有可生物转化LNA产CLNA能力的菌株,其中以植物乳杆菌CCFM261的性能为优。进一步研究发现 植物乳杆菌CCFM261对底物亚麻酸的转化率可达56%,所产生的CLNA主要以游离的形式存在于发酵液中,极利于产物的后期分离与应用。植物乳杆菌CCFA261转化的CLNA主要为生物活性较高的c9,t11,c15-CLNA和t9,t11,c15-CLNA,可达总CLNA量的90%以上。
鉴于上述结果,该植物乳杆菌CCFA261菌株可作为生产CLNA的生物合成系统,在采用生物技术手段生产共轭亚麻酸领域具有较大的开发应用前景。同时,从CLNA及益生菌对人体健康的改善与调节功能出发,将某些益生菌的抗癌活性与它们转化共轭亚麻酸的能力相关联是非常具有研究价值和市场潜力的。
[1] KRIS-ETHERTON P M, HECKER K D, BINKOSKI A E. Polyunsaturated fatty acids and cardiovascular health[J]. Nutrition Reviews, 2004, 62(11): 414-426.
[2] ROBINSON L E, BUCHHOLZ A C, MAZURAK V C. Inflammation, obesity, and fatty acid metabolism: influence of n-3 polyunsaturated fatty acids on factors contributing to metabolic syndrome[J]. Applied Physiology Nutrition and Metabolism-Physiologie Appliquee Nutrition Et Metabolisme, 2007, 32(6): 1 008-1 024.
[3] KOHNO H, YASUI Y, SUZUKI R, et al. Dietary seed oil rich in conjugated linolenic acid from bitter melon inhibits azoxymethane-induced rat colon carcinogenesis through elevation of colonic PPAR gamma expression and alteration of lipid composition[J]. International Journal of Cancer, 2004, 110(6): 896-901.
[4] YASUI Y, HOSOKAWA M, SAHARA T, et al. Bitter gourd seed fatty acid rich in 9c,11t,13t-conjugated linolenic acid induces apoptosis and up-regulates the GADD45, p53 and PPAR gamma in human colon cancer Caco-2 cells[J]. Prostaglandins Leukotrienes and Essential Fatty Acids, 2005, 73(2): 113-119.
[5] IGARASHI M, MIYAZAWA T. Preparation and fractionation of conjugated trienes from alpha-linolenic acid and their growth-inhibitory effects on human tumor cells and fibroblasts[J]. Lipids, 2005, 40(1): 109-113.
[6] IGARASHI M, MIYAZAWA T. Newly recognized cytotoxic effect of conjugated trienoic fatty acids on cultured human tumor cells[J]. Cancer Letters, 2000, 148(2): 173-179.
[7] HENNESSY A A, ROSS R P, DEVERY R, et al. The Health Promoting Properties of the Conjugated Isomers of alpha-Linolenic Acid[J]. Lipids, 2011, 46(2): 105-119.
[8] GORISSEN L, RAES K, WECKX S, et al. Production of conjugated linoleic acid and conjugated linolenic acid isomers byBifidobacteriumspecies[J]. Applied Microbiology and Biotechnology, 2010, 87(6): 2 257-2 266.
[9] HENNESSY A A, BARRETT E, ROSS R P, et al. The production of conjugated alpha-linolenic, gamma-linolenic and stearidonic acids by strains ofBifidobacteriaandPropionibacteria[J]. Lipids, 2012, 47(3): 313-327.
[10] COAKLEY M, ROSS R P, NORDGREN M, et al. Conjugated linoleic acid biosynthesis by human-derivedBifidobacteriumspecies[J]. Journal of Applied Microbiology, 2003, 94(1): 138-145.
The production of conjugated linolenic acid by Lactobacillus plantarum
YANG Qin, YANG Bo, LIU Li-zhi, TAO Rui, CHEN Yong-quan, CHEN Wei, CHEN Hai-qin*
(School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
Conjugated linolenic acids (CLNAs) are a class of fatty acids that possess potential biological activity such as anti-carcinogensis, anti-adipogenesis, anti-inflammation and can be produced microbially by a series of bacteria. Gas chromatography mass spectrometry analyses were performed to acquire the fatty acid profiles of 31 strains ofLactobacillusplantarumand the data were used to assess their ability of CLNA accumulation during linolenic acid (LNA) spiked fermentation. 8 strains shown great probability of converting LNA to CLNA and CCFM261, a strain newly isolated from pickled vegetable, was found to be the best CLNA producer. Detailed investigation of the LNA-CLNA bio-converting property of CCFM261 unveiled that more than 50% of the LNA was converted to its conjugated isomers (CLNA1, CLNA2, CLNA3). The accumulation of CLNAs in CCFM261 started 12 h after the culturation and saturated at about 48 h with a final concentration of 0.1860 mg/mL in ferment. 90% of the CLNA isomers were CLNA1 and CLNA2 which accumulated at a ratio of 2∶1 and were identified asc9,t11,c15-CLNA andt9,t11,c15-CLNA by MS spectrum.
linolenic acid;conjugated linolenic acid; GC-MS;Lactobacillusplantarum; conversion
10.13995/j.cnki.11-1802/ts.201610006
博士(陈海琴教授为通讯作者,E-mail:haiqinchen@jiangnan.edu.cn)。
国家自然科学基金(31571810)
2016-03-29,改回日期:2016-04-22

