里氏木霉Rut-C30发酵热水预处理稻草产纤维素酶
苏存生,贺建龙,熊鹏,岳春,于凤川,孙付保*
1(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡, 214122) 2(淮阴师范学院 化学化工学院, 江苏省生物质能与酶技术重点实验室,江苏 淮安, 223005) 3(南阳理工学院 生物与化学工程学院,河南 南阳, 473004)
里氏木霉Rut-C30发酵热水预处理稻草产纤维素酶
苏存生1,贺建龙2,熊鹏2,岳春3,于凤川1,孙付保1*
1(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡, 214122) 2(淮阴师范学院 化学化工学院, 江苏省生物质能与酶技术重点实验室,江苏 淮安, 223005) 3(南阳理工学院 生物与化学工程学院,河南 南阳, 473004)
为提高工业生产菌TrichodermareeseiRut-C30产酶能力,以热水预处理稻草(hot water pretreated rice straw, HWPRS)为碳源,开展系统优化培养基与培养条件以及采用添加剂等方面的实验工作。菌株初始摇瓶发酵HWPR 产纤维素酶在168 h时滤纸酶活(FPA)为1.20 U/mL。通过单因素实验与正交实验,获得最佳培养基(g/L):HWPRS 50.0、玉米浆6.0、(NH4)2SO44.0、KH2PO41.0、尿素0.2、MgSO4·7H2O 0.4、CaCl20.3;最佳培养条件:pH6.0、转速220 r/min、温度30 ℃、接种量φ6%;优化后菌株产酶FPA达2.69 U/mL,是优化前2倍以上。添加吐温-80能显著提高产酶,β-葡萄糖苷酶活(BG)提高26%;添加乳糖主要能提高BG酶活;实验中首次发现壳聚糖类物质能促进纤维素酶发酵,其中壳聚糖效果最明显,添加1.5 g/L壳聚糖时纤维素酶FPA与BG分别提高了10%和30%,使纤维素酶FPA、CMCase和BG分别达到3.67、8.65和1.76 U/mL。该产酶稳定性为上罐实验证实,所产纤维素酶FPA水平是初始摇瓶发酵的3倍,初步显示了其工业发酵潜力。
热水预处理稻草;里氏木霉Rut-C30;纤维素酶;发酵优化;壳聚糖
在木质纤维素生产燃料乙醇过程中,纤维素酶将纤维质原料水解为可发酵性糖,为后续微生物生产燃料乙醇提供基质,纤维素酶酶解是纤维素乙醇商业化的关键步骤[1-2]。据报道,纤维素酶成本占纤维素乙醇成本的20%~40%,目前纤维素酶成本高和用量大是纤维素乙醇生产成本居高不下的重要原因[1, 3]。可见,如何经济高效地生产纤维素酶是当前纤维素乙醇行业值得关注的课题。
在发酵基质方面,传统上使用纯纤维素及其衍生物,如结晶纤维素、羧甲基纤维素钠和纸浆等,表明了纤维基质发酵产纤维素酶可行性[4-5]。为降低生产成本,近年来逐步出现了利用天然纤维质原料替代高成本的工业产物发酵产纤维素酶的报道,例如利用甘蔗渣、橡木和农作物秸秆等替代纯的纤维素进行发酵产酶[6-7]。2013年,CULBERTSON等[2]用20 g/L的氨气爆破预处理的玉米秸秆进行摇瓶发酵产纤维素酶,酶活在144 h达到1.90 U/mL;2015年,马立娟等[8]用10 g/L的玉米芯进行摇瓶发酵产酶,酶活在120 h达到1.53 U/mL。这些工作展示了利用天然纤维质废弃物发酵产纤维素酶具有切实可行性与潜在经济性。
然而,目前利用天然纤维质原料发酵产酶水平并不高,FPA大多在1.0 U/mL左右。于是,陆续有研究者开展了纤维素酶发酵工艺优化方面的工作。2005年,JUHASZ等[7]以40 g/L酸预处理橡木为底物采用分批补料方式对纤维素酶发酵条件进行优化,酶活在168 h达到3.20 U/mL,比之前提高近1倍;钟桂芳等[9]以18 g/L麸皮为碳源进行响应面优化发酵条件,酶活达到3.12 U/mL,比优化前提高72%。此外,CHANDRA等[10]发酵时添加氨基丁酸与茉莉酸,酶活达到3.21 U/mL,比之前提高3倍;刘佳等[11]在固态发酵时添加鼠李糖与吐温-80使酶活提高50%。这些工作显示,利用实验设计优化和采用合适添加剂等策略进行纤维素酶发酵工艺优化,是提高纤维素酶发酵水平的有效途径。
基于此,本文以HWPRS为碳源,尝试采用试验设计系统优化和添加剂等手段提高工业化菌株T.reeseiRut-C30发酵产酶水平,为现行纤维素酶发酵工业提供技术支撑。实验首先考察了该工业菌株的现行发酵水平,接着依次采用单因素与正交实验对纤维素酶发酵培养基与培养条件进行系统优化,在此基础上开展了吐温-80、乳糖与壳聚糖等添加剂探索,最后在5 L发酵罐上进行了发酵验证。
1 材料与方法
1.1 实验材料
1.1.1 菌种与试剂
里氏木霉T.reeseiRut-C30由淮安百麦绿色能源公司馈赠。热水预处理稻草(hot water pretreated rice straw, HWPRS)是粉碎至粒径小于5 mm的稻草在180 ℃高压热水中处理10 min,由淮安百麦绿色能源公司提供。Whatman No.1滤纸购于英国Whatman公司;吐温-80、乳糖、壳聚糖等试剂均购自于上海国药集团,玉米浆为市场购买。
1.1.2 培养基
种子培养基(g/L):土豆200,葡萄糖20,pH自然。发酵培养基(g/L):HWPRS 20.0,玉米浆2.0,(NH4)2SO41.4,KH2PO42.0,尿素0.3,MgSO4·7H2O 0.3,CaCl20.3,pH5.0;Mandels营养盐微量元素(mg/L):FeSO4·7H2O 5.0,MnSO4·H2O 1.6,ZnSO4·7H2O 1.4,CoC12·6H2O 3.7,过滤除菌后加入培养基。
1.2 培养方法
1.2.1 种子培养
取1.0 mL含量为1.0×108/mL里氏木霉Rut-C30孢子悬液接种到种子培养基中,于30 ℃和180 r/min旋转式摇床培养24 h,获得种子菌液。
1.2.2 纤维素酶发酵的初步探讨
发酵时取上述种子液按体积百分比 6%的接种量接入到发酵培养基上,于30 ℃和180 r/min旋转式摇床培养168 h,定期取样测定酶活。
1.2.3 单因素实验
对发酵培养基(HWPRS、玉米浆、(NH4)2SO4、KH2PO4、尿素、MgSO4·7H2O、CaCl2)和上述培养条件(初始pH、转速、温度、接种量)进行单因素实验,考察某一个因素时保持其他条件不变,找出对纤维素酶影响最为明显的因素。
1.2.4 正交实验
根据上面单因素实验确定的因素水平,设计正交实验。对发酵培养基与发酵条件分别设计L18(37)和L9(34)两个正交表,如表1和表2所示。

表1 L18(37)发酵培养基正交实验因素水平表

表2 L9(34)发酵培养条件正交实验因素水平表
1.2.5 添加剂考察
在正交优化基础上,进行吐温-80添加时间 (24、48、72、96、120 h) 与添加量 (0、1.0、2.0、4.0、6.0 g/L) 优化;在其基础上对乳糖添加量 (0、0.25、0.5、1.0、1.5 g/L) 进行优化;最后优化壳聚糖添加量 (0、0.5、1.0、1.5、2.0 g/L),促进里氏木霉Rut-C30产酶,提高酶活。
1.2.6 上罐放大
按照上述优化好的条件进行5 L发酵罐扩大培养:温度30 ℃,通气量1.5 v/v/min,搅拌转速220 r/min,pH≥4.5,溶氧在前48 h控制在80%左右,48 h后控制在40%左右。每隔24 h取样,测定酶活。
1.3 分析测定方法
1.3.1 酶活测定
发酵液取样后于4 ℃、8 000 r/min离心10 min获得上清液,经适当稀释以测定纤维素酶活性。测定时取稀释酶液0.5 mL与1.0 mL的50 mmol/L柠檬酸缓冲液(pH4.8)混合,加入50 mg (1 cm × 6 cm) Whatman No.1滤纸条后于50 ℃静置反应1 h,加入1.0 mL DNS溶液后于沸水浴5 min。冷却至室温后稀释10倍测定OD540值,并根据相关公式换算成酶活[12]。CMCase与BG则分别以1%的CMC和水杨苷为底物,反应时间30 min,其他条件不变。酶活定义:水解底物时每分钟产生1 μmol葡萄糖所需酶量定义为1个酶活单位(U)。
1.3.2 蛋白测定
参考Bradford法测定蛋白含量[13]。实验时吸取适当稀释发酵液0.5 mL于5 mL离心管中,再加入2.50 mL考马斯亮蓝溶液,通过涡流混匀后测定OD595值,根据蛋白标曲换算成蛋白含量。
2 结果与讨论
2.1 纤维素酶发酵的初步探讨
本实验以合作单位淮安百麦绿色能源生物有限公司的液态发酵培养基和培养条件进行初步的摇瓶发酵,结果如图1所示。随着发酵进行,菌株产酶逐步提高,144 h时纤维素酶FPA、CMCase和BG酶活均达到最高水平,分别为1.20、6.70和0.81 U/mL。该实验结果与公司数据(内部交流)相一致,代表着现有纤维素酶发酵工业水平。已有文献显示,里氏木霉在酸处理橡木、汽爆橡木和玉米芯等天然纤维素质原料上发酵产酶FPA可达3~5 U/mL[7-9],显示出该菌具有较大的发酵潜力。因此,后续实验中尝试从培养基和培养条件等方面对该菌株发酵HWPRS产酶过程进行系统优化以提高其产酶水平。另外,考虑到公司实际生产中采用较昂贵的添加剂进行产酶诱导,所以本文也将探讨一些廉价添加剂的使用以降低纤维素酶生产成本。
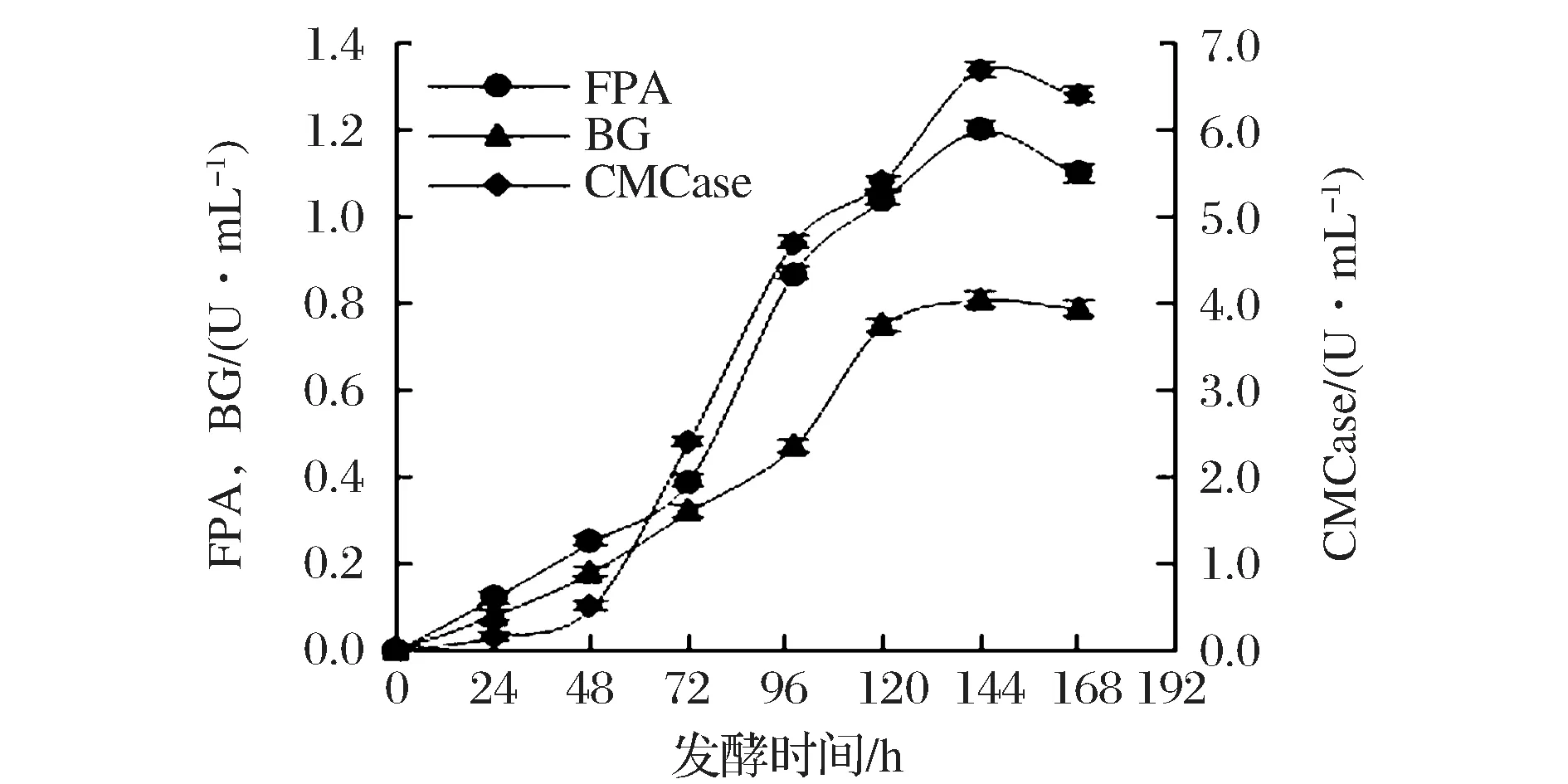
图1 HWPRS发酵纤维素酶初步探索Fig.1 Preliminary cellulase fermentation of HWPRS
2.2 培养基优化
2.2.1 单因素优化
实验对发酵培养基碳源(HWPRS)、氮源[(NH4)2SO4、玉米浆、尿素]和无机盐(KH2PO4、MgSO4·7H2O、CaCl2)等进行单因素实验,结果如图2所示。
当培养基中碳源浓度较低时,发酵所产纤维素酶活随着基质HWPRS添加明显提高,在HWPRS浓度为40.0 g/L时酶活最高,达到1.38 U/mL,此后进一步添加基质酶活反而下降,可能是基质过高会导致整个发酵体系的传质传氧降低,进而影响产酶,也可能是高浓度基质吸附过多纤维素酶导致发酵液中游离酶浓度降低[14-15]。因此,选择40.0 g/L作为适宜的发酵基质浓度。玉米浆作为一种常见易得的氮源,不仅含有丰富的氮元素,又能为微生物生长提供多种必需的生长因子,为合成各种酶提供前体[16]。实验中纤维素酶活随玉米浆浓度增大不断上升,当玉米浆加量为4.0 g/L时酶活达到最高值1.48 U/mL,因此确定玉米浆浓度为4.0 g/L。当(NH4)2SO4浓度达到3.0 g/L时纤维素酶发酵酶活达到最高值1.37 U/mL,因而选择(NH4)2SO4添加量为3.0 g/L,这与文献报道是一致的[15]。同样地,实验中确定尿素添加量为0.3 g/L、KH2PO4为2.0 g/L、MgSO4·7H2O为0.3 g/L和CaCl2为0.3 g/L。

图2 发酵培养基单因素实验Fig.2 Single factor experiment of selecting the fermentation medium
2.2.2 培养基正交实验
上述单因素实验确定出培养基中各成分含量,本实验通过设计正交实验考察这些因素对发酵产酶的影响,结果如表3所示。
对正交实验使用“正交设计助手II v3.1”进行7因素3水平实验设计,并对所得实验结果进行分析。由表3可知,培养基中各成分对纤维素酶产量影响各不相同。由极差分析可知,各个因素对纤维素酶分泌的影响顺序按照极差大小排序依次是:玉米浆 >HWPRS > (NH4)2SO4>尿素 > KH2PO4>MgSO4·7H2O > CaCl2。
根据表4方差分析,培养基中所有成分对纤维素酶影响顺序依次为:玉米浆 > HWPRS > (NH4)2SO4>尿素 > KH2PO4> MgSO4·7H2O > CaCl2,这与上面极差分析是一致的。确定出最佳组合为A3B3C3D1E1F3G2,即产酶最适发酵培养基(g/L):HWPRS 50.0,玉米浆6.0,(NH4)2SO44.0;KH2PO41.0;尿素0.2;MgSO4·7H2O 0.4;CaCl20.3。按照最佳组合进行验证,FPA最高产量达到2.40 U/mL,实验结果处于正交实验中较高水平,结果可信,较优化前提高了1倍;CMCase与BG分别达到7.12 U/mL与0.87 U/mL,与优化前相比略有提高。

表3 L18(37)正交实验及结果
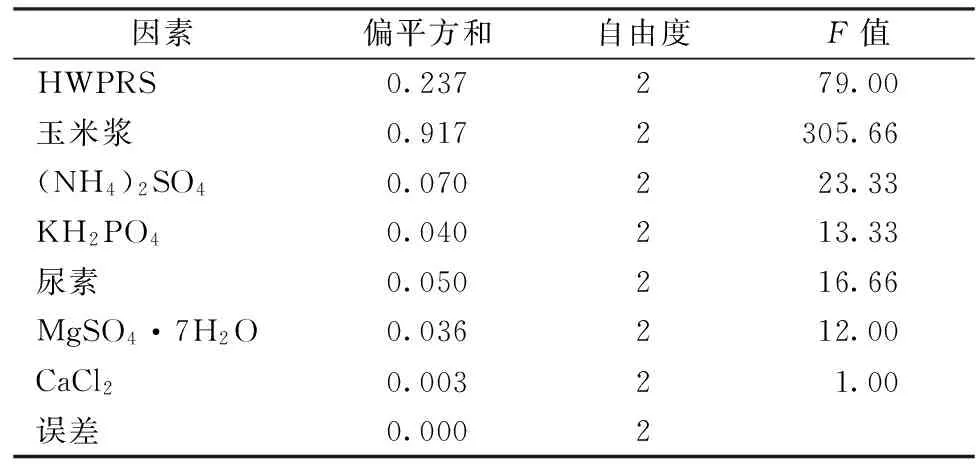
表4 正交实验分析结果
2.3 培养条件优化
培养条件对微生物发酵具有重要意义,在微生物发酵过程中,合适的培养条件不仅能够稳定菌体的生长,还能够促进产酶[5, 17]。在上述最适培养基基础之上,考察初始pH、转速、温度与接种量等主要培养条件对发酵产酶的影响。
2.3.1 培养条件单因素实验
发酵初始pH、转速、温度与接种量等参数的单因素实验如图3所示。当培养基初始pH较低时,纤维素酶发酵酶活随着pH增加而明显上升,在pH5.5时酶活达到最高为2.51 U/mL,因此确定最适发酵初始pH5.5。在转速方面,纤维素酶发酵随着转速增加,传质传氧加快,从而提高了产酶水平;当转速过大时,摇瓶转动产生剪切力也会对菌丝体造成损害,进而影响产酶[18]。当转速为220 r/min时酶活最高达到2.56 U/mL,所以确定220 r/min为最佳转速。在培养温度28~32 ℃时里氏木霉发酵所产酶活变化不大,但温度升高到34 ℃时酶活迅速降低,确定适宜培养温度为30 ℃。同样地,实验中确定最适接种量φ为8%。
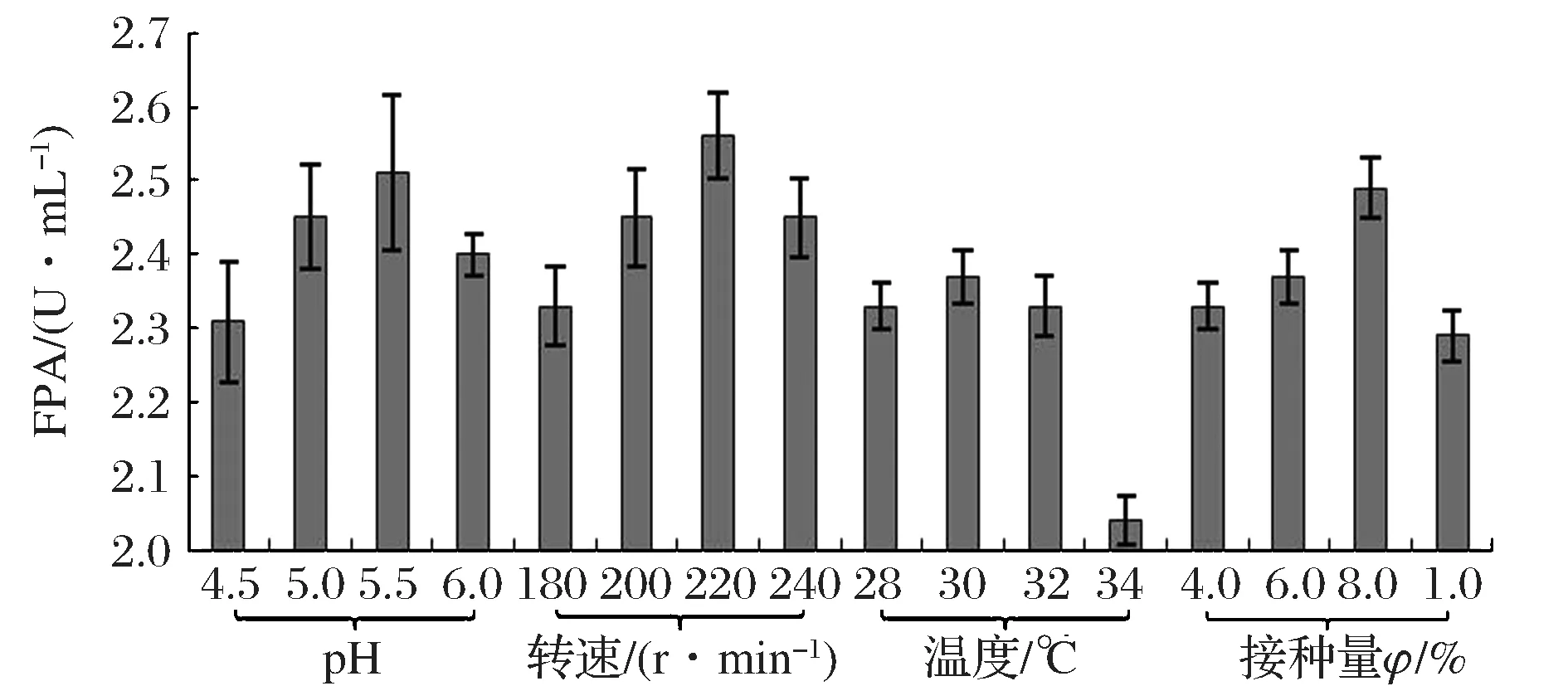
图3 发酵条件单因素实验Fig.3 Single factor experiment of fermentation condition
2.3.2 培养条件正交实验
基于上述的单因素实验结果,对培养条件进行4因素3水平正交实验设计如表5和表6所示。

表5 L9(34)正交实验及结果

表6 正交实验分析结果
经过极差和方差分析,确定各个条件对酶活影响大小顺序依次为:接种量>pH>温度>转速 ,最佳组合为A3B2C2D1,即:pH6.0、转速220 r/min、温度30 ℃、接种量φ6%。进一步实验验证获得该酶发酵酶活为2.69 U/mL,比培养条件优化前提高了12.1%;CMCase与BG达到7.32 U/mL与0.91 U/mL,与优化前相差别不大。
2.4 添加剂对纤维素酶的促进作用
2.4.1 添加吐温-80
一些资料显示,表面活性剂吐温-80能改变细胞结构,增大细胞膜通透性,进而促进内容物外流,使得胞外蛋白分泌加速[11]。本实验考察吐温-80添加时间与添加量对纤维素酶发酵酶活的影响,结果如图4。由图4A可知,在发酵前48 h添加吐温-80不利于发酵产酶,从发酵72 h开始时添加对纤维素酶酶活提高有积极作用,在96 h添加时酶活达到最高水平3.12 U/mL,添加时间再晚时酶活反而降低。因此,选择吐温-80添加时间为发酵96 h。在96 h添加不同量吐温-80考察添加量对产酶影响,如图4B所示。在添加量较低时酶活随着吐温-80添加而明显提高,在添加4.0 g/L时酶活达到3.15 U/mL,添加量再高时酶活反而降低。因此确定在96 h添加吐温-80,添加量为4.0 g/L;此时纤维素酶FPA、CMCase和BG分别达到3.15、8.28和1.22 U/mL,比对照组分别提高了13%、13%和26%。

图4 添加吐温-80对HWPRS发酵产纤维素酶的影响Fig.4 Effect of the Tween-80 on the cellulase production from HWPRS
2.4.2 添加乳糖诱导产酶
文献报道显示,添加乳糖对纤维素酶发酵具有诱导作用。在上述实验基础上,考察乳糖添加对发酵诱导产酶的影响[19]。由图1可知,在发酵48 h内主要是菌体生长,产酶能力较弱,若此时添加乳糖会被消耗用于生长。因此,本实验选择在发酵中期(48、72和96 h)添加不同浓度乳糖(0.25、0.5、1.0、1.5 g/L),考察乳糖对发酵产酶影响。由图5看出,少量乳糖对纤维素酶发酵产酶具有促进作用,但浓度过高也不利于纤维素酶合成,反而抑制酶的表达。主要原因可能是少量乳糖进入细胞内部后诱导酶表达,但乳糖浓度过高时乳糖分解产生单糖抑制了纤维素酶表达[19]。在乳糖添加量0.5 g/L时纤维素酶3种酶活均达到最高水平,FPA、CMCase和BG分别为3.29、8.40和1.36 U/mL。与添加前相比,乳糖添加对BG酶活提高最为明显,提高了13%以上。确定乳糖最佳添加量为0.5 g/L。

图5 乳糖添加对HWPRS发酵产纤维素酶的影响Fig.5 Effect of the lactose addition on cellulase production from HWPRS
2.4.3 添加壳聚糖
壳聚糖是几丁质脱乙酰基后的产物,是自然界中含量仅次于纤维素的天然糖链资源,有文献报道里氏木霉能够降解壳聚糖产生壳寡糖[20]。陆大年等[21]发现在纤维素酶解过程中添加壳聚糖能促进酶解。然而,壳聚糖能否对纤维素酶发酵生产有作用,尚未见诸报道。
选取壳聚糖、几丁质、羧甲基壳聚糖、壳寡糖等几种结构相近的物质,考察它们对纤维素酶发酵影响。由图6可知,发酵时添加壳聚糖能明显提高产酶水平,羧甲基壳聚糖对产酶作用不明显,而几丁质和壳寡糖对产酶有一定抑制作用。因此确定壳聚糖为添加物质。实验接着探讨壳聚糖的最适添加时间与添加量,如图7所示。在发酵前48 h添加壳聚糖对产酶无益,甚至有明显抑制作用,在发酵48 h后添加时壳聚糖对发酵产酶有明显促进作用,在96 h添加时酶活最高达到3.41 U/mL。进一步考察壳聚糖添加量发现,当加量较少时3种酶活均随着壳聚糖添加而不断提高,当壳聚糖添加量为1.50 g/L时酶活达到最高水平,此时FPA、CMCase和BG分别为3.67、8.65和1.76 U/mL,与未添加相比分别提高11%、3%和29%。从结果看出,壳聚糖对纤维素酶BG酶活的促进作用尤为明显。分析原因可能是,壳聚糖在菌体生长早期添加会影响菌体生长与产酶,在菌体进入稳定期大量产酶阶段添加,壳聚糖被快速降解成小分子二(三)糖产物,进入细胞内部后进一步强化纤维素酶诱导表达;此外,壳聚糖还能够特异性地结合在细胞表面增强细胞膜的通透性,促进酶的分泌[22]。因此确定壳聚糖最适添加时间与添加量为:发酵96 h添加1.50 g/L壳聚糖。

图6 不同添加剂对纤维素酶影响Fig. 6 Effect of different additives on cellulase

图7 壳聚糖对HWPRS发酵产纤维素酶促进作用Fig.7 Active role of chitosan addition on the cellulase production from HWPRS
2.5 上罐放大实验
在上述摇瓶发酵基础上,进行5 L发酵罐上产酶实验。发酵温度控制在30 ℃,pH、溶氧控制与发酵酶活情况如图8所示。由图8A看出,在发酵前48 h,发酵液pH迅速下降,通过补加氨水控制pH不低于4.5,此时发酵主要处于菌体旺盛生长阶段,其中在发酵24 h时恒速流加乳糖;发酵48 h后菌体进入稳定期,pH开始回升,溶氧48 h以前控制在80%左右,48 h后在40%左右以使菌体更好产酶[23],其中在发酵96 h添加吐温-80与壳聚糖。由图8B显示,在发酵前48 h由于发酵处于菌体生长期,所以酶蛋白分泌较少,产酶量较低;菌体在发酵48 h后开始大量向外分泌蛋白,相应的纤维素酶酶活FPA和CMCase迅速上升,BG酶活也不断增加。96 h之后,pH趋于稳定,菌体产酶能力有所下降,酶活积累速度下降,在144 h时酶活达到最高值。FPA、CMCase、BG3种酶活分别达到3.50、8.94和1.74 U/mL。与摇瓶发酵结果相比,上罐发酵初步探索的酶活与摇瓶数据相近,但并没有较大程度提高。认为主要原因是摇瓶参数跟上罐参数之间并不完全一致,尤其是在溶氧控制和pH控制上,有待进一步优化。因此后续将通过控制溶氧和pH以及观察菌体形态相结合等策略,进一步提高产酶。
本实验纤维素酶发酵水平与已有报道的比较结果如表7所示。目前的纤维素酶发酵碳源非常广泛,众多研究已从早期的纤维素及其衍生物转向更具工业意义的天然木质纤维素原料,如玉米秸、橡木、玉米芯等,这些基质浓度通常在4%~6%。相对于纤维素及其衍生物发酵(>10 FPU/mL),天然木质纤维素基质发酵产酶仍较低,不足5.0 FPU/mL。本文报道的HWPRS发酵产酶FPA为3~4 U/mL,处于较高水平。与其它天然纤维质原料相比,本发酵所产纤维素酶比酶活明显高于同行报道,比如FPA达4~5 U/mg蛋白;另外,CMCase接近9.0 U/mL,也处于较高水平。由此可见,HWPRS发酵产纤维素酶具有巨大的工业应用潜力。

A-发酵参数控制;B-发酵产酶曲线图8 纤维素酶5 L发酵罐发酵参数Fig.8 Cellulases fermentation in a 5 L stirred tank reactor
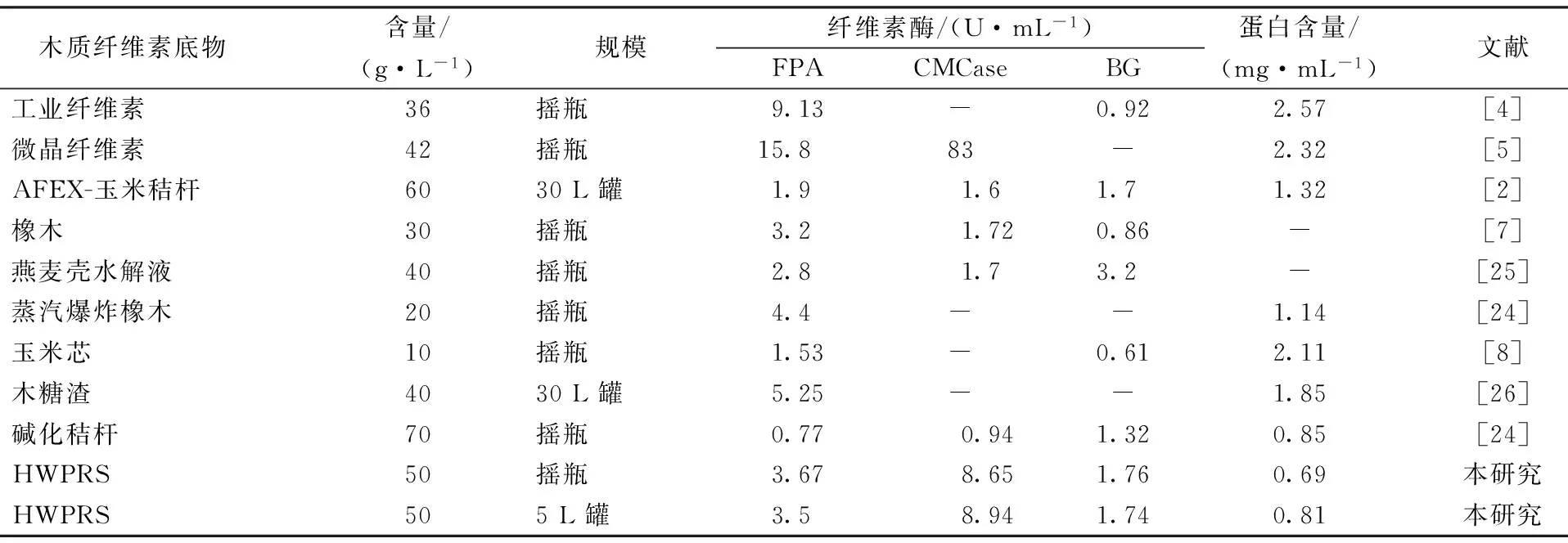
木质纤维素底物含量/(g·L-1)规模纤维素酶/(U·mL-1)FPACMCaseBG蛋白含量/(mg·mL-1)文献工业纤维素36摇瓶9.13-0.922.57[4]微晶纤维素42摇瓶15.883-2.32[5]AFEX-玉米秸杆6030L罐1.91.61.71.32[2]橡木30摇瓶3.21.720.86-[7]燕麦壳水解液40摇瓶2.81.73.2-[25]蒸汽爆炸橡木20摇瓶4.4--1.14[24]玉米芯10摇瓶1.53-0.612.11[8]木糖渣4030L罐5.25--1.85[26]碱化秸杆70摇瓶0.770.941.320.85[24]HWPRS50摇瓶3.678.651.760.69本研究HWPRS505L罐3.58.941.740.81本研究
3 结论
本文通过单因素实验与正交实验对里氏木霉发酵培养基与发酵条件进行优化,显著提高了纤维素酶活水平,纤维素酶FPA达到2.69 U/mL,是优化前2.2倍。吐温-80和乳糖等添加剂也能促进发酵产酶。本文首次发现壳聚糖类物质能促进纤维素酶发酵产酶,使纤维素酶FPA、CMCase和BG分别提高了11%、3%和29%,分别达到3.67、8.65、1.76 U/mL,其发酵稳定性好。结合表7,HWPRS发酵所产纤维素酶FPA比酶活较高,可达4~5 U/mg蛋白,其CMCase接近9.0 U/mL,也处于较高水平。确定HWPRS发酵产纤维素酶具有巨大的工业应用潜力。
[1] DOS REIS L,FONTANA R C, DELABONA PDA S, et al. Increased production of cellulases and xylanases byPenicilliumechinulatumS1M29 in batch and fed-batch culture[J]. Bioresource Technology, 2013, 146: 597-603.
[2] CULBERTSON A,JIN Ming-jie, DA COSTA SOUSA L, et al. In-house cellulase production from AFEX pretreated corn stover usingTrichodermareeseiRut-C30[J]. RSC Advances, 2013, 3: 25960-25969.
[3] 方镇宏, 邓红波, 张小希, 等. 木薯纤维素乙醇发酵的纤维素酶成本评价[J]. 生物工程学报, 2013, 29(3): 312-324.
[4] 张晓月, 孜力汗, 李勇昊, 等. 里氏木霉Rut-C30产纤维素酶培养基优化及其酶解特性[J]. 过程工程学报, 2014, 14(2):312-318.
[5] YAN Zhong-li, CAO Xiao-hong, LIU Qing-dai, et al. A shortcut to the optimization of cellulase production using the mutantTrichodermareeseiYC-108[J]. Indian Journal of Microbiology, 2012, 52(4): 670-675.
[6] 吕雄, 赵晶, 夏黎明. 碳源对里氏木霉纤维素酶诱导合成的影响[J]. 食品与发酵工业, 2010, 36(3): 1-4.
[7] JUHASZ T,SZENGYEL Z, RECZEY K, et al. Characterization of cellulases and hemicellulases produced byTrichodermareeseion various carbon sources[J]. Process Technology, 2005, 40(11): 3 519-3 525.
[8] 马立娟, 蔡瑞, 崔有志, 等. 玉米芯诱导里氏木霉 Rut-C30产纤维素酶的分析[J]. 天津科技大学学报, 2015(3):122-128.
[9] 钟桂芳, 翟莉莉, 樊攀, 等. 里氏木霉产纤维素酶的条件优化及酶学性质研究[J]. 食品与发酵科技, 2013, 49(4): 10-13.
[10] CHANDRA M,SANGWAN N S, KUMAR H, et al. DL-2 aminobutyric acid and calliterpinone are the potential stimulators ofTrichodermacellulase activities[J]. Biomass and Bioenergy, 2014, 62: 212-217.
[11] LIU Jia, YUAN Xing-zhong, ZENG Guang-ming, et al. Effect of biosurfactant on cellulase and xylanase production byTrichodermaviridein solid substrate fermentation[J]. Process Biochemistry, 2006, 41(11): 2 347-2 351.
[12] MILLER G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical Chemistry, 1959, 31(3): 426-428.
[13] BRADFORD M. A rapid method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1-2):248-254.
[14] 王钱钱, 詹怀宇, 孙建中, 等. 纤维素酶在木质纤维素底物上的吸附脱附以及循环利用[J]. 造纸科学与技术, 2014, 33(3): 9-14.
[15] DAOUD F B,KADDOUR S, SADOUN T. Adsorption of cellulaseAspergillusnigeron a commercial activated carbon: kinetics and equilibrium studies[J]. Colloids and Surfaces B: Biointerfaces, 2010, 75(1): 93-99.
[16] 张传志, 康振, 堵国成, 等.重组谷氨酸棒杆菌发酵L-苯丙氨酸培养基的优化[J]. 微生物学通报, 2015, 42(1): 74-84.
[17] ROSYIDA V T,INDRIANINGSIH A W, MARYANA R, et al. Effect of temperature and fermentation time of crude cellulase production byTrichodermareeseion straw substrate[J]. Energy Procedia, 2015, 65: 368-371.
[18] 胡彩静, 代淑梅, 李秋园. 里氏木霉(Trichodermareesei)产纤维素酶液态发酵条件的研究[J]. 食品与发酵工业,2005, 31(9): 45-48.
[19] 王方忠, 蒋艺, 刘奎美, 等. 丝状真菌中纤维素酶与半纤维素酶的合成调控[J]. 生物加工过程, 2014, 12(1): 72-79.
[20] 刘靖, 夏文水. 纤维素酶中双功能酶水解壳聚糖作用方式研究[J]. 食品与发酵工业, 2006, 32(5): 31-35.
[21] 陆大年,付康丽. 一种纤维素酶活化剂: 中国, CN 103695401 A[P]. 2014-04-02.
[22] 余雄伟, 王月慧. 不同分子量壳聚糖对细胞膜通透性的影响[J]. 食品工业, 2011(6): 4-6.
[23] 余晓斌 具润漠. 里氏木霉液体发酵法生产纤维素酶[J]. 食品与发酵工业, 1998, 24(1): 20-25.
[24] ZHANG L,WANG Xiao-qing, RUAN Zhen-hua, et al. Fungal cellulase/xylanase production and corresponding hydrolysis using pretreated corn stover as substrates[J]. Applied Biochemistry and Biotechnology, 2014, 172(2): 1 045-1 054.
[25] SUN Wei-cheng, CHENG Chung-hsien, LEE Wen-chien, et al. Protein expression and enzymatic activity of cellulases produced byTrichodermareeseiRut-C30 on rice straw[J]. Process Biochemistry, 2008, 43(10): 1 083-1 087.
[26] XIA Li-ming, SHEN Xue-liang. High-yield cellulase production byTrichodermareeseiZU-02 on corn cob residue[J]. Bioresource Technology, 2004, 91(3): 259-262.
Cellulase production from the hot water pretreated rice straw by Trichoderma reesei Rut-C30
SU Cun-sheng1, HE Jian-long2, XIONG Peng2, YUE Chun3, YU Feng-chuan1, SUN Fu-bao1*
1(Laboratory of Industrial Biotechnology of Department of Education, School of Bitechnology, Jiangnan University, Wuxi 214122, China) 2(Jiangsu Key Laboratory for Biomass-Based Energy and Enzyme Technology, School of Chemistry and Chemical Engineering, Huaiyin Normal University, Huaian 223005,China) 3(Department of Biological and Chemical Engineering, Nanyang Institute of Technology, Nanyang 473004, China)
In order to enhance the cellulase production ability of industrial strainTrichodermareeseiRut-C30, this study with hot water pretreated rice straw (HWPRS) as carbon source focused on optimization of the fermentation nutrition and condition and the supplement with some additives. The FPA of cellulase produced at our laboratory level for 168 h were 1.20 U/mL. With single-factor and orthogonal experiments, the fermentation medium was optimized as below (g/L): HWPRS 50.0, corn steel liquid 6.0, (NH4)2SO44.0, KH2PO41.0, urea 0.2, MgSO4·7H2O 0.4, CaCl20.3. And the fermentation conditions were selected as follows: pH6.0, rotation speed 220 r/min, temperature 30 ℃, inoculation sizeφ6%. Under above optimized condition, the FPA of cellulase reached 2.69 U/mL, which was double of FPA before optimization. By supplement with some additives, it was found that Tween-80 and lactose both enhanced the enzyme activity of cellulase production significantly, especially the BG activity. Initially, it was found that chitosan and its derivate facilitated cellulase fermentation, in which the chitosan effect was best. The FPA and BG activity of cellulase produced after adding 1.50 g/L chitosan reached 3.67 U/mL and 1.76 U/mL, respectively, which increased by 10% and 30% as compared to that without addition, and the CMCase reached 8.65 U/mL. The fermentation level was basically stable when enlarged to 5 L fermenter level. Thus, the cellulase FPA level studied herein was 3 times of that before the optimization from HWPRS, indicating a promising industrial future of cellulase production.
hot water pretreated rice straw (HWPRS);TrichodermareeseiRut-C30; cellulase; fermentation optimization; chitosan
10.13995/j.cnki.11-1802/ts.201610003
硕士研究生(孙付保副教授为通讯作者,E-mail: fubaosun@jiangnan.edu.cn)。
国家自然科学基金(21176106);中国博士后科学基金(2015M571666);江苏省生物质绿色燃料与化学品重点实验室资助课题(JSBGFC14006);河南省科技开放合作项目(162106000007)
2016-03-02,改回日期:2016-03-28

