新型环糊精手性色谱拆分材料的点击化学调控及拆分性能研究
武志花 赵 杰 李 珅 王 勇*,3
1(天津大学理学院化学系,天津 300072) 2(天津市农业科学院农业资源与环境研究所,天津 300192)3(天津化学化工协同创新中心,天津 300072)
新型环糊精手性色谱拆分材料的点击化学调控及拆分性能研究
武志花1赵 杰2李 珅1王 勇*1,3
1(天津大学理学院化学系,天津 300072)2(天津市农业科学院农业资源与环境研究所,天津 300192)3(天津化学化工协同创新中心,天津 300072)
通过点击化学方式对单叠氮环糊精进行衍生,引入具备不同作用位点的功能化基团,对环糊精手性分离性能进行调控。首先通过醚键将单叠氮环糊精接枝到硅胶表面,进一步通过Cu催化的1,3-偶极环加成反应(点击化学)在环糊精小口端分别引入叔丁基、苯基、酯基和羟基基团,构建了4种新型环糊精手性固定相并通过红外光谱和元素分析对其进行了结构表征。通过高效液相色谱反相分离模式实现了异噁唑啉和丹磺酰氨基酸共16种对映体的手性拆分。酯基功能化的环糊精手性固定相对多数异噁唑啉类有良好的拆分效果,其中,2-氯苯基-异噁唑(2ClPh-OPr)分离度可达1.62。丹磺酰氨基酸类最佳分离pH值为5.0,叔丁基功能化固定相具有最好的分离效果,大部分样品可实现基线分离(Rs>1.5)。
高效液相色谱; 环糊精; 手性固定相; 点击化学
1 引 言
手性药物拆分是当前医药领域的热点和难点之一[1~3]。手性固定相的色谱分析分离技术是迄今为止应用最为成功的分离手段[4,5]。环糊精(Cyclodextrin, CD)手性固定相因其优异的手性选择性以及良好的化学稳定性而成为该领域的研究热点。
环糊精的特殊结构可与多种分子形成稳定的主体-客体包合物,已广泛用于分子识别、分子组装、药物载体、模拟酶以及结构异构和立体异构化合物的分离[6~10]。Armstrong等采用醚键为键合臂,首次获得了对反相分离模式稳定的环糊精固定相,并实现了商品化(Cyclobond series)[11~13]。Muderawan等以脲基为键合臂,制备了结构可控的衍生环糊精手性固定相[14]。Liu等将烯丙基引入键合臂,制备了分离能力优于含氮键合臂的环糊精固定相[15]。Zhang等将β-环糊精通过点击化学接枝到炔基衍生硅胶表面,制备了一种三唑键合臂天然环糊精手性固定相[16]。环糊精改性可改变疏水空腔的几何形貌,引入不同作用力等使固定相具有更高的立体选择性,以适应更多的色谱分离模式[17~20]。Zhou等合成了化学键合单衍生阳离子环糊精固定相[21],并制备出系列希夫碱单臂衍生环糊精手性固定相[22]。
最近,本研究组通过自下而上的点击化学方法实现了硅胶表面环糊精双分子层的制备,并实现了不同类别化合物的有效拆分[23]。基于前期工作,本研究以叠氮环糊精硅胶为母体,采用点击化学[24,25]手段,对环糊精小口端进行功能调控,制备新型环糊精手性分离材料,比较不同修饰基团在手性拆分过程中的影响,以期为实现单层环糊精色谱材料的性能调控提供有益参考。
2 实验部分
2.1 仪器与试剂
FTS3000型傅里叶变换红外光谱仪(美国伯乐公司); Vario Micro cube 型元素分析仪(德国Elementar公司); AVANCE III型400液体核磁共振谱仪(瑞士Bruker公司); P10SNXP1型高压填柱泵(美国 LabAlliance公司); 液相色谱(美国LabAlliance公司)。
γ-(2,3-环氧丙氧)丙基三甲氧基硅烷(KH-560)、1-乙烯基咪唑、叠氮化钠(NaN3)、N,N-二甲基甲酰胺(DMF)、3,3-二甲基-1-丁炔、苯乙炔、丙炔酸甲酯及3-丁炔-1-醇等(希恩思生化科技有限公司); 乙腈、甲醇、三乙胺及冰醋酸(色谱纯,天津康科德科技有限公司); 丹磺酰、氨基酸(Sigma-Aldrich公司,上海); 异噁唑啉全部由实验室自行合成[26],对映体结构列于图1。
图1 对映异构体化学结构Fig.1 Chemical structures of the studied racemates
2.2 环糊精类键合固定相的制备
固定相材料的具体制备路线如图2所示。
2.2.1 单-6-叠氮-β-环糊精功能化硅胶(N3CDCSP)的制备 6.28 g N3-CD搅拌下溶于130 mL无水DMF,加入259.2 mg NaH,室温反应2 h。加入KH-560,氮气保护90℃反应4 h。待反应物冷却至室温,加入12 g活化硅胶,继续反应24 h。依次用DMF、水、乙醇、丙酮清洗,得白色固体粉末。
2.2.2 固定相材料的点击制备 4个250 mL三口瓶中分别加入40 mL DMF及2.2.1节制备的2.5 g N3CDCSP,分别加入0.148 mL 3,3-二甲基-1-丁炔、0.129 mL苯乙炔、0.148 mL 丙炔酸甲酯、 0.91 mL 3-丁炔-1-醇,最后加入70 mg催化剂(PPh3)CuI,90℃反应24 h。抽滤,滤饼用DMF、丙酮洗两遍,60℃真空干燥24 h,得到4种白色固体产物CSP1,CSP2,CSP3以及CSP4。
2.3 色谱柱的填装与色谱实验条件
采用匀浆填充法填装色谱柱,将制备好的固定相装填入不锈钢柱(15 cm×4.6 mm)。装柱压力38 MPa,装柱溶剂为甲醇。

图2 环糊精手性分离材料CSPs的合成路线Fig.2 Synthetic procedure of chiral stationary phases (CSPs)
流动相由甲醇或乙腈与去离子水或三乙胺-乙酸缓冲液(记为TEAA,乙酸调节pH值)通过不同比例混合配制。分析物用甲醇或乙腈-水(1∶1,V/V)配制,浓度约为1 mg/mL。所有缓冲液及配制分析物均经过0.45 μm滤膜过滤。进样体积为10 μL,每个分析物均重复测试3次。检测波长范围为200~300 nm。各对映体分离的保留因子、选择性、分离度等分离参数均通过标准公式(基于USP标准)计算。
3 结果与讨论
3.1 环糊精类键合相的制备与表征
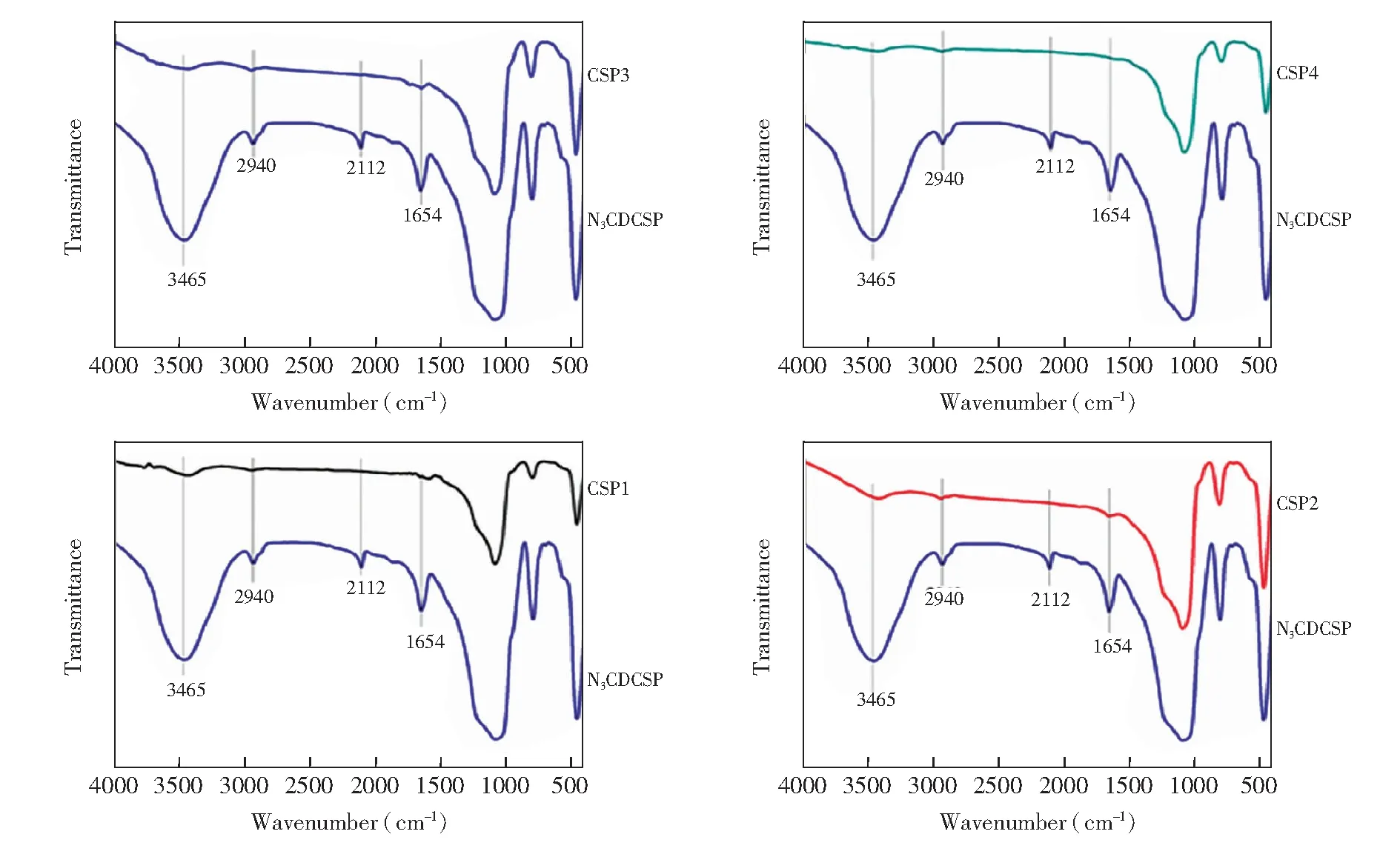
图3 N3CDCSP与CSPs的红外光谱Fig.3 FTIR of azido cyclodextrin functionalized silica (N3CDCSP) and CSPs

表1 N3CDCSP与4种固定相的元素分析结果
Table 1 Elemental analysis of azido cyclodextrin functionalized silica (N3CDCSP) and four stationary phases

SampleN(%)C(%)H(%)CSP10.869.411.88CSP20.819.111.74CSP30.798.561.68CSP40.858.221.80N3CDCSP0.808.151.74CSP1:tert-butylcyclodextrinCSP;CSP2:Phenylcyclo-dextrinCSP;CSP3:estercyclodextrinCSP;CSP4:hy-droxylcyclodextrinCSP.
3.2 新型手性色谱分离材料的色谱行为评价
几类改性基团均具有不同的极性及作用位点,叔丁基可提供较强的疏水及位阻效应,苯基能够提供π-π作用,酯基能够提供氢键电子给体和偶极-偶极作用,羟基则仅提供氢键电子给体或受体作用等。因此,为了研究不同取代基的影响,本研究选取了丹磺酰氨基酸和异噁唑啉两大类共16种对映异构体进行固定相材料的色谱行为评价。3.2.1 异噁唑啉类手性化合物拆分 异噁唑啉类化合物是重要的农药试剂、医药、合成天然化合物的潜在中间体。本研究选择MeOH-H2O作为流动相,考察所合成材料的手性分离性能[27],拆分结果及各材料的分离结果比较如表2和图4所示。整体而言,4种材料都能够对异噁唑啉类化合物产生良好的拆分效果。这主要得益于环糊精疏水空腔与该类化合物的苯环基团能够形成较好的包合物。对比Ph-OPr,4ClPh-OPr,3ClPh-OPr和2ClPh-OPr发现,3位氯取代降低了CSP对其的分离度,而2位和4位取代显著提升了Ph-OPr的分离效果,这可能是由于邻位取代基的影响,2ClPh-OPr和4ClPh-OPr中的苯环能够更好地与环糊精空腔形成匹配包合。4MetPh-OPr,4MOPh-OPr,MDOPh-OPr和4NPh-OPr的分离效果较未取代的Ph-OPr均有显著提高,可归因于苯环的电子云密度提高或共轭体系增大使得包合物更容易稳定。
异噁唑啉类在不同CSP上的拆分结果对比见图4。对于绝大多数异噁唑啉样品,CSP2的选择性最低,且对于Ph-OPr和3ClPh-OPr完全没有拆分效果。从表2可知,大多数样品在CSP2上的保留因子最小。这可能是由于苯环具有较强的π-体系,分离过程中可能会部分嵌入临近的环糊精空腔,导致样品不能够与环糊精形成稳定的包合。从图4a可知,大多数样品在CSP4上获得了最高的选择因子,但分离度的结果(图4b)却不尽相同,这说明不同的取代基修饰对于环糊精固定相的动力学和热力学因素有不同程度的影响。研究表明,CSP3对多数样品具有最大的保留因子(表2),说明酯基取代引入的偶极-偶极作用位点与样品中吡咯烷酮中的羰基产生了强相互作用,这也能解释半数以上样品在CSP3上取得较好分离度的原因。
表2 异噁唑啉类手性拆分结果
Table 2 Chiral resolution of isoxazolines
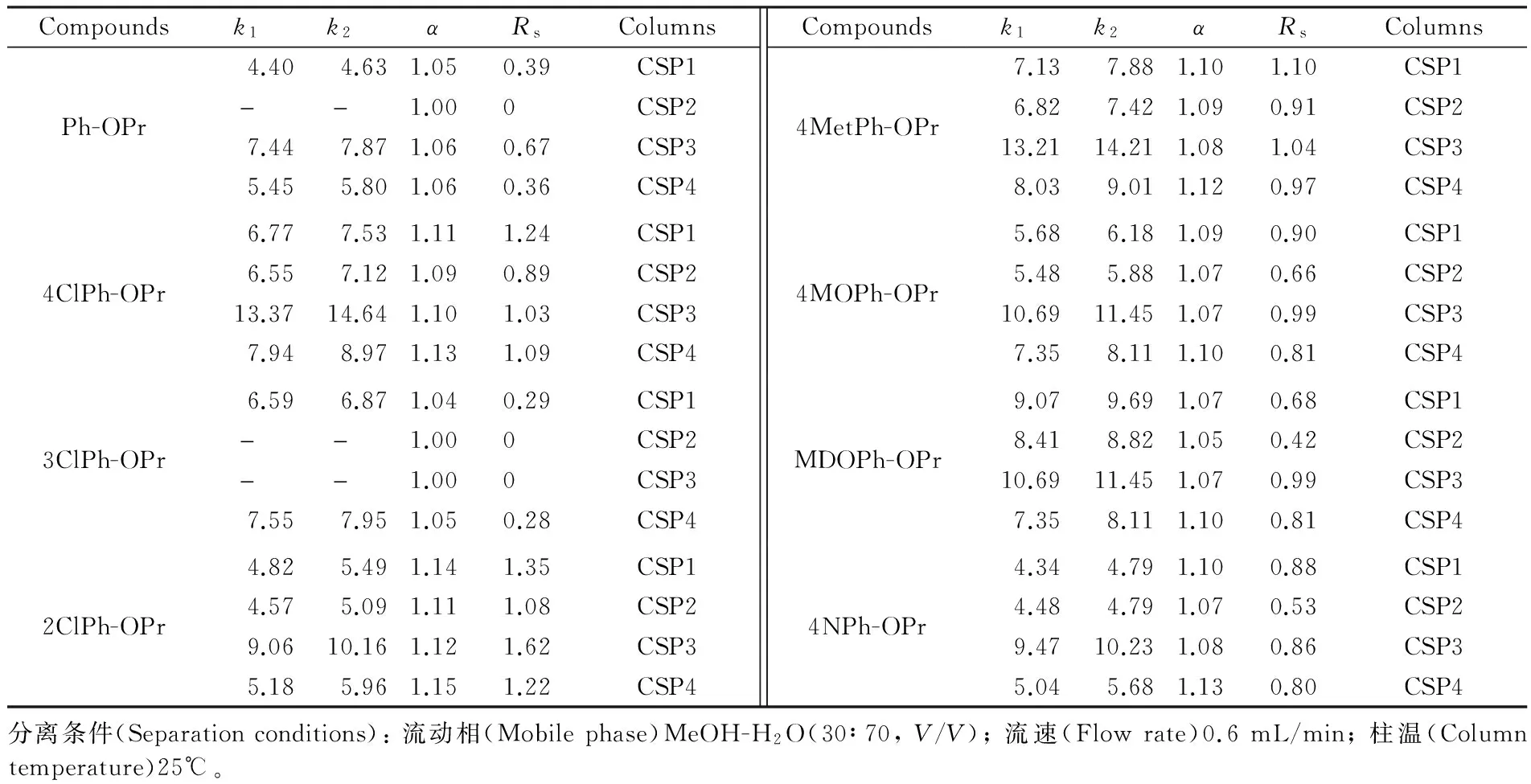
CompoundsPh-OPr4ClPh-OPr3ClPh-OPr2ClPh-OPrk1k2αRsColumns4.404.631.050.39CSP1--1.000CSP27.447.871.060.67CSP35.455.801.060.36CSP46.777.531.111.24CSP16.557.121.090.89CSP213.3714.641.101.03CSP37.948.971.131.09CSP46.596.871.040.29CSP1--1.000CSP2--1.000CSP37.557.951.050.28CSP44.825.491.141.35CSP14.575.091.111.08CSP29.0610.161.121.62CSP35.185.961.151.22CSP4Compounds4MetPh-OPr4MOPh-OPrMDOPh-OPr4NPh-OPrk1k2αRsColumns7.137.881.101.10CSP16.827.421.090.91CSP213.2114.211.081.04CSP38.039.011.120.97CSP45.686.181.090.90CSP15.485.881.070.66CSP210.6911.451.070.99CSP37.358.111.100.81CSP49.079.691.070.68CSP18.418.821.050.42CSP210.6911.451.070.99CSP37.358.111.100.81CSP44.344.791.100.88CSP14.484.791.070.53CSP29.4710.231.080.86CSP35.045.681.130.80CSP4分离条件(Separationconditions):流动相(Mobilephase)MeOH-H2O(30∶70,V/V);流速(Flowrate)0.6mL/min;柱温(Columntemperature)25℃。
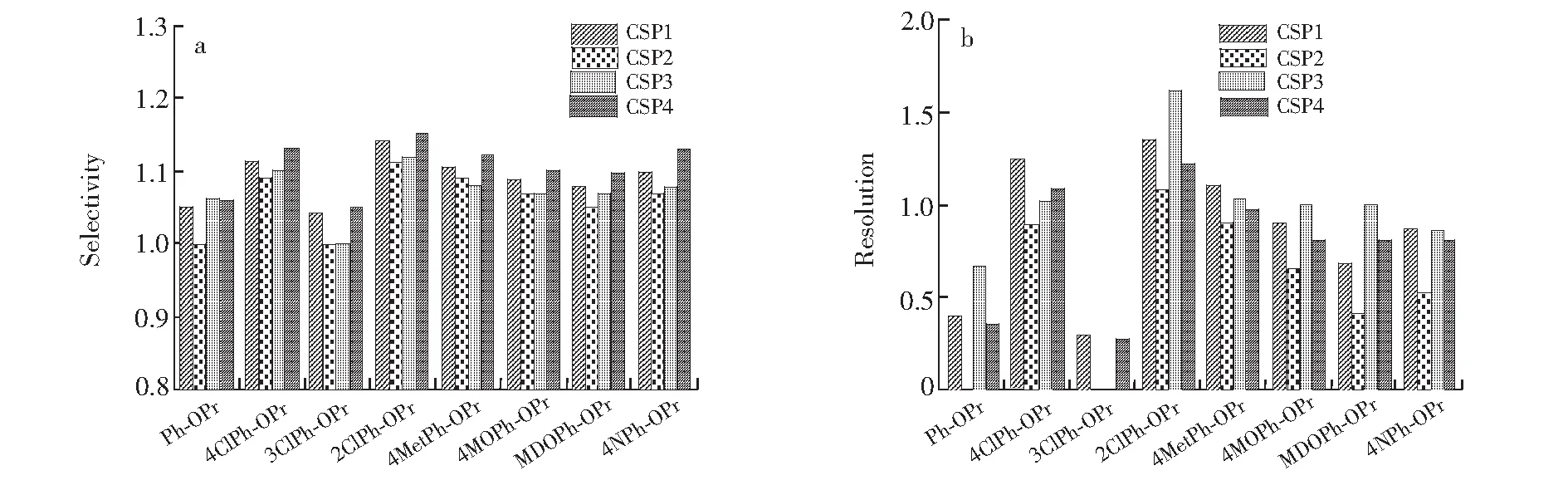
图4 4种固定相分离结果比较Fig.4 Comparison of four CSPs分离条件(Conditions):流动相(Mobile phase)MeOH-H2O(30∶70, V/V),流速(Flow rate)0.6 mL/min; 柱温(Column temperature)25℃。
3.2.2 丹磺酰氨基酸类手性化合物的拆分 因丹磺酰氨基酸类属于两性化合物,本研究选取CSP4为研究对象,乙腈-1% TEAA缓冲液(30∶70,V/V)为流动相,调节缓冲液pH值为4, 5, 6和7,考察pH值对保留因子和分离度的影响。由图5可见,对于保留因子,在实验pH范围内,Dns-Leu, Dns-Aca及Dns-Phe保留因子相对较高,这主要是由于样品中与手性碳相连接的侧链较其余样品疏水性更强,Dns-Aca的侧链中含有6个碳原子,能够与环糊精空腔形成最强疏水相互作用,因此其保留因子值最高。由于丹磺酰氨基酸类属于两性分子,因此随着pH值的增加,其保留因子经历了先增加后减小的过程。在CSP4上,虽然Dns-Aca具有最大的保留因子,但Dns-Leu却实现最高分离度,这说明侧链含有支链有利于提升环糊精的分离效果。考虑到pH=5时大多数样品的分离度最高,本研究选取pH=5,考察其它固定相材料对丹磺酰氨基酸类的拆分效果,分离结果见表3。

图5 pH值对保留因子(a)和分离度(b)的影响Fig.5 pH effect on retention factor (a) and resolution (b)
表3 丹磺酰氨基酸类的手性拆分
Table 3 Chiral resolution of dansyl amino acid
CompoundsDns-NvaDns-ValDns-LeuDns-Abak1k2αRsColumns4.725.291.121.82CSP12.743.021.100.86CSP21.791.991.110.47CSP32.422.771.140.57CSP44.865.741.181.98CSP12.893.351.161.44CSP21.942.301.180.87CSP32.803.441.230.95CSP45.897.451.262.00CSP13.343.891.171.46CSP22.272.861.261.29CSP33.234.101.271.06CSP44.344.821.111.19CSP12.602.881.110.96CSP21.671.831.090.39CSP32.472.841.150.58CSP4CompoundsDns-AcaDns-PheDns-SerDns-Thrk1k2αRsColumns10.1111.861.171.83CSP15.716.251.091.29CSP24.034.821.191.39CSP35.746.901.200.91CSP47.007.921.131.20CSP14.424.891.111.03CSP23.103.451.110.64CSP34.425.051.140.66CSP44.254.851.141.43CSP13.023.341.110.96CSP21.902.171.140.70CSP32.573.001.170.66CSP43.183.771.191.76CSP12.162.541.181.41CSP21.381.631.180.86CSP32.132.661.251.02CSP4分离条件(Conditions):流动相(Mobilephase)CAN-1%TEAA(30∶70,V/V),流速(Flowrate)0.8mL/min;柱温(Columntempera-ture)25℃。
由表3可见,由于萘环能够与环糊精疏水空腔很好地形成紧密包合,4种固定相材料都能够对所有样品具备分离能力。图6更直观地给出了各样品在不同固定相上的保留因子和分离度比较结果。由于存在高疏水侧链,Dns-Aca在所有的固定相上都具有最高保留,也具有相对可观的分离度。由于侧链中支链的影响,Dns-Val、Dns-Leu和Dns-Thr获得较高的分离度,而Dns-Thr侧链中羟基减弱了其疏水作用,因此相比其它两种分离度略低。Dns-Aba的分离度相对较低主要是由于侧链较短,Dns-Phe则由于可能存在苯环、萘环和环糊精空腔间的竞争包合减弱了其分离效果。
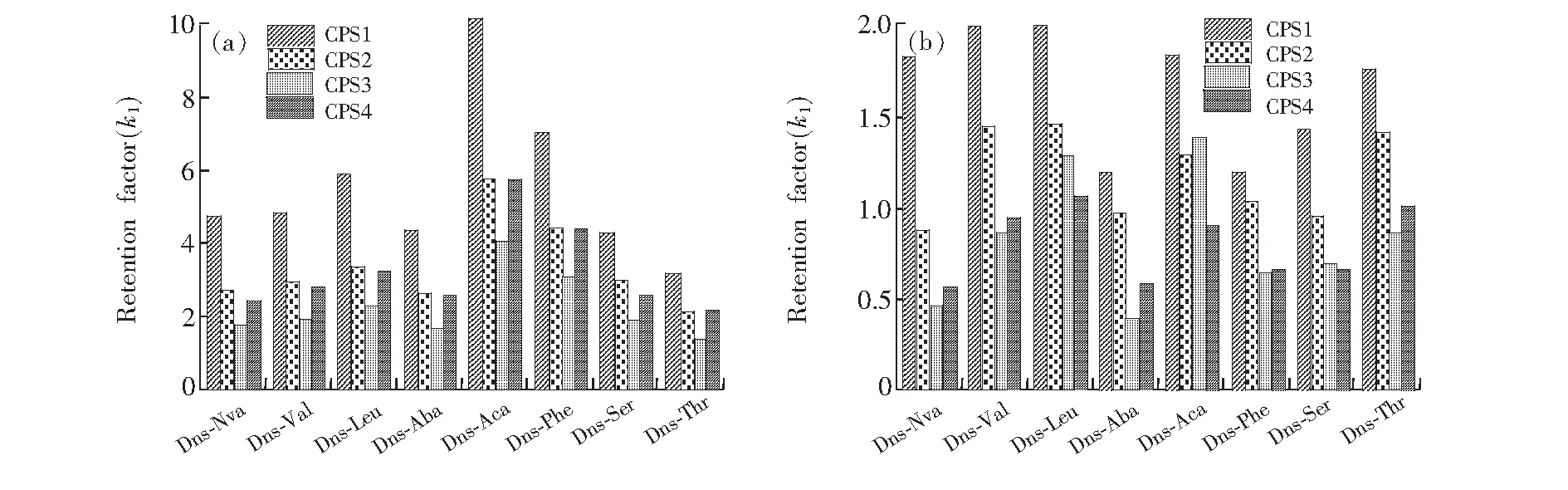
图6 丹磺酰氨基酸在不同CSP上的保留因子(a)和分离度(b)Fig.6 Retention factor (a) and resolution (b) of dansyl amino acids on different CSPs
从图6中分离度对比结果可知,CSP1对于所有的样品都具有最高的保留值和分离度。由于4种CSP具有相同的表面固载量,因此其分离能力的差异完全取决于其改性基团。可以推断,与异噁唑啉类不同,对于丹磺酰氨基酸类对映体,除了环糊精的包合作用,立体效应在其分离过程中占据重要位置。相较于其它改性基团,叔丁基由于具备较大的疏水面, 可引入良好的空间效应,显著提升其分离效果。该结论也可通过丹磺酰氨基酸侧链为支链时具有更高的分离度佐证。因此,对于分离该类对映体,可优先考虑在手性选择剂中引入叔丁基。
3.3 重现性和稳定性
通过长时间间隔多次单一进样(每次5天,共8次平行实验)考察4种固定相的重现性和稳定性。由于醚键和三唑环良好的化学惰性,所制备的4种固定相材料虽经过不同分离条件尤其是缓冲液的冲洗,保留因子和分离度能够很好地保持(相对标准偏差均小于4%),说明所合成的固定相材料具有良好的稳定性。代表性的色谱分离图见图7。

图7 代表性的色谱分离图Fig.7 Representative chromatograms(a: CSP3; b: CSP1)分离条件见表2和表3(Separation conditions see Table 2 and Table 3)。
4 结 论
通过点击化学方法构建了4种新型环糊精手性固定相材料。环糊精中引入偶极-偶极作用有利于异噁唑啉类拆分,且苯环取代基位置对其与环糊精包合物的形成影响显著。对于丹磺酰氨基酸类化合物,侧链性质对其手性分离效果具有重要影响,支链取代基更有利于其手性拆分,因此在固定相中引入空间效应将显著提升其分离效果。
1 Cavazzini A, Pasti L, Massi A, Marchetti N, Dondi F.Anal.Chim.Acta, 2011, 706(2): 205-222
2 Kuang X, Ma Y, Su H, Zhang J, Dong Y B, Tang B.Anal.Chem., 2014, 86(2): 1277-1281
3 Yang X C, Wong S Y, Bwambok D K, Atkinson M B J, Zhang X, White-sides G M, Myerson A S.Chem.Commun., 2014, 50: 7548-7551
4 Fortuna A, Alves G, Falcao A.Biomed.Chromatogr., 2014, 28(1): 27-58
5 Fernandes C, Tiritan M, Pinto M.Chromatographia, 2013, 76(15): 871-897
6 Asman S, Mohamad S, Sarih N M.Int.J.Mol.Sci., 2015, 16(2): 3656-3676
7 Cui H, Chen L, Dong Y L, Zhong S W, Guo D Q, Zhao H, He J, Zou H, Li X J, Yuan Z B.J.Electroanal.Chem., 2015, 742: 15-22
8 ZHANG Yang, LI Lai-Sheng, CHENG Biao-Ping, ZHOU Ren-Dan, NIE Gui-Zhen.Chinese.J.Anal.Chem., 2014, 42(3): 375-383
张 杨, 李来生, 程彪平, 周仁丹, 聂桂珍. 分析化学, 2014, 42(3): 375-383
9 Guitet M, Zhang P, Marcelo F, Tugny C, Jiménez-Barbero J, Buriez O, Ama-tore C, Mouriès-Mansuy V, Goddard J P, Fensterbank L, Zhang Y, Roland S, Ménand M, Sollogoub M.Angew.Chem.Int.Ed., 2013, 52(28): 7213-7218
10 Li S, Xing P, Hou Y, Yang J, Yang X, Wang B, Hao A.J.Mol.Liq., 2013, 188: 74-80
11 Armstrong D W, Stalcup A M, Hilton M L, Duncan Jr J D, Faulkner J R, Chang S C.Anal.Chem., 1990, 62(15): 1610-1615
12 Armstrong D W, DeMond W.J.Chromatogr.Sci., 1984, 22(9): 411-415
13 Hilton H L, Chang S C, Gasper M P.J.Liq.Chromatogr., 1993, 16: 127-147
14 Muderawan I W, Ong T T, Ng S C.J.Sep.Sci., 2006, 29(12): 1849-1871
15 Liu M, Da S L, Feng Y Q, Li L S.Anal.Chim.Acta, 2005, 533(2): 89-95
16 Zhang Y P, Guo Z M, Ye J X, Xu Q, Liang X M, Lei A W.J.Chromatogr.A, 2008, 1191(1): 188-192
17 Yu G Y, Guo L Z, Xie F Y, Yao B X, Zeng Q L, Weng W.Chromatographia, 2011, 73(11): 1049-1055
18 YANG Shao-Ning, LUO Ai-Qin, HOU Ai-Jun.J.Anal.Sci., 2008, 24(5): 615-617
杨少宁, 罗爱芹, 候爱军. 分析科学学报, 2008, 24(5): 615-617
19 Zhong Q Q, He L F, Beesley T E, Trahanovsky W S, Sun P.J.Chromatogr.A, 2006, 1115(1): 19-45
20 Araki T, Tsunoi S, Tanaka M.Anal.Chim.Acta, 2000, 410(1): 37-45
21 Zhou Z M, Li X, Chen X P.Anal.Chim.Acta, 2010, 678(2): 208-214
22 Zhou Z M, Fang M, Yu C X.Anal.Chim.Acta, 2005, 539(1): 23-29
23 Zhao J, Lu X H, Wang Y, Tan T T Y.J.Chromatogr.A, 2014, 1343: 101-108
24 FU Chun-Mei, SHI Hong-Yu, LI Zhang-Wan, QIAN Guang-Sheng.ChineseJ.Anal.Chem., 2010, 38(7): 1011-1014
付春梅, 石宏宇, 李章万, 钱广生. 分析化学, 2010, 38(7): 1011-1014
25 NIE Ji, LI Jian-Ping, DENG Huan, PAN Hong-Cheng.ChineseJ.Anal.Chem., 2015, 43(4): 609-617
聂 骥, 李建平, 邓 欢, 潘宏程. 分析化学, 2015, 43(4): 609-617
26 Gong Y, Wang Y, Zhao W T, Tang X Y.J.Chem.Res., 2013, 37(8): 499-502
21 Yao X B, Gong Y, Mamuti R, Xing W W, Zheng H, Tang X Y. Wang Y.RSCAdv., 2014, 4(8): 30492-30499
(Received 31 July 2015; accepted 13 November 2015)
This work was supported by the National Natural Science Foundation of China (No.21205086), Tianjin Natural Science Fund (No.13JCQNJC05400) and Independent Innovation Project Fund of Tianjin University(No.2015XRX-0021)
Enantioseparation Performance Tuning of Novel Cyclodextrin Chiral Separation Materials via Click Chemistry
WU Zhi-Hua1, ZHAO Jie2, LI Shen1, WANG Yong*1,3
1(DepartmentofChemistry,SchoolofScienceTianjinUniversity,Tianjin300072,China)2(InstituteofAgriculturalResourceandEnvironmentTianjinAcademyofAgriculturalScience,Tianjin300192,China)3(CollaborativeInnovationCenterofChemicalScienceandEngineering,Tianjin300072,China)
This work fabricates four novel chiral stationary phases (CSPs) by tuning the functionality on cyclodextrin (CD) small mouth via click chemistry. Mono-6-deoxy-azido CD was anchored onto silica surface via ether linkage, followed by introducing tert-butyl, phenyl, ester and hydroxyl groups to the azido CD silica respectively. The as-prepared four novel CD CSPs were characterized by FTIR and elemental analysis. 16 enantiomer pairs including isoxazolines and dansyl amino acids could be baseline or partially separated on the current CD CSPs under reversed-phase separation mode. Ester functionalized CD CSP exhibited good chiral recognition towards isoxazolines and the resolution of 2-chlorphenyl-isoxazole(2ClPh-OPr)reached 1.62. The optimum pH for the separation of dansyl amino acids was 5.0. Among the prepared CSPs, Tert-butyl functionalized CD CSP had the best enantioseparation performance towards dansyl amino acids with most of the analytes baseline separated (Rs>1.5).
High performance liquid chromatography; Cyclodextrin; Chiral stationary phase; Click chemistry
10.11895/j.issn.0253-3820.150611
本文系国家自然科学基金(No.21205086)、天津市自然科学基金(No.13JCQNJC05400)、天津大学自主创新基金(No.2015XRX-0021)资助项目
2015-07-31收稿; 2015-11-13接受
* E-mail: wangyongtju@tju.edu.cn

