pGL3-4×PRE-E4-luc报告基因质粒的构建及在p44信号通路中的应用鉴定
生秀梅, WANG Zhengxin
(1.江苏大学 医学院, 江苏 镇江 212013;2.克拉克亚特兰大大学 生物科学系 肿瘤研究与治疗发展中心, 亚特兰大 30314, 美国)
pGL3-4×PRE-E4-luc报告基因质粒的构建及在p44信号通路中的应用鉴定
生秀梅1,2, WANG Zhengxin2*
(1.江苏大学 医学院, 江苏 镇江 212013;2.克拉克亚特兰大大学 生物科学系 肿瘤研究与治疗发展中心, 亚特兰大 30314, 美国)
p53基因是一种重要的抑癌基因,其产物能够与靶DNA特异性结合并激活转录参与诱导细胞凋亡,调控细胞周期,控制细胞的增殖与分化.p44蛋白主要定位于前列腺癌细胞的细胞质,促进癌细胞的增殖.通过shRNA沉默p44的表达后,LNCaP细胞的生长受抑制, p53靶基因TIGAR和GLIPR1的表达增加.为探寻p53是否介导p44对TIGAR和GLIPR1的作用,本研究构建了pGL3-4×PRE-E4-luc报告基因质粒,并将其分别转染经NT-shRNA慢病毒和p44-shRNA慢病毒感染的LNCaP细胞,比较两者荧光素酶活性.结果显示,重组质粒pGL3-4×PRE-E4-luc构建成功,为进一步研究p53在肿瘤发生发展过程中的作用通路提供了新的手段.但LNCaP细胞中p44并非通过p53作用于TIGAR和GLIPR1基因,具体机制仍有待进一步研究.
p53; p53应答元件; 报告质粒; p44通路
p53基因是一种重要的抑癌基因,其产物p53蛋白能够与靶DNA内部或上游特异性序列结合并激活转录参与诱导细胞凋亡,调控细胞周期,控制细胞的增殖与分化[1-4].许多类型的肿瘤都伴有不同程度的p53基因突变,大多数突变发生在编码DNA结合域的保守序列区域,从而导致其特异性结合能力的降低[5-7].EI-Deiry等[8]已鉴定出野生型p53作用靶基因的共有序列,这些序列中含有2个拷贝的5’-PuPuPuC(A/T)(T/A)GPyPyPy-3’,中间相隔0到13 bp.本研究选择4个反向重复的p53应答元件(p53-response elements, PRE)5’-AGACATGCCTAGACATGCCT-3’[9],构建含E4启动子的荧光素酶报告质粒pGL3-4×PRE-E4-luc,并将其导入p53阳性前列腺癌LNCaP细胞以验证其活性.
p44是一种雄激素受体共刺激因子,在增殖活跃的前列腺癌细胞内主要定位于细胞质,为细胞增殖所必须[10,12].TP53诱导的糖酵解和凋亡调节因子(TIGAR),能够参与调节细胞的糖代谢[13,14].神经胶质瘤致病相关蛋白1(GLIPR1)是p53靶基因,其过表达可诱导前列腺癌、肺癌和结肠癌的细胞凋亡[15-18].通过shRNA沉默p44的表达后, 前列腺癌LNCaP细胞的生长被抑制,p53靶基因TIGAR和GLIPR1的表达增加.本研究将构建的pGL3-4×PRE-E4-luc重组报告基因质粒,转染通过shRNA稳定敲低p44的LNCaP细胞及其对照细胞,比较两者荧光素酶活性,用以检测p44是否通过p53作用于TIGAR和GLIPR1.上述 pGL3-4×PRE荧光素酶报告质粒的构建为进一步研究癌细胞中p53的表达、基因型及上下游作用通路提供了新的手段.
1 材料和方法
1.1 材料
重组质粒pGL3-E4-luc与pRL-CMV,前列腺癌LNCaP细胞及大肠杆菌E.coliXL 10-gold感受态细胞由本研究组保存;慢病毒稳转p44-shRNA的LNCaP细胞及其对照稳转NT-shRNA的LNCaP细胞由本研究组构建;Lipofectamine® 2000转染试剂购自Thermo Fisher公司;RPMI 1640培养基购自Cellgro公司.
1.2方法
1.2.1 重组质粒pGL3-4×PRE-E4-luc的构建 5’-AGACATGCCTAGACATGCCT-3’ 为p53的4个反向重复作用元件(PRE),设计合成含5’-AGACATGCCTAGACATGCCT-3’的首尾两段序列,在5’端分别加上XhoI和XbaI的粘性末端,在3’端则分别加上XbaI和XhoI的粘性末端,两段序列分别为:1)5’-TCGAGAGACATGCCTAGACATGCCTT-3’;2)5’-CTAGAAGGCATGTCTAGGCATGTCTC-3’(下划线处为相应粘性末端).将pGL3-E4-luc质粒用XhoI和XbaI进行双酶切,电泳切胶回收后,与退火互补后的上述序列用T4 DNA连接酶室温连接过夜,将连接产物转化至E.coliXL 10-gold,通过DNA测序分析确认构建成功.将该质粒命名为pGL3-4×PRE-E4-luc.
1.2.2 重组质粒pGL3-4×PRE-E4-luc转染LNCaP细胞及其双荧光素酶活性测定 LNCaP细胞接种于24孔板中,用含10%胎牛血清的RPMI 1640培养液于37℃、5%CO2条件下,在细胞培养箱中培养,至细胞密度大小为50%~80%时,更换为无血清无抗生素培养基,使用Lipofectamine® 2000转染试剂进行转染.选择4种浓度pGL3-4×PRE-E4-luc,分别为0、50、100、200 ng,并用pGL3-E4-luc 200、100、150、0 ng相应补齐至质粒总量为200 ng.上述质粒分别与5 ng pRL-CMV共转染LNCaP细胞,6 h后,换新鲜含10%胎牛血清的RPMI 1640培养液培养;继续培养48 h后,收集细胞,按照双荧光素酶报告基因检测试剂盒(Promega)的操作步骤,利用TD20/20Luminator检测荧光素酶活性[10].
1.2.3 重组质粒pGL3-4×PRE-E4-luc在p44通路研究中的应用 将100 ng pGL3-4×PRE-E4-luc和5 ng pRL-CMV分别共转染慢病毒稳转p44-shRNA与NT-shRNA的LNCaP细胞,6 h后,换新鲜含10%胎牛血清的RPMI 1640培养液培养,继续培养48 h后,收集细胞,按照双荧光素酶报告基因检测试剂盒(Promega)的操作步骤,检测荧光素酶活性.
2 结果
2.1 重组质粒 pGL3-4×PRE-E4-luc的构建
将4个反向重复作用原件导入至pGL3-E4-luc的腺病毒启动子E4(-38-+12)的上游构建pGL3-4×PRE-E4-luc(图1).构建的质粒用XhoI和XbaI进行双酶切,20%PAGE胶鉴定,并进行DNA测序分析,结果显示,插入的片段完全正确.至此,重组pGL3-4×PRE-E4-luc报告载体构建成功.
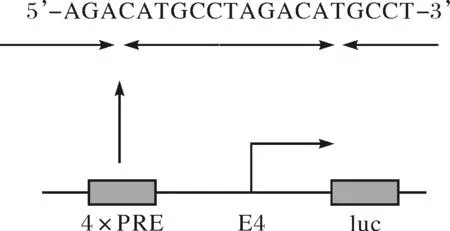
图1 重组质粒pGL3-4×PRE-E4-luc报告质粒的构建Fig.1 Construction of pGL3-4×PRE-E4-luc reporter plasmid
2.2 重组质粒pGL3-4×PRE-E4-luc的活性测定
重组质粒pGL3-E4-luc携带有腺病毒最小启动子E4(-38-+12),启动子活性较低,通常受上游序列的影响[9].pGL3-4×PRE-E4-luc报告质粒在E4上游插入了4个p53应答元件.为了检测pGL3-4×PRE-E4-luc是否具备活性,分别用pGL3-E4-luc (200 ng),pGL3-E4-luc(150 ng)+pGL3-4×PRE-E4-luc(50 ng),pGL3-E4-luc(100 ng)+pGL3-4×PRE-E4-luc(100 ng)及pGL3-4×PRE-E4-luc(200 ng)转染p53阳性前列腺癌LNCaP细胞.结果如图2所示:对照组pGL3-E4-luc活性较低,加入pGL3-4×PRE-E4-luc(50 ng)后,荧光素酶活性显著增高26.3倍;加入pGL3-4×PRE-E4-luc 200 ng后,荧光素酶活性增高49.5倍.说明pGL3-4×PRE-E4-luc报告质粒在LNCap细胞中具备较强活性,p53作用于4×PRE后激活E4启动子,启动了下游luc基因的表达.
2.3 重组质粒pGL3-4×PRE-E4-luc在p44通路中的应用
前期研究中发现p44 shRNA沉默LNCaP细胞p44的表达后,相对内参基因actin mRNA水平而言,p53靶基因TIGAR与GLIPR1的mRNA水平分别上调约5倍与8倍(图3).为此,将pGL3-4×PRE-E4-luc分别转染慢病毒稳转p44-shRNA与NT-shRNA的LNCaP细胞,比较两者荧光素酶活性.如图4A所示,经p44-shRNA慢病毒感染的LNCaP细胞中p44的表达降低,但意外的是 p53的蛋白水平反而降低一倍.与p53的蛋白水平变化趋势一致, p44稳定敲低的LNCaP细胞中荧光素酶活性与对照细胞中无显著差异(图 4B),说明LNCaP细胞中p44并非通过p53作用于TIGAR与GLIPR1基因.
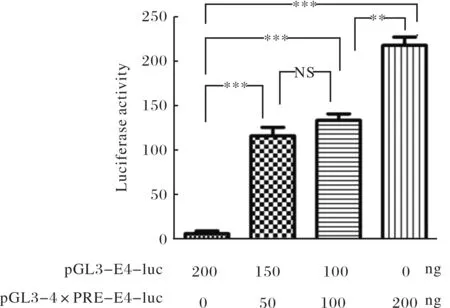
图2 重组质粒pGL3-4×PRE-E4-luc转染LNCap细胞后荧光素酶活性测定Fig.2 Luciferase activity of pGL3-4×PRE-E4-luc after transfected into LNCaP cells注:**, P<0.01;***, P<0.001;NS, P>0.05
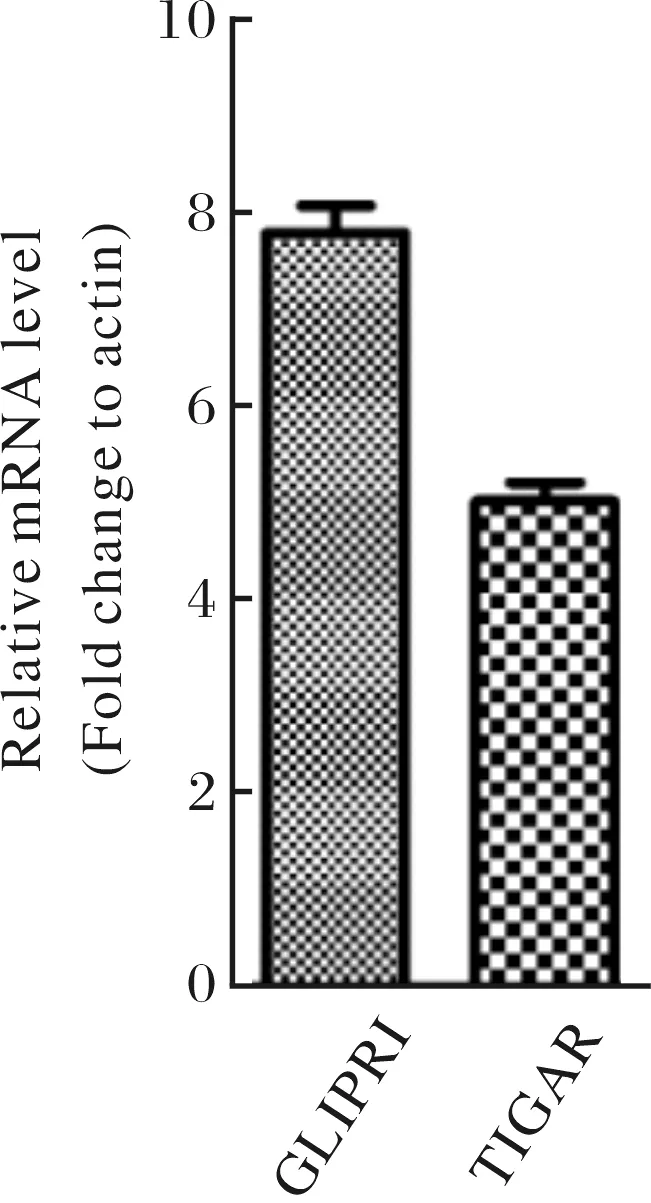
图3 LNCaP细胞中p44抑制TIGAR、GLIPR1的表达Fig.3 p44 inhibited expression of TIGAR and GLIPR1 in LNCaP cells
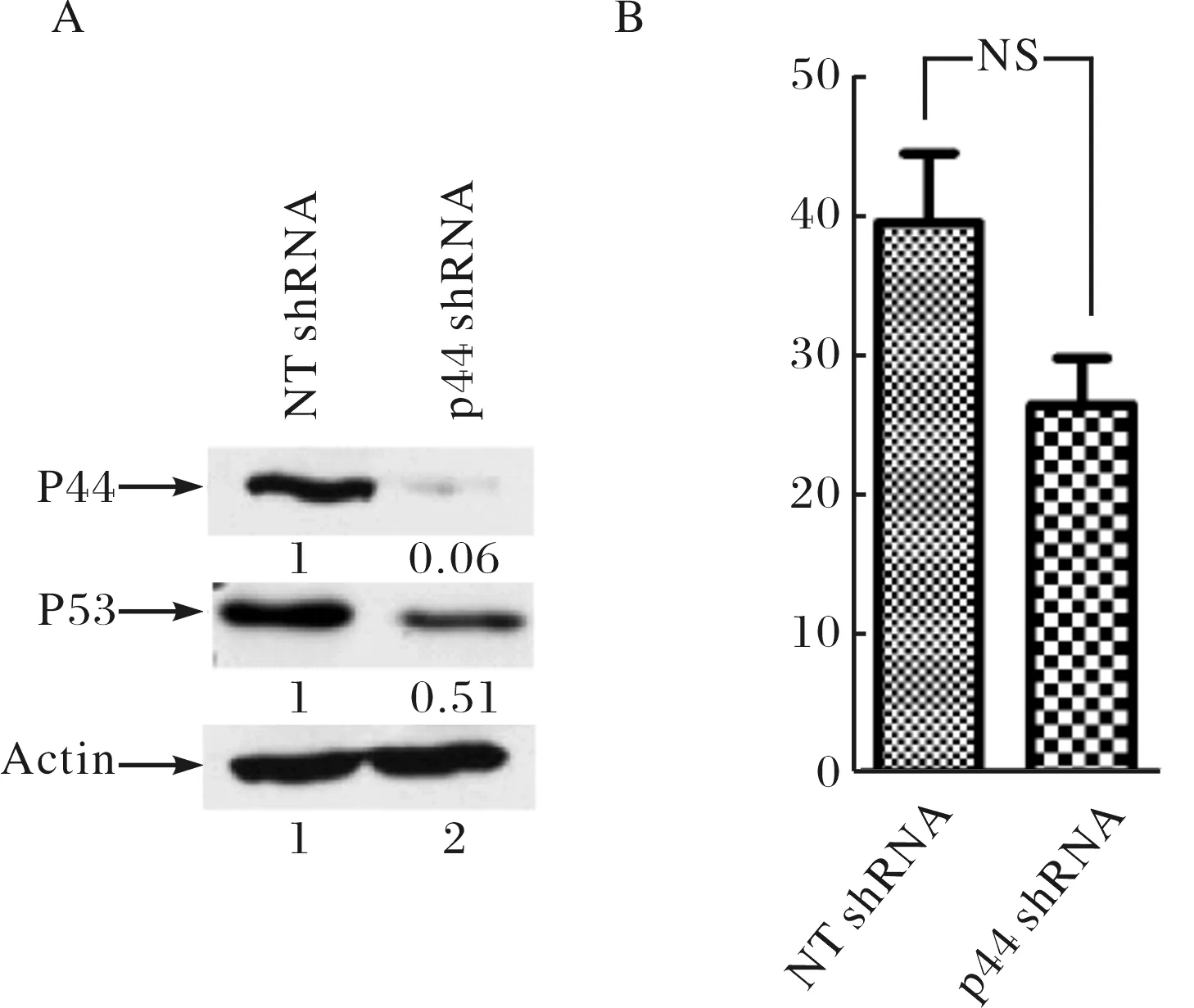
图4 p44并非通过p53通路抑制TIGAR,GLIPR1的表达A.稳转p44-shRNA的LNCaP细胞中p53蛋白水平较对照下调;B.荧光素酶活性在稳转p44-shRNA的LNCaP细胞中与对照细胞中无显著差异(NS,P>0.05)Fig.4 p44 regulated expression of TIGAR and GLIPR1 independent of the p53 signaling
3 讨论
肿瘤是一种多步骤的遗传性疾病,在其发生和发展过程中,会发生一些原癌基因的激活和抑癌基因的失活[9].p53基因是一种重要的抑癌基因,编码分子量为53 kD的核酸磷蛋白[11].p53主要通过与靶基因特异性的DNA序列结合并激活其转录,参与细胞生长的负调控[9].p53基因突变与许多类型的肿瘤相关,其中大多数突变发生在DNA结合域,影响p53蛋白与靶基因的特异性结合[5-7].p53在肿瘤发生中的相关作用通路受到研究人员的广泛重视,荧光素酶报告基因能灵敏、高效地检测细胞内基因的表达水平,是信号通路研究中的重要实验手段之一.为进一步研究p53在肿瘤发生发展过程中的作用通路,本研究构建了pGL3-4×PRE-E4-luc荧光素酶报告质粒.4×PRE为p53作用的4个反向重复的共有序列.pGL3-E4-luc报告基因载体主要含最小腺病毒E4启动子、萤火虫荧光素酶编码基因和供外源DNA片段插入的多克隆位点,并具有氨苄青霉素筛选标记.其中E4启动子活性较低,将4×PRE插入至pGL3-E4-luc后,p53与4×PRE结合后可显著激活E4,启动萤火虫荧光素酶编码基因的表达.LNCaP细胞为p53阳性前列腺癌细胞(如图4A,lane 1),将pGL3-E4-luc和pGL3-4×PRE-E4-luc分别转染LNCaP细胞后,检测荧光素酶活性,结果进一步证实pGL3-4×PRE-E4-luc构建成功,且启动子活性受p53的调节.pGL3-4×PRE荧光素酶报告质粒的成功构建为进一步研究p53在肿瘤发生发展过程中的作用通路提供了有效手段.
p44 shRNA沉默p44的表达后,显著抑制LNCaP细胞的生长,且p53靶基因TIGAR和GLIPR1的表达显著增加.为检测p53是否介导p44作用于TIGAR和GLIPR1,本研究将pGL3-4×PRE-E4-luc转染稳转p44-shRNA的LNCaP细胞,蛋白印记结果显示其中p53的水平反而低于对照细胞,而荧光素酶活性也与对照细胞无显著差异,说明LNCaP细胞中p44对TIGAR与GLIPR1基因的作用并非依赖于p53,其具体机制仍有待进一步研究.
[1] BRAICU O, PILECZKI V, BRAICU C, et al. P53 siRNA: a therapeutic tool with significant implication in the modulation of apoptosis and angiogenic pathways[J]. Clujul Med, 2015, 88(3):333-337.
[2] DONEHOWER L A, BRADLEY A. The tumor suppressor p53[J]. Biochim Biophys Acta, 1993, 1155(2):181-205.
[3] VOGELSTEIN B, KINZLER K W. P53 function and dysfunction[J]. Cell, 1992, 70(4): 523-526.
[4] ZAMBETTI G P, LEVINE A J. A comparison of the biological activities of wild-type and mutant p53[J]. FASEB J, 1993, 7(10):855-865.
[5] BARGONETTI J, FRIEDMAN P N, KERN S E, et al. Wild-type but not mutant p53 immunopurified proteins bind to sequences adjacent to the SV40 origin of replication[J]. Cell, 1991, 65(6):1083-1091.
[6] HOLLSTEIN M, Rice K, Greenblatt M S, et al. Database of p53 gene somatic mutations in human tumors and cell lines[J]. Nucleic Acids Res, 1994, 22(17):551-3555.
[7] KERN S E, KINZLER K W, BRUSKIN A, et al. Identification of p53 as a sequence-specific DNA-binding protein[J]. Science, 1991, 252(5013):1708-1711.
[8] EI-DEIRY W S, KERN S E, PIETENPOL J A, et al. Definition of a consensus binding site for p53[J]. Nat Genet, 1992, 1(1):45-49.
[9] WANG Y, SCHWEDES J F, PARKS D, et al. Interaction of p53 with its consensus DNA-binding site[J]. Mol Cell Biol, 1995, 15(4):2157-2165.
[10] YI P, GAO S, GU Z, et al. P44/wdr77 restricts the sensitivity of proliferating cells to TGF-βsignaling[J]. Biochem Biophys Res Commun, 2014, 450(1):409-415.
[11] MAY P, MAY E. Twenty years of p53 research: structural and functional aspects of the p53 protein[J]. Oncogene, 1999, 18(53):7621-7636.
[12] ZHOU L, WU H, LEE P, et al. Roles of the androgen receptor cofactor p44 in the growth of prostate epithelial cells[J]. J Mol Endocrinol, 2006, 37(2):283-300.
[13] BENSAAD K, TSURUTA A, SELAK M A, et al. TIGAR, a p53-inducible regulator of glycolysis and apoptosis[J]. Cell, 2006, 126(1):107-120.
[14] KIM J, DEVALARAJA-NARASHIMHA K, PADANILAM B J. TIGAR regulates glycolysis in ischemic kidney proximal tubules[J]. Am J Physiol Renal Physiol, 2015, 308(4):F298-308.
[15] REN C Z, LI L K, GOLTSOV A A, et al. mRTVP-1, a novel p53 target gene with proapoptotic activities[J]. Mol Cell Biol, 2002, 22(10):3345-3357.
[16] THOMPSON T C. Glioma pathogenesis-related protein 1: tumor-suppressor activities and therapeutic potential[J]. Yonsei Med J, 2010, 51(5):479-483.
[17] LI L, REN C, YANG G, et al. GLIPR1 suppresses prostate cancer development through targeted oncoprotein destruction[J]. Cancer Res, 2011, 71(24):7694-7704.
[18] LI L, YANG G, REN C, et al. Glioma pathogenesis-related protein 1 induces prostate cancer cell death through Hsc70-mediated suppression of AURKA and TPX2[J]. Mol Oncol, 2013, 7(4):484-496.
Construction of pGL3-4×PRE-E4-luc reporter gene vector and its application on p44 signaling pathway
SHENG Xiumei1,2, WANG Zhengxin2
(1.School of Medicine, Jiangsu University, Zhenjiang, Jiangshu 212013;2.The Center for Cancer Research and Therapeutic Development, Department of Biological Sciences,Clark Atlanta University, Atlanta 30314, USA)
As an important tumor suppressor, p53 plays central roles in cell proliferation inhibition and cell cycle control through specific DNA binding and transcriptional activation. Located in the cytoplasm, p44 is required for proliferation of prostate epithelial cells. The shRNA-mediated silencing of p44 expression strongly inhibited the proliferation of prostate cancer cells and activated the expression of TP53-induced glycolysis and apoptosis regulator(TIGAR) and Glioma pathogenesis-related protein 1(GLIPR1), which were two target genes of p53. To explore whether p53 participates in mediating p44 pathway, the recombinant reporter plasmid pGL3-4×PRE-E4-luc was constructed and transfected into LNCaP cells infected by lentivirus containing NT-shRNA or p44-shRNA, respectively. Then, their luciferase activities were compared. The results showed that the recombinant reporter plasmid pGL3-4×PRE-E4-luc were successfully constructed, providing a novel method for study on the p53 pathway in cancer initiation and development. However, the luciferase activity and western blot results indicated that p44 regulated expression of TIGAR and GLIPR1 independent of the p53 signaling. The detail mechanism requires further investigation.
p53; PRE; reporter plasmid; p44 pathway
2015-11-08.
国家自然科学基金项目(31000046);江苏大学高级人才启动基金项目(11JD063);中国博士后基金面上项目(2015M571702).
1000-1190(2016)01-0093-04
R-331,R737.25
A
*通讯联系人. E-mail: zwang@cau.edu.
