天然产物 Longistylines A的全合成与抑菌活性研究
赵艳敏, 李 平, 田莉莉
(银川能源学院 石油化工系, 银川 750105)
天然产物 Longistylines A的全合成与抑菌活性研究
赵艳敏*, 李 平, 田莉莉
(银川能源学院 石油化工系, 银川 750105)
以廉价的3,5-二羟基苯甲醇为起始原料,经羟基保护、溴代、Arbuzor重排、Wittig-Horner反应、脱甲基保护及C-异戊烯基取代等步骤,首次以较高产率完成了天然产物化合物Longistylines A的全合成, 关键步骤为Wittig-Horner反应以及C-异戊烯基化反应,所有新化合物的结构都经过1H NMR, IR, MS确认.抑菌活性研究表明,该化合物对枯草芽孢杆菌(BacillussubtilisATCC 11562)、金黄色葡萄球菌(StaphylococcusaureusATCC 6538)、溶血葡萄球菌(StaphylococcushaemolyticusATCC 29970)均有良好的抑制作用.
Longistylines A; 异戊烯基化反应; 全合成; 抑菌活性
异戊烯基芪类化合物具有较强的生理药理活性[1-5],已发展成为一类新的重要天然产物. 天然产物 Longistylines A(图1)是一种新型异戊烯基芪类化合物,是巴西学者Franco D M等人从Lonchocarpus violaceus Jacq的根部分离出来的[6],并通过活性实验发现该化合物有较强的抑菌活性.目前对Longistylines A的全合成研究还未见报道,因此开展对它的全合成研究不仅具有重要的理论意义,而且具有潜在的药用价值.
笔者一直从事天然产物的全合成研究[7-11],在以前工作的基础上,开展了Longistylines A的全合成研究,合成路线如图2.
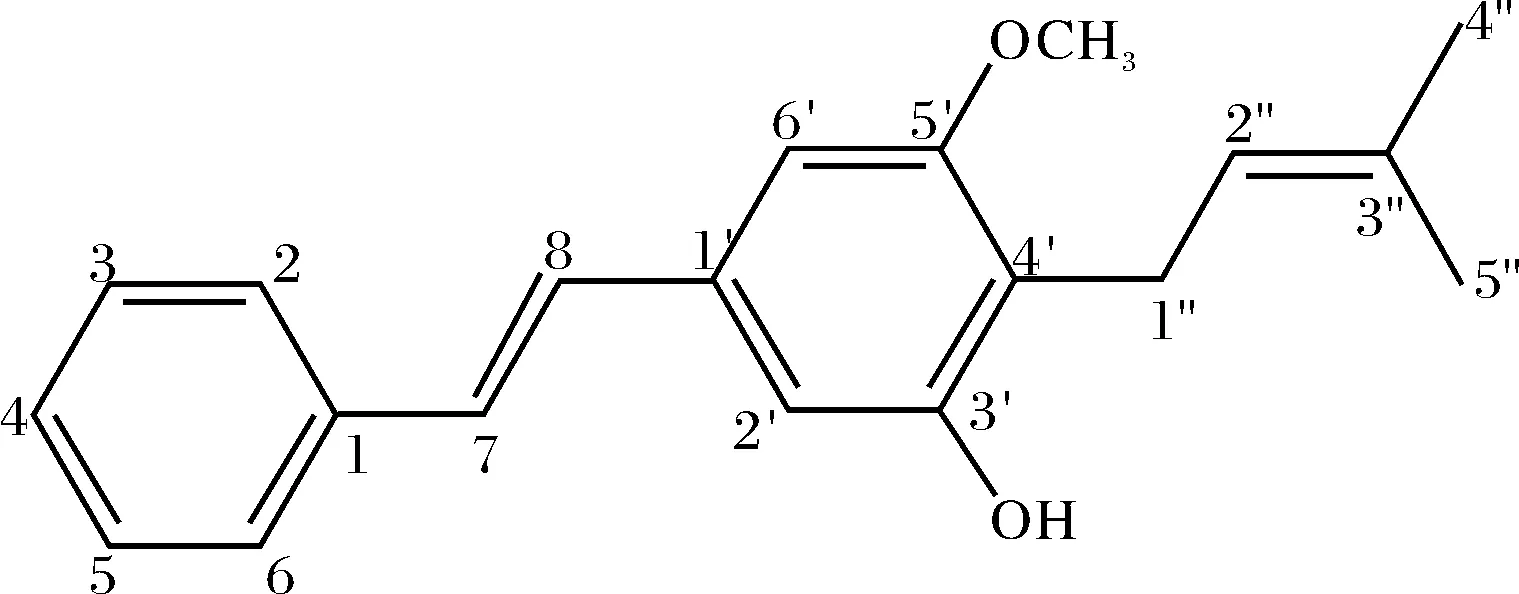
图1 化合物Longistylines A的结构Fig.1 Structure of compound Longistylines A
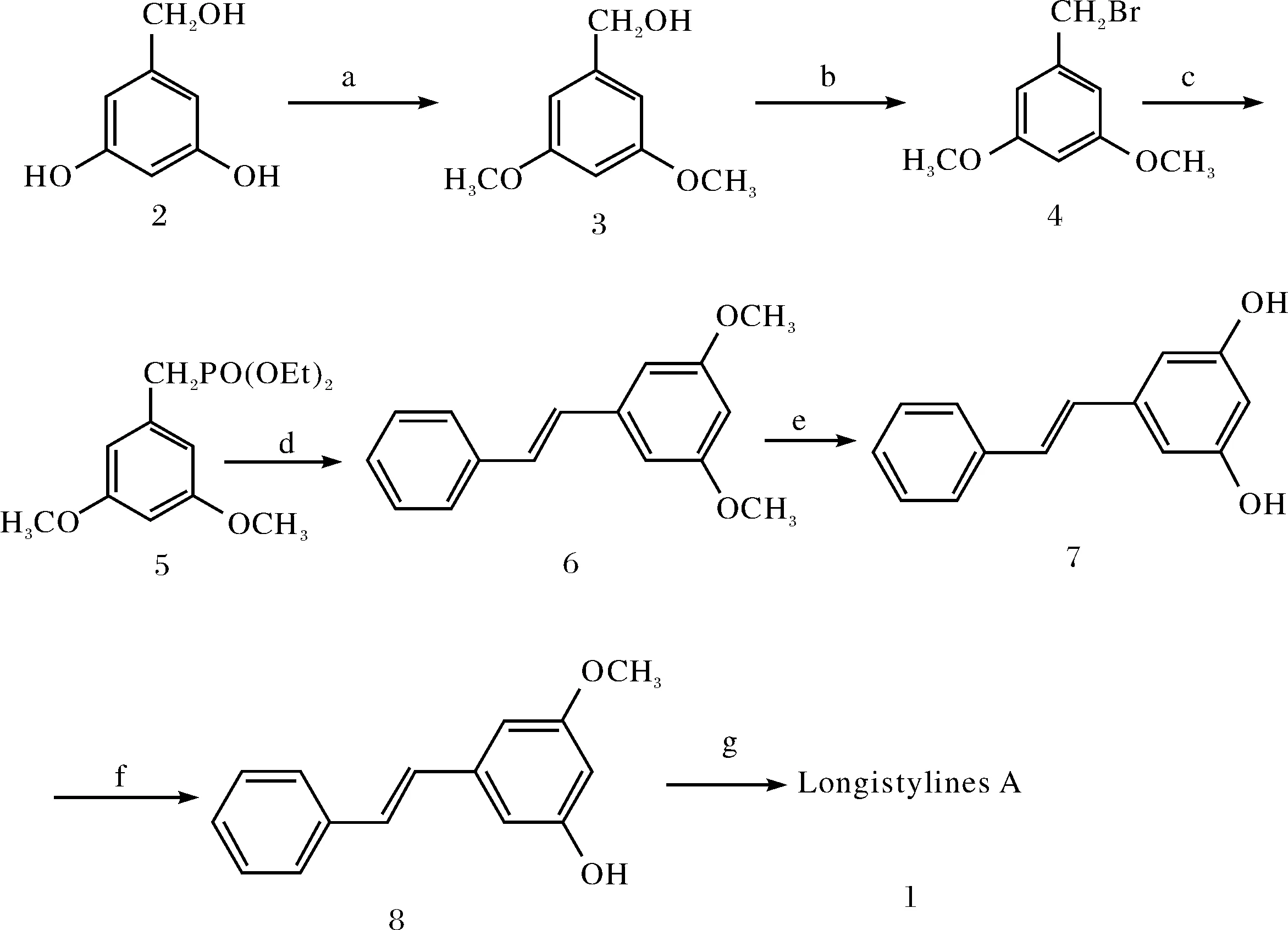
图2 Longistylines A的合成路线Fig.2 Synthetic route of Longistylines A
溶剂及条件: a) K2CO3,(CH3)2SO4,reflux,6.5 h,71%; b) PBr3,CH2Cl2,benzene,0℃ to r.t., 4 h,85%;c) P(OC2H5)3,C16H36NBr,115~125℃, 6 h;d) NaH,THF,benzaldehyde,-5℃ to r.t.,8 h,91%;e) BBr3,CH2Cl2,-5℃ to r.t.,6 h,92%;f)CH3COCH3,K2CO3,(CH3)2SO4,78%;g) K2CO3,CH3COCH3,prenyl bromide,14 h,66%.
1 实验部分
1.1 仪器及试剂
H-谱采用AM-400型核磁共振仪,CDCl3为溶剂内标,用TMS为内标,单位ppm;质谱用HP-5988型质谱仪测定, El源 (70 eV); 所有反应均用TLC跟踪.红外光谱用FTIR-8430S红外光谱仪,KBr压片法测定,单位cm-1; 所使用的无水溶剂均是按标准法处理获得的, 用柱色谱法纯化产品; 所使用的硅胶为200~300目及GF254硅胶.枯草芽孢杆菌(BacillussubtilisATCC 11562)、金黄色葡萄球菌(StaphylococcusaureusATCC 6538)、溶血葡萄球菌(StaphylococcushaemolyticusATCC 29970)(宁夏大学化工院生化实验室提供).
1.2 化合物的合成
1.2.1 3,5-二甲氧基苯甲醇(3)的合成 在100 mL三口瓶中加入3,5-二羟基苯甲醇(700 mg, 5 mmol), 搅拌溶解于12 mL丙酮中,加热至微沸,再加入K2CO3粉末(2.07 g, 15 mmol),继续加热搅拌回流0.5 h后加入新蒸的硫酸二甲酯(1.51 g, 12 mmol),再继续加热回流6 h, 然后加入10 mL的蒸馏水,蒸出丙酮,用三氯甲烷萃取,合并有机相,无水硫酸镁干燥,过滤,蒸除溶剂,析出晶体,用无水乙醇重结晶析出白色的针状晶体598 g,产率71%, m.p.46~48℃;1H NMR(CDCl3, 400 MHz)δ:3.80(s,1H,OH),3.80(s,6H,2×OCH3),4.63(d,J=9.6 Hz, 2H,CH2),6.39(t,J=7.2 Hz, 1H,4-H),6.52(d,J=7.6 Hz, 2H,2,6-H).
1.2.2 3,5-二甲氧基苄溴(4)的合成 在100 mL的圆底烧瓶中加入3,5-二甲氧基苯甲醇(1.466 g, 8.73 mmol),无水二氯甲烷25 mL,搅拌溶解,氮气的保护下,冰水浴控温在0℃,缓慢滴加三溴化磷的苯溶液,30 min加完,保持0℃反应2 h,然后升至室温反应1 h,将反应液倾入100 mL冰水中,搅拌,分出有机层,水洗至中性.有机层用无水硫酸钠干燥,蒸除溶剂,用石油醚∶乙酸乙酯=8∶1的混合溶剂进行柱层析,得白色针状固体1.707 g,收率85%, m.p. 68~70℃;1H NMR(CDCl3, 400 MHz)δ:3.79(s,6H,2×OCH3),4.42(d,J=9.6 Hz, 2H,CH2),6.39(t,J=7.6 Hz, 1H,4-H),6.54(d,2H,J=7.2 Hz, 2,6-H).
1.2.3 3,5-二甲氧基苄基磷酸酯(5)的合成 于100 mL圆底烧瓶中加入3,5-二甲氧基苄溴(1.707 g, 8.41 mmol)、亚磷酸三乙酯(1.42 g, 8.5 mmol)、少量的相转移催化剂四丁基溴化铵,油浴加热至115~125℃反应6 h.将反应物在100℃以下减压蒸馏,除去过量的亚磷酸三乙酯,瓶中剩余的橙红色油状物即为产物,直接用于下一步反应.
1.2.4 3,5-二甲氧基芪(6)的合成 向上步反应得到的磷酸酯油状物中加入氢化钠粉末(1.21 g, 27.75 mmol),冰盐浴冷却至0℃以下,氮气保护下用注射器加入30 mL干燥的四氢呋喃,搅拌30 min后,再缓慢滴加苯甲醛(891.5 mg, 8.41 mmol)的四氢呋喃混合液25 mL,自然升至室温,继续搅拌反应8 h.再冷却0℃,缓慢滴加20 mL水,将反应液倾入30 mL冰水中,乙酸乙酯(3×50 mL)萃取,有机层用饱和氯化钠溶液洗至中性,无水硫酸钠干燥,减压蒸除溶剂,残余物用石油醚∶乙酸乙酯=16∶1的混合溶剂进行柱层析,得淡黄色固体1.836 g,收率91%, m.p. 45~47℃;
1H NMR(CDCl3, 400 MHz)δ:3.84(s,6H,3,5-OCH3),6.70(d,J=8.4 Hz, 2H,2,6-H),6.42(t,J=9.6 Hz, 1H,4-H),7.08(d,J=12.4 Hz,1H,α-H),7.10(d,J=12.4 Hz,1H,β-H);EIMS(m/z): [M+] 240(M+,100),165(39),152(24),120(16),69(47);IR(KBr): 2930,2833,1600,1456,1423,1296,1161,968,692 cm-1.
1.2.5 3,5-二羟基二苯乙烯(7)的合成 向100 mL圆底烧瓶中加入3,5-二甲氧基芪(604 mg, 2.67 mmol),冰水浴冷却至0℃以下,氮气保护下,用注射器加入二氯甲烷25 mL,再缓慢滴加(0.67 mL, 8 mmol)三溴化硼的无水二氯甲烷(20 mL)溶液,室温搅拌6 h,TLC跟踪反应,反应完毕后冰水浴冷却至0℃,滴加冷却蒸馏水25 mL,将反应液倾入30 mL冰水中,用乙酸乙酯(3×30 mL)萃取,有机相用饱和食盐水洗至中性,无水MgSO4干燥,减压蒸除溶剂,得到暗黄色固体粗产物,用石油醚∶乙酸乙酯=8∶1的混合溶剂进行柱层析,得到淡黄色固体490 mg,收率:92%,m.p.125~129℃;1H NMR(CDCl3, 400 MHz)δ:6.29(t,J=14.4 Hz, 1H,4-H),6.59(d,J=8.8 Hz,2H,2,6-H),6.97(d,J=16.8 Hz,1H,α-H),7.01(d,J=16.8 Hz, 1H,β-H),7.45~7.51(m,2H,2′,6′-H),7.30~7.38(m,2H,3′,5′-H),7.23~7.26(m,1H,4′-H);EIMS(m/z): [M+] 212(100),165(39.5),141(20.3),109(23.8),83(28.1),69(94),55(39),43(81.4);IR(KBr):3391,1616,1598,1499,1472,1356,1250,1007,988,962,839,689 cm-1.
1.2.6 3-甲氧基-5-羟基二苯乙烯(8)的合成 将化合物7(424 mg, 2 mmol)溶于8 mL干燥的丙酮中,剧烈搅拌下,加入无水碳酸钾(289.8 mg, 2.1 mmol),常温搅拌30 min后,缓慢滴加(CH3)2SO4(0.11 mL, 1 mmol),继续搅拌30 min后,再加入(CH3)2SO4(0.11 mL, 1 mmol),TLC跟踪反应,搅拌反应5 h后,减压蒸干溶剂,残余物加水溶解后,用乙酸乙酯萃取(3×20 mL),有机相合并后依次用水洗,饱和食盐水洗,无水硫酸镁干燥,过滤去干燥剂.减压蒸除溶剂后,残余物用硅胶柱层析纯化(石油醚∶乙酸乙酯=16∶1)得白色固体352.6 mg,化合物7中一个酚羟基和连接两个苯环的碳碳双键上的氢形成分子内氢键,活性降低,故只能得到O-单烷基化的8,收率78%, m.p.97~100℃.1H NMR(CDCl3, 400 MHz)δ:7.50~7.10(m, 5H, ArH),6.99(d, 1H,J=16.4 Hz,α-H),7.06(d,1H,J=16.4 Hz,β-H), 6.64(d,J=14.4 Hz,1H,2-H), 6.62(d,J=6.4 Hz,1H,6-H), 6.35(s,1H,4-H), 3.65(s,3H,OCH3).
1.2.7 Longistylines A的合合成 将化合物8(452 mg,2 mmol)溶于15 mL干燥的丙酮中, 搅拌下加入无水碳酸钾(138 mg,1 mmol,搅拌5 min后用注射器缓慢滴入异戊烯基溴(2.4 mmol, 约为2.5 mL), 加热回流4 h后停止加热,自然降到室温再继续在室温下反应10 h,乙酸乙酯提取(3×20 mL),有机相合并后依次用水洗,饱和食盐水洗,无水硫酸镁干燥,过滤去干燥剂.减压蒸除溶剂后,残余物用硅胶柱层析纯化(石油醚∶乙酸乙酯=36∶1)得淡黄色固体388 mg,产率为66%.其波谱数据和报道的天然产物Longistylines A是一致的,1H NMR(acetone-d6, 400 MHz) δ: 1.76(s, 3H, 5″-H), 1.82(s, 3H, 4″-H), 3.72 (s,3H, OCH3), 5.24(s ,1H, 3′-OH), 5.28(t,J=7.2 Hz, 1H,2″-H), 6.57 (s, 1H, 2′-H), 6.60 (s, 1H, 6′-H), 6.90( d,J=16.2 Hz, 1H, 8-H), 6.98( d,J=16.2 Hz, 1H, 7-H), 7.24(t,J=7.2 Hz, 1H, 4-H), 7.33( d, 2H,J=7.4 Hz, 3,5-H), 7.44(d, 2H,J=7.2 Hz, 2,6-H); EIMS(m/z): [M]+294 (36), 193 (32), 252(96), 140(100), 75(35)61(28); IR (KBr) υmax:3127, 2639, 1708, 1593, 1348,1209 cm-1.
1.3 初步抗菌活性试验
本实验抑菌活性采用打孔法.首先分别取保存的枯草芽孢杆菌(BacillussubtilisATCC 11562)、金黄色葡萄球菌(StaphylococcusaureusATCC 6538)、溶血葡萄球菌(StaphylococcushaemolyticusATCC 29970)3种菌种,接种到S1液体培养基上,在30℃下培养12 h,再将3种培养液稀释至浓度107 CFU/mL. 随后各取 100 μL 接种于 LB琼脂固体培养基,涂布均匀,固定2 h.在培养基凝固后打孔, 分别取化合物(1)的液体样品和对照样10 μL 点样于孔中. 平板于30℃培养 24 h.用游标卡尺测量抑菌圈直径,每个菌株做3个平行实验,求均值.
抑菌活性实验表明,以3,5-二羟基苯甲醇为原料合成的Longistylines A化合物对枯草芽孢杆菌、金黄色葡萄球菌、溶血葡萄球菌具有良好的抑菌能力,且高于另一种芪类化合物3-羟基-5-甲氧基芪-2-羧酸的抑菌性能.可能的原因是:异戊烯基侧链的存在加强了芪类化合物的抗菌活性.
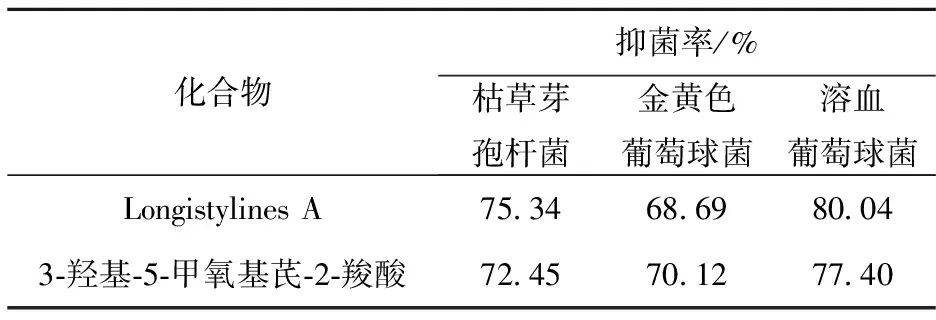
表1 目标化合物的抑菌活性
2 结果与讨论
1) 化合物2在K2CO3作用下与(CH3)2SO4反应以71%的收率得化合物3,化合物3与PBr3在无氧条件下反应以85%的收率得到溴化产物4,化合物4在相转移催化剂四丁基溴化铵作用下与P(OC2H5)3反应得化合物5,化合物5在NaH作用下与苯反应以91%的收率得到化合物6,化合物6在BBr3作用下脱去甲基得化合物7,化合物7与(CH3)2SO4反应以78%的收率得到化合物8,化合物7的一个酚羟基和连接两个苯环的碳碳双键上的氢形成分子内氢键,活性降低,故只能得到O-单烷基化的化合物8;化合物8在强碱性条件下与异戊烯基溴反应以66%的收率得到最终的天然产物1(Longistylines A).
2) 化合物8的异戊烯基化反应是本合成的难点,本文采用在弱碱K2CO3-丙酮的条件下,生成主产物为化合物1,产率66%.为了提高产率,笔者试图用较强的碱NaOH分别在丙酮或水中回流,TLC跟踪,只有很少量的化合物1生成.还试图用NaH作催化剂在苯中回流,化合物的产率也很低.
3) 至此,本文用廉价易得的原料经过7步反应,以26%的总收率首次完成了天然产物Longistylines A的全合成,其波谱数据和报道的天然产物Longistylines A是一致的.并且对合成的目标化合物进行了简单的抗菌活性测试,该化合物对枯草芽孢杆菌(BacillussubtilisATCC 11562)、金黄色葡萄球菌(StaphylococcusaureusATCC 6538)、溶血葡萄球菌(StaphylococcushaemolyticusATCC 29970)3种菌种都表现较好的抗菌活性.
[1] MATSUDA H, MORIKAWA T, TOGUCHIDA I, et a1. Antioxidant constituents from rhubarb: structural requirements of stilbenes for the activity and structures of two new anthraquinone glucosides [J].Bioorg & Med Chem, 2001, 9(1): 41-50.
[2] JEANDET P, BESSIS R, SBAGHI M. The significance of stilbene-type phytoalexins in the Bortrytis cinerea-grapevine interaction [J]. Plant Sciences, 1994, 247-250.
[3] 陈志强, 吴祖泽. 天然羟基芪类化合物抗病毒及抗肿瘤活性的研究进展[J]. 中草药, 2003, 34(6): 11-13.
[4] PACE-ASCIAK C R. Hepoxilins, resveratrol and ethanol as mediators of changes in plasma lipids and lipoproteins [J]. Gen Phurmacol, 1993, 24(6): 805-810.
[5] 单春文, 杨素琴, 何菡萏, 等. 3, 4,5-三羟基芪-3-β-单-D-葡萄糖苷在体外对兔血小板聚集和产生的血栓素B2的影响[J]. 中国药理学报, 1990, 11(6): 527-530.
[6] FRANCO D M, FRANCISCO M, GIOVANNI B, et al. Isolation and structure of Longistylines A, B, C and D, New prenylated stilbenes from Lonchocarpus violaceus [J]. J Nat Prod, 1977, 40: 201-208.
[7] ZHAO Y M, YANG J H, JI C B. First total synthesis of (±)-Abyssinoflavanone V[J]. Chinese Chemical Letters, 2008, 19(6): 658-660.
[8] YANG J H, JIANG S Z, ZHAO Y M, et al. First total synthesis of two nematicidal prenylated flavanones [J]. Chin Chem Lett, 2009, 20(6): 1062-1064.
[9] 赵艳敏. licoagrochalcone A的首次全合成研究[J].合成化学,2014, 22(4):504-506.
[10] 赵艳敏, 李 平, 田莉莉, 等. Dalenin 1的首次全合成研究[J].华中师范大学学报(自然科学版), 2014, 48(6):847-849 .
[11] 赵艳敏, 杨金会. (±)-Abyssinone I的全合成研究[J]. 合成化学, 2010, 18(1):10-12.
Total synthesis and and bacteriostatic activity of nature product Longistylines A
ZHAO Yanmin, LI Ping, TIAN Lili
(Department of Petrochemical Technology, Yinchuan Institute of Energy, Yinchuan 750105)
The total synthesis of natural product Longistylines A was first achieved from cheap material, 3, 5-dihydroxybenzyl alcohol. The synthetic procedure was in the sequence of protection of hydroxyl group, bromination, Arbuzor rearrangement, Wittig-Horner reaction, demethylation and C-prenylation. Wittig-Horner reaction and C-prenylation were key steps. All structures of new compounds were confirmed by IR,1H NMR and MS. And bioassay results indicated the newly synthesized compound possessed good inhibitory effect againstBacillussubtilis,StaphylococcusaureusandStaphylococcushaemolyticus.
Longistylines A ; C-prenylation; total synthesis; the bacteriostatic activity
2015-09-29.
宁夏回族自治区自然科学基金项目(NZ15283).
1000-1190(2016)01-0074-04
O625.1
A
*E-mail: 542540848@qq.com.
