斑马鱼胚胎胚盾特异表达基因的鉴定
万传璐,闫一芳,曹羽,王强
(1.安徽大学生命科学学院,合肥 230601; 2.中国科学院动物研究所膜生物学国家重点实验室,北京 100101)
斑马鱼胚胎胚盾特异表达基因的鉴定
万传璐1,闫一芳2,曹羽2,王强2
(1.安徽大学生命科学学院,合肥 230601; 2.中国科学院动物研究所膜生物学国家重点实验室,北京 100101)
目的 由于原肠期细胞的剧烈运动,在斑马鱼胚胎的背侧汇聚形成了称为胚盾(shield organizer)的结构,是胚胎发育的信号组织中心,在背腹轴建立和胚层诱导过程中具有关键作用。系统鉴定在胚盾特异表达的基因,可为进一步探讨胚盾形成的机制及其指导胚胎早期发育的分子机理提供参考。方法Tg(gsc:GFP) 转基因鱼在胚盾表达特异的绿色荧光。通过流式细胞分选技术分离富集GFP阳性细胞并提取总RNA进行RNA深度测序,检测可能在胚盾高水平表达的基因。然后利用荧光实时定量PCR (quantitative real-time PCR, qRT-PCR)和原位杂交技术鉴定若干在胚盾特异表达的基因。结果 从Tg(gsc:GFP)转基因鱼胚胎中分离富集到了纯度超过96%的GFP阳性细胞,RNA深度测序的结果显示有657个基因的表达水平比整胚细胞或GFP阴性细胞高2倍以上。最后,确认了KIAA1324、ripply1、twist2、isthmin1、nme4、zgc174153、rrbp1b等7个基因在胚盾特异表达。结论 系统鉴定到了斑马鱼胚胎胚盾特异表达基因,为下一步研究这些基因的发育生物学功能奠定了基础。
斑马鱼;胚盾;流式细胞分选;RNA深度测序;原位杂交
在脊椎动物发育过程中,原肠期是体轴建立和中内胚层形成的重要时期。斑马鱼胚胎进入原肠期后,细胞除了外包运动以外,还要进行内卷和汇聚延伸运动。内卷发生在胚盘的边缘,导致了内部细胞层-下胚层的形成。下胚层将会衍生出中胚层和内胚层。而外层细胞构成上胚层,将来形成外胚层,包括表皮外胚层和神经外胚层。在外包和内卷的同时,上胚层和下胚层的细胞都向胚胎的背侧汇聚,形成了躯体轴线的原基,也就是所谓的胚盾。它是胚胎背部的标志,是斑马鱼发育的信号组织中心[1]。在爪蟾、鸟类、鱼类、哺乳动物中也陆续发现了类似组织中心的存在。组织中心自身可以形成脊索、前脊索板、神经底板、背部内胚层等中轴组织,同时还可以指导其周围的细胞分化为体节、神经组织、肝脏、胰腺等,在胚胎早期发育中具有重要功能。研究表明,斑马鱼胚盾表达并分泌的Bmp信号抑制因子,如chordin、follistatin、noggin等,通过拮抗来自腹部的BMP 信号,使其形成一定的浓度梯度来指导胚胎背腹轴的建立[2-3]。
斑马鱼胚盾的形成与Wnt/β-catenin及Nodal/Smad2信号密切相关(Dale and Jones 1999)。在Wnt信号被激活后,β-catenin进入细胞核内作为转录调控因子发挥作用[4]。在斑马鱼胚胎发育至128细胞时,β-catenin就已经在背侧细胞的核内积聚,这种不对称分布是胚胎背腹分化的早期标志[5]。在ichabod和tokkaebi斑马鱼突变体中, β-catenin不能在细胞核内积聚,导致胚盾不能形成,胚胎产生腹部化的表型[6-7]。最近的研究表明,母源性wnt8a的表达是β-catenin入核,指导胚盾形成的至关重要的因素[8]。在囊胚中期,β-catenin开始激活bozozok、chordin、dkk1、sqt、cyc等合子基因表达[1]。其中,Sqt和Cyc是激活Nodal/Smad2信号通路的配体蛋白[9]。
Nodal信号分子为TGF-β家族一员。在Nodal信号通路中,Nodal配体与I型受体ALK4(ActRIB)或者ALK7,以及II型受体ActRIIA或者ActRIIB结合形成复合体,使得I型受体被激活的II型受体磷酸化。活化的I型受体募集并磷酸化Smad2,从而导致其与Smad4结合形成复合体。Smad复合体可以进入细胞核中,并且与FoxH1或者Mixer等转录因子结合,共同调节目标基因的转录[10-12]。Nodal/Smad2信号不但对于中内胚层的诱导是至关重要的,而且在中内胚层的背腹分化过程中也是必不可少的。在Nodal与I型、II型受体形成复合物的过程中,有一类非常关键的辅助受体EGF-CFC家族蛋白Oep(One-eyed pinhead)是必需的[13]。斑马鱼MZoep突变体胚胎,缺少母源和合子期表达的Oep,不能形成胚盾,而且绝大部分的中胚层和全部内胚层缺失[14,15]。sqt;cyc双突变体胚胎也有类似表型[16]。
在胚胎发育过程中,基因的组织特异性表达通常意味着此基因可能在该组织形成时期发挥重要作用。Wnt和Nodal信号通路虽然对于胚盾的形成非常重要,但它们在原肠期的调控机制还不清楚。本文鉴定到的斑马鱼胚盾特异表达的基因,将为深入探讨它们与Wnt和Nodal信号活性的关系及在体轴建立和中内胚层形成中的功能提供有意义的线索。
1 材料与方法
1.1 实验动物
实验中所用到的野生型斑马鱼为Tuebingen品系。Tg(gsc:GFP)转基因斑马鱼购自斑马鱼国际资源中心(ZL820, Zebrafish International Resource Center)。胚胎在Holtfreter 液(0.05 g/L KCl, 0.1 g/L CaCl2, 0.2 g/L NaHCO3, 3.5 g/L NaCl, pH 值为7.0)中28.5℃培养至所需时期。
1.2 GFP阳性细胞的分离富集
Tg(gsc:GFP)转基因斑马鱼胚胎生长至胚盾期时收集胚胎,脱卵膜,然后无Ca2+的Ringer缓冲液(116 mmol/L NaCl, 2.9 mmol/L KCl, 5 mmol/L HEPES, pH 7.2)室温浸泡15 min。去除Ringer缓冲液,加入蛋白酶处理液(含有0.25% trypsin及 1 mmol/L EDTA的PBS缓冲液)28.5℃孵育,期间不时用200 μL的枪头吹打胚胎,直至镜下观察大部分胚胎已分散为单个细胞。随后加入1 mol/L的CaCl2(终浓度为2 mmol/L)和胎牛血清(终浓度为10%)终止反应。离心去上清,用含1%胎牛血清的无酚红L-15培养基将细胞重悬至细胞密度为每毫升107。最后通过MoFlo XDP 高速多色流式细胞分选仪进行GFP阳性细胞的分选并分析细胞纯度。
1.3 RNA提取及深度测序
分选到的GFP阳性细胞(50万左右)用Trizol(15596-026, Invitrogen)一步法提取总RNA 约2 μg,送至上海生物芯片有限公司进行深度测序。
1.4 半定量RT-PCR(Semi-quantitative Reverse Transcription PCR)
每种样品以1 μg总RNA为底物,反转录试剂盒ReverTra Ace qPCR RT Kit(F0921K,TOYOBO)制备斑马鱼胚胎cDNA,然后对样品中的目的基因进行PCR扩增。PCR产物进行1%琼脂糖凝胶电泳。样品中的β-actin基因的表达做为内部参照。gsc基因引物为: F,5’-GAGACGACACCGAACCATTT-3’;R, 5’-CCTCTGACGACGACCTTTTC-3’。boz基因引物为: F,5’-ATACTCACGCAGCTTTTGGG-3’;R,5’-GACTTACTATGCAGGGCAACC-3’。chd基因引物为: F,5’- TAGACTGCTGTAAGGAGTGTCCTC-3’;R,5’- CCATGAAGTCCTCTATGCATTCCG-3’。内参β-actin基因引物为: F,5’- ATGGATGATGAAATTGCCGCAC-3’;R,5’-ACCATCACCAGAGTCCATCACG-3’。
1.5 荧光实时定量PCR
以各样品cDNA为模板,利用SYBR® Premix Ex Taq II (RR820A, Takara)试剂盒,按照说明书在CFX96 PCR仪(Bio-Rad)中进行荧光实时定量PCR。β-actin基因的表达做为样品内部参照,gsc和chd基因做为阳性对照。这些基因的引物序列同上。icn基因引物为: F,5’-ATGGCTACGTCAGATACCCAGAAAG-3’;R, 5’-GCAAAGCATTGTGATACAGGCA-3’。ihha基因引物为: F,5’-AAGCAGCAGGACAGCACGGACG-3’;R, 5’-ATCCAGTGAA GCAATGAGGAATACC-3’。frzb基因引物为: F,5’-TACCAAGACCCTGCGAAATGTAACC-3’;R, 5’-GAGGGATGTTGACCAGAGATGACTT-3’。slit3基因引物为: F,5’-AGGCTTGTTCGCTCCTCTGC-3’;R, 5’-GAAACTTCTTGCCCTTGACCTG-3’。ednra基因引物为: F,5’-GCATCGTGTTTGTGGTGGGAATAG-3’;R, 5’-TTGAGCACTGTAATCCCAACAGACG-3’。
1.6 原位杂交
相应探针的制备及原位杂交实验操作参见孟亚平等的文章[17]。
2 结果
2.1Tg(gsc:GFP)转基因斑马鱼胚胎适合于分离富集胚盾中胚层细胞
goosecoid(gsc) 基因特异表达于斑马鱼原肠期胚胎的胚盾区域,是常用的背侧中胚层标识基因。由1.8 kbgsc启动子驱动表达GFP的Tg(gsc:GFP)转基因斑马鱼胚胎,GFP具有与内源gsc基因相似的时空表达[18]。为了确定适合分离富集胚盾中胚层细胞的发育时期,我们从受精后单细胞期至胚盾期,详细观测了活体Tg(gsc:GFP)转基因斑马鱼胚胎GFP的表达图式。结果表明,在Sphere期及Sphere期之前没有检测到绿色荧光表达(图1 A至E’),30%外包期的Tg(gsc:GFP)斑马鱼胚胎在预定背部中胚层有可观测到微弱的绿色荧光表达(图1F和F’),而生长至胚盾期,背部中胚层的荧光变得比较明亮(图1G至H’)。鉴于此时期的背部组织比较典型,而且有较为明亮的特异荧光表达,胚盾期的Tg(gsc:GFP)转基因斑马鱼胚胎适合于分离富集背部信号组织中心的细胞。
2.2 流式细胞分选获得高纯度的GFP阳性细胞
确定在胚盾期从Tg(gsc:GFP)转基因斑马鱼胚胎分离GFP阳性细胞后,我们分批收集胚盾期胚胎,使用胰蛋白酶将胚胎消化吹散为单个细胞,最后通过流式细胞仪进行分选富集。图2A的结果表明背部中胚层GFP阳性细胞数目仅为整个胚胎细胞数的3%左右。进一步的纯度分析表明,分选到的细胞GFP阳性率超过了96%。chordin(chd)和bozozok(boz)是除gsc外另外两个已知的胚盾特异表达基因。我们对这三个基因在GFP阳性细胞、GFP阴性细胞和来自于野生型胚胎未进行分选的细胞的表达进行了检测。半定量RT-PCR的结果揭示,gsc、boz和chd在GFP阳性细胞中的表达明显高于GFP阴性细胞及未进行分选富集的细胞,表明我们分选到的GFP阳性细胞确实为胚胎的胚盾细胞。
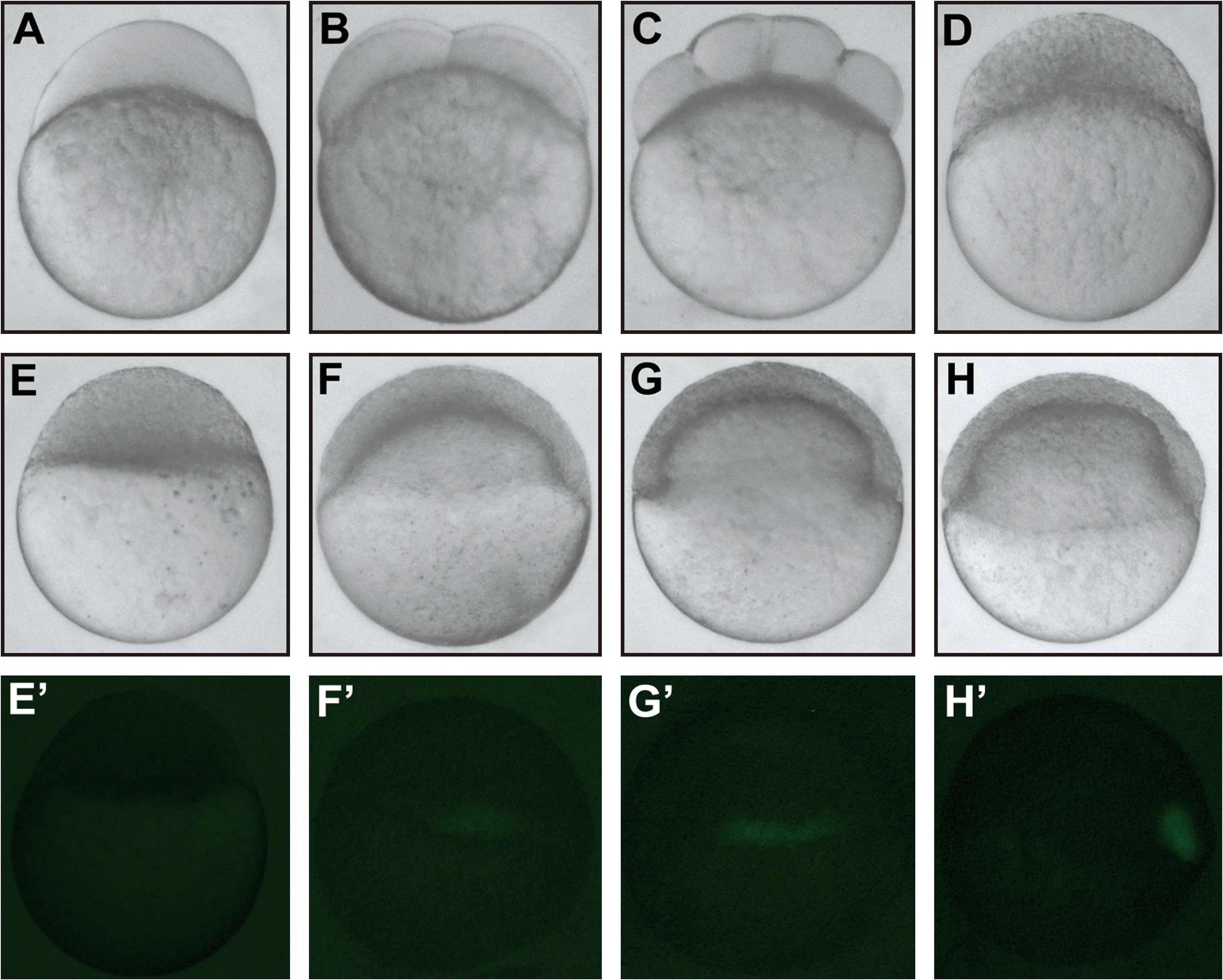
注:A~H,相应时期明场照片;E’~H’,相应时期暗场荧光照片。A~D为侧面观,动物极向上,E~H’为背部观。A,1细胞期;B,4细胞期;C,8细胞期;D,1000细胞期;E,Sphere期;F,30%外包期;G,50%外包期;H,胚盾期; Tg(gsc:GFP)转基因斑马鱼胚胎在30%外包期开始在预定胚盾区域有微弱的荧光表达,胚盾期有比较明亮的特异表达的荧光。图1 Tg(gsc:GFP)转基因斑马鱼胚胎GFP荧光的时空表达谱Note. A, 1-cell stage; B, 4-cell stage; C, 8-cell stage; D 1000-cell stage; E and E’, Shere stage; F and F’, 30% epiboly stage; G and G’, 50% epiboly stage; H and H’, Shield stage. A to H, bright-field images of living Tg(gsc:GFP) transgenic zebrafish embryos at indicated stages. E‘ to H’, fluorescence images of embryos in panels E to H. Embryos in panels A to D were shown in lateral views with the animal pole at the top, while embryos in panels E to H’ were shown in dorsal views. Note that the expression of GFP is detectable in the pre-organizer region of 30% epiboly Tg(gsc:GFP) embryos, but becomes much stronger in the dorsal mesoderm at shield stage.Fig.1 The spatiotemporal expression pattern of GFP in Tg(gsc:GFP) transgenic zebrafish embryos.
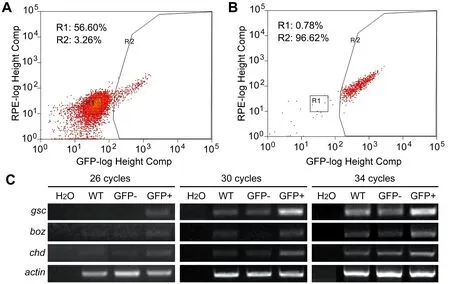
注:A,通过流式细胞仪从胚盾期Tg(gsc:GFP)胚胎分离GFP阳性细胞。B,流式细胞仪分析富集到的GFP阳性细胞的纯度。C,不同循环数的半定量RT-PCR实验检测gsc、boz和chd在GFP阳性细胞、GFP阴性细胞及未进行分选的细胞中的表达。图2 斑马鱼胚胎胚盾细胞的分离富集Note. A: Cells expressing GFP were isolated from enzymatically dispersed Tg(gsc:GFP) embryos. B: The purity of isolated GFP-positive cells was analyzed by FACS. C: The expression of gsc, boz and chd in isolated or non-isolated cells was examined by semi-quantitative RT-PCR at different cycle numbers.Fig.2 Separation and enrichment of cells located in the zebrafish shield organizer.
2.3 系统鉴定胚盾高表达基因
为了鉴定在斑马鱼胚胎的胚盾高表达的基因,我们从GFP阳性(GFP+)细胞、GFP阴性细胞(GFP-)和未进行分选富集的野生型胚胎细胞(WT)提取总RNA,然后进行了深度测序。每个样品的测序通量均为4G。结果表明,在GFP阳性细胞中,有928个基因的转录本拷贝数比GFP阴性细胞高2倍以上,而与未分选的野生型胚胎细胞相比,有2004个基因有高表达(2倍以上)(图3A)。以GFP阴性细胞和未分选的野生型胚胎细胞做为对照,共有657个基因高表达于GFP阳性细胞中(2倍以上)(图3A和3B)。这657个基因中有许多以前报导过的在胚盾特异表达的基因,如gsc、boz、chd、floatinghead(flh)、net1、dickkopfWNTsignalingpathwayinhibitor1b(dkk1b)、sonichedgehoga(shha)等。图3C中列出了在GFP阳性细胞中富集度最高的前20个基因。目前并不清楚这些基因的是否特异表达于胚盾,大部分基因的发育生物学功能也未见报导。为了进一步确认这20个基因是否在胚盾高表达,我们从中随意挑取了5个基因。通过qRT-PCR进行验证。结果显示,和阳性对照(gsc和boz)类似,ictacalcin(icn)、indianhedgehoghomologa(ihha)、frizzled-relatedprotein(frzb)、slithomolog3 (slit3)和endothelinreceptortypeA(ednra)均在GFP阳性细胞中有显著的富集(图3C)。以上结果表明,在斑马鱼胚盾有高水平表达的基因得到了系统的鉴定。
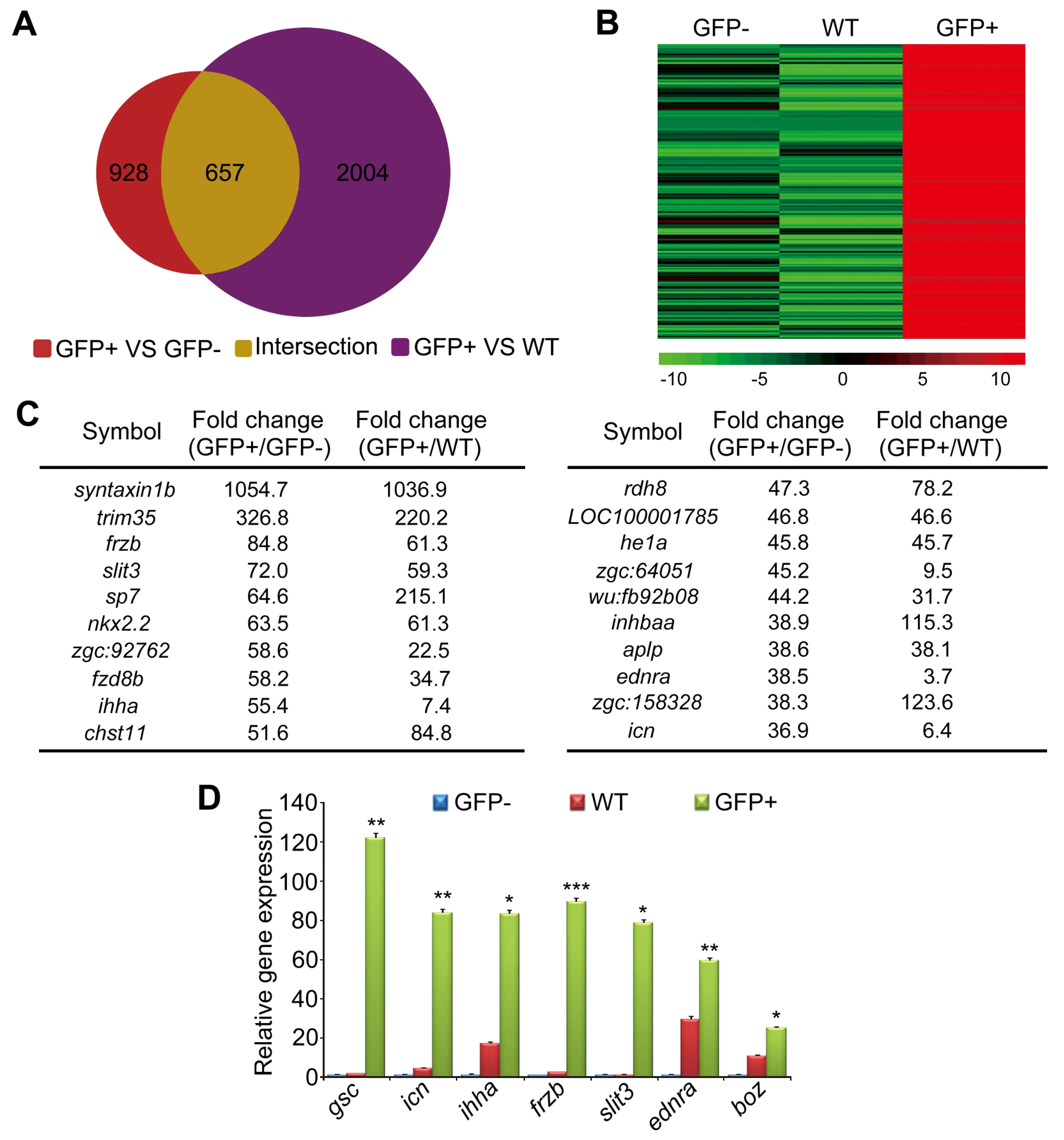
注:A,分别以GFP阴性细胞和未分选的野生型胚胎细胞为对照,在GFP阳性细胞中高表达的基因数目(2倍以上)。与GFP阴性细胞相比较,有928个基因在GFP阳性细胞中高表达(红色区域);与未分选的野生型胚胎细胞相比较,有2004个基因在GFP阳性细胞中高表达(紫色区域);与两种对照相比较,在GFP阳性细胞中高表达的基因有657个(代表红色与紫色重叠的黄色区域)。B,657个基因的红绿热图。C,在GFP阳性细胞中富集度最高的前20个基因。基因表达的差异根据RNA测序结果的RPKM (Reads Per Kilobases per Millionreads)确定。 D,以gsc和boz的表达为阳性对照,qRT-PCR检测icn、ihha、frzb、slit3和ednra在GFP阳性细胞、GFP阴性细胞及未进行分选的野生型细胞中的表达差异。β-actin的表达做为样品的内部参照。*P<0.05, **P<0.01, ***P<0.001; n=3。图3 系统鉴定斑马鱼胚胎胚盾高表达基因Note. A, The number of organizer highly expressed genes (more than 2-fold) in GFP+ cells when compared to GFP-cells (red) or non-isolated cells (purple) or both (yellow). B, Heat map of 657 genes which are highly expressed in GFP+ cells but transcribed at a relatively low level in GFP- cells and non-isolated cells. C, The top 20 enriched genes in GFP+ cells according to RPKM values. D, The expression differences of icn, ihha, frzb、slit3 and ednrathese in GFP+, GFP- and non-isolated cells were validated by qRT-PCR analysis. The expression of gsc and boz was examined as positive control. The expression of β-actin was used as a reference to normalize the amount of mRNAs in each sample. *P<0.05, **P<0.01, ***P<0.001; n =3. Fig.3 Global identification of zebrafish shield organizer expressed genes.
2.4 原位杂交确定胚盾特异表达的基因
整胚原位杂交是研究胚胎基因表达的常用方法,可以给出特定基因在胚胎发育过程中的时空表达图谱,在发育生物学研究中起着重要作用。为了最终确定在胚盾特异表达的基因,我们在上述657个基因之中,检测了一些可能具有重要发育生物学功能的基因在斑马鱼胚胎中的表达图谱。结果表明,KIAA1324、transcriptionalrepressor1 (ripply1)、twist2、isthmin1、nucleosidediphosphatekinase4 (nme4)、zgc174153和ribosomebindingprotein1homologb(rrbp1b)均在斑马鱼胚胎的胚盾区有高水平表达(图4A至G’),其中KIAA1324(图4A和A’)、ripply1(图4B和B’)、nme4(图4E)和rrbp1b(图4G)非常特异的表达于胚盾。我们还进一步检测了rrbp1b在尾芽期(bud stage)的表达,发现rrbp1b转录本特异表达于脊索(图4G’)。脊索由来自胚盾区域的中胚层发育而来,因此,这一结果进一步证实了rrbp1b在胚盾的特异表达。我们还发现,twist2(图4C和C’)、isthmin1(图4D和D’)及zgc174153(图4F)除了在胚盾有高水平表达,还表达于胚盘边缘的中内胚层细胞所在区域。

注:A,KIAA1324;B,ripply1;C,twist2;D,isthmin1;E,nme4;F,zgc174153;G,rrbp1b。A,B,C,D,E, F和G是侧面观,胚盾在右侧;A’,B’,C‘和D’是相应基因的动物极,从上向下观测;G’是rrbp1b在尾芽期的表达,背部观。图4 原位杂交鉴定到的数个代表性基因在斑马鱼胚胎胚盾的特异表达Note. A, KIAA1324; B, ripply1; C, twist2; D, isthmin1; E, nme4; F, zgc174153; G, rrbp1b. A, B, C, D, E, F and G, shield-stage embryos were shown in lateral views with the animal pole at the top; A’, B’, C‘ and D’, animal poles in veryical views with the dorsal to the right. G’, The expression of rrbp1b in bud-stage embryo. Dorsal view with head at the top.Fig.4 The organizer expressed genes were identified by whole mount in situ hybridization.
3 讨论
在脊椎动物胚胎发育过程中,Wnt和Nodal信号是两种重要的形态发生素,参与了背部信号组织中心的形成和体轴的建立等重要的发育事件的调控。为了探讨Nodal信号通路如何在斑马鱼胚胎中行使其发育功能,包括我们在内的研究者已经通过各种办法探讨了它们在胚胎早期发育所调控的基因。例如,利用斑马鱼基因芯片技术,检测sqt过量表达的胚胎、缺失Nodal 信号的MZoep突变体或野生型胚胎中差异表达的基因,发现了近2000个基因的表达受到Nodal信号调控[19]。通过类似的策略,辅助以原位杂交技术,有近百个表达于胚胎胚盾或胚盘边缘区域的Nodal信号调控基因被发现[20]。通过ChIP-chip技术,我们发现在原肠胚早期,Smad2可以结合在679个基因的启动子或增强子区,调控其表达[21]。然而,Wnt信号在胚胎早期发育中所调控的基因还不清楚。本研究通过分离富集Tg(gsc:GFP)转基因鱼胚盾细胞,系统鉴定了在胚盾特异表达的基因,为研究这些基因的发育生物学功能提供了基础。但是,这些胚盾高表达基因是否受到Nodal或Wnt信号调控,它们是否会形成反馈机制调控Nodal或Wnt信号活性等重要的科学问题还有待于进一步探讨。
本研究通过原位杂交技术鉴定确认了KIAA1324,ripply1,twist2,isthmin1,nme4,zgc174153,rrbp1b等7个基因在胚盾高表达。其中KIAA1324、ripply1、nme4和rrbp1b非常特异的表达于胚盾,而twist2、isthmin1和zgc174153除了在胚盾有高水平表达,还表达于胚盘边缘的中内胚层细胞,说明它们也可能是潜在的中内胚层形成调控基因。鉴于我们只是随机对很小比例的基因进行了原位杂交检测,可能在我们鉴定到的657个基因中,还有很多胚盾特异表达的基因有待于使用同样的方法进一步确定。
[1] Schier AF, Talbot WS. Molecular genetics of axis formation in zebrafish [J]. Annu Rev Genet, 2005, 39: 561-613.
[2] Schulte-Merker S, Lee KJ, McMahon AP, et al. The zebrafish organizer requires chordino [J]. Nature, 1997, 387: 862-863.
[3] Wagner DS, Mullins MC. Modulation of BMP activity in dorsal-ventral pattern formation by the chordin and ogon antagonists [J]. Dev Biol, 2002, 245: 109-123.
[4] Logan CY, Nusse R. The Wnt signaling pathway in development and disease [J]. Annu Rev Cell Dev Biol, 2004, 20: 781-810.
[5] Schneider S, Steinbeisser H, Warga RM, et al. Beta-catenin translocation into nuclei demarcates the dorsalizing centers in frog and fish embryos [J]. Mech Dev, 1996, 57: 191-198.
[6] Kelly C, Chin AJ, Leatherman JL, et al. Maternally controlled (beta)-catenin-mediated signaling is required for organizer formation in the zebrafish [J]. Development, 2000, 127: 3899-3911.
[7] Nojima H, Shimizu T, Kim CH, et al. Genetic evidence for involvement of maternally derived Wnt canonical signaling in dorsal determination in zebrafish [J]. Mech Dev, 2004, 121: 371-386.
[8] Lu FI, Thisse C, Thisse B. Identification and mechanism of regulation of the zebrafish dorsal determinant [J]. Proc Natl Acad Sci U S A, 2011, 108: 15876-15880.
[9] Schier AF. Nodal signaling in vertebrate development [J]. Annu Rev Cell Dev Biol, 2003, 19: 589-621.
[10] Reissmann E, Jornvall H, Blokzijl A, et al. The orphan receptor ALK7 and the Activin receptor ALK4 mediate signaling by Nodal proteins during vertebrate development [J]. Genes Dev, 2001, 15: 2010-2022.
[11] Yeo C, Whitman M. Nodal signals to Smads through Cripto-dependent and Cripto-independent mechanisms [J]. Mol Cell, 2001, 7: 949-957.
[12] Liu F. Smad3 phosphorylation by cyclin-dependent kinases [J]. Cytokine Growth Factor Rev, 2006, 17: 9-17.
[13] Shen MM, Schier AF. The EGF-CFC gene family in vertebrate development [J]. Trends Genet, 2000, 16: 303-309.
[14] Zhang J, Talbot WS, Schier AF. Positional cloning identifies zebrafish one-eyed pinhead as a permissive EGF-related ligand required during gastrulation [J]. Cell, 1998, 92: 241-251.
[15] Gritsman K, Zhang J, Cheng S, et al. The EGF-CFC protein one-eyed pinhead is essential for nodal signaling [J]. Cell, 1999, 97: 121-132.
[16] Feldman B, Gates, MA, Egan, ES, et al. Zebrafish organizer development and germ-layer formation require nodal-related signals [J]. Nature, 1998, 395: 181-185.
[17] 孟亚平,刘春业,石德利. ripply1在斑马鱼早期胚胎背腹发育中的作用 [J]. 中国实验动物学报, 2015, 23(5): 446-452.
[18] Dumortier JG, Martin S, Meyer D, et al. Collective mesendoderm migration relies on an intrinsic directionality signal transmitted through cell contacts [J]. Proc Natl Acad Sci U S A, 2012, 109: 16945-16950.
[19] 孙智慧,孟安明. 斑马鱼胚胎中受Nodal 信号调控基因的鉴定 [J]. 生物化学与生物物理进展, 2007, 34(6): 595-603.
[20] Bennett JT, Joubin K, Cheng S, et al. Nodal signaling activates differentiation genes during zebrafish gastrulation [J]. Dev Biol, 2007, 304: 525-540.
[21] Liu Z, Lin X, Cai Z, et al. Global identification of SMAD2 target genes reveals a role for multiple co-regulatory factors in zebrafish early gastrulas [J]. J Biol Chem, 2011, 286: 28520-28532.
Identification of zebrafish shield organizer-specific genes
WAN Chuan-lu1,YAN Yi-fang2,CAO Yu2,WANG Qiang2
(1. School of Life Science, Anhui University, Hefei, 230601, China; 2. State Key Laboratory of Membrane Biology, Institute of Zoology, Chinese Academy of Sciences, Beijing, 100101)
Objective During zebrafish gastrulation, dramatic movements rearrange cells into three germ layers and contribute to the formation of the shield organizer, which acts as a dorsal signal center to pattern the body axis. Global identification of shield organizer-specific genes in early gastrulas will be valuable for studying the regulatory cascades during organizer formation and body axis establishment. MethodsTg(gsc:GFP) transgenic embryos express GFP in the shield organizer, which is controlled by a 1.8 kbgscpromoter. Flow cytometry technology and RNA deep sequencing analysis were applied to isolate GFP positive cells from theTg(gsc:GFP) transgenic embryos and systematically uncover the genes highly expressed in the dorsal organizer. Subsequently, the expression of shield organizer-specific genes was further confirmed by quantitative real-time PCR and whole mountinsituhybridization method during zebrafish embryonic development. Results GFP-positive cells exceeding 96% purity were isolated from shield-stageTg(gsc:GFP) transgenic embryos and 657 organizer highly expressed genes were identified through RNA deep sequencing analysis. The results ofinsituhybridization experiments revealed that a number of genes includingKIAA1324,ripply1,twist2,isthmin1,nme4,zgc174153 andrrbp1bwere expressed in shield organizer during zebrafish gastrulation. Conclusions The identification of these shield organizer-specific genes in the current study provides useful clues to explore the zebrafish developmental functions in further studies.
Zebrafish; Shield organizer; FACS; RNA deep sequencing;insituhybridization
WANG Qiang. E-mail: qiangwang@ioz.ac.cn
国家自然科学基金面上项目(No. 31271532);优秀青年科学基金项目(No.31322035)资助。
万传璐(1988-),男,硕士研究生, 研究方向: 发育生物学。Email: w.chl.chzhz@163.com
王强(1975-),男,研究员,博士生导师,主要从事发育信号转导的研究。Email: qiangwang@ioz.ac.cn
研究报告
Q95-33
A
1005-4847(2016)05-0441-07
10.3969/j.issn.1005-4847.2016.05.001
2016-03-14

