比较谷氨酸引起两品种大鼠培养星形胶质细胞肿胀的差异
师忠芳,徐立新,卢易,董丽萍,闫旭,杨少华,3,袁芳*
(1. 首都医科大学 北京市神经外科研究所,首都医科大学附属北京天坛医院,北京 100050;2. 首都医科大学附属北京天坛医院,北京 100050;3. 北德克萨斯大学医学中心神经与药理系,美国德克萨斯州沃思堡 76107)
比较谷氨酸引起两品种大鼠培养星形胶质细胞肿胀的差异
师忠芳1,徐立新1,卢易2,董丽萍1,闫旭1,杨少华1,3,袁芳1*
(1. 首都医科大学 北京市神经外科研究所,首都医科大学附属北京天坛医院,北京 100050;2. 首都医科大学附属北京天坛医院,北京 100050;3. 北德克萨斯大学医学中心神经与药理系,美国德克萨斯州沃思堡 76107)
目的 比较Wistar大鼠及SD大鼠培养星形胶质细胞(AST)对谷氨酸所致细胞肿胀的差异。方法 利用新生1 d的Wistar大鼠和SD大鼠进行AST原代及传代培养,传代培养10 d分别给予1、10 mmol/L谷氨酸孵育48 h,通过乳酸脱氢酶释放率检测细胞活性,通过胶质纤维酸性蛋白(GFAP)免疫荧光染色、Image Pro Plus软件测量细胞周长表示细胞体积变化,通过逆转录实时荧光定量PCR法检测水通道蛋白4(AQP4) mRNA表达变化。结果 谷氨酸对不同品种大鼠AST活性影响没有差异(P>0.05)。在正常情况下,Wistar大鼠AST周长小于SD大鼠,在给予谷氨酸处理后,均明显大于SD大鼠(P<0.05)。在给予1 mmol/L谷氨酸后,Wistar大鼠AST的AQP4 mRNA表达明显高于SD大鼠(P<0.05)。结论 Wistar大鼠AST对谷氨酸所致细胞肿胀较SD大鼠明显,且谷氨酸对两品种大鼠AST上AQP4表达变化的影响存在差异。
谷氨酸;星形胶质细胞;水通道蛋白4;大鼠
谷氨酸是中枢神经系统最重要的兴奋性氨基酸,对神经系统正常功能的维持起重要作用。缺血性脑损伤时,脑内谷氨酸浓度增高,产生兴奋性神经毒性作用,加重脑损伤,引起脑水肿[1]。研究表明脑水肿主要是星形胶质细胞(astrocytes, AST)肿胀,谷氨酸增加能引起星形胶质细胞肿胀[2,3]。大量研究显示,水通道蛋白4(aquaporin 4, AQP4)参与缺血性脑损伤后脑水肿的发生发展[4]。我们的研究发现谷氨酸能引起培养AST肿胀和AQP4表达变化[5]。已有研究发现Wistar大鼠及Sprague-Dawley (SD)大鼠在缺血性脑损伤所致脑梗死体积,病变区域的脑血流量及表观弥散系数变化之间存在差别[6,7],但是不同品种大鼠AST对谷氨酸所致细胞肿胀是否存在差异不清楚,因此本研究观察谷氨酸所致的Wistar大鼠及SD 大鼠培养AST体积及AQP4表达变化是否存在差异。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级新生1 d的雄性Wistar大鼠和SD大鼠各27只,由军事医学科学院实验动物中心提供[SCXK(军)2012-0004]。在北京市神经外科研究所动物室屏障环境 【SYXK(京)2013-0009】进行实验,实验过程按实验动物使用的3R原则给予人道的关怀,并通过北京市神经外科研究所动物福利伦理审查(编号No.201401007)。
1.1.2 实验试剂
最低必需培养基(minimum essential medium, MEM) (Gibco)、胎牛血清(fetal bovine serum, FBS) (Gibco)、胰蛋白酶(Merck)、兔抗大鼠胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)多克隆抗体(Dako)、Alexa Fluor 488标记山羊抗兔IgG二抗 (Molecular Probes)、含4′6-二脒基-2-苯基吲哚(DAPI)的荧光封片剂(中杉金桥)、乳酸脱氢酶(lactate dehydrogenase, LDH)比色测定法试剂盒(普利莱)、TRIzol试剂(Life Technologies)、逆转录试剂盒(Promega)、SYBR Green I 核酸染料试剂盒(Roche)、L-谷氨酸钠(国药集团)。
1.1.3 实验仪器
细胞培养箱(Thermo)、荧光倒置相差显微镜(Zeiss)、多功能酶标仪(Tecan)、实时荧光定量PCR仪(Roche)。
1.2 方法
1.2.1 细胞培养
大鼠AST原代培养参考McCarthy的方法并加以改良[3],无菌条件下,取新生1 d 的Wistar和SD雄性乳鼠大脑皮层组织,将其切割成约1 mm3小块,吹打过滤后,接种于含10%FBS的MEM培养基中,置37℃、5% CO2培养箱。每3~4 d换液1次。原代培养约10 d后进行传代培养,经过大约10 d,GFAP免疫细胞荧光染色鉴定培养细胞纯度,之后将培养液分别更换为含有1、10 mmol/L 的L-谷氨酸钠的MEM培养液继续培养48 h,对照组细胞实验仅更换新鲜培养液。
1.2.2 GFAP免疫荧光染色及细胞周长测定
根据我们已发表文献的方法进行实验[8]:培养细胞丙酮固定30 min,正常羊血清封闭15 min,加入兔抗大鼠GFAP抗体(1∶50),阴性对照用PBS代替一抗,4℃过夜。Alexa Fluor 488标记山羊抗兔IgG (1∶100)避光孵育3 h,含DAPI的荧光封片剂封片,倒置荧光显微镜下观察并采集图像。利用Image-Pro Plus 图像分析软件对细胞周长进行测定,每孔细胞随机选择3个高倍视野(×200),每个视野计数10个细胞的周长,其均数代表该视野细胞周长测量结果,每组测量3孔细胞。
1.2.3 LDH释放率检测细胞活性
分别在1、10 mmol/L谷氨酸孵育48 h后取培养基上清5 μL(细胞外),接着将细胞及培养上清于-80℃冰箱中反复冻融两次后,从培养板中取5 μL裂解液(细胞内外),之后按照LDH试剂盒说明操作,用多功能酶标仪于440 nm波长处测定LDH含量。计算LDH释放率,LDH释放率=(细胞外LDH活力单位/细胞内外总LDH活力单位) × 100%。
1.2.4 逆转录实时荧光定量聚合酶链反应(quantitative reverse transcription PCR,RT-qPCR)法检测AQP4 mRNA表达
根据我们已发表文献的方法[9]:使用TRIzol试剂提取培养细胞总RNA,应用Promega公司逆转录试剂盒合成cDNA,然后利用SYBR Green方法进行PCR实验。按照GenBank大鼠AQP4(NM012825.4)序列、β-actin (NM031144.3)序列进行引物设计,AQP4上游:5’-TGAATCCAGCTCGATCCTTTG-3’,下游:5’-TATCCAGTGGTTTTCCCAGTTTC-3’; β-actin上游:5’-CGTTGACATCCGTAAAGACC-3’,下游5’-CTAGGAGCCAGAGCAGTAATC-3’,由深圳华大基因科技服务有限公司合成。PCR反应体系包括:AQP4或β-actin上游引物和下游引物各1 μL,SYBR Green PCR Master Mix 10 μL,模板cDNA 1 μL,DEPC水7 μL。PCR反应条件:95℃预热10 min,95℃变性15 s,60℃退火30 s,72℃延伸30 s,共40个循环。荧光信号用LightCycler480 SW1.5软件进行分析,用AQP4/β-actin来表示AQP4 mRNA表达水平。
1.2.5 数据分析

2 结果
2.1 大鼠体外培养AST鉴定
GFAP细胞免疫荧光染色显示,不同品种大鼠体外培养AST均呈现大致均一的单层扁平细胞,具有短而粗大的细胞突起,培养细胞95%以上为GFAP免疫荧光染色阳性细胞。可以明显看出Wistar大鼠AST小于SD大鼠,见图1。
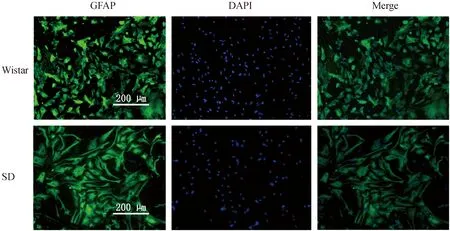
图1 Wistar与SD大鼠培养星形胶质细胞GFAP免疫荧光染色(×200)Fig.1 Immunofluorescence staining for GFAP in the cultured astrocytes of Wistar and SD rats
2.2 细胞活性变化
谷氨酸对Wistar大鼠AST的LDH释放率没有影响(P>0.05)。1 mmol/L谷氨酸不引起SD大鼠AST的LDH释放率变化(P>0.05),而10 mmol/L谷氨酸能引起细胞LDH释放率增加(P<0.05)。 但是Wistar大鼠与SD大鼠AST的LDH释放率在给予1、10 mmol/L谷氨酸后的差异均无显著性(P>0.05),提示谷氨酸对不同品种大鼠AST活性的影响没有差异,见图2A。
2.3 细胞周长变化
已有研究提示细胞周长比细胞直径能更加精确地反映细胞体积的变化[10],因此本研究应用细胞周长变化来代表细胞体积的变化。细胞周长测量结果显示,未给予谷氨酸处理情况下Wistar大鼠AST周长比SD大鼠周长少20% (P<0.05),给予谷氨酸处理48 h后,Wistar大鼠和SD大鼠的AST周长均增加 (P<0.05),并且1及10 mmol/L谷氨酸处理后,Wistar大鼠AST周长增加均大于SD大鼠(P<0.05),分别多20%和60%,见图2B、图3。
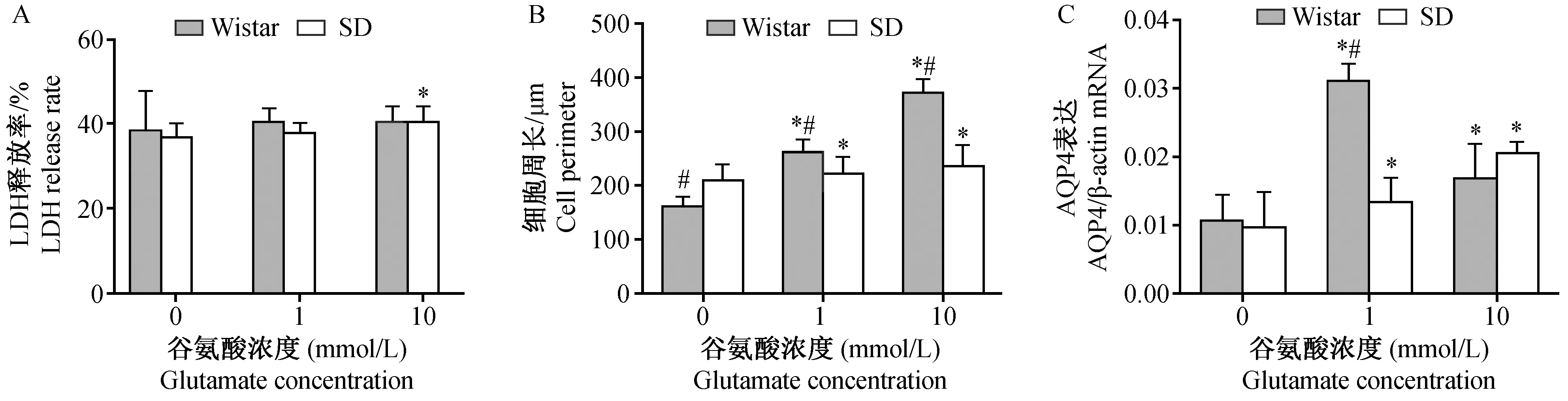
注:A:细胞活性; B:细胞周长; C:AQP4表达。与0 mmol/L谷氨酸组比较,*P<0.05 差异有显著性;与SD大鼠比较,#P<0.05 差异有显著性。图2 谷氨酸引起Wistar与SD大鼠星形胶质细胞活性、周长及水通道蛋白4表达变化的比较±s)Note. A: Cell viability; B: Cell perimeter; C: AQP4 mRNA expression.*P<0.05, compared with the 0 mmol/L glutamate group; #P<0.05, compared with the SD rats.Fig.2 Comparison of the effect of glutamate on cultured astrocytes of the Wistar and SD rats

图3 谷氨酸孵育后Wistar与SD大鼠培养星形胶质细胞GFAP免疫荧光染色(×200)Fig.3 Immunofluorescence staining for GFAP in cultured astrocytes of the Wistar and SD rats after incubation wih glutamate
2.4 AQP4表达变化
RT-qPCR结果显示,未给予谷氨酸处理组不同品种大鼠AST上AQP4表达没有差异(P>0.05)。 给予谷氨酸孵育48 h后,Wistar大鼠和SD大鼠AQP4 mRNA表达均增加(P<0.05),但两品种的变化规律不同。在Wistar大鼠,1 mmol/L谷氨酸引起AQP4表达增加,10 mmol/L谷氨酸导致AQP4表达降低(P<0.05),但仍高于对照组。在SD大鼠,谷氨酸可引起AQP4表达持续增加(P<0.05)。Wistar大鼠与SD大鼠比较,1 mmol/L谷氨酸引起Wistar大鼠的AQP4表达水平是SD大鼠的230% (P<0.05), 而10 mmol/L谷氨酸引起的AQP4表达变化两者没有明显差异(P>0.05),见图2C。
3 讨论
已有的研究表明在大鼠整体脑缺血模型中Wistar大鼠和SD大鼠的脑梗死体积及模型稳定性存在差异[6],本研究我们首次利用体外培养星形胶质细胞比较了谷氨酸所致细胞肿胀Wistar大鼠和SD大鼠的差异,结果发现谷氨酸引起的细胞体积变化Wistar大鼠比SD大鼠更加显著,并且AQP4表达变化规律不同。
Wistar大鼠与SD大鼠都是白色封闭群大鼠,SD大鼠是由封闭群Wistar大鼠培育而成。Wistar大鼠是1907年由美国费城Wistar研究所动物室培育,该品种大鼠头部较宽,耳朵较长,尾的长度小于身长;SD大鼠是1925年由美国SD农场用Wistar大鼠培育而成,该品种大鼠头部狭长,尾长接近于身长,生长发育较Wistar快。在本研究中,我们发现,不同品种大鼠培养AST形态大致相同,但Wistar大鼠AST体积明显小于SD大鼠,同时,通过细胞周长的测量我们发现Wistar大鼠AST周长比SD大鼠小约20%,这一实验结果与大体动物的发现是相似的。在本研究中我们发现谷氨酸可以引起Wistar大鼠和SD大鼠体外培养AST体积增加,而且Wistar大鼠来源AST体积增加更加显著,提示谷氨酸引起的Wistar大鼠细胞肿胀较SD大鼠明显。Walberer等[11]研究发现,永久性大鼠大脑中动脉栓塞模型能导致Wistar大鼠比SD大鼠出现更加严重的脑水肿,我们的研究结果可以解释这一实验现象。许多研究显示Wistar大鼠与SD大鼠对不同刺激及药物的敏感程度在有些方面存在很大差异[12],朱英标等[13]研究发现与Wistar大鼠相比,SD大鼠实验性自身免疫性脑脊髓炎发病潜伏期较长,神经症状较严重,总体中枢炎症改变较为严重;O’Malley等[14]研究发现应激暴露能导致SD大鼠下丘脑细胞外信号激酶磷酸化水平增加及促肾上腺皮质激素释放因子增加,而Wistar大鼠没有此改变。王克柱等[15]研究发现经典条件反射阶段SD大鼠对饮水盒的探索能力强,而在奖励性操作条件反射阶段Wistar大鼠的操作能力优于SD大鼠,这些研究充分表明Wistar大鼠与SD大鼠对相同刺激的反应存在差别,我们的研究也说明谷氨酸引起的Wistar大鼠AST细胞肿胀程度大于SD大鼠。
AQP4是CNS含量最多的水通道蛋白,主要表达于AST足突处的细胞膜上,参与脑内水平衡等生理功能,病理情况下参与各种脑疾病包括缺血性脑损伤等所致脑水肿的形成与消散[16,17]。Tang等[18]研究发现培养AST缺氧复氧导致的细胞肿胀与AQP4表达上调密切相关,我们的前期研究发现谷氨酸长时间作用可以引起AST上AQP4表达的动态变化[5]。 在本研究中我们观察到谷氨酸引起Wistar大鼠与SD大鼠AST上AQP4表达增高, Wistar大鼠AST在给予1 mmol/L谷氨酸孵育后AQP4表达量比SD大鼠高130%,同时显示出比SD 大鼠更加明显的细胞肿胀,推测谷氨酸孵育后Wistar大鼠AST较SD大鼠细胞更加肿胀可能与其AQP4表达量的显著增加有关。研究表明AQP4表达受蛋白间的相互作用、蛋白激酶C磷酸化、转录因子活化、信号转导途径等多种因素的调节,我们的研究发现细胞外信号调节激酶可能参与培养AST划痕损伤后AQP4表达调节[8],另有研究发现大鼠脑缺血再灌注损伤后梗死核心区及半暗带巨噬细胞炎症蛋白-1α表达增加[19],同时会激活Wnt7a信号通路[20]。谷氨酸所致AST上AQP4表达变化引起细胞肿胀的信号通路分子机制,有待于进一步研究。
研究表明在脑内除了有大量AQP4表达外,还有AQP1、3、5、8、9、12等的表达。本研究结果发现10 mmol/L谷氨酸引起Wistar大鼠AST较SD大鼠细胞更加肿胀,但AQP4表达却不高。分析其原因可能是较高浓度的谷氨酸作用AST时,有其他水通道蛋白参与细胞肿胀的调节。有研究报道称AQP1及AQP9在各种脑疾病及急性脑损伤所致脑水肿的形成消散中其重要作用[4]。不同品种大鼠AST对谷氨酸引起的肿胀敏感程度不同除了AQP4以外是否还有其他水通道蛋白如AQP1、AQP9等参与也有待于进一步探讨。
通过本研究我们发现,谷氨酸引起Wistar大鼠体外培养AST肿胀比SD大鼠更加严重,可能与谷氨酸引起不同品种大鼠AST上AQP4表达差异有关。该实验结果提示我们在开展脑水肿相关研究时选择实验动物及分析实验结果时应该考虑不同品种间的差异。
[1] Stokum JA, Kurland DB, Gerzanich V, et al. Mechanisms of astrocyte-mediated cerebral edema [J]. Neurochem Res, 2015, 40(2): 317-328.
[2] Han BC, Koh SB, Lee EY, et al. Regional difference of glutamate-induced swelling in cultured rat brain astrocytes [J]. Life Sci, 2004, 76(5): 573-583.
[3] Yuan F, Wang T. Glutamate-induced swelling of cultured astrocytes is mediated by metabotropic glutamate receptor [J]. Sci China C Life Sci, 1996, 39(5): 517-522.
[4] Vella J, Zammit C, Di Giovanni G, et al. The central role of aquaporins in the pathophysiology of ischemic stroke [J]. Front Cell Neurosci, 2015, 9: 108.
[5] 路杨, 师忠芳, 袁芳, 等. 谷氨酸引起培养大鼠星形胶质细胞水通道蛋白4表达动态变化 [J]. 中国康复理论与实践, 2010, 16(1): 29-31.
[6] Duverger D, MacKenzie ET. The quantification of cerebral infarction following focal ischemia in the rat: influence of strain, arterial pressure, blood glucose concentration, and age [J]. J Cereb Blood Flow Metab, 1988, 8(4): 449-461.
[7] Bardutzky J, Shen Q, Henninger N, et al. Differences in ischemic lesion evolution in different rat strains using diffusion and perfusion imaging [J]. Stroke, 2005, 36(9): 2000-2005.
[8] Shi ZF, Zhao WJ, Xu LX, et al. Downregulation of aquaporin 4 expression through extracellular signal-regulated kinases1/2 activation in cultured astrocytes following scratch-injury [J]. Biomed Environ Sci, 2015, 28(3): 199-205.
[9] 师忠芳, 赵焕英, 袁芳, 等. MAPKs信号通路干预对体外培养大鼠星形胶质细胞划痕损伤后水通道蛋白4表达的影响 [J]. 首都医科大学学报, 2010, 31(2): 228-232.
[10] Sorensen AG, Patel S, Harmath C, et al. Comparison of diameter and perimeter methods for tumor volume calculation [J]. J Clin Oncol, 2001, 19(2): 551-557.
[11] Walberer M, Stolz E, Müller C, et al. Experimental stroke: ischaemic lesion volume and oedema formation differ among rat strains (a comparison between Wistar and Sprague-Dawley rats using MRI) [J]. Lab Anim, 2006, 40(1): 1-8.
[12] Manduca A, Campolongo P, Palmery M, et al. Social play behavior, ultrasonic vocalizations and their modulation by morphine and amphetamine in Wistar and Sprague-Dawley rats [J]. Psychopharmacology (Berl) [J]. 2014, 231(8): 1661-1673.
[13] 朱英标, 李晓莉, 童巧文, 等.SD大鼠和Wistar大鼠实验性自身免疫性脑脊髓炎发病情况比较 [J]. 中国实验动物学报, 2009, 17(3): 166-171.
[14] O’Malley D, Julio-Piepera M, Dinan TG, et al. Strain differences in stress-induced changes in central CRF1 receptor expression [J]. Neurosci Lett, 2014, 561: 192-197.
[15] 王克柱, 徐攀, 卢聪, 等. 两品系大鼠在经典条件反射和操作式条件反射中的行为学表现 [J]. 中国实验动物学报, 2016, 24(1): 65-71.
[16] 林锋, 吴江. 脑水肿与通道蛋白4的关系及进展 [J]. 中国医药导报, 2012, 9(10): 17-19.
[17] 陈文斌, 林思永, 冯作炫. 七氟醚与大鼠缺血性脑水肿脑组织内水通道蛋白4表达的影响 [J]. 中国医药导报, 2013, 10(18): 27-29.
[18] Tang Z, Sun X, Huo G, et al. Protective effects of erythropoietin on astrocytic swelling after oxygen-glucose deprivation and reoxygenation: mediation through AQP4 expression and MAPK pathway [J]. Neuropharmacology, 2013, 67: 8-15.
[19] 王荣亮, 赵海苹, 罗玫, 等. 远程缺血后适应对大鼠脑缺血再灌注损伤后MIP-1α表达的影响 [J]. 中国比较医学杂志, 2013, 23(8): 24-29.
[20] 薛金龙, 孙芳玲, 刘婷婷, 等. 莫诺苷对局灶性脑缺血再灌注大鼠Wnt7a和APC表达的影响 [J]. 中国比较医学杂志, 2014, 24(9): 9-13.
Comparison of the differences in glutamate-induced astrocyte swelling between Wistar and Sprague-Dawley rats
SHI Zhong-fang1, XU Li-xin1, LU Yi2, DONG Li-ping1,YAN Xu1, YANG Shao-hua1,3, YUAN Fang1*
(1. Beijing Institute of Neurosurgery, Beijing Tiantan Hospital, Capital Medical University, Beijing 100050, China;2. Beijing Tiantan Hospital, Capital Medical University, Beijing 100050; 3. Department of Pharmacology and Neuroscience, University of North Texas Health Science Center, Fort Worth, Texas 76107, USA)
Objective To compare the differences between the cell swelling of cultured astrocytes (AST) from Wistar and Sprague-Dawley (SD) rats after incubation with glutamate. Methods Primary cultured AST derived from the cerebral cortex of one-day-old Wistar or SD rats were prepared. The cultured AST received 1 or 10 mmol/L glutamate treatment for 48 h on the tenth day after subculture. The viability of AST was determined by lactate dehydrogenase (LDH) kit to assess the cell injury, and the perimeter of AST was measured using Image Pro Plus software after glial fibrillary acidic protein immunofluorescence staining to evaluate the astrocyte swelling. Then, the expression of aquaporin 4 (AQP4) in cultured AST was detected by quantitative reverse transcription polymerase chain reaction. Results No significant difference was found in the LDH release after the glutamate treatment in cultured AST from these two strains (P>0.05). The perimeter of AST from normal Wistar rats was shorter than that from SD rats, but was longer after the treatment of glutamate (P<0.05). Meanwhile, AQP4 expression in the Wistar rats was significantly higher than that from SD rats after incubation with 1 mmol/L glutamate (P<0.05). Conclusions These results suggeste that cultured AST from Wistar rats are more susceptible to glutamate-induced swelling than that from SD rats, and there are differences between the effects of glutamate on AQP4 expression in astrocytes of Wistar and SD rats.
Glutamate; Astrocyte; Aquaporin 4; Rats
YUAN Fang, E-mail: florayuan@vip.sina.com
国家自然科学基金(NO. 81271286,81228009);北京市自然科学基金面上项目(项目资助号:7152027)。
师忠芳(1980-),女, 硕士研究生,专业:神经病理与病理生理学。E-mail: shizhongfangbj@163.com
袁芳(1963-), 女,研究员,研究方向:神经功能保护,癫痫及脑肿瘤相关研究。E-mail: florayuan@vip.sina.com
研究报告
Q95-33
A
1005-4847(2016)05-0454-06
10.3969/j.issn.1005-4847.2016.05.003
2016-04-05

