文蛤肉水解液的致突变性
高梅,曹冲,王功霞,汤连升,贾庆文
(山东省药学科学院,山东省化学药物重点实验室,济南 250101)
文蛤肉水解液的致突变性
高梅,曹冲,王功霞,汤连升,贾庆文
(山东省药学科学院,山东省化学药物重点实验室,济南 250101)
目的 评价文蛤肉水解液的致突变性,为文蛤的开发利用提供实验数据。方法 采用Ames试验、小鼠嗜多染红细胞骨髓微核试验和CHL细胞体外染色体畸变试验3项致突变性试验,检测文蛤肉水解液有无致突变作用。结果 Ames试验中文蛤肉水解液各剂量组回变菌落数均在正常范围内,均未超过自发回变菌落数的2倍,在加与不加S9时5株试验菌株结果为阴性。CHL细胞体外染色体畸变试验,文蛤肉水解液各剂量组的染色体畸变率与阴性对照组比较,差异无显著性(P>0.05),结果为阴性。小鼠骨髓微核试验,各剂量组的微核率与阴性对照组比较,差异无显著性(P>0.05),结果为阴性。结论 在本试验条件和范围下,文蛤肉水解液未见潜在的致突变作用。
文蛤;致突变性;Ames试验;染色体畸变试验;微核试验
文蛤(Meretrix Meretrix Linnaeus) 又称为蛤蜊,是沿海地区常见的经济贝类,不仅肉质鲜美,营养丰富,而且具有极高的药用价值,古书籍《本草纲目》、《伤寒论》、《方脉正宗》、《本草备要》中均记载了文蛤的药用功效[1]。近代研究表明,文蛤中的一些成分,具有广泛的药理活性,除具有降血糖、降血脂作用外,还有增强免疫功能、抗艾滋病、抗衰老,抗肿瘤等作用[2-13],因此,文蛤无论食用、药用,开发应用前景看好,但对文蛤的毒性研究报道较少,特别是致突变性。基于此,为了解文蛤肉水解液的致突变性,根据《药物遗传毒性研究技术指导原则》[14],本文选用标准组合中的体外细菌回复突变试验(Ames试验)、体外细胞染色体畸变试验、小鼠骨髓嗜多染红细胞微核试验3项经典试验,按照GLP要求对文蛤肉水解液进行了致突变性安全性毒理学评价,为安全用药提供研究依据。
1 材料与方法
1.1 动物
KM小鼠50只,SPF级,体重25~30 g,雌雄各半,北京维通利华实验动物技术有限公司提供【SCXK(京)2012-0001】,试验在本中心屏障环境动物实验设施内进行【SYXK(鲁)2014 0008】。试验期间动物房环境温度为20~26℃,湿度为40%~70%。
1.2 菌株
TA97a、TA98、TA100、TA102、TA1535购自美国Moltox公司。
1.3 细胞株
中国仓鼠肺细胞(CHL细胞)购自中国科学院上海生命科学研究院。
1.4 主要试剂
文蛤肉水解液由山东省药学科学院中医药研究所提供,批号140319;敌克松购自Supelco,批号408-98A;叠氮钠购自Amresco,批号416A052;2-氨基芴购自Sigma,批号S90850V;1,8-二羟基蒽醌购自Sigma,批号STBC1841V;RPMI 1640购自赛默飞世尔生物化学制品(北京)有限公司,批号NZD1128;新生牛血清购自杭州四季青公司,批号130105;注射用丝裂霉素购自浙江海正药业股份有限公司,批号130607;环磷酰胺购自江苏恒瑞医药股份有限公司,批号14010425;肝微粒体酶(S9),美国Moltox公司。
1.5 主要仪器
LMQ.C立式灭菌器,山东新华医疗器械股份有限公司;TXB622L电子天平,岛津企业管理(中国)有限公司;ZHWY-100B恒温培养振荡器,上海智城分析仪器制造有限公司;SPX-250B-Z生化培养箱,上海博迅实业有限公司医疗设备厂;Thermo 3111二氧化碳细胞培养箱,Thermo Scientific公司;TD5A-WS台式低速离心机,湖南湘仪离心机仪器有限公司;DM LS2显微镜,德国Leica公司;SW-CJ-2FXS超净工作台,苏州佳宝净化工程设备有限公司;HFsafe-1500TE生物安全柜,上海力申科学仪器有限公司。1.6 试验方法[15-19]
1.6.1 Ames试验
采用TA97a、TA98、TA100、TA102和TA1535 5株试验菌株,对5株菌株分别进行组氨酸需求特性鉴定、结晶紫敏感特性鉴定、紫外线敏感特性鉴定、抗氨苄青霉素特性鉴定、抗四环素特性鉴定、自发回变鉴定、回变诊断性鉴定,经鉴定合格。每一菌株分别设5个剂量组,各剂量组浓度分别为每皿5000、2500、1250、625、312.5 μg,试验同时设阴性对照组和阳性对照组。采用平皿掺入法,每组均做3个平行皿,37℃培养箱培养48 h后,计数每皿的回变菌落数。试验重复一次。
1.6.2 染色体畸变试验
CHL细胞检测无支原体污染。将指数生长的CHL细胞接种于25 cm2细胞培养瓶(每瓶5 mL),接种浓度为每毫升10×104个,置37℃、5% CO2培养箱中培养24 h后,加入受试物,文蛤肉水解液高、中、低剂量组的终浓度分别为5、2.5、1.25 mg/mL,阴性对照组(0.9%氯化钠注射液),阳性对照组[-S9:环磷酰胺,20 μg/mL;+ S9:丝裂霉素,0.15 μg/mL(4 h)、0.05 μg/mL(24 h)]。分别培养4、24 h,4 h组设+S9组。各组观察200个中期分裂相细胞,计数每组细胞的染色体结构畸变率。
1.6.3 小鼠骨髓微核试验
选取25~30 g的KM小鼠50只,每组10只,文蛤肉水解液高、中、低剂量分别为2000、1000、500 mg/kg,同时设立阴性对照组、阳性对照组(注射用环磷酰胺,40 mg/kg)。各剂量组按20 mL/kg体重灌胃给予实验动物,给药1次/日,给药2 d,间隔24 h,末次给药后20 h取材制备骨髓涂片,阳性对照组单次腹腔注射给药。计数2000个嗜多染红细胞的微核发生率,计数200个嗜多染红细胞(PCE)所观察到的正染红细胞(NCE),计算PCE/(PCE+NCE)的比值。
1.6.4 数据处理
2 结果
2.1 Ames试验
文蛤肉水解液Ames试验结果见表1。试验结果可见,不同剂量的文蛤肉水解液在有和无S9活化系统的条件下,其回变的菌落数均在正常范围内,均为超过阴性对照组的两倍,且各剂量组间无明显的剂量反应关系,阳性对照组均高于相应的阴性对照菌落数两倍以上,差异有显著性(P<0.01),两次试验结果一致。根据Ames试验结果的判断标准,文蛤肉水解液的Ames试验为阴性。
2.2 染色体畸变试验
试验结果见表2(观察细胞数为200个)。试验结果可见,在有和无S9活化系统的条件下,无论染毒4 h还是24 h,阴性对照组染色体畸变率均<5%,不同剂量的文蛤肉水解液染色体畸变率均<5%,与阴性对照组比较,差异无显著性(P>0.05)且未呈现剂量-反应关系;阳性对照组畸变率均>20%,与阴性对照组比较,差异有显著性(P<0.01)。显示文蛤肉水解液的染色体畸变试验为阴性。
2.3 小鼠骨髓微核试验
文蛤肉水解液的小鼠骨髓嗜多染红细胞微核率的影响结果见表3(观察细胞数2000个)。结果显示,各剂量组的PCE/(PCE+NCE)与阴性对照组比较,差异无显著性(P>0.05)。各剂量组的小鼠骨髓微核率与阴性对照组比较差异无显著性(P>0.05),而阳性对照组微核率与阴性照组比较差异有显著性(P<0.01),有极高的致突变性。结果表明,文蛤肉水解液对小鼠骨髓微核率的发生没有明显升高作用。
3 讨论
致突变性研究在药物研发尤其是在药物筛选阶段,处于比较重要的位置,在很大程度上将影响新药研发的进程。目前我国指导原则中致突变性试验推荐的标准试验组合为:① 1项体外细菌基因突变试验;② 1项采用哺乳动物细胞进行的体外染色体损伤评估试验,或体外小鼠淋巴瘤tk试验;③ 1项采用啮齿列动物造血细胞进行的体内染色体损伤试验[20]。因此,本实验选取了Ames试验、CHL细胞体外染色体畸变试验、小鼠骨髓嗜多染红细胞微核试验3项经典试验对文蛤肉水解液进行了致突变性安全性研究。其中,Ames试验是检测基因突变的最常用方法,染色体畸变试验是反应细胞染色体损伤的敏感指标,试验通过显微镜直接观察染色体数目和结构的异常,骨髓微核试验是以诱发小鼠骨髓红细胞微核为指标来推断受试物致染色体或有丝分裂器损伤的一种哺乳动物体内试验。
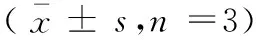
表1 文蛤肉水解液 Ames试验结果
注:与阴性对照组比较,*P<0.01。
Note. Compared with the negative control, the difference is statistically significant (*P<0.01).
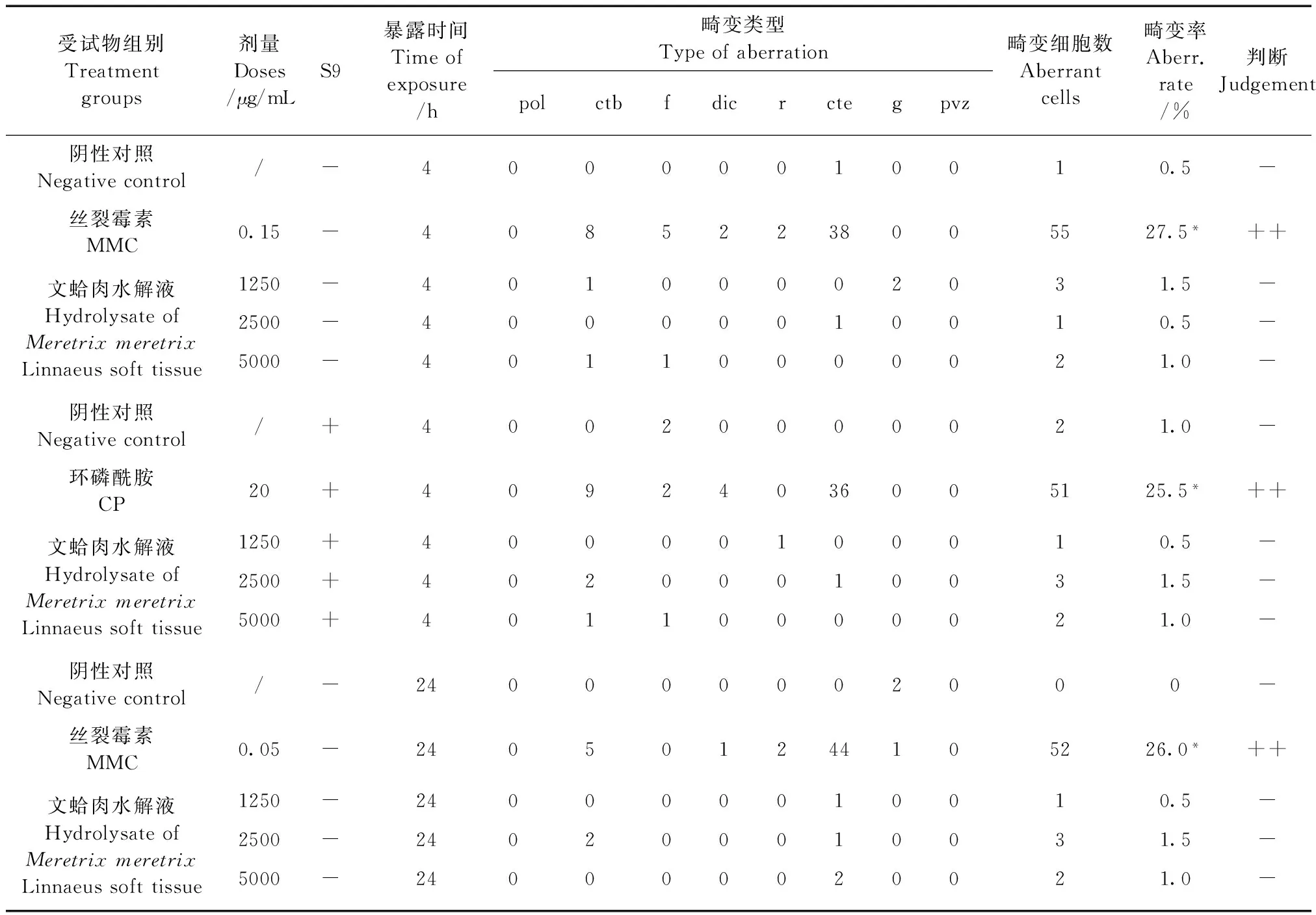
表2 文蛤肉水解液染色体畸变试验结果
注:pol,多倍体;ctb,染色单体断裂;f,断片;dic,双着丝点;r,环状染色体;cte,染色单体交换;g,裂隙;pvz,粉碎;在计算染色体畸变率时裂隙不计入其中。与阴性对照组比较,*P<0.01。
Note. Pol: Polyploidy; ctb: Chromatid break; f: Fragment; dic: Dicentrics; r: Circular chromosome; cte: Chromatid exchange; g: Gap; pvz: Crush; Excluding gaps. Compared with the control group,*P<0.01.
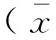
表3 文蛤肉水解液小鼠骨髓微核试验结果±s,n=5)
注:与阴性对照组比较,*P<0.01。
Note. Compared with the negative control, the difference was statistically significant (*P<0.01).
文蛤肉水解液、各种文蛤提取物、文蛤蛋白、文蛤多糖几乎都是从鲜文蛤软体部分提取而来,对这些成分的研究主要集中在其抗肿瘤、抗氧化、抗突变等药理活性方面[21-25],随着对文蛤应用的扩展,较大量摄入文蛤的安全性受到研究者的关注。本实验采用Ames试验、CHL细胞体外染色体畸变试验、小鼠骨髓嗜多染红细胞微核试验,对文蛤肉水解液进行了体外致突变变作用的评价,从体内外比较全面的反映了受试物对原核细胞和真核细胞的致突变性。三个试验剂量都是根据指导原则要求所设计的最大剂量,使得药物暴露量得到了保证,同时均设立阴性、阳性对照,保证了试验系统的可靠性。本研究的Ames试验,受试物各剂量组在有无代谢活化系统时回变菌落数均未超过阴性对照组菌落数2倍,亦无剂量-效应关系,鼠伤寒沙门氏菌TA97a、TA98、TA100、TA102、TA1535 5株试验菌株,在加与不加S9时,均未呈现遗传毒性;CHL细胞体外染色体畸变试验,阳性对照组细胞畸变率明显高于阴性对照组,差异有显著性(P<0.01),文蛤肉水解液高、中、低剂量组的染色体畸变率均小于<5%,与阴性对照组比较差异无显著性(P>0.05),表明文蛤肉水解液无直接或间接的诱发CHL细胞染色体畸变作用;小鼠骨髓微核试验,阳性对照组细胞畸变率明显高于阴性对照组,差异有显著性(P<0.01),文蛤肉水解液高、中、低剂量组微核率与阴性对照组比较差异无显著性(P>0.05),表明在所测剂量范围内未发现受试物导致小鼠微核发生率增加。综上所述,在本实验条件和剂量范围内,未发现文蛤肉水解液致突变性作用。
[1] 谢辉, 钟正伟, 朱文仓, 等. 文蛤药用价值研究进展 [J]. 承德石油高等专科学校学报, 2005, 7(2): 9-12.
[2] 徐秀兰,李泰明,张传儒.文蛤水解液降糖及降脂作用的实验研究[J]. 中国生化药物杂志, 1999, 20(6): 298-299.
[3] Yamazaki M, Tansho S, Kisugi J, et al. Purification and characterization of a cytolytic protein from purple fluid of the sea hare, Dolabella auricularia. [J]. Chem Pharm Bull (Tokyo), 1989, 37(8): 2179-2182.
[4] Kisugi J, Kamiya H, Yamazaki M. Purification of dolabellanin-C an antineoplastic glycoprotein in the body fluid of a sea hare, Dolabella auricularia [J]. Dev Comp Immunol, 1989,13(1): 3-8.
[5] Yamazaki M. Antitumor and antimicrobial glycoproteins from sea hares [J]. Comp Biochem Physiol C, 1993, 105(2): 141-146.
[6] 严晓丹, 钱建瑛, 许泓瑜, 等. 文蛤不同极性提取物对糖尿病小鼠将血糖作用的研究 [J]. 中国海洋生物, 2015, 34(5): 71-76.
[7] 阎欲晓, 粟桂娇, 李小梅, 等. 文蛤蛋白抗氧化活性肽的研究 [J]. 食品工业科技, 2007, 28(12): 121-123.
[8] 范成成, 张剑, 康劲翮, 等. 文蛤多肽的体外抗癌活性研究 [J]. 台湾海峡, 2009, 28(4): 472-476.
[9] 张剑, 康劲翮, 刘凤娇, 等. 文蛤多肽对体外培养宫颈癌Hela细胞的抑制作用 [J]. 厦门大学学报(自然科学版), 2009, 48(5): 729-732.
[10] 何雅军, 吴谦, 朱瑞斐, 等. 文蛤多糖与文蛤提取物对小鼠免疫调节影响的比较研究 [J]. 广东药学, 1994, (3): 50-53.
[11] 杜正彩, 侯小涛, 黄庆, 等. 文蛤化学成分与药理作用研究进展 [J]. 安徽农业科学, 2014, 42(2): 439-441.
[12] 何雅军, 吴谦, 朱瑞斐. 文蛤提取物对小鼠迟发型超敏反应的双向免疫调节作用 [J]. 中国海洋药物, 1995, 14(3): 20-21.
[13] 冷波, 康劲翮, 贺量, 等. 文蛤多肽对体外培养人肝癌细胞SMMC-7721的抑制作用 [J]. 厦门大学学报(自然科学版), 2007, 46(5): 593-597.
[14] 《药物遗传毒性研究技术指导原则》课题研究组.【ZH】GPT2-1, 药物遗传毒性研究技术指导原则 [S].国家食品药品监督管理局药品审评中心, 2007: 7-10.
[15] 《药物遗传毒性研究技术指导原则》课题研究组.【ZH】GPT2-1, 药物遗传毒性研究技术指导原则 [S].国家食品药品监督管理局药品审评中心, 2007: 24-32.
[16] 袁伯俊, 廖明阳, 李波. 药物毒理学实验方法与技术 [M]. 北京: 化学工业出版社, 2007, 263-271.
[17] 中华人民共和国卫生部,保健食品检验与评价技术规范 [M], 2003, 189-207.
[18] 彭双清, 郝卫东. 药物安全性评价关键计数 [M]. 第1版. 北京: 军事医学科学出版社, 2013, 238-239.
[19] Hori H, Takayanagi T, Kamada Y, et al. Genotoxicity evaluation of sesamin and episesamin [J]. Mutat Res, 2011, 719(1-2): 21- 28.
[20] 黄芳华,王庆利.药物遗传毒性研究评价的技术要求与常见问题 [J]. 中国新药杂志, 2014, 23(18): 2112-2116.
[21] 张广钦, 禹志领, 赵厚长, 等. 文蛤肉水解液降血脂作用的实验研究 [J]. 中国海洋药物, 1997, 16(2): 21-24.
[22] 肖湘, 陈贤裕. 文蛤活性蛋白的分离及体外抗氧化作用 [J]. 中国海洋药物, 2007, 26(6): 24-27.
[23] 张玉艳, 张胜华, 宁璇璇, 等. 文蛤体液蛋白体内外抗肿瘤作用的研究 [J]. 中国新药杂志, 2009, 18(18): 1787-1792.
[24] Leng B, Liu XD, Chen QX. Inhibitory effects of anticancer peptide from Mercenaria on the BGC-823 cells and several enzymes [J]. FEBS Lett. 2005, 579 (5): 1187 -1190.
[25] 袁强,袁弘.文蛤多糖对小鼠调节血糖和抗应激功能的影响 [J]. 中国现代应用药学杂志, 2007, 24(2): 113-114.
Mutagenicity evaluation of the hydrolysate ofMeretrixmeretrixLinnaeus soft tissue
GAO Mei, CAO Chong, WANG Gong-xia, TANG Lian-sheng, JIA Qing-wen
(Shandong Academy of Pharmaceutical Sciences, Shandong Provincial Key Laboratory of Chemical Drugs, Jinan 250101, China)
Objective To evaluate the mutagenicity of hydrolysate ofMeretrixmeretrixLinnaeus soft tissue, so as to provide experimental basis for its exploitation. Methods Three mutagenicity tests were used to evaluate the mutagenic effects, including Ames test, CHL chromosome aberration assay and bone marrow micronucleus assay in mice. Results In Ames test, the revertant colonies numbers in each group were twice less than the numbers of spontaneous revertant colonies, five bacterial strains showed negative results with or without S9 activation, and the result of Ames test was negative. The CHL chromosome aberration assay and bone marrow micronucleus assay showed that the chromosome aberration rate and micronucleus rate of each dose group showed no significant difference compared with the negative control group, respectively (P>0.05). Conclusions Under this condition, the results show that all of the Ames test, chromosome aberration assay and bone marrow micronucleus assay are negative, and no mutagenicity is observed in the hydrolysate ofMeretrixmeretrixLinnaeus soft tissue.
Meretrix Meretrix Linnaeus; Mutagenicity; Ames test; Chromosome aberration assay; Micronucleus assay
GAO Mei. E-mail: gaomei729@163.com
山东省自主创新及成果转化专项(项目编号:2014ZZCX02104)。
高梅(1983-),女,硕士研究生,主管药师,研究方向:药物安全性评价,E-mail: gaomei729@163.com
研究报告
Q95-33
A
1005-4847(2016)05-0521-05
10.3969/j.issn.1005-4847.2016.05.015
2016-02-29

