异丙酚对大鼠抑郁模型电休克治疗后认知功能和海马Glu浓度及Tau蛋白磷酸化程度的影响
姚柱炜 蒙剑锋 栾宏权
广东深圳市龙岗区第五人民医院神经外科 深圳 518111
·论著·
异丙酚对大鼠抑郁模型电休克治疗后认知功能和海马Glu浓度及Tau蛋白磷酸化程度的影响
姚柱炜 蒙剑锋△栾宏权
广东深圳市龙岗区第五人民医院神经外科 深圳 518111
目的 探讨异丙酚对电休克治疗后抑郁大鼠认知功能及海马Glu浓度和Tau蛋白磷酸化的影响。方法 选择雌性SD(Sprague Dawley)大鼠建立大鼠抑郁模型,利用旷场试验选择得分30~80分大鼠20只,随机分为4组(n=5):A组注射生理盐水,B组给予异丙酚,C组给予电休克治疗,D组给予电休克和异丙酚注射联合处理,E组正常小鼠,注射生理盐水。处理后3 d进行Morris水迷宫试验,记录逃避潜伏期(s)、经过原平台位置次数(次)、原平台所在象限停留时间(s)。随后检测海马Glu浓度和Tau蛋白磷酸化程度。结果 与A组相比较,C组逃避潜伏期(s)延长、经过原平台位置次数(次)、原平台所在象限停留时间(s)减少,海马Glu浓度和Tau蛋白磷酸化程度增高(P<0.05);与C组相比,D组逃避潜伏期(s)缩短,经过原平台位置次数(次)、原平台所在象限停留时间(s)增加,海马Glu浓度和Tau蛋白磷酸化程度减低(P<0.05)。结论 ECT通过增高Glu浓度促进Tau蛋白磷酸化,影响抑郁大鼠认知功能,而异丙酚可以调节ECT引起的Glu浓度和Tau蛋白磷酸化程度,进而改善大鼠认知功能。
异丙酚;电休克疗法;认知功能;谷氨酸;Tau蛋白
神经外科手术后导致的认知功能障碍仍困扰着广大临床医生。术后抑郁症主要影响患者的海马结构。对于一些精神障碍患者,电休克疗法(electroconvulsive therapy,ECT)是有效的躯体干预治疗方式,但同时也可导致神经心理功能障碍等不良反应。目前我们已知Tau 蛋白和Glu都是重要的神经递质,对认知功能的调节受自身磷酸化程度和突触间隙剂量影响[1-2]。ECT治疗后的患者出现认知功能障碍机制有多种,其中包括诱导Glu过度释放,诱导Glu依赖的LTP过程[3],而N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR)拮抗剂则可以避免ECT引起的LTP抑制作用,阻断Glu大量释放造成的GluR过度兴奋[2,4]。在此我们通过构建抑郁后ECT大鼠模型,检测大鼠海马Glu浓度和Tau蛋白磷酸化程度,探讨异丙酚是否通过影响Glu浓度调节Tau蛋白磷酸化程度,并用水迷宫评价是否影响大鼠认知功能。
1 材料与方法
1.1 实验材料 Harvard啮齿类动物ECT仪,上海移数信息科技有限公司的Morris水迷宫(中国),AstraZeneca公司的异丙酚(意大利);实验动物:清洁级(国家标准GB:14925-2001)雌性SD(Sprague Dawley)大鼠,鼠龄24周,体质量(275±25)g。
1.2 方法
1.2.1 制作大鼠抑郁模型:将大鼠各自单独饲养于一笼,用轻度慢性不可刺激构建大鼠抑郁模型。以1次/s的频率在水平方向摇晃鼠笼,共15 min;持续1 d将鼠笼倾斜45°;用夹子夹鼠尾1 min;1 d内不予饮水、进食;在45 ℃热水中、4 ℃冰水中游泳5 min;1 d内将大鼠处于白天无光、夜间灯照环境使其昼夜颠倒;予1 d潮湿垫料,每天给予不同刺激,相邻两天不用同种刺激,共28 d。适应性培养1周后在20:00点进行旷场试验,大鼠在旷箱内四肢全落在1个格子里视为水平活动1次,反映其活动度,为水平计分,两爪腾空或爬在箱壁上视为竖直活动1次,反映大鼠好奇程度,为竖直计分。2次/周,共1周。2次结果取平均值,选水平得分和垂直得分的总分30~80分的大鼠20只[5]。
1.2.2 动物分组:利用随机分组方法将模型动物分成4组,A组予生理盐水经腹腔注射,B组予异丙酚经腹腔注射,C组进行电休克处理,D组予异丙酚经腹腔注射后行电休克治疗,E组为正常大鼠作对照并注射生理盐水。B、D组注射异丙酚80 mg/kg,A、C、E组均予等体积生理盐水。先行腹腔药物注射后行ECT,在C、D组大鼠双耳上夹休克仪电极(正弦波,50 mA,50 Hz),通电1 s诱使大鼠出现强直-阵挛抽搐发作,A、B、E组大鼠双耳夹电极但不通电。各组处理均1次/d,7 d,于15:00~17:00进行。
1.2.3 水迷宫试验:利用Morris水迷宫试验对大鼠认知功能进行评价。圆柱形恒温水池作为水迷宫,将水池分为4个象限,以方向为坐标(NE、SE、NW和SW),NE象限中央水面下1 cm放置平台。池壁池水均为黑色,水温24~25 ℃,室内避光、安静,各物品摆放位置固定。定位航行试验,共6 d,每天在固定时间段行4次试验。背向池壁将大鼠随机从各个象限放入水池,2 min内记录大鼠寻到平台的时间,若2 min后大鼠仍未寻到平台则引导大鼠至平台,并记为120 s,此即为水迷宫试验逃避潜伏期(s)、原平台所在象限停留时间(s),同时记录经过原平台位置次数(次)。将后3 d结果取平均值用于大鼠记忆功能的评估。每次实验完后擦干大鼠并休息3 min,随后进行第2次实验。空间探索实验第7天撤去平台,背向池壁从距离平台最远处将大鼠放入水中,1 min内记录大鼠逃避潜伏期(s)、原平台所在象限停留时间(s)、经过原平台位置次数(次)。
1.2.4 大鼠海马取材:水迷宫试验完成后,经腹腔注射1%戊巴比妥使大鼠麻醉,并迅速断头取出双侧海马组织,右侧海马组织固定于10%多聚甲醛中,左侧海马组织先称质量,随后将1 mL甲醇-水离心液加入,在低温下搅拌并获得匀浆,控制温度在4 ℃时取部分匀浆液以10 000 r/min转速离心15 min,离心后分离获取上清,并行进一步过滤后在-80 ℃低温下保存。以μg·g-1作为单位计算组织中的含量。
1.2.4.1 海马Glu浓度测定:仪器及试剂:Eppendof公司的centrifuge5810R低温高速离心机,Waters公司的HPLC色谱系统;Dima公司的C18-ODS色谱柱。流动相A、B分别为0.1 mol/L醋酸钾及甲醇。采用二元梯度洗脱方法,洗脱步骤为:(T,B%)(0,45%)(1,65%)(6,75%)(20,45%),其中T代表时间(单位:min),B%代表B流动相占总洗脱过程百分比。利用孔径为0.45 μm的微孔过滤膜过滤流动相,随后用超声脱气。流速为1.0 mL/min,所激发的波长为250 nm,发射的波长为410 nm,并根据Glu峰面积进行定量估算。制备标准液:标准溶液为100 μmol·L-1,采用Glu标准品制备而成,并在稀释后测定。制备衍生化试剂:将20 mg OPA加至500 μL甲醇中并在超声作用下溶解,随后将500 μL β-巯基乙醇加入,最后再加入pH 10.0的硼酸缓冲液9 mL,避光并密封,保存温度在0~4 ℃。衍生及分析:将100 μL标准液和100 μL衍生化试剂加至EP管中予2 min反应时间,随后进样20 μL。
1.2.4.2 海马Tau蛋白磷酸化程度测:通过免疫组化方法测定右侧海马组织中Tau蛋白磷酸化程度。行脱水透明、浸蜡包埋、切片(4 μm)、二甲苯脱蜡后用抗ptau-Ser202多克隆抗体,抗ptau-Ser396单克隆抗体(1:200)进行免疫组化染色,任意选择3张切片,在每张切片选择CA1区、CA2区的随机5个视野,用Image-Pro plus 6.0软件分析阳性细胞平均吸光度值,去除各区5个视野中的最大值、最小值,计算剩余数的平均值,通过均值评价Tau-Ser202、Tau-Ser396磷酸化水平。

2 结果
2.1 大鼠学习记忆功能改变 处理后各组大鼠水迷宫试验结果见表1。相较于A组,C、D组逃避潜伏期(s)延长,原平台所在象限停留时间(s)及经过原平台位置次数(次)减少(P<0.05);相较于C组,D组逃避潜伏期(s)缩短,原平台所在象限停留时间(s)及经过原平台位置次数(次)增多(P<0.05)。
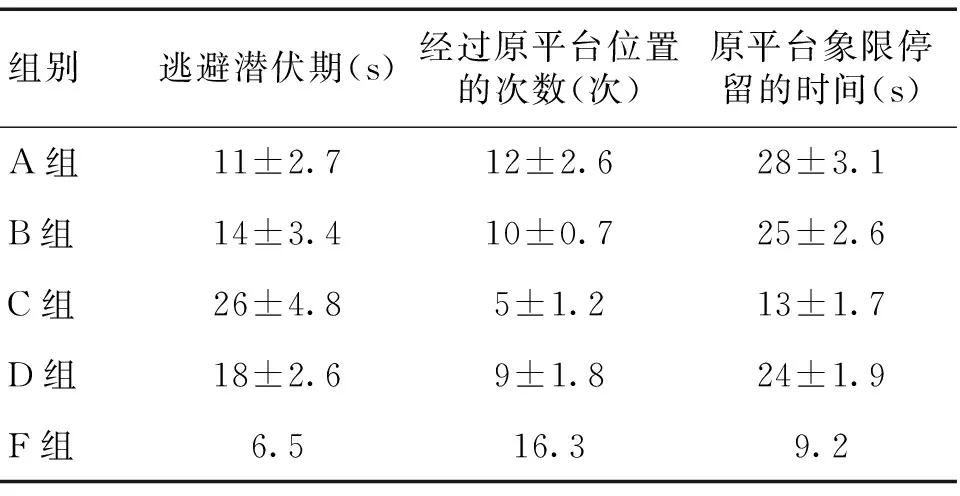
表1 各组Morris水迷宫试验结果
2.2 海马Glu浓度测定 A组Glu浓度51±11.2,B组为63±9.5,C组为170±21.4,D组为94±17.8,F组为72.6,C、D组海马内Glu浓度较A组高(P<0.05);而D组海马内Glu浓度又较C组低(P<0.05)。
2.3 海马Tau蛋白磷酸化程度改变 与A组相比,用ECT处理后的C组Tau蛋白磷酸化(ptau-ser202、ptau-ser396)水平升高(P<0.05);与C组相比,D组Tau蛋白磷酸化(ptau-ser202、ptau-ser396)水平降低(P<0.05)。见表2。

表2 海马Tau蛋白磷酸化程度,平均吸光度值)
3 讨论
Tau 蛋白是Weingarlen等[6]于1975年发现的在微管组装过程中发挥重要作用的糖蛋白,同时也是重要的记忆相关蛋白。目前大量研究表明,Tau蛋白过度磷酸化可导致神经元异常放电,使得微管组装过程受阻,引起微管破坏、神经毒性等,亦是阿尔兹海默病的早期事件[7]。Glu作为一种重要的兴奋性神经递质,其过度活化能引起胞内Ca2+超载,进而导致神经元变性死亡[8],此外,尚能使多种蛋白激酶的活性受抑制,如Akt,而Akt通过一系列信号通路又能参与Tau蛋白磷酸化程度的调控[9]。ECT治疗术后引起的认知功能障碍仍是目前神经外科术后值得关注的问题,本实验中C组Glu浓度和Tau蛋白磷酸化程度与A组相比明显升高,认知功能也明显降低。因此,我们认为,ECT等应激可引起Glu过度活化,一方面,其兴奋性毒性经一系列信号过程直接损伤神经元;另一方面,通过促进Tau蛋白磷酸化也可导致神经元损伤,进而影响到机体认知功能。
Vossel等[10]发现,过度激活NMDAR可通过活化GSK-3β、酪蛋白激酶2等增加Tau磷酸化程度,从而导致神经元受损。而NMDAR拮抗剂可与GluR结合进而减轻Glu与其受体结合引起的过度兴奋性反应,有研究表明NMDAR拮抗剂可显著抑制冷水应激引起的磷酸化Tau蛋白水平升高[11-12]。本实验数据表明,与A组大鼠相比,C组海马出现Glu浓度增高,Tau蛋白磷酸化程度明显增高(P<0.05),而与C组相比,D组Glu浓度和Tau蛋白磷酸化程度又有明显降低(P<0.05)。提示异丙酚作为NMDAR拮抗剂一种,可降低ECT引起的海马Glu浓度增高,进而下调Tau蛋白磷酸化水平,实现对认知功能的改善。但Veaelis等[13]研究表明,异丙酚本身对病人的认知功能亦有一定损伤,陈静等[14]实验亦发现异丙酚能够下调海马神经元内NF-κB活性及增加胞内Ca2+浓度,进而引起神经元损伤。本实验还发现,与A组相比,B组认知功能并未得到明显改善,同时Glu浓度和Tau蛋白磷酸化程度也未明显下降,提示异丙酚本身并不会改善大鼠认知功能,这点在黎平等[15]和Dong等[16]实验中亦有证实。因此,ECT通过增高Glu浓度促进Tau蛋白磷酸化,进而影响抑郁大鼠认知功能,而异丙酚可以调节ECT后引起的Glu浓度和Tau蛋白磷酸化程度,进而改善大鼠认知功能。
本研究选择轻微慢性不可逆刺激构建大鼠抑郁模型,一方面可以避免嗅球切除模型中可能出现的手术应激和其余脑组织损伤;另一方面,耗时长,费时费力。利用旷场试验评价建模是否成功,Morris水迷宫试验用于评价大鼠认知功能,选择逃避潜伏期、经过原平台位置次数、原平台所在象限停留时间作为评价指标,是大鼠模型中常用的试验。
[1] Kopeikina KJ,Carlson GA,Pitstick R,et al.Tau accumulation causes mitochondrial distribution deficits in neurons in a mouse model of tauopathy and in human Alzheimer's disease brain[J].Am J Pathol,2011,179(4):2 071-2 082.
[2] Allyson J,Dontigny E,Auberson Y,et al.Blockade of NR2A-containing NMDA receptors induces Tau phosphorylation in rat hippocampal slices[J].Neural Plast,2010,2010:340 168.
[3] Andrade C,Singh NM,Thyagarajan S,et al.Possible glutamatergic and lipid signalling mechanisms in ECT-induced retrograde amnesia:experimental evidence for involvement of COX-2,and review of literature[J].J Psychiatr Res,2008,42(10):837-850.
[4] De Calignon A,Fox LM,Pitstick R,et al.Caspase activation precedes and leads to tangles[J].Nature,2010,464(7 292):1 201-1 204.
[5] 孙世光,王婧婧,李自发,等.旷场实验:昆明小鼠行为学评价方法的重测信度检验[J].中华行为医学与脑科学杂志,2010,19(12):1 093-1 095.
[6] Weingarten MD,Lockwood AH,Hwo SY,et al.A protein factor essential for microtubule assembly[J].Proc Natl Acad Sci U S A,1975,72(5):1 858-1 862.
[7] 陈琛,张中豪,吴秋艳.APP/tau/PS1三转基因阿尔茨海默病小鼠行为学、炎症反应及自噬水平的研究[J].中华神经医学杂志,2015,14(2):119-124.
[8] Liu Z,Li H,Zhang W,et al.Neuregulin-1beta prevents Ca(2+)overloading and apoptosis through PI3K/Akt activation in cultured dorsal root ganglion neurons with excitotoxicity induced by glutamate[J].Cell Mol Neurobiol,2011,31(8):1 195-1 201.
[9] Lehtihet M,Webb DL,Honkanen RE,et al.Glutamate inhibits protein phosphatases and promotes insulin exocytosis in pancreatic beta-cells[J].Biochem Biophys Res Commun,2005,328(2):601-607.
[10] Vossel KA,Zhang K,Brodbeck J,et al.Tau reduction prevents Abeta-induced defects in axonal transport[J].Science,2010,330(6 001):198.
[11] Ying WF,Feng Q,Cheng M,et al.The Activation of Excitatory Amino Acid Receptors Is Involved in tau Phosphorylation Induced by Cold Water Stress[J].Prog Biochem Biophys,2010,37(5):510-516.
[12] Petroni D,Tsai J,Mondal D,et al.Attenuation of low dose methylmercury and glutamate induced-cytotoxicity and tau phosphorylation by an N-methyl-D-aspartate antagonist in human neuroblastoma(SHSY5Y)cells[J].Environ Toxicol,2013,28(12):700-706.
[13] Veselis RA,Reinsel RA,Feshchenko VA,et al.Information loss over time defines the memory defect of propofol:a comparative response with thiopental and dexmedetomidine[J].Anesthesiology,2004,101(4):831-841.
[14] 陈静,利莉,梁羽冰,等.异丙酚对胎鼠离体海马神经元钙离子浓度和NF-κB活性的影响[J].中华麻醉学杂志,2014,34(3):286-289.
[15] 黎平,闵苏,魏珂,等.异丙酚联合电休克治疗对抑郁大鼠行为学和学习记忆功能的影响[J].中华麻醉学杂志,2007,27(10):940-943.
[16] Dong J,Min S,Wei K,et al.Effects of electroconvulsive therapy and propofol on spatial memory and glutamatergic system in hippocampus of depressed rats[J].J ECT,2010,26(2):126-130.
(收稿2015-10-02)
The impact of propofol on cognitive function and Glu concentration and extent of Tau phosphorylation in depressed rats after electroconvulsive therapy
YaoZhuwei,MengJiangfeng,LuanHongquan
DepartmentofNeurosurgery,LonggangDistrictFifthPeople'sHospitalofShenzhen,Shenzhen518000,China
Objective To discuss the impact of propofol on cognitive function,Glu concentration and extent of Tau phosphorylation in depressed rats after electroconvulsive therapy. Methods Female Sprague Dawley (SD) rats were selected to establish depression model and field test was used to select 20 rats,with scores 30 to 80.These SD rats were divided them into four groups randomly (n=5):A group injected with saline;B group injected with propofol;C group treated with ECT;D group treated with ECT and propofol;E group selected normal rats in contrast and injected with saline. Three days after treatment,Morris water maze test was used to record escape latency(s),the number of passing by the original platform position,the residence time of the original platform quadrant(s),then Glu concentration and extent of Tau phosphorylation were also determined by relevant experiments. Results Compared to A group,the escape latency(s) prolonged,the number of passing by the original platform position,the residence time of the original platform quadrant(s) reduced,Glu concentration and extent of Tau phosphorylation in hippocampus raised in C group (P<0.05);compared to C group,the escape latency(s) reduced,the number of passing by the original platform position,the residence time of the original platform quadrant (s) raised,Glu concentration and extent of Tau phosphorylation in hippocampus reduced in D group (P<0.05). Conclusion ECT can promote Tau phosphorylation through rising Glu concentration,and then influence cognitive function of depressed rats. Propofol can regulate Glu concentration and Tau phosphorylation that aroused by ECT,and then improve cognitive function of depressed rats.
Propofol;Electroconvulsive therapy;Cognitive function;Glu;Tau
深圳市科技计划(JCYJ20150331095655740)
R-332
A
1673-5110(2016)19-0001-03
△通讯作者:蒙剑锋,深圳市龙岗区第五人民医院神经外科,副主任医师,Email:szmengjianfeng@sina.com

