5—氟尿嘧啶对小麦、白菜和水稻生理生化特性的影响
李威+恽烨+张银龙
摘要:在前期获得5氟尿嘧啶对小麦、白菜和水稻种子萌发的急性毒性数据的基础上,研究5-氟尿嘧啶(2.5~100 mg/kg)对小麦、白菜和水稻幼苗叶片中叶绿素、可溶性蛋白和主要抗氧化酶活性的影响。结果表明,短时间暴露时(7 d),5-氟尿嘧啶对3种作物幼苗叶片中叶绿素和可溶性蛋白含量表现为低浓度促进高浓度抑制,超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性也受到不同程度的诱导,对5-氟尿嘧啶表现出一定的抗性;长时间暴露时(21 d),3种作物幼苗叶片中叶绿素和可溶性蛋白含量下降,与5-氟尿嘧啶浓度表现出明显的剂量-效应关系,SOD、POD和CAT活性也不同程度地受到了抑制,抗氧化防御功能降低。本研究结果可为环境中5-氟尿嘧啶的生态风险评估提供基础数据。
关键词:5-氟尿嘧啶;生理生化;叶绿素;可溶性蛋白;抗氧化酶
中图分类号: X820.4 文献标志码: A
文章编号:1002-1302(2016)09-0465-04
随着现代环境分析技术水平的提高,药品类污染物在环境中的频繁检出引起了科学工作者对其生态风险的广泛关注[1-2]。5-氟尿嘧啶(5-fluorouracil)是一种常用的抗癌药,主要用于乳腺癌和消化系统癌等癌症的治疗。5-氟尿嘧啶经注射或口服进入人体后,60%~90%可被人体代谢排出,剩余10%~40%则以母体化合物的形式进入医院废水或市政废水中[3]。根据资料预测,污水处理厂出水中5-氟尿嘧啶的浓度可达到23 mg/L[4]。而且,随着门诊病人的增多,水环境中的抗癌药浓度有升高的趋势[5],因此5-氟尿嘧啶的生态毒性效应逐渐受到重视。
已有不少学者研究了5-氟尿嘧啶对不同的生物的生态毒性效应。如Zounkova等研究发现,5-氟尿嘧啶对恶臭假单胞菌生长(Pseudomonas putida)的EC50值为0.027 mg/L,对近头状伪蹄形藻(Pseudokirchneriella subcapitata)的EC50值为0.11 mg/L,对绿藻(Desmodesmus subspicatus)的EC50值为48 mg/L,对大型蚤的EC50值为36 mg/L[6-7]。Deyoung等发现5-氟尿嘧啶对黑头呆鱼(Pimephales promelas)生长的EC50值为400 mg/L[8]。恽烨等研究发现5-氟尿嘧啶对小麦(Triticum aestivum)、白菜(Brassica pekinensis)和水稻(Oryza sativa)种子的根伸长半数抑制浓度分别为212.80、102.53、13.30 mg/L[9]。
现有的生态毒性数据表明,5-氟尿嘧啶不太可能引起急性毒性效应,但是生物长期暴露于低浓度的抗癌药胁迫中,是否会引起生理生化等方面的影响还未可知。因此,本试验以小麦、白菜和水稻为受试生物,通过研究低浓度5-氟尿嘧啶长期胁迫对小麦、白菜、水稻的叶绿素和抗氧化酶系统的影响,为5-氟尿嘧啶的生态风险评价提供基础数据。
1 材料与方法
1.1 试验材料
试验药品5-氟尿嘧啶纯度为99%,购于北京百灵威科技有限公司。
供试种子为小麦(Triticum aestivum),偃展4110;白菜(Brassica pekinensis),青杂改良三号;水稻(Oryza. sativa),抗优818。供试种子均购自南京金盛达种子公司。
供试土壤采自南京林业大学北大山0~20 cm表土(修休耕地,未受人为污染,属于清洁土壤),pH值为7.23,有机质含量为2.86%,总氮、总磷、总钾的含量分别为1.36、0.02、3.20 mg/kg。
1.2 幼苗生理生态毒性试验
称取200 g风干土壤于95 mm×60 mm×70 mm(上口直径×下底直径×高)的塑料花盆中(盆底铺1层滤纸),采用土壤染毒法将配制好的5-氟尿嘧啶溶液按水土比1 ∶5投加到土壤中,置于恒温光照培养箱中,(25±1) ℃下暗平衡48 h。选取饱满、均匀的小麦、白菜和水稻种子,灭菌消毒后用镊子播种于土壤中,每盆15粒种子,调节水土比1 ∶5,置于恒温光照培养箱中培养,光—暗周期为12 h—12 h,恒温(25±1) ℃,早晚各浇水1次。5-氟尿嘧啶试验浓度为2.5、5.0、10.0、50.0、100.0 mg/kg,同时设置空白对照,每个处理3组平行,在培养的7、14、21 d分别采样进行分析测定。
1.3 生理生化指标测定方法
叶绿素(Chlorophyll,Chl)的测定采用95%乙醇浸提法[10]。称取0.05 g作物幼苗叶片剪碎至刻度试管中,加入10 mL 95%乙醇,使叶片完全浸入,加盖放在暗处浸提至叶片完全变白时用分光光度计分别在665、649 nm测定浸提液的吸光度,根据公式(1)和(2)分别计算叶绿素a和叶绿素b的浓度(mg/g)。
称取0.1 g作物幼苗的叶片在预冷的磷酸缓冲溶液(50 mmol/L NaH2PO4·Na2HPO4,pH值7.8,加1%聚乙烯吡咯烷酮)中匀浆,4 ℃下13 000 r/min离心30 min,上清液即为提取液[11]。可溶性蛋白(SP)含量测定采用考马斯亮蓝染色法[12];超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)光化学还原反应法[10];过氧化物酶(POD)活性测定采用愈创木酚法[10];过氧化氢酶(CAT)活性采用紫外吸收法[13]。
1.4 数据分析与处理
采用SPSS 16.0 和Excel对试验数据进行统计分析及作图,试验结果采用平均值±标准差表示。对试验数据进行LSD多重比较,统计显著性水平为P<0.05。
2 结果与分析
2.1 5-氟尿嘧啶对3种作物幼苗叶片中叶绿素含量的影响
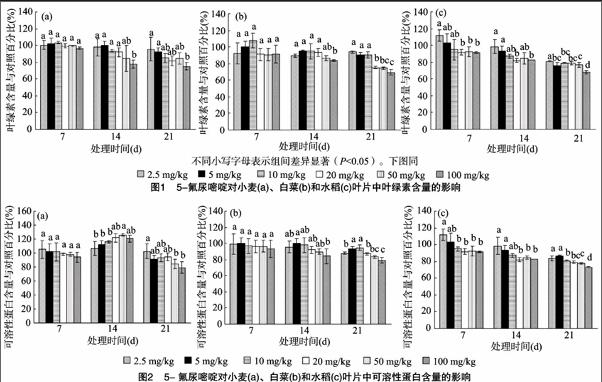
不同浓度5-氟尿嘧啶对小麦、白菜和水稻的叶绿素含量的影响见图1。暴露7 d时,3种作物叶片中叶绿素含量下降不明显,与对照组百分比均大于90%,且在个别低浓度出现了一定的促进作用,如5-氟尿嘧啶浓度为10 mg/kg时,小麦和白菜叶绿素含量分别高出对照组3.5%、7.8%。小麦和白菜各5-氟尿嘧啶处理组间在7 d时无显著性差异,但水稻组间有显著性差异(P<0.05)。随着暴露时间的延长,小麦、白菜和水稻叶片中叶绿素含量随5-氟尿嘧啶浓度的升高而显著下降。暴露14 d时,高浓度处理组与低浓度处理组间有显著性差异,当5-氟尿嘧啶浓度为5 mg/kg和100 mg/kg时,小麦叶片叶绿素含量抑制率分别为0.3%和21.9%,白菜叶片叶绿素含量抑制率分别为4.7%和16.7%,水稻叶片叶绿素含量的抑制率分别为6.7%和17.5%。暴露21 d后,5-氟尿嘧啶对叶绿素的抑制效应更加显著,小麦、白菜和水稻在100 mg/kg 处理下分别低于对照组25.0%、30.5%、32.0%,各处理组间均有显著差异,5-氟尿嘧啶对作物叶片叶绿素含量表现明显的剂量-效应关系。
2.2 5-氟尿嘧啶对3种作物幼苗叶片中可溶性蛋白含量的影响
5-氟尿嘧啶对小麦、白菜和水稻叶片可溶性蛋白含量的影响见图2。暴露7 d时,不同浓度的5-氟尿嘧啶对小麦和白菜可溶性蛋白含量没有明显影响,各处理组间均无显著性差异;低浓度的5-氟尿嘧啶促进了水稻可溶性蛋白含量增加,高浓度的5-氟尿嘧啶则明显抑制了可溶性蛋白含量增加,低浓度处理组与高浓度处理组有显著性差异,5-氟尿嘧啶浓度为5 mg/kg 和100 mg/kg时,水稻叶片中可溶性蛋白的含量分别为对照组的103.2%和91.1%。暴露时间延长到14 d时,5-氟尿嘧啶各处理组都促进了小麦叶片中可溶性蛋白的含量,而对白菜叶片中的可溶性蛋白则表现为抑制作用,组间存在显著性差异(P<0.05)。随着暴露时间延长至21 d时,5-氟尿嘧啶对3种作物幼苗叶片中的可溶性蛋白合成均有抑制作用,处理组间有显著性差异(P<0.05);当5-氟尿嘧啶处理浓度为100 mg/kg时,对小麦、白菜和水稻可溶性蛋白含量的抑制率分别为20.9%、20.8%、26.8%。
2.3 5-氟尿嘧啶对3种作物幼苗抗氧化酶活性的影响
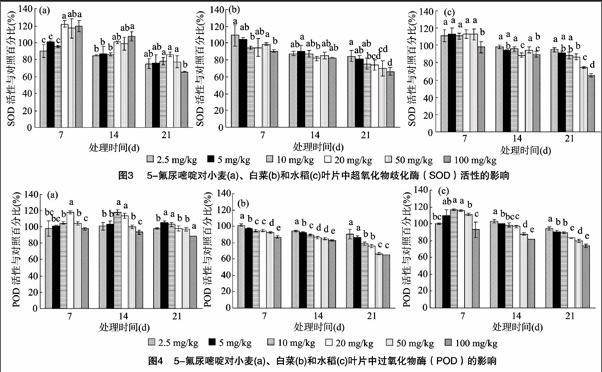
5-氟尿嘧啶对小麦、白菜和水稻3种作物幼苗叶片中SOD活性的影响如图3所示。在暴露时间7、14 d时,小麦叶片中SOD的含量随5-氟尿嘧啶浓度增加而有升高的趋势;暴露21 d时,小麦叶片中SOD的含量则表现为先升高后降低的趋势,处理组间存在显著性差异(P<0.05)。对于同一暴露浓度而言,小麦叶片中SOD含量随暴露时间的延长而降低,如在5-氟尿嘧啶浓度为50 mg/kg时,暴露7、14、21 d后,小麦叶片中SOD活性与对照组的百分比分别为117.2%、98.6%、77.5%。白菜和水稻叶片中SOD活性表现出了与小麦不同的变化规律。暴露7 d时,低浓度的5-氟尿嘧啶促进了白菜和水稻叶片中的SOD活性,而高浓度的5-氟尿嘧啶则抑制了其活性,各处理组间具有显著性差异(P<0.05)。暴露14、21 d 后,白菜和水稻叶片的SOD活性抑制率总体表现为随5-氟尿嘧啶浓度增加而增加,如10、100 mg/kg 的5-氟尿嘧啶暴露21 d后,白菜叶片中SOD活性抑制率分别为24.4%、33.6%;水稻叶片中SOD活性抑制率分别为11.6%、34.9%。
5-氟尿嘧啶对小麦、白菜和水稻幼苗叶片中POD活性的影响见图4。在不同暴露时间下,小麦叶片的POD活性均随着5-氟尿嘧啶浓度的升高先上升后下降,变化接近于“钟形”,且组间有显著性差异(P<0.05)。白菜叶片中POD活性则随着5-氟尿嘧啶的浓度升高和暴露时间的延长而降低,且组间具有显著性差异(P<0.05),当5-氟尿嘧啶浓度从2.5 mg/kg 增加到100 mg/kg,白菜叶片中POD活性抑制率在暴露14 d时从5.7%增加到17.3%,暴露21 d时由29.5%增加到34.5%。水稻暴露7 d时,POD的活性变化与小麦类似,即随5-氟尿嘧啶浓度的升高先上升后下降,后随时间延长,其POD活性与5-氟尿嘧啶浓度表现出负相关,组间存在显著性差异(P<0.05)。
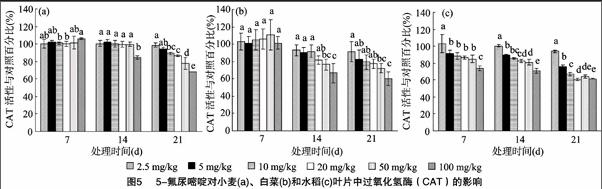
5-氟尿嘧啶对小麦、白菜和水稻幼苗叶片中CAT活性的影响如图5所示。小麦暴露7、14 d时,除100 mg/kg 5-氟尿嘧啶处理组外,CAT活性与对照组相近,受5-氟尿嘧啶影响不大。但暴露21 d时,小麦叶片中CAT活性则与5-氟尿嘧啶浓度之间呈现显著的负相关关系,其抑制率由5-氟尿嘧啶处理浓度为2.5 mg/kg的1.5%增加至100 mg/kg时的32.4%,增加了30.9百分点。白菜暴露7 d时,5-氟尿嘧啶对其叶片中CAT活性无显著影响。当暴露时间延长到14、21 d时,白菜叶片中CAT活性的抑制率随5-氟尿嘧啶浓度升高逐渐减低,且组间存在显著性差异(P<0.05)。水稻叶片中CAT活性随5-氟尿嘧啶浓度升高和暴露时间延长表现为降低的趋势,当5-氟尿嘧啶浓度为5 mg/kg时,暴露7、14、21 d后,水稻叶片中CAT活性的抑制率分别为8.7%、10.4%、24.5%;当5-氟尿嘧啶浓度为100 mg/kg时,水稻叶片中CAT活性的抑制率分别为25.9%、29.0%、38.7%。
3 讨论与结论
叶绿素含量是反映光合强度的重要指标,可以作为判断植物光合生理能力、反映环境胁迫状况的依据[14]。在本研究中,低浓度的5-氟尿嘧啶(<10 mg/kg)短时间暴露时对3种作物叶片的叶绿素含量有一定的激活作用,但高浓度的5-氟尿嘧啶和较长的暴露时间都使得作物叶片中的叶绿素含量降低,说明5-氟尿嘧啶影响了小麦、白菜和水稻的光合作用过程。这可能是因为在污染物的胁迫下,捕光叶绿素a/叶绿素b结合蛋白(Chl a/b-Pro)合成的转录过程受到抑制,而且初期形成的叶绿素单体也被光氧化分解,导致光捕获化合物的形成受到影响,从而影响叶绿素的积累[15-16]。
可溶性蛋白含量是植物体内代谢过程中蛋白质损伤的重要指标,其变化可以反映细胞的蛋白质合成、变性及降解等多方面的信息[17]。当植物适应其生长环境进入旺盛的生长期后,各种代谢活动旺盛,可溶性蛋白的合成能力也有所增强。但是在有机物、重金属以及寒旱等胁迫下,植物体内的可溶性蛋白含量可能会下降[13,18]。本研究中,短时间低浓度的5-氟尿嘧啶暴露可以诱导小麦、白菜和水稻幼苗中可溶性蛋白的合成,但是高浓度的5-氟尿嘧啶暴露则抑制了3种作物叶片中可溶性蛋白的合成,特别是高浓度5-氟尿嘧啶(≥20 mg/kg)处理21 d时,3种作物幼苗叶片中可溶性蛋白含量显著下降。
有机物、重金属污染以及干旱等不利环境条件或导致植物体内H2O2和O-2· 等活性氧物质的增多,植物的抗氧化防御体系则能去除或降低活性氧物质的含量[19]。SOD、POD和CAT是生物体抗氧化防御系统中典型的抗氧化酶,它们的活性变化间接指示了机体内的氧化胁迫强度。SOD能将O-2· 转化成O2和H2O2,抑制高活性·OH等自由基的形成,防止活性氧物质积累对植物体的危害。在本研究中,低浓度的5-氟尿嘧啶短时间暴露时,小麦、白菜和水稻叶片中SOD活性有升高现象,可能是由于植物体内活性氧物质积累,激活本身存在的SOD酶或者通过诱导酶蛋白编码基因的表达而激活机体本身合成新的 SOD[20]。POD和CAT是消除H2O2的重要酶类,它们可以协同作用将SOD歧化自由基的产物H2O2转化为H2O和O2[17]。在暴露时间较短时,作物叶片中的POD和CAT的活性也受到一定程度的诱导,这与SOD诱导产生H2O2的量下降存在一定关系。抗氧化酶活性的启动说明3种作物都具有一定的抵抗氧化胁迫的能力。随着暴露时间延长,小麦、白菜和水稻叶片中SOD、POD和CAT活性主要呈现下降趋势,说明5-氟尿嘧啶胁迫超过了植物细胞的耐受限度,抗氧化酶活性受到抑制,自身的抗氧化防御功能降低。
参考文献:
[1]Fent K,Weston A A,Caminada D. Ecotoxicology of human pharmaceuticals [J]. Aquatic Toxicology,2006,76(2):122-159.
[2]Santos L H M L M,Araújo A N,Fachini A,et al. Ecotoxicological aspects related to the presence of pharmaceuticals in the aquatic environment [J]. Journal of Hazardous Materrials,2010,175(1/2/3):45-95.
[3]Straub J O. Combined environmental risk assessment for 5-fluorouracil and capecitabine in Europe[J]. Integrated EnvironmentalAssessment and Management,2009,6(S1):540-566.
[4]Johnson A C,Jurgens M D,Williams R J,et al. Do cytotoxic chemotherapy drugs discharged into rivers pose a risk to the environment and human health? An overview and UK case study [J]. Journal ofHydrology,2008,348(1/2):167-175
[5]Besse J P,Latour J F,Garric J. Anticancer drugs in surface waters what can we say about the occurrence and environmental significance of cytotoxic,cytostatic and endocrine therapy drugs? [J].Environmental International,2012,39(1):73-86.
[6]Zounkova R,Odraska P,Dolezalova L,et al. Ecotoxicity and genotoxicity assessment of cytostatic pharmaceuticals [J]. Environmental Toxicology and Chemistry,2007,26(10):2208-2214.
[7]Zounkova R,Kovalova L,Blaha L,et al. Ecotoxicity and genotoxicity assessment of cytotoxic antineoplastic drugs and their metabolites[J]. Chemosphere,2010,81(2):253-260.
[8]Deyoung D J,Bantle J A,Hull M A,et al. Differences in sensitivity to developmental toxicants as seen in Xenopus and Pimephales embryos[J]. Bulletin of Environmental Contamination and Toxicology,1996,56(1):143-150.
[9]恽 烨,李 威,张银龙,等. 5-氟尿嘧啶与镉单一及复合污染对三种作物种子萌发的影响[J]. 农业环境科学学报,2014,33(6):1075-1081.
[10]刘家尧,刘 新. 植物生理学实验教程[M]. 北京:高等教育出版社,2010:13-15.
[11]Polle A,Eiblemeier M,Sheppard L,et al. Responses of antioxidative enzymes to evelated CO2 in leaves of beech (Fagus sylvatica L.) seedlings grown under a range of nutrient regimes [J]. Plant Cell Environment,1997,20:1317-1321.
[12]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry,1976,72:248-254.
[13]Wu X Y,Von Tiedemann A. Impact of fungicides on active oxygen species and antioxidant enzymes in spring barley (Hordeum vulgare L.) exposed to ozone [J]. Environment Pollution,2002,116:37-47.
[14]刘碧云,周培疆,李佳洁,等. 丙体六六六对斜生栅藻生长及光合色素和膜脂过氧化影响的研究[J]. 农业环境科学学报,2006,25(1):204-207
[15]Horvth G,Droppa M,Oravecz. Formation of the photosynthetic apparatus during greening of cadmium poisoned barley leaves [J]. Planta,1996,199:238-243.
[16]Alberte R S,Friedman A L,Gustafson D L,et al. Light-harvesting systems of brown algae and diatoms. isolation and characterization of chlorophyll a/c and chlorophyll a fucoxanthin pigment-protein complexes [J]. Biochimica et Biophysica Acta,1981,635(2):304-316.
[17]肖明月,安 婧,纪占华,等. 六种常见抗生素对小白菜种子萌发及生理特性的影响[J]. 生态学杂志,2014,33(10):2775-2781.
[18]Liao X R,Chen J,Zhou Y F. Effect of salicylic acid on the isozymes of peroxidase and catalase in cells of wheat callus [J]. Journal of Triticeae Crops,2000,20(2):66-68.
[19]安 婧,周启星,刘维涛. 土霉素对小麦种子发芽与幼苗生长发育的生态毒性[J]. 环境科学,2009,30(10):3022-3027.
[20]林仁漳,杜文超,王晓蓉,等. 土壤外源Cd对小麦幼苗生长自由基代谢及抗氧化酶活性的影响[J]. 农业环境科学学报,2008,27(1):23-29.

