封闭循环流水养殖的花鳗鲡脂肪酸特征分析
卢珍华, 江兴龙, 郑向华, 江泽琦, 赖晓健, 郭彩华
(1 集美大学食品与生物工程学院,福建 厦门361021;2 集美大学水产学院,福建 厦门361021;3 厦门出入境检验检疫局检验检疫技术中心, 福建 厦门361026;4 解放军后勤工程学院,重庆 400016 )
封闭循环流水养殖的花鳗鲡脂肪酸特征分析
卢珍华1, 江兴龙2, 郑向华3, 江泽琦4, 赖晓健2, 郭彩华1
(1 集美大学食品与生物工程学院,福建 厦门361021;2 集美大学水产学院,福建 厦门361021;3 厦门出入境检验检疫局检验检疫技术中心, 福建 厦门361026;4 解放军后勤工程学院,重庆 400016 )
为探寻封闭循环流水养殖模式下养殖的较大型(≥2 kg)花鳗鲡(Anguillamarmorata)各可食部的脂肪酸特征,利用索氏抽提法获得各部位的粗脂肪,以37种脂肪酸甲酯混标标准品为标准,气相色谱外标法检测脂肪酸的组成。检测结果显示,鱼皮中粗脂肪含量最高为26.96%,鱼肉的粗脂肪含量为10.36%;不同可食部的脂肪酸组成基本相似,饱和脂肪酸9种,单不饱和脂肪酸6 种,多不饱和脂肪酸8 种,饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸间的比例大约都为1∶3∶1,三大类脂肪酸中含量最高的分别为软脂酸C16∶0、油酸C18∶1n9c和二十二碳六烯酸C22∶6n3,油酸在不同可食部中均超过20 g/100 g总脂,C22∶6n3(DHA)在不同可食部中含量在4.42~5.59 g/100 g总脂之间。研究表明,较大型花鳗鲡是人体所需脂肪酸的良好食物来源。
花鳗鲡;封闭循环流水;气相色谱法;脂肪酸
花鳗鲡(Anguillamarmorata)分布于中国、菲律宾、印度尼西亚、南非、孟加拉湾、印度和斯里兰卡等国的沿海水域[1-2],其生活史是深海中产卵孵化,淡水中生长成熟,再洄游到深海。我国现有的花鳗鲡集约化养殖技术主要有土池养殖、水泥池养殖、水库网箱养殖、封闭循环流水养殖和工厂化温排水养殖[3-6]。关于花鳗鲡脂肪酸的组成及营养价值已有相关研究报道[7-10],但都未介绍所研究花鳗鲡的养殖模式。封闭循环流水养殖模式是在2003年以后得到推广的集约化养殖模式[11],关于在该模式下养殖的所获得的2 kg及以上重量的花鳗鲡的脂肪酸组成特征还未见报道。本研究以目前主流养殖模式即封闭循环流水养殖模式下收获的较大型花鳗鲡为对象,采用索氏抽提法提取脂肪,利用气相色谱仪对花鳗鲡各部位的脂肪酸组成和特征进行分析,进而对2 kg及以上重量花鳗鲡的养殖方式和营养价值之间的关系进行研究。
1 材料与方法
1.1 材料
花鳗鲡由集美大学养殖试验厂封闭循环流水系统提供。养殖池水体积0.85 m3,养殖密度60 kg/m3,养殖车间温度25 ℃左右,每天早、晚各投喂1 次,每次喂料2 h 后从养殖池底部排出约15%的养殖污水,同时添加新水,之后不间断地进行水循环和充气。采样时间2014年6—8月及11—12月,共获得花鳗鲡样品10尾,雌雄各半,平均个体重量 (2 050±50) g,体长 (91.5±3.1) cm。
37种脂肪酸甲酯混标标准品购于ANPEL Scientific Instrument(上海)有限公司,规格为25 mg色谱纯;无水乙醚、正己烷、氢氧化钾、甲醇等均为国产分析纯。
1.2 仪器与设备
仪器与设备包括:Agilent 6890N型气相色谱仪和G188顶空进样器(美国Agilent公司);EL104型电子天平(METTLER TOLEDO上海公司);DHG-9146A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);SY1-2型电热式恒温水浴锅(天津欧诺仪器仪表有限公司);MS3 basic漩涡混均器(厦门精艺兴业科技有限公司)。
1.3 粗脂肪含量测定方法
参照王立新等[12]的方法经改进后测定花鳗鲡的粗脂肪含量。原料花鳗鲡快速急冻1 h后剖杀,清洗、沥水后分别取鱼头、鱼皮、鱼肉、中背连皮鱼肉、鱼骨头等样本。每种花鳗鲡样本剁碎,分别称取(16±1) g鲜样于已称重的表面皿中,105 ℃鼓风干燥箱中干燥3~4 h,在干燥器内冷却至室温称重,再于干燥箱中干燥直至恒重。
取12 cm×15 cm脱脂滤纸,折成筒状再将底部折起封闭,做成滤纸筒,用药勺刮取已干燥的样品于滤纸筒中,将其放入索氏提取器的抽取管内,将表面皿上的样品残留用少量乙醚洗3次,入滤纸筒内,连接已干燥至恒重的提取瓶,组装好索氏提取器,表面皿再次称量。索氏提取器于55 ℃水浴锅中恒温抽提,每小时回流次数控制在6次以上,整个抽提过程用时约6 h。提取完毕后,取出滤纸筒,回收乙醚,待提取瓶内的乙醚剩1~2 mL时再干燥2 h,放干燥器内冷却0.5 h后称重,并重复操作至恒重。通过计算,获得花鳗鲡各部位的脂肪含量值。
1.4 气相色谱法检测脂肪酸含量
1.4.1 样品前处理
参照张立坚等[13]的方法分析花鳗鲡各可食部的脂肪酸组成。将提自鱼头、鱼皮、鱼肉、中背连皮鱼肉、鱼骨头的油脂各称取0.25 g,在具塞试管中用正己烷定容至5 mL后涡旋混匀,再加1 mL 4 mol/L KOH-CH3OH溶液,涡旋振荡,静置至上清液分层澄清。1份吸取200 μL澄清上清液到进样瓶中加800 μL正己烷(稀释5倍),另1份吸取100 μL澄清上清液到进样瓶中加900 μL 正己烷(稀释10倍)。进样瓶编号后置于气相色谱仪的G188顶空进样器中。同时做平行试验。
37种脂肪酸甲酯混标标准液的配制:将脂肪酸甲酯混标标准品溶解在10 mL正己烷中,配置成2.5 mg/mL的标准液。
1.4.2 色谱条件与分析
AgilentHP-88毛细管柱100.0 m×250 μm×0.20 μm;进样口温度250 ℃;检测器(FID)温度280 ℃;柱程序升温150 ℃保持1 min,以1.5 ℃/min升至210 ℃,再以30 ℃/min升至250 ℃,保持5 min;载气N2的纯度≥99.99%;分流比10∶1;尾吹45 mL/min。
外标法测定,面积归一化法计算各脂肪酸的含量。
1.5 测试数据的处理
2 结果与分析
2.1 粗脂肪含量的比较分析
花鳗鲡各部位粗脂肪含量测定结果表明,鱼皮中粗脂肪含量显著高于其他部位(P<0.05),其次为鱼骨头、中背连皮鱼肉、鱼头和鱼肉(P<0.05),最高含量达(26.96±0.34) g/100 g;鱼骨头中脂肪含量为(20.78±0.29)g/100 g;中背连皮鱼肉的脂肪含量为(13.05±0.42)g/100 g;而鱼头和鱼肉的脂肪含量最低,分别为(10.17±0.92)g/100 g和(10.36±0.45)g/100 g。
相关研究表明,体长31~41.5 cm、体重51.8~163.64 g和体长(40.7±0.7)cm、体重(167.9±10.7)g的花鳗鲡肌肉脂肪含量分别为5.08%[7]和(8.62±1.01)%[9],体重约1 kg花鳗鲡鱼肌肉脂肪含量为10.86%[10],本研究所用的花鳗鲡体重(2 050±50) g、体长 (91.5±3.1) cm,其肌肉脂肪含量为(10.36±0.45)%。差异的主要原因:一是个体处在不同的生长阶段;二是养殖模式可能不同,封闭循环流水养殖模式下花鳗鲡的运动较少;三是与饲料组成有关,本研究所用的养殖饲料是鳗鱼粉状配合饲料,饲料用量根据池鳗数量参照投饵表,并根据气候,水温水质还有鳗鱼生长及摄食状况来推算日投饵量及鱼油添加量。
2.2 花鳗鲡不同部位的脂肪酸组成
37种标准脂肪酸甲酯色谱图见图1。经气相色谱仪测定,37种标准脂肪酸甲酯的总含量为2.43 mg/mL,回收率是97.31%。图2为提自鱼皮的油脂经甲酯化及澄清后,再稀释5倍所得到的气相色谱图。

图1 37种标准脂肪酸甲酯色谱图Fig.1 Gas chromatography of 37 kinds of standard fatty acids
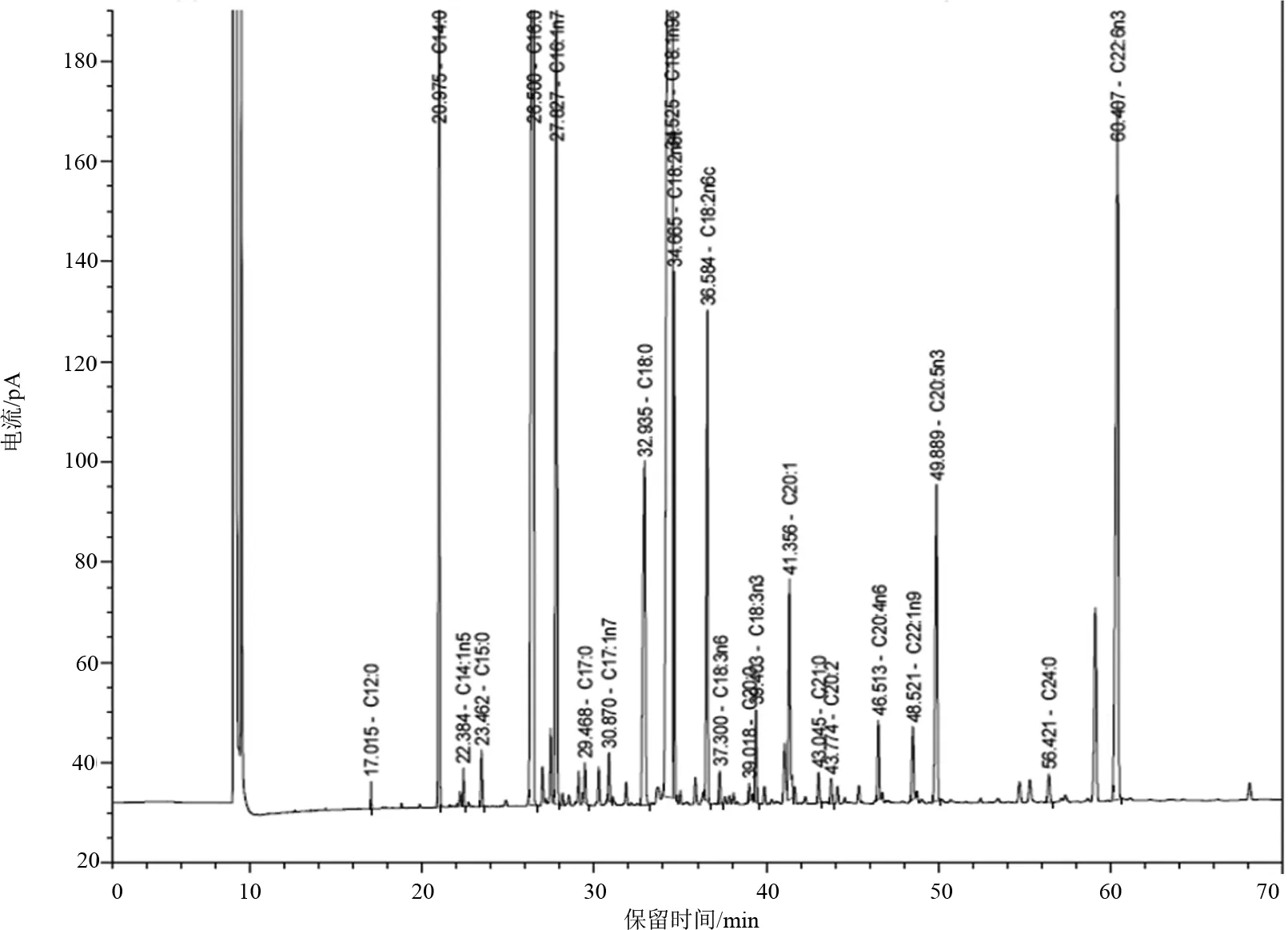
图2 鱼皮脂肪酸甲酯色谱图Fig.2 Gas chromatography of fatty acids in skin of Anguilla marmorata
本研究共检测出23 种脂肪酸,其碳链长度最短的是12个碳原子,最长的是 24个碳原子,其中饱和脂肪酸从C12∶0~C24∶0共9种,单不饱和脂肪酸从C14∶1n5~C22∶1n9共6 种,多不饱和脂肪酸从C18∶2n6t~C22∶6n3共8 种(表1)。花鳗鲡不同可食部的脂肪酸组成基本相似,饱和脂肪酸中均以软脂酸C16∶0含量最高,单不饱和脂肪酸中均以油酸C18∶1n9c含量最高,而多不饱和脂肪酸中均以二十二碳六烯酸C22∶6n3(DHA)为最高。

表1 花鳗鲡各部位的脂肪酸组成
注:“-”代表未检测出。
罗鸣钟等[9]采用的脂肪酸甲酯标准品含27种标准样,检测到花鳗鲡肌肉含16种脂肪酸,其中7种是饱和脂肪酸(SFAs),2种是单不饱和脂肪酸(MUFAs),7种为多不饱和脂肪酸(PUFAs),多不饱和脂肪酸中以C22∶6n3的含量为最高。本研究所用的脂肪酸甲酯标准品含37种标准样,花鳗鲡肌肉中检测到SFAs有8种,MUFAs有6种,PUFAs有8 种,其中C22∶6n3是含量最高的PUFAs。与罗鸣钟等[9]的结果相比,检测到了C21∶0和C24∶0两种SFAs,但没有检测到C19∶0;PUFAs中有检测到二十碳五烯酸C20∶5n3(EPA),但罗鸣钟等[9]的结果中没有C20∶5n3。闵志勇等[8]认为C20∶5维持在较低的水平。结果差异分析,可能的原因,一是所用花鳗鲡的个体大小不同;二是实验中所用脂肪酸甲酯标准品不同。
2.3 花鳗鲡各可食部脂肪酸饱和程度分析
花鳗鲡各可食部脂肪酸饱和程度的分析结果见表2。本研究检测到的各类脂肪酸经分类总结可见,虽然不同部位的粗脂肪含量差异显著,但SFAs总量、MUFAs和PUFAs总量间的比例都大约为1∶3∶1,其中MUFAs含量均显著高于SFAs和PUFAs的含量(P<0.05),而SFAs与PUFAs的含量均无显著差异(P>0.05)。
本研究中,花鳗鲡的脂肪酸在种类比例方面表现为较佳的营养学特征[10]。饱和脂肪酸与多不饱和脂肪酸比例接近1∶1;单不饱和脂肪酸中油酸C18∶1n9c的含量显著高于其它类型单不饱和脂肪酸。人体摄入的脂肪酸比例是衡量食物脂肪酸营养的主要指标。一些发达国家和国际组织均提出了相应的标准[14];中国营养学会也于2014 年提出了推荐比例,认为3种脂肪酸的质量比为1∶1∶1;世界卫生组织建议对单不饱和脂肪酸在膳食中的比例可以不限量[15]。
血液胆固醇含量是人类脂类营养水平以及风险评估的主要指标。有研究表明,油酸C18∶1n9c可以降低血液中有害胆固醇及总胆固醇含量[16-17],油酸含量常作为评定食品营养价值的重要指标,在营养学界油酸被称为“安全脂肪酸”[18]。本研究表明,花鳗鲡不同可食部单不饱和脂肪酸中,均以油酸C18∶1n9c含量最高,均超过20 g/100 g总脂。可见花鳗鲡是一种安全脂肪酸的来源食物。
本研究中的花鳗鲡不同可食部EPA+DHA含量显著高于其它类型多不饱和脂肪酸,且以DHA含量最高,在不同部位的含量为4.42~5.59 g/100 g总脂之间。可见,含有较高DHA含量的花鳗鲡对人体的健康是有利的。
3 结论
封闭循环流水养殖模式下养殖的较大体重花鳗鲡(≥2 kg),其粗脂肪含量较高,以鱼肉粗脂肪含量为例约为10.36%。花鳗鲡各可食部脂肪酸组成基本相似,饱和脂肪酸中均以软脂酸C16∶0含量最高,单不饱和脂肪酸中均以油酸C18∶1n9c含量最高,而多不饱和脂肪酸中均以二十二碳六烯酸C22∶6n3含量最高,SFAs、MUFAs和PUFAs总量间的比例大约都为1∶3∶1。
□
[1] 袁瑛,闵志勇.花鳗鲡的基础生物学研究[J].水产科学,2005,24(9):29-31.
[2] 戈贤平,宋迁红,赵永锋.淡水优势水产品养殖7日通[M].北京:中国农业出版社,2004:4-6.
[3] 欧宗东,卢家书,符泽雄.花鳗鲡池塘养殖的效果[J].农技服务,2010,27(12):1567-1586.
[4] 李岑鹏,关瑞章,江兴龙,等.循环水处理系统处理鳗鲡养殖污水的应用实验[J].集美大学学报:自然科学版,2009,14(2):126-130.
[5] 曲焕韬,李鑫渲,王敏懿,等.花鳗鲡工厂化循环水高密度养殖模式初探[J].渔业现代化,2009,36(4):13-16.
[6] 吴万夫,张荣权.渔业工程技术[M].郑州:河南科学技术出版社,2000:122-126.
[7] 闵志勇.花鳗鲡和日本鳗鲡肌肉生化成分的比较研究[J].集美大学学报:自然科学版,1998,3(3):132-135.
[8] 闵志勇,吴志强.三种鳗鲡肌肉脂质和脂肪酸组成的分析[C]//中国动物学会成立65周年年会论文集,1999:794-800.
[9] 罗鸣钟,关瑞章,靳恒. 五种鳗鲡的含肉率及肌肉营养成分分析[J].水生生物学报,2015,39(4):714-722.
[10]甘炼,周李柳,李小霞,等.花鳗鲡成鱼肌肉脂肪酸组成分析[J].淡水养殖,2014,41(6):302-305.
[11]张树林,李彤,焦万明.封闭循环水工厂化养殖实用模式试验[J].渔业现代化,2003(6):9-11.
[12]王立新,郑尧,艾闽,等.中国大鲵皮肤营养成分分析[J].淡水渔业,2011,41(1):92-95.
[13]张立坚,杨会邦,张俊杰,等.罗非鱼不同组织脂肪酸含量的分析[J].淡水渔业,2010,40(2):36-40.
[14]TOMASZ P, MARTA G, MAGDALENA K,etal. A randomized controlled study of the efficacy of six-month supplementation with concentrated fish oil rich in omega-3 polyunsaturated fatty acids in first episode schizophrenia[J]. Journal of Psychiatric Research, 2016, (73):34-44.
[15]李楠.关于奶粉中DHA和AA的疑惑[EB/OL]. (2014-04-29),http://news.xinhuanet.com/food/2014-04/29/c_126445363.htm.
[16]LIN C F,GRAY J I,ASGHAR A,etal. Effects of dietary oils and α-tocopherol supplementation on lipid composition and stability of broiler meat[J]. Journal of Food Science, 2006,54(6) :1457-1460.
[17]VERENA N, DORIS R, JACOB E,etal. Proposal on the usage of conversion factors for fatty acids in fish and shellfish[J]. Food Chemistry, 2014, 153:457-463.
[18]崔和平,郭兴凤.多不饱和脂肪酸对人体神经系统保健作用研究进展[J].河南工业大学学报:自然科学版,2012, 33(3):97-102.
[19]YING X,YANG W,ZHANG Y. Comparative studies on fatty acid composition of the ovaries and hepatopancreas at different physiological stages of the Chinese mitten crab[J]. Aquaculture, 2006, 256(1-4) :617-623.
[20]KREMMYDAL S, TCRZICKA E, STANKOVA B,etal. Fatty acids as biocompounds:their role in human Metabolism, health and disease [J]. Biomed Pap, 2011, 155(3):195-218.
Characterization of fatty acids ofAnguillamarmoratacultured in a closed recirculating flow-water culture system
LU Zhenhua1, JIANG Xinglong2, ZHEN Xianghua3, JIANG Zeqi4, LAI Xiaojian2, GUO Caihua1
(1 College of Food and Biological Engineering, Jimei University, Xiamen 361021,China; 2 Fisheries College of Jimei University, Xiamen 361021, China; 3 Technical Center of Xiamen Entry-Exit Inspection and Quarantine Bureau, Xiamen 361026, China 4 Logistic Engineering University of PLA, Chongqinng 400016,China)
To characterize the fatty acids in various edible parts of large-sizeAnguillamarmorata(≥2 kg) cultured in a closed recirculating flow-water culkture system, crude fat was extracted by Soxhlet extraction method, and then the contents of fatty acids were determined by Gas Chromatography (GC) with a external standard that consists of 37 methyl fatty acids. The results indicated that there was highest amounts of crude fat (26.96%) in fish skin, and 10.36% in fish flesh. Different edible parts in this study showed similar composition of fatty acids, the proportion of different saturated fatty acids (SFAs) to monounsaturated fatty acids (MUFAs) and polyunsaturated fatty acids (PUFAs) were approximately 1∶3∶1.The highest contents found in SFAs, MUFAs and PUFAs were palmitic acid (C16∶0), oleic acid (C18∶1n9c) and docosahexaenoic acid (C22∶6n3) respectively. The content of oleic acid which was namedSafeFattyAcid by nutriology fields in various edible parts were over 20 g/100 g of lipids, the content of docosahexaenoic acid which was known as DHA in various edible parts were between 4.42 g/100 g and 5.59 g/100 g of lipids. To conclude,Anguillamarmorataweighed over 2kg was a good food source for the intake of dietary fatty acids.
Anguillamarmorata; closed recirculating flow-water culture system; gas chromatography; fatty acids; fatty acid
2015-08-03
2016-01-19
福建省海洋与渔业厅项目“鳗鲡现代产业技术教育部工程研究中心(201501050003)”
卢珍华(1971—),女,高级实验师,研究方向:食品化学。E-mail:zhlu@jmu.edu.cn
郭彩华(1963—),女,副教授,硕士,研究方向:水产生物化学。E-mail:chguo@jmu.edu.cn
10.3969/j.issn.1007-9580.2016.01.012
S96;TS254.5
A
1007-9580(2016)01-062-06

