枯草芽孢杆菌对海水鱼塘生态因子的影响
王月霞, 杨秀兰, 杜荣斌, 刘立明, 刘义豪
(1山东省海洋资源与环境研究院,山东 烟台 264006;2烟台大学海洋学院,山东 烟台 264005)
枯草芽孢杆菌对海水鱼塘生态因子的影响
王月霞1, 杨秀兰2, 杜荣斌2, 刘立明2, 刘义豪1
(1山东省海洋资源与环境研究院,山东 烟台 264006;2烟台大学海洋学院,山东 烟台 264005)
为探讨枯草芽孢杆菌(Bacillussubtilis)在鱼类养殖池塘中的生态作用,采用直接往养殖水体中投放该制剂的方法,研究分析微生物数量及其与环境因子的相关关系。结果显示,枯草芽孢杆菌,实验池数量为0.35×103~1.45×103cfu/mL,对照池为0.04×103~0.08×103cfu/mL;浮游植物生物量,实验池为0.094~1.521 mg/L,对照池为0.103~0.763 mg/L,实验池中枯草芽孢杆菌数量和浮游植物生物量均高于对照组。试验鱼塘中枯草芽孢杆菌与硅藻数量呈显著正相关,相关系数0.844(P<0.05);当溶氧≥6 mg/L时, 枯草芽孢杆菌与亚硝酸盐氮含量呈显著负相关,相关系数-0.915(P<0.05)。溶氧过低(<2 mg/L)时,枯草芽孢杆菌对亚硝酸盐氮、氨氮没有明显的降解作用;溶氧≥6 mg/L时,对亚硝酸盐氮、氨氮的降解作用明显。研究表明,投放适量浓度的枯草芽孢杆菌能有效改善养殖水体状况,对水质起到进一步净化作用。
枯草芽孢杆菌;菌落数;溶氧;海水鱼池;氨氮:亚硝酸盐氮
枯草芽孢杆菌(Bacillus subtilis)作为水产养殖中的饲料添加剂或辅助剂[1-4],对于提高鱼类消化力与免疫力有明显作用[5-7];其作为降解氨氮、亚硝酸盐氮的水质净化剂也获得了显著的效果[8-14]。枯草芽孢杆菌是好氧菌,在自然条件下鱼池溶氧主要来源于浮游植物和大型藻类的光合作用,因此其净化水质不仅与溶氧有关,而且还与浮游植物等其它生态条件有关[15-16]。对于室外养鱼池,施加枯草芽孢杆菌对各生态因子的影响目前报道的尚不够全面,特别是枯草芽孢杆菌与溶氧、浮游植物、大型藻类的关系有待于进一步研究。本试验在这些方面做了一些探索,以丰富枯草芽孢杆菌应用技术和基础理论的研究。
1 材料与方法
1.1 试验设计
试验于2015年4—5月在烟台大学海洋学院小黑山岛科研基地进行。2个面积均为40.0 m2、平均水深3.5 m的室外养鱼池作为对照池和试验池,分别放养体重约(150±5.8)g梭鱼(Chelonhaematocheilus)(500尾/池)和体重约(50±3.4)g黒鲷(Sparusmacrocephlus)(1 000尾/池)。
1.2.1 养殖管理
饵料投喂定时、定点,配合饲料日投饵量为鱼体重的0.5%~2%;4月28日试验池投放枯草芽孢杆菌单一微生态制剂1 600 mL(实测该原液浓度为3.4×109cfu/mL),换算后池水浓度为4.5×104cfu/mL;对照池没有施加制剂。
1.2.2 水样采集与测定
实验池和对照池各设2个采样点,先用采水器采下层水作为溶氧水样,再采上、下两层的混合水样作为其它水化学检测水样和微生物检测水样。微生物检测水样用灭菌瓶单独存放,6 h内进行检测。4月28日当日采样1次,以后每5 d采样1次。
测定方法:溶氧(DO)使用碘量法,亚硝酸盐氮(NO2--N)使用萘乙二胺分光光度法,氨氮(NH4+-N)使用次溴酸盐氧化法(GB 17378.4—2007),硝酸盐氮(NO3--N)使用鋅镉还原法(GB/T 12763.4—2007),COD使用碱性高锰酸钾法(GB 17378.4—2007)。
1.2.3 微生物测定
总菌数计数目前大多采用倾注平板计数法,该法取量准确,有规范的技术与器材,总计数的准确度高于涂布法,但由于此法菌落容易包埋于培养基中,不易辨别枯草芽孢杆菌典型菌落特征,所以枯草芽孢杆菌计数采用涂布平板计数法。
倾注平板计数:取1mL摇匀的水样,稀释浓度为1.0×10-1、1.0×10-2和1.0×10-3,分别在三个梯度中各均匀取出1 mL稀释液,加入到无菌培养皿中,添加约48 ℃的培养基进行平板培养,每个梯度做2个平板,30 ℃培养48 h后计数菌落数。选择每板30~300菌落的稀释梯度为有效菌落数,计算出鱼池中的总菌数。
涂布平板计数:同步用倾注平板计数时制作的同一水样及梯度进行涂布平板计数。首先制作琼脂平板,然后在其表面涂布各梯度水样(用量0.1 mL)。30 ℃下培养48~96 h后(以能区分枯草芽孢杆菌典型特征为标准),计数枯草芽孢杆菌典型菌落数,求出百分比,再用倾注平板计数法观察的总菌数换算出菌落数。
2 结果与分析
2.1 枯草芽孢杆菌数与总菌数
枯草芽孢杆菌菌数及鱼塘总菌数见表1。对照池中的枯草芽孢杆菌是自然水域中存在的,其数量远少于实验池。

表1 枯草芽孢杆菌在鱼池中的分布与数量
2.2 溶氧的变化
从试验期间溶氧的变化(图1)可知,4月28日至5月19日,实验池中的溶氧一直低于对照池,其中5月5日—5月10日溶氧不足2.0 mg/L,枯草芽孢杆菌也出现滞长。因枯草芽孢杆菌是好氧菌,会大量消耗水中溶氧。5月10日取水后使用气泡石机械充氧,溶氧明显回升,5月26日由于实验池浮游植物数量急剧增加,溶氧达到最大值13.51 mg/L,枯草芽孢杆菌回升到1.06×103cfu/mL。
2.3 氨氮的变化
由图2可知,实验池氨氮浓度除5月26日其他都高于同期对照池,该日的实验池氨氮浓度(0.011 mg/L)低于同期对照池的氨氮浓度(0.020 mg/L),结合图1,此时溶氧已上升并超过对照池,显示溶氧浓度较低时(6.0 mg/L以下),实验池枯草芽孢杆菌虽然较多但氨氮仍高于对照池,当实验池溶氧浓度超过6.0 mg/L,氨氮浓度才由5月10日的1.837 mg/L直至降到5月26日的0.011 mg/L。

图1 溶氧的变化Fig.1 The variation of dissolved oxygen
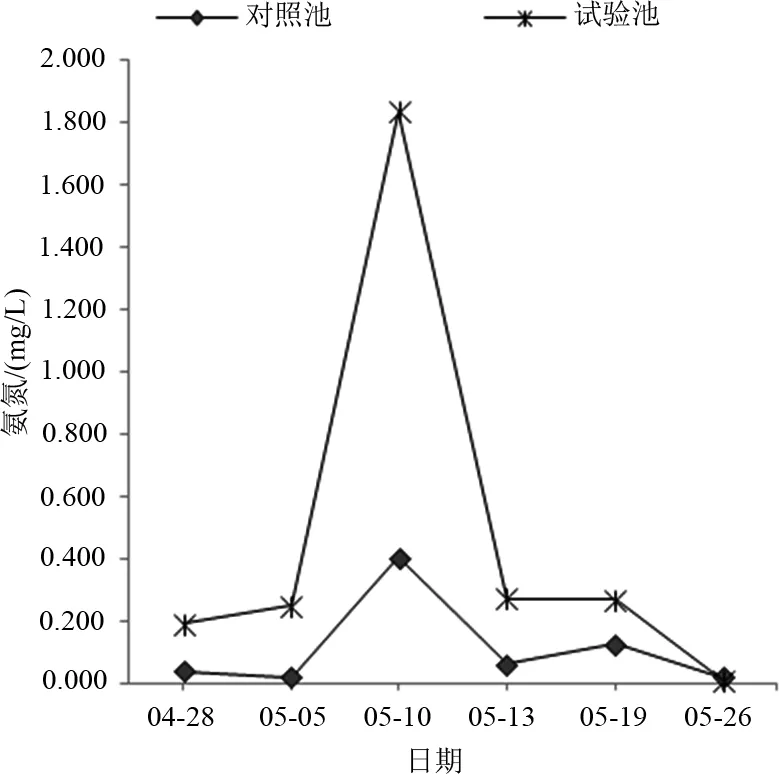
图2 氨氮的变化Fig.2 The variation of ammonia nitrogen
2.4 亚硝酸盐氮的变化
4月28日实验池投放了枯草芽孢杆菌,亚硝酸盐氮浓度开始明显上升,直至5月19日始终高于对照池,说明枯草芽孢杆菌对降解亚硝酸盐氮没有作用,但5月26日测定结果表明枯草芽孢杆菌降解亚硝酸盐氮的作用明显,这可能与实验池溶氧上升到6.0 mg/L以上有关(图3)。

图3 亚硝酸盐氮的变化Fig.3 The variation of nitrite nitrogen
2.5 硝酸盐氮的变化
由图4可知,实验池硝酸盐含量大多比对照池少,这可能与缺氧有关。本实验由于施加枯草芽孢杆菌过量,使得水中溶氧降低,因此影响了亚硝酸盐氮降解转化为硝酸盐氮的作用。所以,实验池硝酸盐氮并没有因施加好氧性枯草芽孢杆菌而增加。

图4 硝酸盐氮的变化Fig.4 The variation of nitrate nitrogen
2.6 枯草芽孢杆菌与浮游植物
将枯草芽孢杆菌数(表1)与主要浮游植物优势种的个体数(表2、表3)用SPSS 19.0软件进行了相关性分析(表4),枯草芽孢杆菌与小球藻几乎不相关;与色球藻在对照池出现明显负相关(相关系数-0.929);与硅藻在实验池出现正相关(相关系数0.844)。色球藻在有枯草芽孢杆菌、溶氧充足的条件下生长受到抑制,可能与色球藻个体小(2 μm左右)且主要以氨氮为营养盐有关。而枯草芽孢杆菌在溶氧充足的条件下降解氨氮,所以不利于其生长。实验后期,色球藻、裸藻爆发,可能与先前溶氧不足、氨氮过高有关。硅藻一般个体较大(20~200 μm),可利用氨氮及硝酸盐氮,故其生长较快。
2.7 枯草芽孢杆菌与主要生态因子的相关性分析
枯草芽孢杆菌数与各化学指标的相关系数见表4。本实验中,由于实验池溶氧缺乏,枯草芽孢杆菌与亚硝酸盐氮的相关性小于对照池,在对照池有明显的负相关(相关系数-0.915);枯草芽孢杆菌与氨氮、硝酸盐氮相关系数均较小。从枯草芽孢杆菌与各生态因子相关性分析看,实验池没有对照池理想,也可以认为对照池的枯草芽孢杆菌量更为适宜。
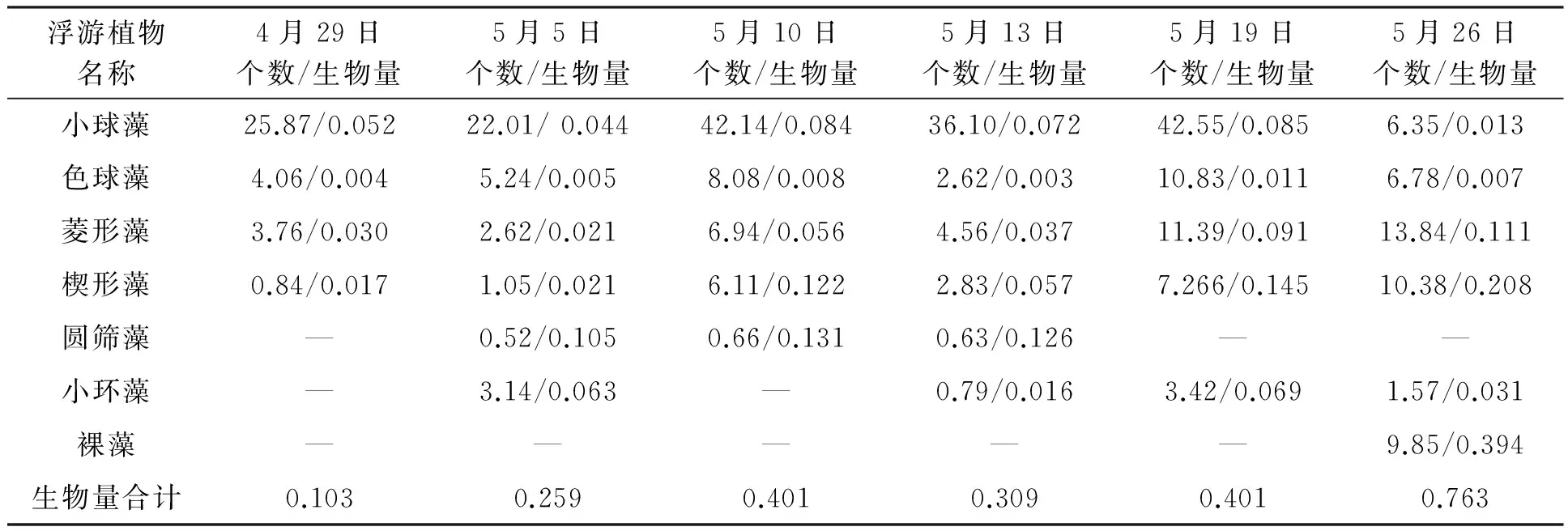
表2 对照池浮游植物个数及生物量
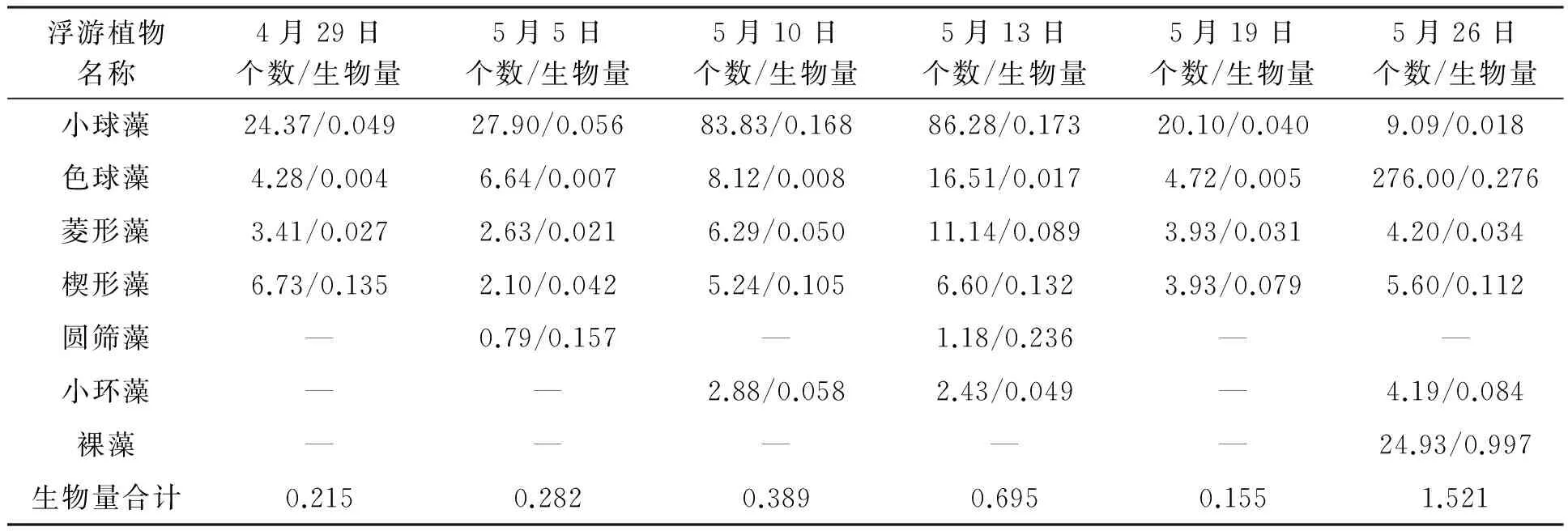
表3 实验池浮游植物个数及生物量
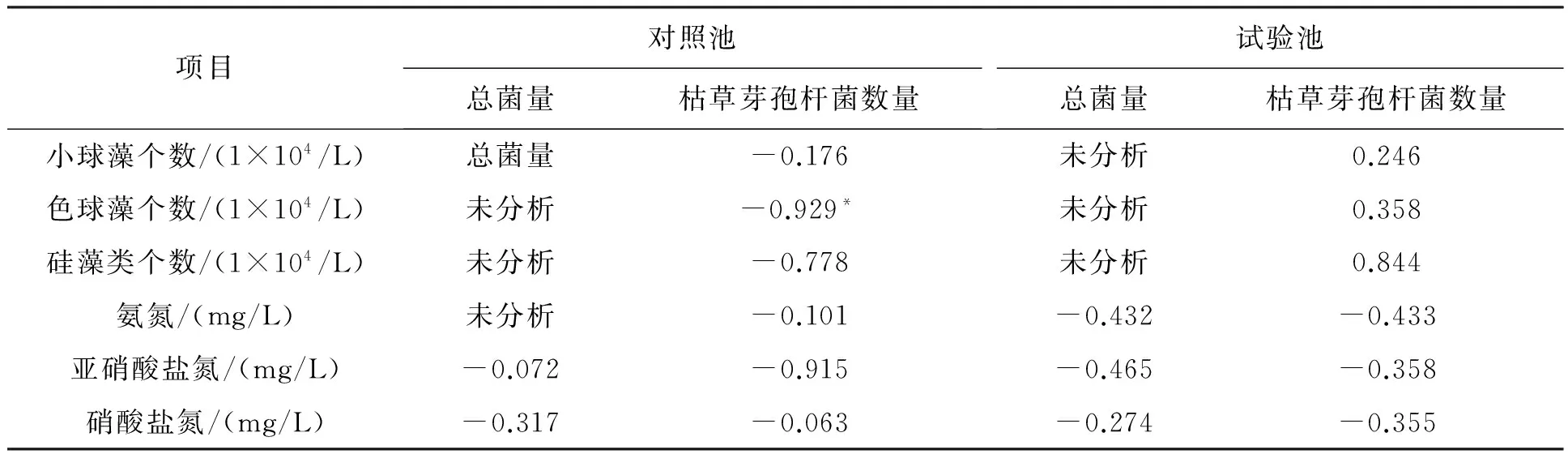
表4 枯草芽孢杆菌与各生态因子的相关系数
注:*表示在0.05水平(双侧)上显著相关。
3 讨论
3.1 大量施加枯草芽孢杆菌会使鱼池溶氧短时间内大幅下降
在实验池加入枯草芽孢杆菌单一微生态制剂13.3 mL/m3后,实验池中枯草芽孢杆菌数瞬时可达4.5×104cfu/mL(实测该制剂浓度3.4×109cfu/mL),好氧菌的突然增加,使溶氧在几天内迅速下降,这与汤宝贵[17]等所做的研究相符。溶氧的迅速下降,会导致枯草芽孢杆菌沉淀、养殖生物缺氧死亡、氨氮等有毒有害物质积累,形成恶性循环,为养殖生产带来不利影响。因此,本研究认为利用枯草芽孢杆菌净化海水鱼池水质时,其鱼池中枯草芽孢杆菌数量应控制在1.0×104cfu/mL数量级以下,并及时补充溶氧。
3.2 枯草芽孢杆菌降解亚硝酸盐氮、氨氮的效果与溶氧关系密切
本实验表明,当溶氧浓度超过5.92 mg/L时,枯草芽孢杆菌才能使实验池中氨氮、亚硝酸盐氮浓度显著下降。枯草芽孢杆菌对氨氮的降解作用受到菌量、转化作用的影响,有一定的滞后,溶氧升高并不能立即使氨氮浓度降低。对照池中溶氧浓度高于6 mg/L,枯草芽孢杆菌浓度在0.1×104~0.4×104cfu/mL是最佳生态调控指标,枯草芽孢杆菌与亚硝酸盐氮的相关性显著(相关系数-0.915),随着枯草芽孢杆菌数升高,亚硝酸盐氮含量降低。实验池溶氧前期低于6 mg/L时,枯草芽孢杆菌与亚硝酸盐氮相关系数只有-0.358。实验池最后2次测定:溶氧由5.915 mg/L升到13.51 mg/L,亚硝酸盐氮则由0.172 5 mg/L降至0.003 mg/L,氨氮由0.267 5 mg/L降至0.011 0 mg/L, 这时对亚硝酸盐氮、氨氮的去除率分别为98%、95.88%,比王庚申等[18]用复合微生态制剂去除梭子蟹养殖废水亚硝酸盐氮的去除率20%~55%、氨氮的去除率36.17%~86.96%更高。
3.3 枯草芽孢杆菌对浮游植物优势种的影响
从本实验结果可知,枯草芽孢杆菌可以促进水体中小球藻、硅藻、裸藻的生长,随着水温的逐渐升高,优势种依次为小球藻、硅藻、裸藻。但在试验后期,裸藻、色球藻大量增殖,抑制了小球藻的数量,特别是喜氮裸藻的大量繁殖,有制造氧气、降低氨氮的作用,益于枯草芽孢杆菌的繁殖,使得后期的枯草芽孢杆菌菌落数量增多。
4 结论
综上所述,由于室外海水鱼塘施加了枯草芽孢杆菌,使得养殖水域的溶氧、氨氮、亚硝酸盐及浮游植物等发生了很大变化,枯草芽孢杆菌不仅影响了化学指标,还影响了生物指标在鱼池中的消长与变化,特别是造成溶氧的变化,溶氧的变化反过来又影响到枯草芽孢杆菌自身降解氨氮与亚硝酸盐氮的效果,说明枯草芽孢杆菌与溶氧是一个生态调控的统一体。在没有增氧设备的室外养殖水域中不宜使用过多的枯草芽孢杆菌;在充氧设备较好的室内鱼类养殖池,使用枯草芽孢杆菌可以降低养殖成本,提高养殖效益。
□
[1] 王高学,白冰.9种细菌成分及其代谢产物对鲫鱼免疫功能的影响[J].西北农林科技大学学报:自然科学版,2006,34(2):39-44.
[2] 谢佳磊,肖丹,殷蝶,等.枯草芽孢杆菌对克氏原螯虾免疫机能的影响[J].淡水渔业,2007,37(6):24-27.
[3] 沈文英,李卫芬,梁权,等.饲料中添加枯草芽孢杆菌对草鱼生长性能、免疫和抗氧化功能的影响[J].动物营养学报,2011,23(5):881-886.
[4] 杜宣,周国勤,茆健强,等. 3种微生态制剂的氨基酸组成及对鲤鱼消化酶活性的影响[J].云南农业大学学报,2006, 21(3):351-354.
[5] 陶宝华,胡超群,任春华,等.弧菌疫苗对斑节对虾和日本对虾免疫预防的作用[J].水产学报,2000(6):23-25.
[6] 周海平,李卓佳,杨莺莺,等.乳酸杆菌LH对几种水产养殖病原弧菌的抑制作用[J].台湾海峡,2006(3):47-49.
[7] 刘克琳,何明清.益生菌对鲤鱼免疫功能影响的研究[J].饲料工业,2000,21(6):24-25.
[8] 王岩.海水池塘养殖模式优化:概念、原理、方法[J].水产学报,2004,28(5):568-572.
[9] 王亚敏,王印庚.微生态制剂在水产养殖中的作用机理及应用研究进展[J].动物医学进展,2008,29(6):72-75.
[10]张峰峰,谢凤行.枯草芽孢杆菌水质净化作用的研究[J].华北农学报,2009,24(4):218-221.
[11]刘慧玲,黄翔鹄,李长玲,等.不同浓度的枯草芽孢杆菌对罗非鱼鱼苗的养殖水体水质及其抗病力的影响[J].水产养殖,2011,30(10):5-9.
[12]杨秀兰,宋向军,杜荣斌,等.微生态制剂调节水质的效果与质量研究[J].齐鲁渔业,2013,30(3):3-5.
[13]宋协法,康萌萌,彭磊,等.益生菌对半滑舌鳎养殖水质及仔稚鱼生长的影响研究[J].渔业现代化,2011,38(6):30-34.
[14]李燕,崔杰鑫,赵文,等.微生物方法降解刺参养殖池塘中氨态氮的研究进展[J].微生物学杂志;2012,32(3):76-79.
[15]王志刚,胡凡光,魏庆钢,等.海黍子对仿刺参生长及水质环境因子的影响[J].渔业现代化,2015,42(1):11-15.
[16]罗勇胜,张道波,李卓佳,等.有益菌与大型藻类净化集约化养殖废水的展望[J].海洋湖沼通报;2006,(2):111-115.
[17]汤保贵,徐中文,张金燕,等.枯草芽孢杆菌的培养条件及对水质的净化作用[J].淡水渔业,2007,37(3):45-48.
[18]王庚申,张涛,谢建军,等.复合微生态制剂和曝气对梭子蟹养殖废水的净化效果[J].渔业现代化,2014,41(2):12-17.
Effects of Bacillus subtilis on the ecological factors in marine fish pond
WANG Yuexia1, YANG Xiulan2, DU Rongbin2, LIU Liming2, LIU Yihao1
(1 Shandong Marine Resource and Environment Research Institute, Yantai 264006,China; 2 School of Ocean, Yantai University, Yantai 264005, China)
To discuss the ecological effects of micro-ecological agents ofBacillussubtilisinto marine fish pond, the relationship between microorganism quantity and environmental factors was investigated in marine fish pond by artificially adding method. The results showed that the quantity ofBacillussubtilisamounted to 0.35×103-1.45×103cfu/mL in the experiment group, and 0.04×103- 0.08×103cfu/mL in the control group; the phytoplankton biomass (0.102 6-0.763 2 mg/L in the experiment group and 0.093 6-1.520 9 mg/L in the control group) were both significantly higher in the experiment group than those in the control group. In the experiment group; the Bacillus subtilis amounts were significantly positive correlative with the diatom abundance (correlation coefficient=0.844,P<0.05), but those were significantly negative correlative with the nitrite nitrogen concentration (correlation coefficient=-0.915,P<0.05), if the dissolved oxygen concentration was more than 6 mg/L. In addition, if the dissolved oxygen concentration was too low (<2 mg/L), there was no degradation effect ofBacillussubtilison ammonia nitrogen and nitrite nitrogen in the seawater, but there was a significant degradation effect of Bacillus subtilis on ammonia nitrogen and nitrite nitrogen when the dissolved oxygen concentration reached to 6 mg/L or more. Thus it can be inferred that the appropriate concentration ofBacillussubtiliscan effectively improve the condition of aquaculture water, and further purify the water quality.
Bacillussubtilis; colony number; dissolved oxygen; marine fish pond; ammonia nitrogen; nitrite nitrogen
2015-07-16
2015-11-09
国家海洋公益性行业科研专项(201205025)
王月霞(1974—),女,助理工程师,研究方向:海洋生物与水产养殖。E-mail:zuweiliyt@163.com
杨秀兰(1957—),女,教授,研究方向:水域生态学。E-mail:yangxiulan@126.com
10.3969/j.issn.1007-9580.2016.01.001
S917.1
A
1007-9580(2016)01-001-06

