微酸性电解水对活品虾夷扇贝存活率的影响及杀菌效果
李国威, 傅润泽, 沈 建, 樊 文, 徐文其
(1广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,水产品深加工广东普通高等学校重点实验室,国家贝类加工技术研发分中心(湛江),广东 湛江,524088;2中国水产科学研究院渔业机械仪器研究所,上海 200092;3上海海洋大学食品学院,上海 201306)
微酸性电解水对活品虾夷扇贝存活率的影响及杀菌效果
李国威1, 傅润泽2,3, 沈 建2, 樊 文2,3, 徐文其2
(1广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,水产品深加工广东普通高等学校重点实验室,国家贝类加工技术研发分中心(湛江),广东 湛江,524088;2中国水产科学研究院渔业机械仪器研究所,上海 200092;3上海海洋大学食品学院,上海 201306)
以活品虾夷扇贝(Patinopectenyessoensis)为实验对象,用不同理化性质的微酸性电解水(slightly acidic electrolyzed water,SAEW)处理受试扇贝,并用副溶血性弧菌人工浸染经微酸性电解水处理过的扇贝,检测其存活率、微酸性电解水杀菌效果、副溶血性弧菌的变化规律,以及虾夷扇贝在不同电解水处理阶段的菌相。结果显示,微酸性电解水处理1 min、2 min、4 min,扇贝存活率均为80%,处理8 min存活率为82%,均高于染菌组和对照组;电解水处理时间与细菌总数和大肠菌群呈显著负相关(P<0.05),与处理时采用的电解水有效氯浓度没有显著性关系(P>0.05)。采用电解水处理8 min后,活品虾夷扇贝体内染上的副溶血性弧菌数量从>1 100 MPN/g降至28 MPN/g。扇贝初期主要菌群为假单胞菌和弧菌,在经过微酸性电解水处理后,其体内的菌群趋于复杂化,优势菌群有所改变,细菌总数有所下降。24 h后经电解水处理或者未处理的虾夷扇贝体内优势腐败菌均为假单胞菌。研究表明,SAEW在虾夷扇贝净化中具有一定的应用潜力。
活品虾夷扇贝;微酸性电解水;存活率;杀菌效果;副溶血性弧菌;菌相
虾夷扇贝(Patinopectenyessoensis)是大型低温海产双壳贝类,于20世纪80年代初引入中国,现已在辽宁、山东等地进行规模化养殖,是中国北方沿海地区重要的经济型养殖贝类之一。作为非选择滤食性生物,虾夷扇贝在养殖过程中非常容易富集环境中的微生物[1],在捕获后的流通环节中也容易发生交叉污染。严重的微生物污染不仅使扇贝自身发生病害,造成运输过程中的死亡,不良的生理状态同时也会影响到其风味品质。另外,迅速繁殖的病原微生物也会产生食品安全问题,如虾夷扇贝极易受到副溶血性弧菌(Vibrioparahaemolyticus)的感染[2-3]。有报告表明,双壳贝类中副溶血性弧菌检出率接近30%[4]。
贝类前期的净化杀菌手段主要有含氯消毒剂杀菌、紫外线杀菌及臭氧杀菌[5]。含氯消毒剂是最早应用于贝类净化的化学试剂,因其味道会影响品质,故许多国家和地区现在已不再使用;紫外线处理方式受到当地海水浑浊度、颜色和可溶性铁盐的影响,也具有相当的局限性;目前适用的贝类净化手段是臭氧杀菌。开发新型贝类净化杀菌手段也是国内外研究的热点之一。
电解水又称电解离子水或者氧化电位水[6],其中微酸性电解水(Slightly Acidic Electrolyzed Water,SAEW)制取方便、广谱高效、分解快且无气味残留,有研究表明,微酸性电解水对植物或者动物基本上没有毒性[7-9]。目前尚未有将微酸性电解水应用于活品贝类净化的相关报道,本研究以活品虾夷扇贝为实验对象,采用不同理化性质的微酸性电解水处理受试扇贝,探讨其对活品虾夷扇贝的影响,为微酸性电解水在活品虾夷扇贝净化中的实际应用提供一定的理论基础和实践参考。
1 材料与方法
1.1 材料、仪器与试剂
底播虾夷扇贝购自大连獐子岛,平均壳宽(78±11.2)mm,重量(64.3±8.4)g。选取鲜活个体当天运至实验室,放入事先搭建的低温循环水(水温10 ℃)保活平台中,静养24 h后,除去死亡个体,待其生理状况稳定后进行实验。
主要仪器:LRH-70生化培养箱,VS-1300型超净工作台,LS-B50L型蒸汽灭菌锅,PHS-25型数显pH计,RC~3F型高质量有效氯测定仪,显微镜,拍打式均质器,低温保活平台(自制,主要包括净化过滤装置和循环降温系统),电解水装置(一室型,实验室自制)。
主要生化试剂:营养琼脂培养基,革兰氏染色试剂(杭州微生物试剂有限公司),O/F培养基,氧化酶试纸,3%NaCl碱性蛋白胨水,硫代硫酸盐-柠檬酸盐-胆盐-蔗糖(TCBS)琼脂,3%氯化钠胰蛋白胨大豆琼脂,结晶紫中性红胆盐琼脂(VRBA),煌绿乳糖胆盐(BGLB),生化试剂鉴定盒(广东环凯微生物试剂有限公司)。
1.2 方法
1.2.1 微酸性电解水的制备
微酸性电解水制取装置主要由耐腐蚀塑料电解槽、铂钛合金电极片、电源系统及控制系统等构成。使用浓度0.06%的氯化钠(NaCl)溶液和不同体积(μL)的盐酸(HCl)(质量浓度36.5%),电解后获得微酸性电解水。电解条件:电流1.8 A,极板间距20 cm,时间10 min。表1为所得电解水的物理参数。氧化还原电位(ORP)采用pH计,在电极转换后利用其电位测定功能进行测定。有效氯质量浓度(ACC)采用RC-3F型高质量有效氯测定仪测得。所有电解水制备后立即使用。电解水物理参数测量平行次数为3次。
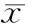
表1 不同电解水的物理参数
1.2.2 副溶血性弧菌菌液的扩增及染菌处理
将斜面保存的副溶血性弧菌菌种(ATCC17802)扩增活化。实验样品分为6组,每组50只。其中,1组不做任何处理(对照组),1组接种副溶血性弧菌后不作处理(染菌组),其余4组(实验组)按照预实验和相关文献[10],确定处理时间分别为1 min、2 min、4 min和8 min。实验前在暂养箱里加入含有副溶血性弧菌的海水,每箱水约60 L,水温10 ℃,海水中副溶血性弧菌浓度约为1×105cfu/100 mL。将对照组之外的5组放入染菌海水中,26 ℃室温下放置1 h,使副溶血性弧菌均匀分布至扇贝体内。
1.2.3 存活率测定
结合预实验的结果,将染菌扇贝取出放入电解水(0.06% NaCl+650 μL HCL,理化参数见表1)中分别处理,与染菌组和对照组同时取样检测,每批取样5个,剩余的扇贝每隔2 h观察其存活率并统计。
S=(Ns/Nt)×100%
式中:S—存活率,%;Ns—观察时扇贝存活数量,个;Nt—实验开始时扇贝总数,个。
1.2.4 杀菌效果测定
除闭壳肌外将扇贝全肉用无菌研钵捣碎,制成1∶10的样品匀液,每组均按照国标[11]中的操作梯度稀释并测定菌落总数。设3个稀释度,每个稀释度做2次平行实验,以生理盐水为空白作对照实验,用不同时间和不同ACC的电解水处理,处理结果以log10cfu/g表示。大肠菌群采用国标[12]中的大肠菌群平板计数法,其结果以cfu/g表示。
1.2.5 副溶血性弧菌测定
将上述扇贝稀释液按照国标[13]处理,对所有生长的增菌液做生化鉴定筛选,将结果按照国标[13]的方法记录并报告。
1.2.6 菌相的生化检测
菌相分析采用生化实验鉴定盒鉴定。根据伯杰氏细菌手册(第八版)[14]及DORTHE等[15]提出的水产品细菌鉴定流程,取4个点做菌相分析,每个菌相点取30个进行生化实验,鉴定到属,结果以每种细菌占挑取的总菌落数所占百分比表示。
1.3 数据分析
每个样品做3个平行,使用软件SPSS19.0分析处理时间和盐酸浓度对细菌总数和大肠菌群的相关性,采用独立样本t检验,显著性界值以P<0.05为显著。同时采用Excel 2007进行数据处理、作图及分析。
2 结果
2.1 微酸性电解水处理对染菌后扇贝的存活率影响
由图1可见,各组扇贝8 h前的存活率均超过90%,随着时间的延长,其存活率逐渐下降。10 h后染菌组和对照组的存活率迅速下降,实验结束(12 h)时对照组的存活率为72%,染菌组的存活率为70%。经微酸性电解水处理的各组实验结束时,1 min、2 min、4 min组存活率均为80%,8 min处理组达到82%。该实验以存活率为标准,初步发现微酸性电解水处理的胁迫作用对活品虾夷扇贝并未造成致命性的影响。

图1 电解水处理后虾夷扇贝存活率Fig.1 Survival rate of the scallop after electrolyzed water treatment
2.2 处理时间对虾夷扇贝体内细菌总数和大肠菌群的影响
采用电解水处理虾夷扇贝后,其体内的细菌总数和大肠菌群的数量随着时间的延长而呈现降低的趋势(图2)。数据分析表明,细菌总数和大肠菌群的数量随着处理时间具有显著性差异,其相关性为负相关(P≤0.05),在8 min时细菌总数和大肠菌群分别降至4.8log10cfu/g和500 cfu/g,与初始相比,分别下降了65%和74%。
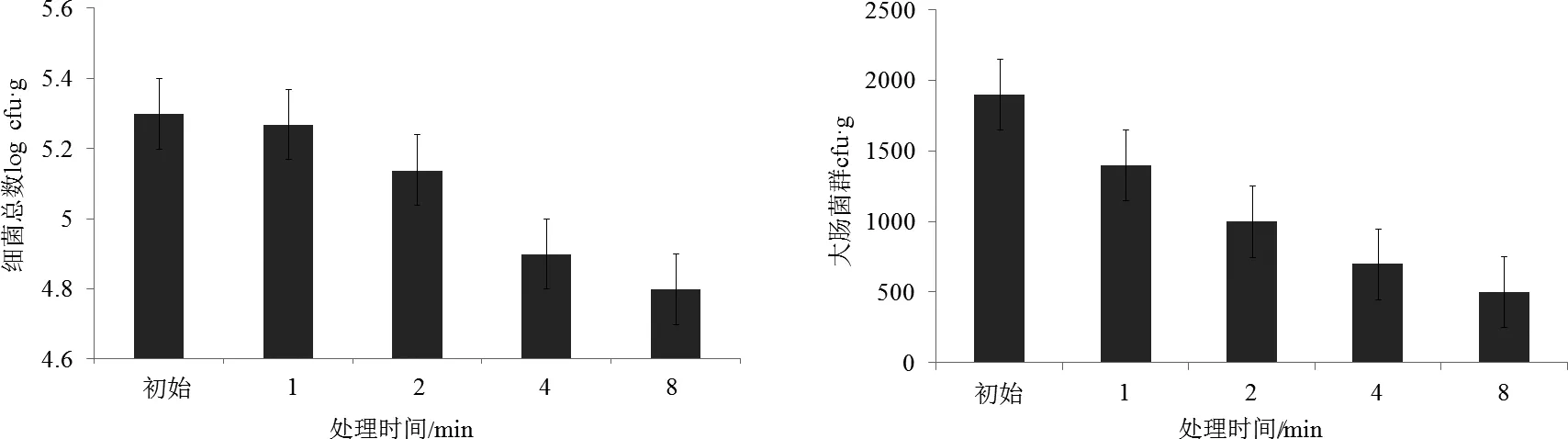
图2 虾夷扇贝体内细菌总数和大肠菌群随电解水处理时间的变化Fig.2 Changes of bacteria and coliforms in the live scallop as different time of electrolyzed water treatment
2.3 电解水ACC对细菌总数和大肠菌群的影响
经电解水处理后,细菌总数最高的是ACC为34 mg/L的微酸性电解水,ACC 41 mg/L的微酸性电解水对细菌总数和大肠菌群均有最高的杀菌效率(图3)。通过SPSS19.0分析,有效氯浓度和杀菌效率并无显著相关性(P≤0.05)。
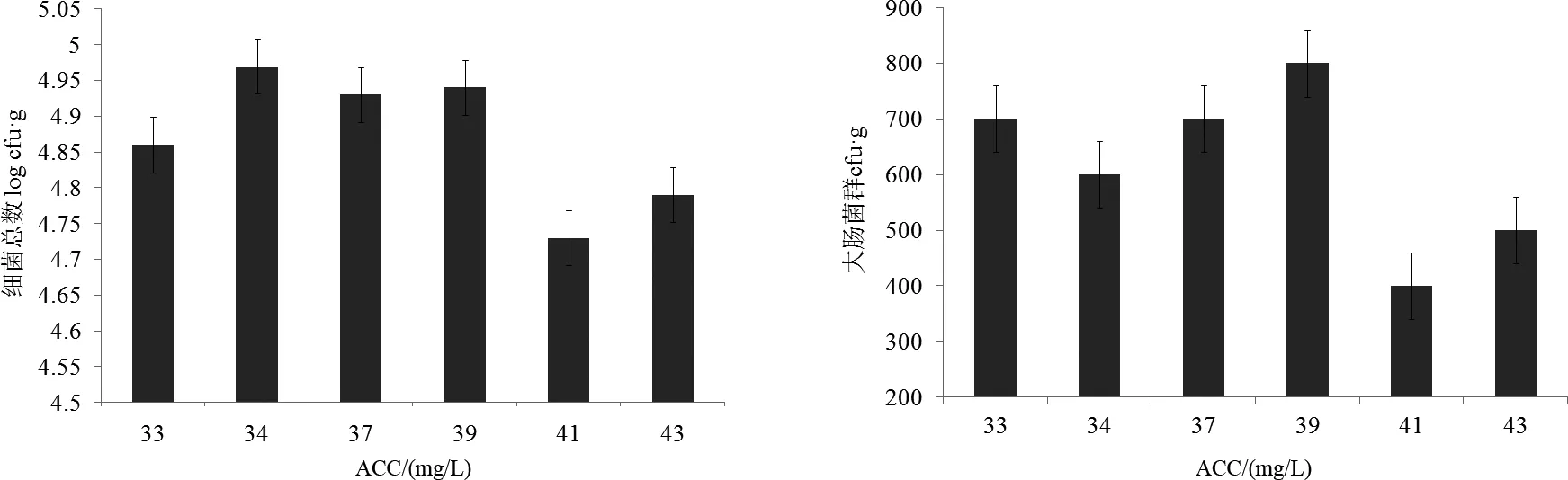
图3 电解水对虾夷扇贝细菌总数和大肠菌群数量的影响Fig.3 Changes of bacteria and coliforms in the live scallop after electrolyzed water treatment
2.4 对扇贝体内染副溶血性弧菌的影响
由图4可看出,与染菌组>1 100 MPN/g相比,处理时间1 min组扇贝体内的副溶血性弧菌下降至150 MPN/g,而且处理时间越长其数量越少,最长的8 min组扇贝体内副溶血性弧菌仅为28 MPN/g。
图4 电解水处理染菌虾夷扇贝体内副溶血性弧菌的变化Fig.4 Changes of Vibrio parahaemolyticusin the contaminated scallop treated by electrolyzed water
2.5 虾夷扇贝各阶段菌相分析
虾夷扇贝初始的优势菌包括:假单胞菌属(31.25%)、弧菌属(25%)、产碱杆菌(18.75%)、奈瑟氏菌(12.5%)、丹毒丝菌(6.25%)和色杆菌(6.25%)(表3)。经电解水处理后,虾夷扇贝的菌相有了很大的变化,总共检出13种属的细菌(表4),其主要优势菌包括:由假单胞菌属变为弧菌属(25%)、克雷伯氏菌属(16.67%)、棒状杆菌属(16.67%)、肠杆菌属(16.67%),这4个属的细菌占了电解水处理后细菌种类的75%,其余9种属的细菌占比25%。

表3 生鲜虾夷扇贝菌相组成
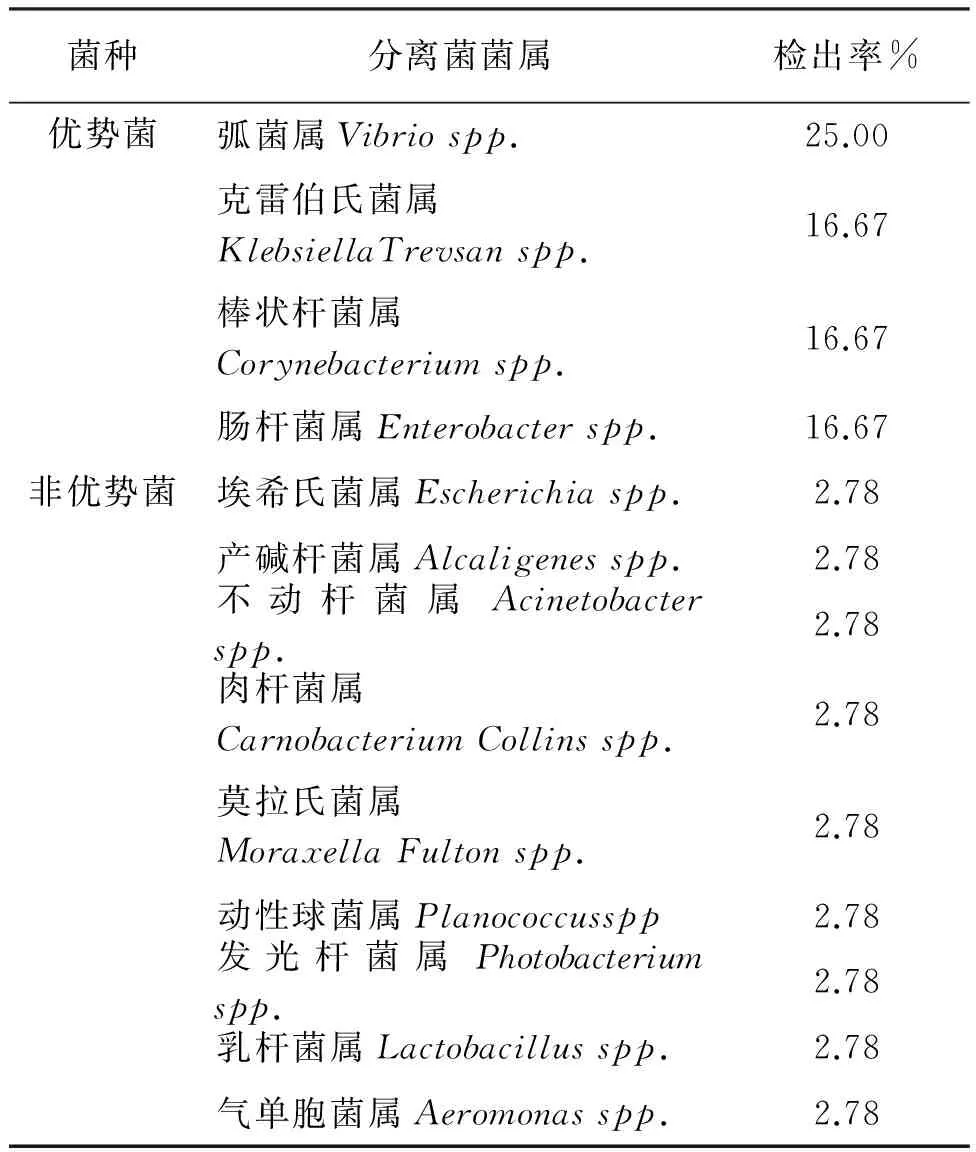
表4 电解水处理后虾夷扇贝菌相组成
未经电解水处理,24 h后,虾夷扇贝体内的优势菌包括假单胞菌属(35%)、弧菌属(25%)、气单胞菌属(20%);非优势菌包括发光杆菌属(5%)、色杆菌属(5%)、邻单胞菌属(5%)和莫拉斯菌属(5%),4种属的细菌只占总体菌相的1/5(表5)。经过电解水处理,24 h后,虾夷扇贝体内的优势菌包括假单胞菌属(44.44%)、气单胞菌属(16.67%)、弧菌属(16.67%)、邻单胞菌属(11.11%);非优势菌有色杆菌属(5.56)和莫拉氏菌属(5.56)(表6)。
3 讨论
3.1 扇贝存活率的变化
根据相关研究报道,净化过程一般不会造成净化对象的大量死亡[15]。本实验中的较高死亡率,推测是由于扇贝在运回实验室过程中因机械损伤引起应激反应,同时又受到染菌处理和环境变化等多种因素联合作用而造成。
3.2 微酸性电解水处理后微生物总数的变化
实验中活品虾夷扇贝自身具有免疫系统,与微酸性电解水同时发挥作用。然而实验结果与HAO等[16]研究电解水对芫荽叶的杀菌效率存在一定的数量差异。这可能是由于采用微酸性电解水处理扇贝时,扇贝生存环境相对自然环境变得恶劣,滤水能力受到抑制,降低了与外界的物质交换能力,电解水无法进入壳内和体内进行完全消毒。
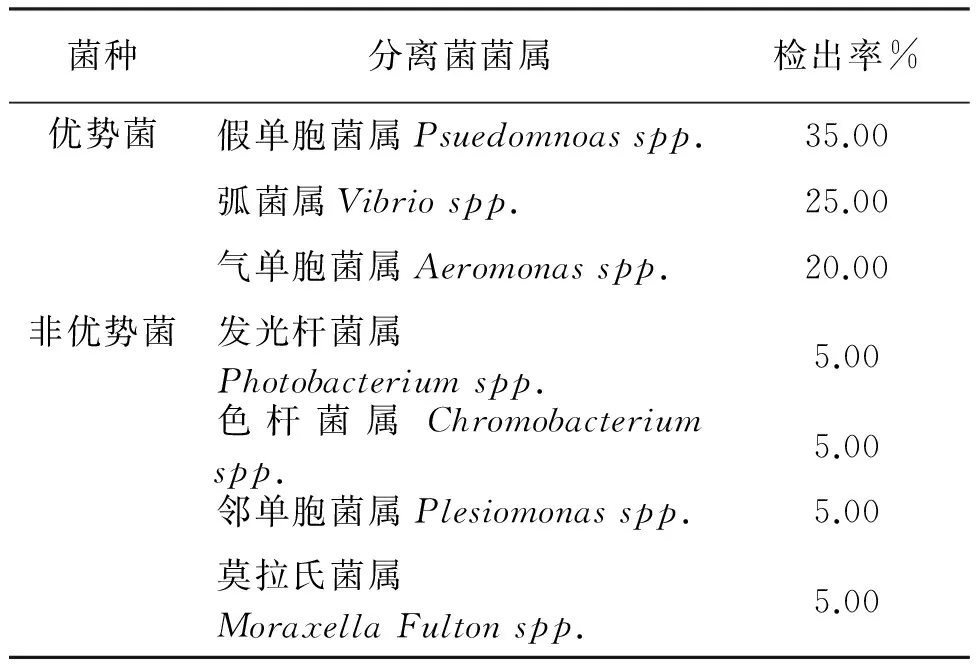
表5 生鲜虾夷扇贝24 h后菌相组成

表6 电解水处理虾夷扇贝24 h后菌相组成
3.3 微酸性电解水处理后大肠菌群的变化
可上市的养殖贝类中大肠杆菌的安全限量,与欧盟制定的《双壳贝类和投放市场的卫生条件规定》(93/51/EEC)[17]和中国的《贝类净化技术规范》[18]是一致的,均为≤3 cfu/g。本研究中,虾夷扇贝体内的大肠菌群远远高于上述生食限量标准,但扇贝的食用方式主要是煮熟食用,国内并无相关规定,还有待进一步完善。
3.4 微酸性电解水处理后副溶血性弧菌数量的变化
副溶血性弧菌主要存在于近海岸的海水、海底沉积物和鱼虾贝类等海产品体内,是引起食源性疾病的主要病原之一[19]。相关文献中,微酸性电解水的杀菌效果验证多数是对食物表面消毒[7, 20]、食品加工表面材料[21],或者对纯菌液的杀灭效果[22-23],均可完全杀灭。本研究中,可能由于实验染副溶血性弧菌的浓度较高,与实际情况相比是一种非常极端的情况,在实验后期微酸性电解水有效杀菌成分已经消耗完毕的情况下,无法完全杀灭已经浸染入扇贝肠道内的副溶血性弧菌,导致结果与上述研究结果有所差距。
3.5 扇贝菌相的变化
水产品在相同的地理条件下,同类型产品中只有一种或几种微生物总是作为优势腐败菌出现。水产品贝类的优势菌群为假单胞菌、腐败希瓦氏菌、弧菌、肠杆菌等[24]。本实验虾夷扇贝24 h后的优势菌群为假单胞菌,假单胞菌为专性需氧的革兰氏阴性杆菌,无芽孢,是假单胞菌科的细菌模式属,其广泛存在于海水、淡水和土壤中,是一种条件致病菌。研究发现,假单胞菌是太平洋牡蛎在0 ℃、5 ℃和10 ℃条件下的优势腐败菌[25],同时也是多种水产品的优势腐败菌[26-27]。本实验中,鲜活虾夷扇贝净化前后其体内的优势菌群主要为假单胞菌,在后续的保活流通中需要特别注意。
4 结论
利用微酸性电解水处理活品虾夷扇贝可以提高扇贝的存活率;微酸性电解水的处理时间与细菌总数和大肠菌群的数量有显著正相关(P>0.05),与有效氯质量浓度(ACC)没有相关性(P<0.05);微酸性电解水在净化后可以杀灭相当一部分的副溶血性弧菌,但如果副溶血性弧菌浓度过高则需要考虑细菌残留问题;虾夷扇贝在电解水处理后,后期繁殖的优势菌是假单胞菌。
本研究的不足之处是:未检测经微酸性电解水处理后活品虾夷扇贝的生理活性变化;微酸性电解水对虾夷扇贝可能会造成扇贝的应激反应,没有对这些反应进行实验观察。微酸性电解水如果应用于大规模工厂化生产,其成本和制作工艺是否需要改进还需要进一步实验证明。
□
[1] 聂芳红,谢日东,雷晓凌,等.湛江水产品中大肠菌群的分离鉴定与分类研究[J].广东农业科学,2014(6):166-171.
[2] 陈洪友,屠丽红,陈敏,等.贝类水产中副溶血性弧菌菌型分布研究[J].疾病监测,2014(7):522-527.
[3] 胡婕,陈茂义,陈婷,等.水产品及其环境中副溶血性弧菌污染状况与毒力基因分布研究[J].公共卫生与预防医学,2013(4):33-37.
[4] 高玮,金沁,赵冉.贝类产品中副溶血性弧菌的污染状况调查[J].江苏农业科学,2014(2):258-259.
[5] 周剑君,徐善良,王丹丽.双壳贝类的微生物污染途径及净化技术[J].生物学通报, 2008(6):15-17.
[6] 蓝蔚青,谢晶.酸性电解水对冷藏带鱼保鲜效果的影响研究[J].天然产物研究与开发,2011(5).913-917.
[7] 孙芳艳,钱培芬.微酸性电解水的临床应用与进展[J].上海护理.2011,11(2):66-69
[8] 曹薇,张春玲,李保明.喷洒微酸性电解水对荞麦芽菜生长的影响[J].农业工程学报,2012(9):159-164.
[9] 梁永娅,余晓青, MIDORI KURAHASHI,等. 微酸性电解水的研究与应用展望[J].科技创新导报,2012(34):27-28.
[10]DING T, RAHMAN S M E, OH D. Inhibitory effects of low concentration electrolyzed water and other sanitizers against food borne pathogens on oyster mushroom [J]. Food Control, 2011,22(2):318-322.
[11]GB 4789.2-2010,食品安全标准 食品微生物学检验 菌落总数测定[S].
[12]GB 4789.3-2010,食品安全标准 食品微生物学检验 大肠菌群计数[S].
[13]GB 4789.7-2013,食品安全标准 食品微生物学检验 副溶血性弧菌检验[S].
[14]布坎南(R.E.Buchanan)等, 中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组译. 伯杰细菌鉴定手册[M]. 北京:科学出版社, 1984.
[15]BAGGE-RAVN D, NG Y, HJELM M,etal. The microbial ecology of processing equipment in different fish industries—analysis of the microflora during processing and following cleaning and disinfection [J]. International Journal of Food Microbiology, 2003,87(3):239-250.
[16]HAO J X, QIU S, LI H Y,etal. Roles of hydroxyl radicals in electrolyzed oxidizing water (EOW) for the inactivation of Escherichia coli [J]. International Journal of Food Microbiology, 2012,155(3):99-104.
[17]93/51/EEC, On the mirobiological criteria applicable to the production of cooked crustaceans and molluscan shellfish. Official Journal of European Commnities,NoL13,11-13[S]
[18]SC/T 3013-2002 中华人民共和国水产标准 贝类净化技术规范[S]
[19]陶晶,杨瑞金,张文斌,等.牡蛎净化工艺的研究[J].食品科技,2008(7):108-112.
[20]赵越,费飞.葫芦岛市海产品副溶血性弧菌感染率的调查[J].中国城乡企业卫生,2014(4):69-70.
[21]沈晓盛,鲁健章,姝亚,等.电解水的抑菌活性及对食品加工表面材料的消毒效果[J].微生物学通报, 2007(3):483-486.
[22]HUANG Y R, HSIEH H S, LIN S Y,etal. Application of electrolyzed oxidizing water on the reduction of bacterial contamination for seafood [J]. Food Control, 2006,17(12):987-993.
[23]WANG J J, ZHANG Z H, LI J B,etal. ModelingVibrioparahaemolyticusinactivation by acidic electrolyzed water on cooked shrimp using response surface methodology [J]. Food Control, 2014,36(1):273-279.
[24]谢军,孙晓红,潘迎捷,等.酸性电解水对副溶血性弧菌的杀灭效果[J].江苏农业学报,2010(4):822-827.
[25]曹荣,薛勇,薛长湖,等.气调包装对太平洋牡蛎冷藏保鲜效果的研究[J].食品工业科技, 2009(5):307-309.
[26]GENNARI M, TOMASELLI S, COTRONA V. The microflora of fresh and spoiled sardines (Sardinapilchardus) caught in Adriatic (Mediterranean) Sea and stored in ice [J]. Food Microbiology, 1999,16(1):15-28.
[27]张璟晶,唐劲松,管远红,等.冰鲜银鲳鱼优势腐败菌的分离鉴定及其致腐能力分析[J].食品与机械, 2014(6):75-78.
The effects of slightly acidic electrolyzed water on the disinfection and survivial rate of live Japanese scallop (Patinopectenyessoensis)
LI Guowei1,2, FU Runze2,3, SHEN Jian2, FAN Wen2,3, XU Wenqi2
(1 College of Food Science and Technology, Guangdong Ocean University, Guangdong Provincial Key Laboratory of Aquatic Products Processing and Safety, Key Laboratory of Advanced Processing of Aquatic Products of Guangdong Higher Education Institution, National Research and Development Branch Center for Shellfish Processing (Zhanjiang),Zhanjiang 524088, China; 2 Fishery Machinery and Instrument Research Institute, Chinese Academy of Fishery Sciences, Shanghai 200092, China; 3 College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China)
The aims of this study were to test the feasibility of slightly acidic electrolyzed water directly used for sterilization and purification of live Japanese scallop. The live Japanese scallop as test object were treated with different physicochemical properties of slightly acidic electrolyzed water (SAEW), and then artificially dipped withVibrioparahaemolyticus. The disinfection effect of slightly acidic electrolyzed water, the survival rate of the scallop, the variation ofV.parahaemolyticusand the microflora in different stages of water treatment were tested or determined by statistical method and biochemical experiments. The results showed that the survival rates after 1min group, 2 min group and 4min group treated with slightly acidic electrolyzed water were all 82%, 8min group was 80%, the survival rates of the scallop in slightly acidic electrolyzed water groups were higher than that of the control (infected) group. The time of electrolyzed water treatment was significantly positive correlated with the total number of bacteria and coliforms (p<0.05), and was no significantly related to the effective chlorine concentration of the electrolytic water used in the process of treatment (p>0.05). And the quantity ofV.parahaemolyticusin the live scallop fell from >1 100 MPN/g to 28 MPN/g along with time extending of treatment of the electrolyzed water. In this experiment, the main bacteria in the early stage of the scallop werePseudomonasandVibrio. After the treatment, bacteria in the scallop tended to be complex, the dominant bacteria changed and the total number of bacteria decreased. The specific spoilage organism (SSO) after 24 h wasPseudomonasin the treated scallop or not. In summary, SAEW has a potential application in the purification of live Japanese scallop.
live Japanese scallop (Patinopectenyessoensis); slightly acidic electrolyzed water; survival rate; disinfection effect;Vibrioparahaemolyticus; microflora
2015-09-25
2015-12-19
国家科技支撑计划课题(2015BAD17B01);现代农业产业技术体系—贝类体系“贝类保活流通与初加工(CARS4808B)”
李国威(1990—),男,硕士研究生,研究方向:海洋生物资源利用。E-mail:gdlgw123@foxmail.com
沈建(1971—),男,研究员,研究方向:水产品加工技术装备。E-mail:shenjian@fmiri.ac.cn
10.3969/j.issn.1007-9580.2016.01.013
S983
A
1007-9580(2016)01-068-07

