双齿围沙蚕过氧化歧化酶活性对复合污染的不确定性响应
葛长字, 刘云松, 柴延超, 李云梦, 王海青, 阚慢慢
(1 山东大学深圳研究院,广东 深圳 518057; 2 山东大学(威海)海洋学院,山东 威海264209)
双齿围沙蚕过氧化歧化酶活性对复合污染的不确定性响应
葛长字1,2, 刘云松2, 柴延超2, 李云梦2, 王海青2, 阚慢慢2
(1 山东大学深圳研究院,广东 深圳 518057; 2 山东大学(威海)海洋学院,山东 威海264209)
内在底栖生物用于环境监测、生物修复时,为判断过氧化物歧化酶(SOD)活性用作生物指示物反映环境状况的适宜性,以海沙模拟生态毒理学模式生物双齿围沙蚕(Perinereisaibuhitensis)的生境,设计均匀试验并将双齿围沙蚕暴露于不同污染水平的重金属-营养盐-石油烃复合污染15 d,研究其SOD活性在有沉积物时的变化特征。结果显示,各个处理间双齿围沙蚕的SOD活性差异不显著;重金属、营养盐和石油烃均不能显著影响双齿围沙蚕的SOD活性;双齿围沙蚕的SOD活性和污染物之间不存在显著的剂量-毒性效应关系;双齿围沙蚕的SOD活性服从Logistic分布,SOD活性对复合污染的响应不确定。因此,SOD活性能否用于反映环境条件值得商榷;内在底栖生物用作生物监测/生物修复种时,应慎重使用SOD活性反映环境状况。
双齿围沙蚕;复合污染;SOD活性;不确定性响应
过氧化歧化酶(SOD)是生物抵御胁迫的首道防线,其活性与单一污染间有剂量-毒性效应关系[1],常作为生物指示物用于环境监测[2]。随着人类活动加剧,污染呈多元化和多源性的特点[3],以重金属、营养盐和石油烃为代表的复合污染尤其严重。寻求合适的生物指示物进行复合污染早期预警、生态修复效果评价已成为研究热点。内在底栖生物常被用作生物监测或生态修复,SOD活性反映环境状况的适应性却存在质疑。现有资料多是单一污染研究[4],复合污染对SOD活性的影响不明确。此外,以内在底栖生物为研究对象的生态毒理学研究,通常未模拟其生境[5]。因此,迄今为止尚难明确解答上述质疑。本文以海沙模拟生态毒理学模式生物——双齿围沙蚕(Perinereisaibuhitensis)的生境[6],将其暴露于重金属-营养盐-石油烃复合污染15 d,研究其SOD活性的变化。该研究结果将有助于判断当内在底栖生物用于环境监测、生态修复时,SOD活性作为生物指示物反映环境状况的适宜性。
1 材料与方法
1.1 材料
在铺有厚3 cm海沙的水槽中充气驯养双齿围沙蚕10 d,每3 d换水1次,每2 d过量投喂1次饲料(为有机物含量15.70 %的海带粉及养虾池塘底泥的混合物)。海沙经自来水清洗5~6遍,并在60 ℃下烘干,有机物含量0.08 %。海沙粒径≤0.180 mm、0.180~0.250 mm、0.250~0.425 mm、0.425~0.850 mm和≥0.850 mm的配比分别为(0.58±0.36)%、 (8.39±1.58)%、 (68.70±1.08)%、(21.73±2.84)%和(0.60±0.11)%。分别以原子荧光法、无火焰原子吸收分光光度法和荧光分光光度法测定海水(沙)中重金属汞(Hg)、镉(Cd)和石油烃含量,重金属和石油烃均为痕量;以靛酚蓝法测定经过处理的海水(沙)的氨氮(NH4+-N),结果显示未检出。
1.2 方法

表1 实验水体污染物浓度
注:*—未测出,为使用回归分析处理数据而以0.00计算。
1.3 统计分析
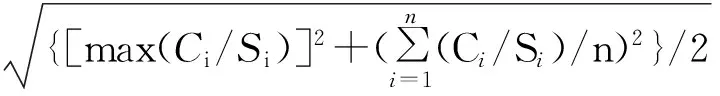
将综合污染程度视为一个因素,则上述均匀试验可视为一项16个水平的单因素完全随机化实验设计。方差齐性时,进行单因素方差分析并以Bonferroni检验,比较不同综合污染程度下的双齿围沙蚕SOD活性差异;否则以Dunnett’s-T3检验分析。为确定复合污染对SOD活性的影响,在SPSS13.0中进行多元回归分析。以Matlab2012b的dfittool工具箱确定SOD活性的分布形式,以corrcoef函数进行相关性分析。差异显著性水平为5 %。
2 结果
2.1 双齿围沙蚕SOD活性对复合污染的响应
当石油烃、NH4+-N、Hg2+和Cd2+浓度分别为435.00、3.00、0.00和0.10mg/L时,双齿围沙蚕SOD活性最大,为(16.48±1.78)U/mg;当浓度分别为217.50、4.00、5.00和0.36mg/L时,SOD活性最小,为(10.02±3.52)U/mg。各处理间的双齿围沙蚕SOD活性差异不显著(图1)。
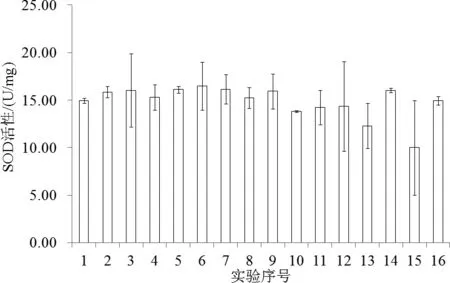
图1 复合污染下双齿围沙蚕SOD活性Fig.1 SOD activity of rag-worm under mutiple-contamination
2.2 污染物对双齿围沙蚕SOD活性的影响
回归分析获得14个反映复合污染对SOD活性影响的回归方程(表2)。这些方程的统计学意义都不显著,即SOD活性不受这些因素影响。

图2 双齿围沙蚕SOD活性分布Fig.2 Distribution of SOD activity of rag-worm

序号回归方程RP1y=(15.14±0.73)-(1.69±3.55)x10.290.642y=(14.67±0.93)-(2.45±3.68)x1+(0.16±0.19)x20.180.633y=(15.08±1.10)-(2.49±3.71)x1+(0.17±0.19)x2-(0.10±0.14)x30.220.714y=(14.61±1.36)-(2.54±3.76)x1+(0.16±0.19)x2-(0.08±0.15)x3+(1.00×10-3±0.00)x40.240.795y=(15.51±1.57)-(17.77±13.07)x1+(0.16±0.19)x2-(0.09±0.15)x3+(1.00×10-3±0.00)x4+(36.57±32.19)x120.320.706y=(14.96±1.81)-(15.56±13.37)x1+(0.60±0.73)x2-(0.09±0.15)x3+(1.00×10-3±0.00)x4+(33.19±33.01)x12-(0.06±0.09)x220.340.767y=(14.98±2.19)-(15.60±13.97)x1+(0.60±0.78)x2-(0.10±0.58)x3+(1.00×10-3±0.00)x4+(33.32±34.85)x12-(0.06±0.10)x22+(1.00×10-3±0.06)x320.340.858y=(15.90±2.93)-(18.12±15.12)x1+(0.44±0.86)x2-(0.20±0.62)x3-(3.00×10-3±0.10)x4+(40.64±38.51)x12-(0.04±0.11)x22+(0.01±0.06)x32+(7.06×10-6±0.00)x420.360.909y=(14.37±3.08)-(18.81±14.83)x1+(0.81±0.89)x2+(0.17±0.66)x3-(3.00×10-3±0.10)x4+(84.21±49.10)x12-(0.10±0.11)x22-(0.03±0.07)x32+(7.15×10-6±0.00)x42-(4.01±2.88)x1x20.440.7810y=(13.36±3.33)-(15.62±15.14)x1+(0.31±1.10)x2+(0.63±0.86)x3+(1.00×10-3±0.01)x4+(88.28±49.66)x12+(0.04±0.12)x22-(0.04±0.07)x32+(8.25×10-7±0.00)x42-(3.04±3.12)x1x2-(2.05±2.44)x1x30.470.7911y=(13.19±3.72)-(15.92±16.02)x1+(0.38±1.26)x2+(0.73±1.30)x3+(1.00×10-3±0.01)x4+(88.33±50.87)x12+(0.04±0.14)x22-(0.05±0.11)x32+(8.87×10-8±0.00)x42-(3.20±3.52)x1x2-(2.14±2.64)x1x3+(4.00×10-3±0.04)x1x40.470.8612y=(13.68±3.60)+(40.26±38.82)x1+(2.63±1.87)x2-(1.84±2.06)x3+(6.00×10-3±0.01)x4-(33.84±91.68)x12-(0.28±0.24)x22-(0.21±0.15)x32-(5.10×10-6±0.00)x42+(9.63±7.88)x1x2-(0.02±0.04)x1x3+(0.59±0.38)x1x4+(0.01±0.03)x2x30.560.7113y=(14.54±3.80)+(148.34±143.69)x1-(4.18±8.19)x2-(1.58±2.10)x3+(0.04±0.04)x4-(111.03±135.38)x12+(0.13±0.58)x22-(0.36±0.25)x32+(1.00×10-7±0.00)x42-(26.81±15.70)x1x2+(4.28±0.50)x1x3-(0.08±0.09)x1x4+(1.17±0.83)x2x3+(0.01±0.01)x2x40.580.7414y=(12.99±7.13)+(101.78±23.22)x1-(0.45±17.03)x2-(2.34±3.64)x3+(0.03±0.05)x4-(72.09±204.50)x12-(0.13±1.17)x22-(0.31±0.33)x32-(5.50×10-5±0.00)x42-(25.86±16.53)x1x2+(12.15±32.15)x1x3-(0.10±0.11)x1x4+(1.03±1.00)x2x3+(0.01±0.03)x2x4-(2.00×10-3±0.01)x3x40.580.81
注:x1、x2、x3和x4分别表示Hg2+、Cd2+、NH4+-N和石油烃的浓度;y表示SOD活性;括号内数值表示均值±标准误。
3 讨论
3.1 双齿围沙蚕SOD对复合污染的响应
各处理组间内梅罗污染指数最高值是最低值的5.45倍。因此,实验设计的污染物范围无论是从单一污染还是复合污染看,涵盖范围都较大。依据相关文献[7,16-17],双齿围沙蚕SOD活性应处于不同水平,然而研究结果与之相反,各处理组间的SOD活性差异并不显著。
SOD作为生物指示物多用于环境监测[18]。SOD等抗氧化系统酶对单一污染的响应规律基本一致,低浓度或短时间的污染物暴露会诱导SOD活性,而长时间或高浓度污染物暴露则会抑制SOD活性,存在剂量(时间)-毒性效应[19],SOD活性一般呈现先诱导后被抑制的现象[20]。不铺设沉积物,将双齿围沙蚕置于含苯并(α)芘的水体中,其SOD活性呈先被诱导而后被抑制的特点[21]。这种变化依赖于污染物和受试生物种类,如在马拉硫磷胁迫下,双齿围沙蚕SOD活性随污染物浓度升高而先下降后被诱导,最后被抑制[22]。然而,本研究中均未出现这两类变化规律,即SOD活性并未因处理水平变化而出现显著变化。分析认为,SOD活性与污染物存在剂量-毒性效应关系的实验,均未模拟受试生物的生境而直接将受试生物暴露于污染物[23]。本研究以海沙模拟双齿围沙蚕生境,海沙的存在减少了双齿围沙蚕暴露于污染物的表面积,减少了粘液分泌量,从而提高了其耐污性。这和以人工土壤模拟蚯蚓生境,蚯蚓SOD活性对除草剂的响应呈现出不确定性的结果相一致[24]。
3.2 SOD活性对生态胁迫响应的多样性
SOD活性对生态胁迫的响应与生物种类、生态胁迫类型、生态胁迫暴露时间等因素有关[25]。双齿围沙蚕直接置于含铅(Pb2+)水体的首日其SOD活性升高,暴露10 d后其SOD活性受到抑制[2]。鲈鱼(Dicentrarchuslabrax)暴露于呋喃丹96 h后,其游泳速度显著降低,而SOD活性并未发生显著变化[26]。单一因素Cd2+会降低大鼠SOD活性[27],而单一因素Cr6+能使大鼠SOD活性增加[28]。这种SOD活性对生态胁迫产生单调性响应大多是单因素实验结果。此外,即使是在单因素作用下,受试生物SOD活性的变化也未必是线性的。高浓度丙环唑会降低虹鳟SOD活性,而低浓度则会使SOD活性升高[29]。
多因素作用下,除各因素主效应外,其可能的交互效应会使SOD活性呈现出不同的响应特点。单独直接暴露于Cu2+或石油烃,前3 d双齿围沙蚕的SOD活性会降低,而在6 d后恢复到正常水平;Cu2+和石油烃对双齿围沙蚕SOD活性产生依赖于剂量和暴露时间的交互效应[23]。Cd2+能降低大鼠的SOD活性,氯化锌(ZnCl2)和亚硒酸钠(Na2SeO3)的添加则能矫正Cd2+的氧化效应[27]。同样,Na2SeO3能够矫正Cr6+产生的氧化胁迫[28]。因此,生物SOD活性对外界胁迫的响应具有多样性的特点。
本研究中双齿围沙蚕SOD活性服从Logistic分布,处于某一范围的SOD活性,其对应的环境条件不是唯一的。因此,应慎重利用SOD活性来反映环境条件,单纯利用SOD活性难以有效指示污染状况。
4 结论
模拟双齿围沙蚕生境,在实验设计的污染物浓度范围内,双齿围沙蚕SOD活性在各处理组间的差异不显著,各污染物对双齿围沙蚕SOD活性不产生显著影响,SOD活性与污染物间不存在显著的剂量-毒性效应关系。双齿围沙蚕SOD活性服从Logistic分布,相同的SOD值可以对应不同的环境条件,利用测定的SOD活性难以有效反映环境状况。SOD活性是否能用于反映环境条件值得商榷;内在底栖生物用作生物监测或生物修复种时,应慎重使用SOD活性来反映环境状况。
□
[1] 王军,霍军,程会昌,等.不同浓度菊酯类农药对黄河鲤鱼肝胰脏SOD活性和MDA含量的影响[J].江苏农业科学,2013,41(2):263-264.
[2] TIAN Y L, LIU H J, WANG Q X,etal. Acute and chronic toxic effects of Pb2+on polychaetePerinereisaibuhitensis:Morphological changes and responses of the antioxidant system [J]. Journal of Environmental Sciences, 2014, 26:1681-1688.
[3] 方叠,钱跃东,王勤耕,等.区域复合型大气污染调控模型研究[J].中国环境科学,2013,33(7):1215-1222.
[4] 栾红艳,赵卫红,苗辉. Cd2+胁迫下中肋骨条藻细胞内多胺的生理响应[J].中国环境科学,2015,35(5):1487-1494.
[5] 苏恩萍,孟范平,孙婷,等.短期暴露于城市污水处理厂尾水的文蛤抗氧化酶响应[J].中国环境科学,2014,34(2):511-517.
[6] YANG D Z, ZHOU Y B, ZHAO H,etal. Molecular cloning, sequencing, and expression analysis of cDNA encoding metalloprotein II(MP II) induced by single and combined metals (Cu(II), Cd(II)) in polychaetePerinereisaibuhitensis[J]. Environmental Toxicology and Pharmacology, 2012, 34:841-848.
[7] 王晶,周启星,张倩茹,等.沙蚕暴露于石油烃、Cu2+和Cd2+毒性效应及乙酰胆碱酯酶活性的响应[J].环境科学,2007,28(8):1796-1801.
[8] 王琳,潘鲁青,苗晶晶,等.汞、镉和苯并[a]芘、多氯联苯对栉孔扇贝幼贝单一与联合毒性的研究[J].海洋环境科学,2010,29(4):535-540.
[9] 王琳,潘鲁青,徐超群,等. Cd2+-苯并[a]芘复合污染对菲律宾蛤仔急性毒性和解毒代谢酶活力的影响[J].水生生物学报,2011, 35(1):37-44.
[10]阚文静,张秋丰,石海明,等.近年来渤海湾营养盐变化趋势研究[J].海洋环境科学,2010,29(2):238-241.
[11]曲丽梅,姚德,丛丕福.辽东湾氮磷营养盐变化特征及潜在性富营养评价[J].环境科学,2006,27(2):263-267.
[12]孙晓霞,孙松,赵增霞,等.胶州湾营养盐浓度与结构的长期变化[J].海洋与湖沼,2011,42(5):662-669.
[13]吴敏兰.北部湾北部海域营养盐的分布特征及其对生态系统的影响研究[D].厦门:厦门大学, 2014.
[14]关伯仁. 评内梅罗的污染指数[J]. 环境科学, 1994,4:67-71.
[15]GB3097-1997.海水水质标准 [S].
[16]孙福红,周启星,张倩如.石油烃、Cu2+对沙蚕的毒性效应及对其抗氧化酶系统的影响[J].环境科学,2006,27(7):1415-1419.
[17]孙福红,周启星.沙蚕耐污染的特征及机理研究进展[J].应用生态学报,2006,17(3):530-534.
[18]蒋玫,李磊,沈新强,等.基于综合生物标志物响应指数评价0#柴油和平湖原油胁迫下的縊蛏(Sinonovaculaconstricata)毒性效应[J].环境科学学报,2015,35(4):1174-1182.
[19]刚猛,高翔,吕昕璐,等. 0号柴油分散液对马粪海胆GPX活性的影响[J].海洋环境科学,2013,32(6):806-808.
[20]张宜奎,宋秀凯,刘爱英,等. Cd2+胁迫对文蛤鳃组织SOD、CAT活性及MDA含量的影响[J].安全与环境学报,2011,11(6):19-23.
[21]张宁,周启星,李婷,等.氧化型染发剂对沙蚕的毒性效应及对部分酶活性的影响[J].生态毒理学报,2008,3(1):65-71.
[22]吕林兰,董学兴,黄金田,等.马拉硫磷对双齿围沙蚕抗氧化酶的影响[J].安徽农业科学,2010,38(11):5719-5722.
[23]SUN F H, ZHOU Q X, WANG M,etal. Joint stress of copper and petroleum hydrocarbons on the polychaetePerinereisaibuhitensisat biochemical levels [J]. Ecotoxicology and Environmental Safety, 2009, 72:1887-1892.
[24]武贤莉,黄红琼,杨毅,等.除草剂对蚯蚓CAT和SOD活性的影响 [J].内江师范学院学报,2011,26(6):39-42.
[25]ATLI G, CANLI M. Response of antioxidant system of freshwater fishOreochromisniloticusto acute and chronic metal (Cd, Cu, Cr, Zn, Fe) exposure [J]. Ecotoxicology and Environmental Safety, 2010, 73:1884-1889.
[26]HERNA′NDEZ-MORENO D, PEREZ-LOPEZ M, SOLER F,etal. Effect of carbofuran on the sea bass (DicentrarchuslabraxL.):Study of biomarkers and behavior alterations [J]. Ecotoxicology and Environmental Safety, 2011, 74:1905-1912.
[27]JIHEN E H, IMED M, FATIMA H,etal. Protective effects of selenium (Se) and zinc (Zn) on cadmium (Cd) toxicity in the liver of the rat:Effects on the oxidative stress [J]. Ecotoxicology and Environmental Safety, 2009, 72:1559-1564.
[28]SOUDANI N, SEFI M, AMARA I B,etal. Protective effects of Selenium (Se) on Chromium (VI) induced nephrotoxicity in adult rats [J]. Ecotoxicology and Environmental Safety, 2010, 73:671-678.
[29]LI ZH, ZLABEK V, GRABIC R,etal. Biochemical and physiological responses in liver and muscle of rainbow trout after long-term exposure to propiconazole [J]. Ecotoxicology and Environmental Safety, 2010, 73:1391-1396.
Uncertain responses of SOD activity of rag-worm (Perinereisaibuhitensis) to multiple-contamination
GE Changzi1,2, LIU Yunsong2, CHAI Yanchao2, LI Yunmeng2, WANG Haiqing2, KAN Manman2
(1 Shenzhen Research Institute of Shandong University, Shenzhen 518057, China; 2 Marine College, Shandong University, Weihai 264209, China)
To judge suitability of SOD (Superoxide Dismutase) activity used as one biological indicator to reflect environmental conditions if buried type benthos is used for environmental monitoring or bioremediation, the following uniform experiments were conducted. Rag-worms (Perinereisaibuhitensis), one species of model organisms of ecological toxicology, were exposed to different concentration levels of multiple-contamination of heavy metals, nutrients and petroleum hydrocarbon for 15 days, during which inhabits of rag-worms were simulated by sands and SOD activity were measured. There was no significant difference of SOD activity of rag-worm under different treatments. SOD activity couldn’t be significantly influenced by heavy metals, nutrients and petroleum hydrocarbon. There was no dose-toxicity relation between SOD activity and contaminants. Responses of SOD activity to multiple-contamination were uncertain and SOD activity obeyed Logistic distribution. Thus, whether the SOD activity can be used for the inversion of environmental conditions should be deliberated. As buried type benthos is used for environmental monitoring and bioremediation, it should be cautious to select SOD activity as biological indicator to reflect the environmental conditions .
Perinereisaibuhitensis; multiple-contamination; SOD activity; uncertain response
2015-09-20
2016-01-11
山东省科技发展计划(2014GSF117042);中国博士后基金项目(2013M541905);深圳市科技发展计划项目(JCYJ20140418115449187);“十二五”国家支撑计划项目(2011BAD13B02);海洋公益性行业科研专项经费项目(201205001)。
葛长字(1973—), 男, 副教授, 研究方向:海洋生态学。E-mail:changzige@ouc.edu.cn
10.3969/j.issn.1007-9580.2016.01.002
X174
A
1007-9580(2016)01-007-06

