SBP1基因在涎腺肿瘤中的表达及相关性分析
李 伟,王银龙,朱友明,陆婧雅,朱 丽,许旭东,汪 聪
SBP1基因在涎腺肿瘤中的表达及相关性分析
李 伟1,王银龙1,朱友明1,陆婧雅1,朱 丽2,许旭东1,汪 聪1
目的 研究硒结合蛋白1(SBP1)在涎腺肿瘤中的表达情况,明确其与涎腺肿瘤发生、发展、侵袭及转移的关系。方法 收集15组涎腺肿瘤及其瘤旁组织,提取组织内RNA,采用实时荧光定量RT-PCR法检测组织中SBP1的表达。设计及合成SBP1的shRNA序列,慢病毒转染scc-3细胞,应用MTT、细胞划痕实验检测细胞增殖与迁移。结果 SBP1在涎腺肿瘤中的表达明显低于正常涎腺组织(P<0.05);划痕试验和MTT检测显示SBP1对肿瘤细胞的增殖与迁移起抑制作用。结论 SBP1在涎腺肿瘤组织中低表达,具有抑制肿瘤细胞的增殖和迁移能力。可作为涎腺肿瘤的早期诊断和预后判断的早期指标。
涎腺肿瘤;硒结合蛋白1;增殖;迁移
涎腺肿瘤约占头颈部肿瘤的3%~6%,其肿瘤细胞形态、组织结构和生物学行为具有多样性,涎腺肿瘤也比较多样及复杂,临床疗效难以预料[1]。研究[2]显示硒元素具有显著抗癌和预防癌症的效果。硒元素在体内是以硒蛋白质的形式存在,其中,硒结合蛋白1(Selenium binding protein 1,SBP1)被认为是硒元素抑癌作用的重要载体。人硒结合蛋白1
(SBP1)位于染色体lq21-22上,是一种特殊的含硒蛋白质,能够促进肿瘤细胞的凋亡。研究[3]表明SBP1在许多肿瘤组织中表达下调,这提示其与肿瘤的发生发展可能有关。目前,SBP1在涎腺肿瘤发生中的作用的相关研究较少。该研究选用人舌鳞状细胞癌scc-3细胞系,检测SBP1对其迁移与增殖的影响,选取15组良性涎腺肿瘤和正常涎腺组织,检测SBP1的表达水平。
1 材料与方法
1.1 细胞株 人舌癌鳞状细胞株scc-3由安徽医科大学口腔实验室提供。DMEM培养基+10%胎牛血清培养。
1.2 标本来源 组织来源:随机选取2014年5月~2015年5月安徽医科大学第一附属医院和安徽省口腔医院颌面外科经手术切除、病理证实的涎腺病变组织15例,及手术中切除的病变涎腺组织10 mm以外的正常涎腺组织15例。所有涎腺肿瘤患者为在院初诊患者,即之前未做过局部扩大切除手术,并且术前均未进行过放疗、化疗等治疗,病例组除涎腺肿瘤外,无其他系统性疾病。组织处理方法:将获取的组织样品置于冻存管内,并用记号笔标记编号。标本存置于液氮罐中保存待用。做好登记组织样品的详细内容,如组织类型、编号、日期以及患者的基本资料。
1.3 材料与仪器 DMEM培养基、胰蛋白酶、10%胎牛血清(美国HyClyone公司);逆转录反应试剂盒、QRT反应试剂盒(日本TaKaRa公司);质粒提取试剂盒(美国Axygen公司);RNA抽提试剂TRIzol、细胞裂解液(上海碧云天公司);构建载体所用的大肠杆菌Dh5α、病毒包装细胞系293T(安徽医科大学口腔实验室);沉默SPB1(shSBP1)(美国Sigma公司);限制性内切酶EcoR I和 Xba I(英国Invitrogen公司);24、12、6孔板(美国Corning Costar公司);无水乙醇、异丙醇(上海生物工程技术服务有限公司)。
1.4 方法
1.4.1 细胞培养 scc-3细胞株、293T细胞培养于含10%胎牛血清的DMEM培养基中,常规加入青霉素和链霉素,置5% CO2、饱和湿度、37 ℃培养箱内培养。根据细胞生长情况,2~3 d传代1次,取对数生长期的细胞用于实验。
1.4.2 过表达SBP1的构建及目的基因扩增 在Pubmed上检索人源性的SBP1的Nucleotide核苷酸序列,检索到SBP1的CDS序列后,利用DNA club软件设计出SBP1的基因序列,SBP1上游引物:5′-GCGAATTCATGCCAACAGGCCTGGTCAGG-3′,下游引物:5′-GCACGCGTCTAGACATCCTCTTCTGCATCT-3′。引物由上海生工生物工程技术服务有限公司合成。限制性内切酶为EcoR I:GAATTC;Xba I:TCTAGA。将含有待扩增序列的DNA为模板进行PCR反应,30 μl总体积包括:上游引物1 μl,下游引物1 μl,cDNA 1 μl,2×Pfu PCR MasterMix 15 μl,无菌蒸馏水12 μl。在PCR扩增仪上完成PCR扩增。反应条件如下:95 ℃预变性10 min,95 ℃变性1 min,56 ℃退火1 min,72 ℃延伸3 min,完成30个循环,最后72 ℃延伸10 min,置于4 ℃保温。将PCR反应产物进行琼脂糖凝胶电泳,电泳结果经紫外监测仪观察,并将目的条带进行产物回收。
1.4.3 质粒的扩增和提取 将设计引物时设计的限制性内切酶37 ℃水浴酶切相应DNA片段和表达载体,将酶切产物进行琼脂糖凝胶电泳并产物回收后,回收后的酶切产物和载体在T4连接酶下连接1 h后转入感受态大肠杆菌Dh5α,次日手抽酶切验证,并通过测序获得含有SBP1片段载体的大肠杆菌Dh5α菌株。
1.4.4 shSBP1病毒的包装及感染 2 μg PLKO.1空载或PLKO.1-SBP1、2 μg pREV、2 μg pGag和1 μg pVSVG转染入生长在6孔板中的HEK 293T细胞中,用纯DMEM培养基培养6 h后更换含有20%胎牛血清的DMEM培养基,培养24 h后,收集含有病毒的培养基上清液,上清液用0.45 μm PVDF 滤头(Millipore)过滤。过滤后含有病毒的培养基上清分别感染scc-3细胞,同时加入4 μg/ml polybrene(美国Sigma公司),37 ℃孵育24 h后更换含10%胎牛血清的DMEM培养基培养并加入5 μg/ml puromycin筛选细胞24 h。
1.4.5 划痕实验检测细胞迁移能力 取处于对数生长期的慢病毒感染的scc-3细胞,5×105个/每孔,均匀接种于6孔板,分为正常组、shSBP1组、SBP1过表达组,24 h后待细胞长至90%,用灭菌的移液器枪头,在培养板底部均匀划出两条划痕,然后用PBS洗去被划下的细胞,并以此时间点作为0 h,细胞用hochest染色后,0、24、48 h时用荧光显微镜下观察细胞迁移情况,并进行拍照、比较。
1.4.6 MTT法检测细胞增殖能力 取对数生长期的scc-3细胞,分为正常组、shSBP1组、SBP1过表达组,2 000个/每孔均匀接种于96孔板,每孔加入体积200 μl培养基培养,每组设3个复孔,用倒置显微镜观察细胞情况,待细胞贴壁后,按时间梯度加入药物,加入20 μl MTT溶液(终浓度为5 g/L),37 ℃孵育4 h后吸走上清液,每孔加入DMSO 150 μl,震荡10 min,用酶联免疫监测仪测定各孔吸收值,绘制细胞生长曲线。
1.4.7 实时荧光定量逆转录聚合酶连反应(qRT-PCR)检测SBP1 mRNA的表达水平 总RNA提取及cDNA合成:取100 mg冷冻的涎腺肿瘤组织及瘤旁组织,用组织剪剪碎,TRIzol法获取组织总RNA。取总RNA进行逆转录获得cDNA,-20 ℃保存备用。qRT-PCR法检测SBP1 mRNA的相对表达水平,SBP1及内参β-actin的引物经GenBank检索引物序列并设计合成。扩增条件:94 ℃预变性1 min,94 ℃变性1 min,56 ℃退火1 min,72 ℃延伸2 min,共30个循环。待反应结束后,取反应产物进行琼脂糖凝胶电泳检测,电泳后紫外灯下观察电泳条带并进行拍照。

2 结果
2.1 SBP1对细胞迁移的影响 SBP1被认为是硒元素抑癌作用的重要载体,通过划痕实验可以看出当培养48 h后正常组与SBP1过表达组比较,细胞向中间迁移速度明显较快(图1A),而在scc-3肿瘤细胞株中沉默SBP1时,24 h后shSBP1组向中间迁移的速度明显快于正常组(图1B),差异有统计学意义(P<0.05)。过表达SBP1可抑制细胞迁移,而敲低SBP1明显促进细胞的迁移,说明SBP1具有抑制细胞迁移的能力。

图1 划痕试验检测SBP1对肿瘤细胞迁移能力的影响
A:scc-3肿瘤细胞分别感染正常组和SBP1过表达组,48 h后观察和比较两组细胞的迁移能力;B:scc-3肿瘤细胞分别感染正常组和shSBP1组,24 h后观察和比较两组细胞的迁移能力
2.2 SBP1对细胞增殖的影响 通过MTT实验检测不同SBP1表达程度时scc-3的生长曲线,差异有统计学意义(P<0.05),48 h后,正常组较SBP1过表达组细胞增殖能力明显较高(图2A),而在scc-3肿瘤细胞株中沉默SBP1时,shSBP1组细胞增殖能力则明显高于正常组(图2B)。过表达SBP1可抑制肿瘤细胞增殖,而敲低SBP1则促进肿瘤细胞增殖。说明SBP1具有抑制细胞增殖的能力。
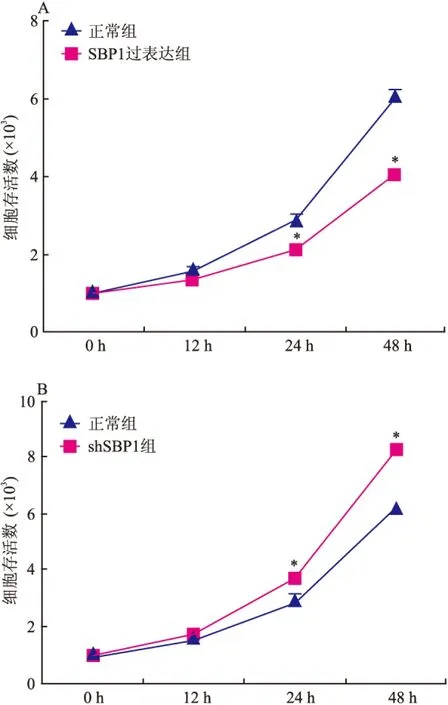
图2 MTT法检测SBP1对肿瘤细胞增殖能力的影响
A:scc-3肿瘤细胞分别感染正常组和SBP1过表达组,检测不同时间段scc-3肿瘤细胞的活性;B:scc-3肿瘤细胞分别感染正常组和shSBP1组,检测不同时间段scc-3肿瘤细胞的活性;与正常组比较:*P<0.05
2.3 SBP1在涎腺肿瘤组织的表达 应用qRT-PCR法检测15对良性涎腺肿瘤组织和瘤旁组织中SBP1 mRNA的表达水平,差异有统计学意义(P<0.05)。11例肿瘤组织SBP1 mRNA的表达水平均低于相应的瘤旁组织,4例肿瘤组织SBP1 mRNA的表达水平则高于相应的瘤旁组织。表明在涎腺肿瘤组织中,SBP1的表达水平呈现下调趋势。见图3。
3 讨论
肿瘤指在各种致瘤因素的作用下,机体局部组织的细胞在基因水平上无法调控自身的生长过程,导致单克隆性异常增生而形成的新生物。涎腺肿瘤约占口腔颌面部肿瘤的20%,发病率较高,并不断上升。涎腺肿瘤细胞的形态、组织结构和生物学行为比较复杂,涎腺肿瘤种类也比较多样[4],临床疗效较差。因缺乏特异性的早期检测涎腺肿瘤的生物学标记,难以做到早发现、早诊断、早治疗。

图3 涎腺肿瘤组织中SBP1的表达1~15:涎腺肿瘤和瘤旁组织标号
学者们对涎腺肿瘤的发病机制进行大量研究,认为肿瘤的发生可能与体内某些元素的缺失有关,硒元素是其中的一种。硒是人体内具有抗癌活性的微量元素,SBP1是一种与其他含硒蛋白质有明显差异的特殊的蛋白。SBP1参与了细胞周期的调控,与多种肿瘤的发生、发展及预后相关。与正常组织比较,SBP1在前列腺癌[5]、胃癌[6]、结直肠癌[7]等组织中表达明显减少。大量学者认为SBP1的表达变化可能是肿瘤发生发展的重要事件,SBP1对细胞周期进行调控,抑制肿瘤细胞生长,其表达减少可能是正常细胞向肿瘤细胞转化的过程。研究[8]显示SBP1通过阻止过氧化物对DNA的损伤,增加p53和COX-2的表达,从而改变DNA、RNA、蛋白质的合成,阻止癌细胞的生长等。研究[9]表明SBP1的表达受到低氧诱导因子-1α(hypoxia-inducible factor-1α)的调控,HIF-1α在低氧条件下表达增高并诱导多种靶基因表达,进而调节细胞增殖、血管新生和重构。
肿瘤发生的过程是多阶段并逐步演进,细胞通过一系列进行性的改变向恶性发展[10-11]。本研究MTT检测结果显示SBP1基因的表达,使肿瘤细胞的增殖能力受到抑制。划痕试验结果显示SBP1的表达使肿瘤细胞的迁移能力受到抑制。说明SBP1可能参与肿瘤细胞周期的调控。
涎腺肿瘤组织中SBP1的表达水平显著低于瘤旁组织。提示:① SBP1与涎腺肿瘤的发生有关,可能在一定程度上抑制了涎腺肿瘤的发生及发展;② SBP1可能是涎腺组织中的生理蛋白,但是处于激活状态,一旦体内特定通路遭到抑制,便诱导了肿瘤的发生;③ SBP1可作为涎腺肿瘤的肿瘤标志物,进一步研究在不同的涎腺肿瘤中的表达量,对肿瘤作出明确诊断;④ 可以探寻SBP1基因失活的通道,进行早期干预,阻止肿瘤的发生发展;⑤ 本研究显示并非所有的肿瘤组织中SBP1都呈低表达,说明在涎腺肿瘤的发生过程中SBP1是其发生的一个重要因素,但是并不是导致涎腺肿瘤发生的唯一原因,与SBP1无关因素在涎腺肿瘤发生过程中也发挥重要作用,涎腺肿瘤的发生是多种因素综合产生的结果,这也是日后研究的重点。
[1] Bansal A K,Bindal R,Kapoor C, et al. Current concepts in diagnosis of unusual salivary gland tumors[J]. Dent Res J(Isfahan), 2012, 9(Suppl 1):S9-S19.
[2] Björnstedt M, Fernandes A P. Selenium in the prevention of human cancers[J]. EPMA J, 2010, 1(3): 389-95.
[3] Jerome-Morais A,Wright M E,Liu R, et al. Inverse association between glutathione peroxidase activity and both selenium-binding protein 1 levels and gleason score in human prostate tissue[J]. Prostate, 2012, 72(9):1006-12.
[4] Donadio E, Giusti L, Seccia V, et al. New insight into benign tumours of major salivary glands by proteomic approach[J]. PLoS One, 2013, 8(8): e71874.
[5] Ansong E, Ying Q, Ekoue D N, et al. Evidence that selenium binding protein 1 is a tumor suppressor in prostate cancer[J]. PLoS One,2015, 10(5): e0127295.
[6] Zhang C, Xu W, Pan W, et al. Selenium-binding protein 1 may decrease gastric cellular proliferation and migration[J]. Int J Oncol, 2013, 42(5): 1620-9.
[7] Pohl N M, Tong C, Fang W, et al. Transcriptional regulation and biological functions of selenium-binding protein 1 in colorectal cancerinvitroand in nude mouse xenografts[J]. PLoS One, 2009, 4(11): e7774.
[8] Silvers A L, Lin L, Bass A J, et al. Decreased selenium-binding protein 1 in esophageal adenocarcinoma results from posttranscriptional and epigenetic regulation and affects chemosensitivity[J]. Clin Cancer Res, 2010, 16(7): 2009-21.
[9] Scortegagna M, Martin R J, Kladney R D, et al. Hypoxia-inducible factor-1 suppresses squamous carcinogenic progression and epithelial-mesenchymal transition[J]. Cancer Res, 2009, 69(6): 2638-46.
[10]Chen S H, Li D, Xu C. Downregulation of Col1a1 induces differentiation in mouse spermatogonia[J]. Asian J Androl, 2012, 14(6):842-9.
[11]Terova G, Rimoldi S, Bernardini G, et al. Inhibition of myostatin gene expression in skeletal muscle of fish byinvivoelectrically mediated dsRNA and shRNAi delivery[J]. Mol Biotechnol, 2013, 54(2): 673-84.
Expression of SBP1 gene in salivary gland tumor
Li Wei,Wang Yinlong,Zhu Youming,et al
(DeptofOralandMaxillofacialSuger,TheAffiliatedStomatologyHospitalofAnhuiMedicalUniversity,Hefei230032)
Objective Selenium binding protein 1 (SBP1) located on chromosome lq21-22, a kind of special selenium protein,can promote the apoptosis of tumor cells.To discuss the expression of human SBP1 and to clarify its relationship with the occurrence, development, invasion and metastasis in salivary gland tumor. Methods The salivary gland tumor tissues (n=15) were collected and their mRNA was abstracted. The relative expression of SBP1 was quantified by SYBR Green real-time PCR. SBP1 lentivirus were transfected into scc-3 cells after designing shRNA SBP1 sequence.The proliferation and growth ability of SBP1 were detected by MTT test respectively,and migration ability was detected by cell scratch assay. Results The positive rates of expression of SBP1 were significantly lower in tumor tissues (P<0.05). SBP1 inhibited tumor cell proliferation and migration ability. Conclusion The expressions of SBP1 in salivary gland tumor and peritumoral tissue are different.Low expression of SBP1 may inhibit tumor cell proliferation and migration ability.It is a reliable marker of earlier period diagnosis and prognosis of the salivary gland tumor.
salivary gland tumor; selenium binding protein 1; proliferation; metastasis
时间:2016-8-10 11:04:48
http://www.cnki.net/kcms/detail/34.1065.R.20160810.1104.012.html
2016-06-12接收
国家自然科学基金(编号:31501103);安徽省自然科学基金(编号:1508085QC62)
1安徽医科大学附属口腔医院口腔颌面外科,合肥 230032
2安徽医科大学第二附属医院儿科,合肥 230601
李 伟,女,硕士研究生;
王银龙,男,教授,硕士生导师,责任作者,E-mail:wangylah@sina.com
R 739.8
A
1000-1492(2016)10-1449-05
10.19405/j.cnki.issn1000-1492.2016.10.012

