二去水卫矛醇对肺癌NCI-H460细胞DNA拓扑异构酶Ⅱ的抑制作用
黄银妹,刘华钢,苏桂玉,李英杰,王小洁,蒋 霞
(1. 广西医科大学药学院,广西 南宁 530021;2.广西食品药品监督管理局,广西 南宁 530022;3.广西中医药大学药学院,广西 南宁 530001;4.暨南大学药学院中药及天然药物研究所,广东 广州 510632;5.广西医科大学第一附属医院临床药学部,广西 南宁 530021)
二去水卫矛醇对肺癌NCI-H460细胞DNA拓扑异构酶Ⅱ的抑制作用
黄银妹1,刘华钢2,苏桂玉3,李英杰4,王小洁1,蒋 霞5
(1. 广西医科大学药学院,广西 南宁 530021;2.广西食品药品监督管理局,广西 南宁 530022;3.广西中医药大学药学院,广西 南宁 530001;4.暨南大学药学院中药及天然药物研究所,广东 广州 510632;5.广西医科大学第一附属医院临床药学部,广西 南宁 530021)
目的 评价二去水卫矛醇(dianhydrogalactitol, DAG)在肺癌NCI-H460细胞上的抗肿瘤作用,探讨其抗肿瘤作用机制。方法 采用CCK-8法、细胞克隆形成实验,评价DAG对NCI-H460细胞的增殖抑制作用。显微拍照观察细胞形态改变;Hoechst 33342检测细胞核染色质的变化。Real time PCR法检测拓扑异构酶Ⅱ(Topo Ⅱ)mRNA的表达水平。Western blot法检测Topo Ⅱ蛋白表达水平。另外,应用计算机模拟分子对接技术来预测DAG与Topo Ⅱ的相互作用。
二去水卫矛醇;肺癌;NCI-H460细胞;拓扑异构酶Ⅱ;拓扑异构酶Ⅱ抑制剂;分子对接
肺癌是最常见的恶性肿瘤之一,严重影响着人类的生命健康。在我国的癌症统计数据中,肺癌的发病率和死亡率均位居第一位,是癌症死亡的主要原因。在新增癌症患者中,肺癌的发病率逐年上升。据估计,2015年我国肺癌患者新增病例数将会达到73.33万人,死亡人数达到61.02万人[1]。Topo Ⅱ对于真核细胞的存活起着重要的作用,其在DNA的复制、转录、重组过程中,以及在形成正确的染色体结构、染色体分离和浓缩中发挥着重要的作用[2],是抗肿瘤药物的重要靶标。Topo Ⅱ抑制剂按抑制机制可以分为催化抑制剂和毒剂,Topo Ⅱ催化抑制剂作用于Topo Ⅱ催化反应的各个不同阶段,抑制Topo Ⅱ的催化活性;而Topo Ⅱ毒剂能够捕获并稳定Topo Ⅱ催化过程的中间产物——可切割复合物,造成DNA双链断裂[3]。例如,阿克拉霉素和依托泊苷作为Topo Ⅱ抑制剂应用于临床,但阿克拉霉素心脏毒性大,依托泊苷骨髓抑制作用较明显。因此,寻找新型高效低毒的Topo Ⅱ抑制剂是目前迫切需要解决的问题。
从天然植物中提取化合物进行筛选和发掘,是开发高效低毒抗癌药物的重要途径。如从罗汉果分离出的罗汉果醇被证明具有诱导肺癌细胞A549 凋亡的作用[4]。二去水卫矛醇(1,2:5,6-dianhydrogaIactitol, DAG)也是一种新型的植物生物碱类抗肿瘤药,属己糖醇类化合物,其化学名称为1,2,5,6-二脱水半乳糖醇。DAG是主产于广西的卫矛科植物蜜花美登木(Meytenusconfertiflotus)中分离出的卫矛醇(dulcitol)为原料[5],经溴化、消除反应而制得的1,6-二溴卫矛醇的双环氧化产物。其具有易溶于水,抗肿瘤活性高等优点[6]。DAG目前已应用于临床,主要用于慢性粒细胞性白血病的治疗[7]。DAG对恶性胶质瘤也有疗效,目前已进入Ⅱ期临床研究[8]。此外,DAG还对复发性脑瘤、胃癌、肝癌、鼻咽癌等均有抑制作用[9-10]。值得注意的是,DAG在临床上也应用于肺癌的治疗,且疗效明显[11]。然而,DAG抗肺癌作用机制尚不清楚。据研究报道,DAG抗肿瘤的主要机制是直接结合到DNA或RNA上,从而影响DNA的复制和转录[12]。然而,国内外关于DAG与Topo Ⅱ相互作用的机制尚未报道。为此,本研究将探讨DAG对肺癌细胞DNA Topo Ⅱ表达的影响,为DAG的临床应用提供新的科学依据。
1 材料与方法
1.1 材料
1.1.1 药物与试剂 DAG由广西梧州制药(集团)股份有限公司提供;依托泊苷(VP16)为齐鲁制药有限公司产品;RPMI 1640培养基为美国Hyclone公司产品;胎牛血清为浙江天杭生物科技股份有限公司产品;青霉素-链霉素为北京索莱宝科技有限公司产品;0.25%胰蛋白酶为美国Thermo Fisher公司产品;CCK-8为上海尚宝生物科技有限公司产品;Hoechst 33342为南京凯基生物科技发展有限公司产品;RNA提取试剂盒、逆转录试剂盒、荧光定量试剂盒均为日本TaKaRa公司产品;Topo Ⅱα和Topo Ⅱβ抗体为美国Abcam公司产品;β-actin抗体和二抗均为美国CST公司产品。
1.1.2 细胞培养 人肺癌细胞NCI-H460购自中科院上海细胞库。细胞接种在25 cm2培养瓶中,所用培养基含有RPMI 1640培养基、10%(V/V)胎牛血清与1%(V/V)青霉素-链霉素,在37℃、5%(V/V)CO2培养箱中培养。
1.1.3 仪器 CO2培养箱(美国Thermo Forma公司);酶标仪(香港分子仪器公司);荧光倒置显微镜(日本Olympus公司);实时荧光定量PCR仪(美国ABI公司) ;蛋白免疫印记系统(美国Bio-Rad公司)。
1.2 方法
1.2.1 CCK-8实验方法 取处于对数生长期的细胞,接种于96孔培养板,每孔加入5.0×103个细胞。设空白组、对照组和不同浓度的给药组,待细胞贴壁,加入不同浓度的药物。药物作用48 h后吸出培养基,每孔加入CCK-8 10 μL,在培养箱中孵育1.5 h,使用酶标仪在450 nm处测定吸光度,计算细胞存活率。同时,以依托泊苷做为阳性对照。使用Graphpad软件计算半数抑制浓度(IC50)。
1.2.2 集落形成实验 取处于对数生长期的细胞,接种于6孔培养板,每孔加入300个细胞。设空白对照组和不同浓度的给药组,待细胞贴壁,加入不同浓度的药物。同时,以依托泊苷做为阳性对照。药物作用24 h后吸出培养基,同时加入5 mL新鲜培养基,培养7 d后吸出培养基,用甲醇在-20℃条件下固定细胞30 min,加入结晶紫染色15 min, PBS清洗2次后,记录每孔细胞团的数目。
1.2.3 细胞形态学观察 取处于对数生长期的细胞,接种于6孔培养板,每孔加入3.0×105个细胞。设空白对照组和不同浓度的给药组,24 h后,加入不同浓度的药物。药物作用24 h后吸出培养液,PBS清洗2次。在倒置显微镜下观察细胞的形态,并随机拍照。
1.2.4 Hoechst 33342染色 取处于对数生长期的细胞,接种于6孔培养板,每孔加入3.0×105个细胞。设空白对照组和不同浓度的给药组,细胞贴壁后,加入不同浓度的药物。药物作用48 h后吸出培养基,用PBS清洗1次,每孔加入PBS(含1 g·L-1Hoechst 33342),在37℃培养箱中避光孵育10 min。用PBS清洗2次,在激发波长350 nm,发射波长460 nm的荧光显微镜下随机拍照。
1.2.5 Western blot 取处于对数生长的细胞,接种于6孔培养板,每孔加入3.0×105个细胞。培养24 h后,设置空白对照组和不同浓度的给药组,作用48 h。收集各组细胞,采用RIPA裂解液裂解细胞后,离心收集上清。使用BCA蛋白定量试剂盒测定蛋白浓度后,按每孔30 μg蛋白电泳分离,然后将蛋白转到PVDF膜上,5%(W/W)牛奶封闭后敷上Topo Ⅱα和Topo Ⅱβ抗体,以β-actin作为内参。孵完一抗后,室温下孵育二抗1 h,接着用ECL显影液曝光显影。蛋白条带应用Image J软件进行光密度值定量分析。
1.2.6 Real time PCR检测Topo Ⅱ在肺癌NCI-H460细胞的表达 取处于对数生长期的细胞,接种于25 cm2培养瓶,每瓶加入1.0×106个细胞。设空白对照组和不同浓度的给药组,待细胞贴壁,加入不同浓度的药物。药物作用48 h后,按照TRIzol裂解液说明书提取细胞总RNA。取2 μg RNA做逆转录模板,按照说明书合成cDNA。引物由北京六合华大基因科技股份有限公司合成。Topo Ⅱα上游序列:5′-TTGCAGCCCATTGGTCAGTT-3′,下游序列:5′-AGGACCACCCAGTACCGATT-3′。Topo Ⅱβ上游序列:5′-GTGCTGAGGGCATTGGTACT-3′,下游序列:5′-AGCAGCTTCTGCTTGTGCTA-3′。β-actin上游序列:5′-ACAGAGCCTCGCCTTTGCC-3′,下游序列:5′-GCGTACAGGGATAGCACAGC-3′。 Real time PCR反应体系为20 μL。应用SYBR Green试剂盒,在ABI7300 Real time PCR 系统中进行。
1.2.7 模拟分子对接 为了研究DAG与TOP Ⅱ的分子对接方式,我们运用了Sybyl 8.0软件(Tripos Inc.)中的Surflex-dock模块。人Topo Ⅱα ATPase(PDB code: 1ZXM)的晶体结构和Topo Ⅱβ(PDB code:3QX3)的晶体结构是从蛋白数据Protein Data Bank(PDB)中获得[13-14]。DAG、沙尔威辛和依托泊苷3D结构的确定是根据其平面化学结构和手性,并对其进行能量最小化。采用自动搜索模式,将沙尔威辛对接进入Topo Ⅱα,依托泊苷对接进入Topo Ⅱβ。利用分数最高的结合模式做为最优结合。按上述对接方法,将DAG对接入Topo Ⅱ结构,以研究其与Topo Ⅱ的结合位点。
2 结果
2.1 DAG对NCI-H460细胞增殖活力的影响 CCK-8细胞活力检测结果显示,经不同浓度DAG作用48 h后,NCI-H460细胞的OD值与对照组相比呈下降趋势,且具有明显浓度依赖性关系,其IC50为(9.68±1.02) mg·L-1,而阳性对照依托泊苷的IC50为(5.19±0.53) mg·L-1。提示DAG具有明显的体外抗肺癌活性,但其活性稍弱于依托泊苷。见Fig 1。

Fig 1 Cell viability of NCI-H460 cells treated with DAG and VP16 respectively
2.2 DAG对NCI-H460细胞克隆形成的影响 细胞克隆形成实验结果表明,DAG在处理24 h后撤除药物继续培养,依然能明显地抑制NCI-H460细胞克隆团的形成,并呈剂量依赖性,与阳性药依托泊苷效果类似。上述结果表明DAG能持续抑制NCI-H460细胞的增殖。见Fig 2。
2.3 DAG对NCI-H460细胞形态的影响 在倒置显微镜下观察,各给药组细胞均不同程度出现细胞变圆缩小、贴壁能力减弱、胞质内颗粒边缘化,甚至细胞破碎等损伤现象,随着浓度的增加,细胞数量明显减少,而空白组细胞生长良好,细胞形态完整。见Fig 3。

Fig 2 The colony numbers of NCI-H460 cells treated with DAG and VP16 respectively
**P<0.01vscontrol

Fig 3 Morphological changes of NCI-H460 cells treated with DAG(×200)
A: Control group; B: DAG 2.5 mg·L-1; C: DAG 5.0 mg·L-1; D: DAG 10.0 mg·L-1. Scale bar: 50 μm
2.4 DAG 引起NCI-H460细胞核染色质的变化 Hoechst 33342是一种可以穿过细胞膜与染色质结合的蓝色荧光染料。细胞染色后通过荧光显微镜观察,结果显示正常未给药组细胞内荧光较弱,细胞核形态正常,DAG作用48 h后细胞内荧光强度随DAG浓度的提高明显增强,并出现胞核形态异常,凝缩现象,提示DAG对NCI-H460细胞的DNA具有损伤作用。见Fig 4。

Fig 4 Morphological changes of nucleus induced by DAG in NCI-H460 cells (×200,stained with Hoechst 33342)
A: Control group; B: DAG 2.5 mg·L-1; C: DAG 5.0 mg·L-1; D: DAG 10.0 mg·L-1. Scale bar: 50 μm
2.5 DAG对NCI-H460细胞Topo Ⅱ mRNA的影响 Topo Ⅱ在DNA的复制、转录、重组过程中具有重要作用,当Topo Ⅱ受到抑制时,可以导致DNA双链断裂。为此,我们检测了DAG对Topo Ⅱ mRNA的影响。结果表明,与空白对照组相比,不同浓度的DAG能明显抑制Topo Ⅱα mRNA的表达。同样,DAG也能抑制Topo Ⅱβ mRNA的表达,与空白组相比差异具有统计学意义(P<0.01)。以上研究结果表明DAG对Topo Ⅱ的不同亚型的表达均具有明显的抑制作用。见Fig 5。
2.6 DAG对NCI-H460细胞TOPO Ⅱ蛋白的影响 Topo Ⅱ mRNA的表达水平直接与蛋白表达水平有关。为了验证Topo Ⅱ mRNA受到抑制后蛋白表达水平是否也随之降低,我们进一步检测了Topo Ⅱα和Topo Ⅱβ蛋白表达水平。Fig 6结果表明,不同浓度的DAG均能明显降低Topo Ⅱα的表达水平。另外,DAG在5 mg·L-1和10 mg·L-1两个浓度下能明显抑制Topo Ⅱβ的表达,与mRNA的表达水平具有一定的一致性。以上研究结果提示DAG可抑制TopoⅡα和TopoⅡβ的蛋白表达。

Fig 5 Effects of DAG on mRNA expression of TopoⅡα,TopoⅡβ in NCI-H460 cells
**P<0.01vscontrol
2.7 Docking分析 为了进一步研究DAG对Topo Ⅱ的影响,采用计算机分子模拟对接方法探讨DAG与Topo Ⅱ是否具有相互作用,以及其作用方式和结合位点。对接模型结果显示,DAG与Topo Ⅱα之间形成了3个氢键,DAG的三元环中的氧原子与Topo Ⅱα 在120和121 2个色氨酸的残基形成具有相互作用的氢键,3-C上的羟基与140位上的赖氨酸残基也形成1个氢键。与阳性药沙尔威辛相比,140位上的赖氨酸残基同样被沙尔威辛占据,显示DAG结合位点与沙尔威辛部分重合。DAG的1,2-环氧及3-C上的羟基与Topo Ⅱβ在52位上的精氨酸残基形成2个氢键,此外,3-C上的羟基与1375位的氨基酸形成共轭与单原子相互作用,而这些位点同样被依托泊苷占据,显示DAG与Topo Ⅱβ 的结合占据依托泊苷与TopoⅡβ的结合位点。综上所述,计算机分子模拟对接结果显示,DAG与TopoⅡ的结合位点与沙尔威辛、依托泊苷部分重叠。如Fig 7所示。
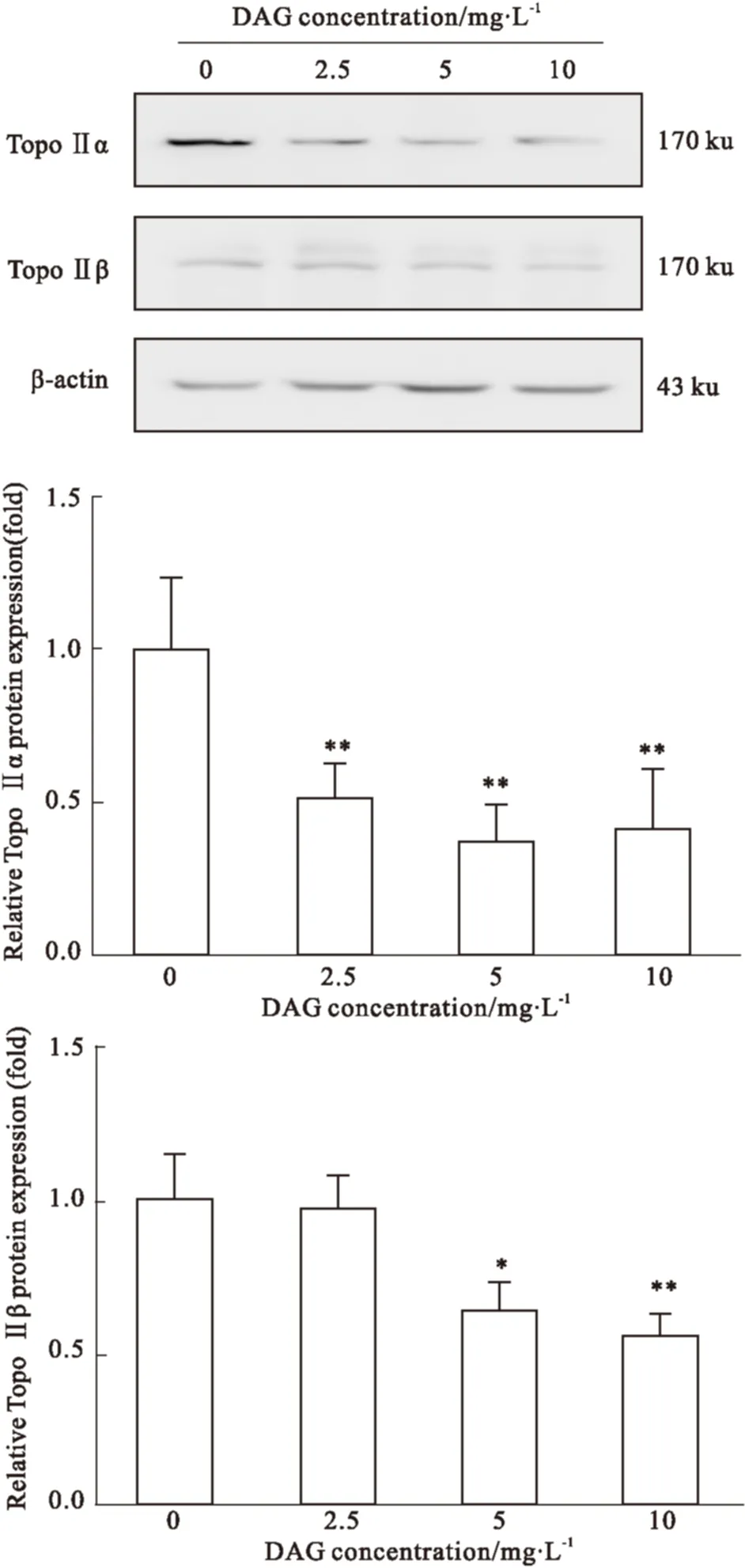
Fig 6 Effects of DAG on protein expression of TopoⅡα,TopoⅡβ in NCI-H460 cells
*P<0.05,**P<0.01vscontrol
3 讨论
TopoⅡ在生物界普遍存在,是细胞内一种重要的核酶,为生长所必需。TopoⅡ分为α和β 2个亚型,可催化DNA 拓扑异构化即超螺旋状态和解螺旋状态相互的转换反应,其功能由ATP提供能量,Mg2+也是必须的。TopoⅡ能识别特殊的DNA序列,并将双链DNA选择性切断[15]。在许多肿瘤细胞中,TopoⅡ的含量及活性远远高于正常组织的细胞,因此,TopoⅡ已成为抗肿瘤药物研究中的重要靶点。TopoⅡ抑制剂可分为TopoⅡα抑制剂和TopoⅡβ抑制剂,目前这2种抑制剂的作用区别尚未清楚。TopoⅡ抑制剂通过影响TopoⅡ作用过程的各个阶段来影响双链DNA的断裂和再连接反应。它可以作用于DNA,也可以作用于拓扑异构酶,还可以作用于TopoⅡ-DNA可切割复合物,影响DNA复制过程,导致细胞凋亡[16]。

Fig 7 Molecular docking of DAG with TopoⅡα and TopoⅡβ
A: The docking prediction of DAG bound to the TopoⅡα; B: The docking prediction of salvicine bound to the TopoⅡα; C: The docking prediction of DAG bound to the TopoⅡβ; D: The docking prediction of etoposide bound to the TopoⅡβ.
DAG对肺癌NCI-H460细胞的研究中,经不同浓度处理48 h后,CCK-8细胞活力检测实验、细胞克隆形成实验均表明DAG对肺癌NCI-H460细胞有明显的抑制作用,且具有明显的浓度依赖关系,其活性与阳性药依托泊苷接近,说明DAG抗肿瘤活性明显。DAG在15 mg·L-1浓度下可抑制大部分肿瘤细胞的增殖,提示该浓度是DAG较为合适的治疗窗。Hoechst 33342实验中发现NCI-H460细胞胞核出现明显的破碎现象,提示DAG可引起DNA损伤,可能引起细胞凋亡。进一步机制研究发现,DAG能明显降低TopoⅡα、TopoⅡβ mRNA水平,并且随着DAG浓度的增加,抑制作用逐步增加。与此相对应的是,DAG也能抑制细胞内TopoⅡα和TopoⅡβ的蛋白表达。为了更进一步探讨DAG与TopoⅡ之间是否具有直接的结合作用,通过分析人TopoⅡα ATPase晶体结构及TopoⅡβ的晶体结构,发现DAG主要通过极性的氢键结合到TopoⅡ上,且与阳性药结合位点有部分重叠,说明其与阳性药的结合区域相似,可能会导致TopoⅡ活性受到抑制。Levin等[12]以14C标记DAG对3种鼠类脑肿瘤的活性进行研究,发现DAG均可与RNA和DNA结合,且与RNA的结合能力为DNA的6倍。因此,DAG可能是通过与TopoⅡ mRNA结合,从而影响TopoⅡ蛋白的合成,进而引起细胞内DNA的断裂,最终导致细胞死亡。另一方面,DAG也有可能和TopoⅡ直接结合,影响TopoⅡ的活性,从而导致DNA复制和转录过程受到影响,进而影响TopoⅡ mRNA的转录水平,但是DAG的具体作用机制尚待进一步研究。
(致谢:本文实验在广西医科大学药学院公共实验平台完成,对参与实验的人员表示感谢!)
[1] Chen W, Zheng R, Badde P D, et al. Cancer statistics in China, 2015 [J].CACancerJClin, 2016, 66(2) :115-32.
[2] Bertrand R, O'Connor P M, Kerrigan D, et al. Sequential administration of camptothecin and etoposide circumvents the antagonistic cytotoxicity of simultaneous drug administration in slowly growing human colon carcinoma HT-29 cells [J].EurJCancer, 1992, 28A(4-5):743-8.
[3] Felix C A. Leukemias related to treatment with DNA topoisomerase Ⅱ inhibitors [J].MedPediatrOncol, 2001, 36(5):525-35.
[4] 刘 灿, 蔡天宇, 赵晓萌, 等. 罗汉果提取物诱导肺癌细胞A549凋亡的研究[J].中国药理学通报, 2015, 31(9):1310-4.
[4] Liu C, Cai T Y, Zhao X M, et al. The study of mogrol on apoptosis of A549 cells[J].ChinPharmacolBull, 2015, 31(9):1310-4.
[5] Shirota O, Morita H, Takeya K, et al. Isolation of antitumor substance, dulcitol, from Maytenus ebenifolia [J].NatMed, 1998, 52(2):184-6.
[6] Németh L, Institóris L, Somfai S, et a1. Pharmacologic and antitumor effects of 1,2:5,6-dianhydrogalactitol (NSC-132313) [J].CancerChemotherRep, 1972, 56(5):593-602.
[7] Lin B J, Tao R F. New drugs of dianhydrogalactitol to chronic granulo cyte leukemia [J].NewMed, 1980, 11(12):619-20.
[8] DelMar Pharmaceuticals, Inc. Safety study of VAL-083 in patients with recurrent malignant glioma [EB/OL]. https://clinicaltrials.gov/ct2/show/NCT01478178?term=NCT01478178&rank=1.
[9] Eagan R T, Creagan E T, Bisel H F, et al. Phase Ⅱ studies of dianhydrogalactitol-based combination chemotherapy for recurrent brain tumors [J].Oncology, 1981, 38(1):4-6.
[10]张慧玲,王稼农, 梁 霜, 等. 二去水卫矛醇对四种肿瘤细胞的体外抑制作用 [J]. 广西科学, 2013, 20(1):82-4.
[10]Zhang H L, Wang J N, Liang S, et al. Inhibition effect of 1,2:5,6-dianhydrogalctitol in four different kinds of tumor cellsinvitro[J].GuangxiSci, 2013, 20(1):82-4.
[11]Eagan R T, Ingle J N, Frytak S, et al. Platinum-based polychemotherapy versus dianhydrogalactitol in advanced non-small cell lung cancer [J].CancerTreatRep, 1977 , 61(7):1339-45.
[12]Levin V A, Freeman-Dove M A, Maroten C E. Dianhydrogalactitol (NSC-132313): pharmacokinetics in normal and tumor-bearing rat brain and antitumor activity against three intracerebral rodent tumors [J].JNatlCancerInst, 1976, 56(3):535-9.
[13]Hu C X, Zuo Z L, Xiong B, et al. Salvicine functions as novel topoisomerase Ⅱ poison by binding to ATP pocket [J].MolPharmacol, 2006, 70(5):1593-601.
[14]Wu C C, Li T K, Farh L, et al. Structural basis of type Ⅱ topoisomerase inhibition by the anticancer drug etoposide [J].Science, 2011, 333(6041):459-62.
[15]穆大力, 贾汝梅. 拓扑异构酶及其抑制剂研究进展 [J]. 医学综述, 2004, 10(11): 649-50.
[15]Mu D L, Jia R M. Advances in studies of topoisomerase and its inhibitors[J].MedRev, 2004, 10(11): 649-50.
[16]Khélifa T, Beck W T. Merbarone, a catalytic inhibitor of DNA topoisomerase Ⅱ, induces apoptosis in CEM cells through activation of ICE/CED-3-like protease[J].MolPharmacol, 1999, 55(3):548-56.
Inhibitory effect of dianhydrogalactitol on DNA TopoⅡ in NCI-H460 cells
HUANG Yin-mei1, LIU Hua-gang2, SU Gui-yu3, LI Ying-jie4, WANG Xiao-jie1, JIANG Xia5
(1.PharmacyCollege,GuangxiMedicalUniversity,Nanning530021,China;2.GuangxiFoodandDrugAdministration,Nanning530022,China; 3.PharmacyCollege,GuangxiUniversityofChineseMedicine,Nanning530001,China;4.InstituteofTraditionalChineseMedicineandNaturalProducts,JinanUniversity,Guangzhou510632,China;5.DeptofClinicalPharmacy,theFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China)
Aim To evaluate the antitumor activity of dianhydrogalactitol (DAG)invitro, and further clarify its underlying mechanisms. Methods The inhibitory effect of DAG in NCI-H460 cells was detected by CCK-8 assay and colony formation assay. The morphology of cells treated with DAG was observed under optical microscope. Nuclear morphology was captured by fluorescence microscopy after Hoechst 33342 staining. Real-time PCR was used to analyze the expression level of topoisomerase Ⅱ (Topo Ⅱ) mRNA. The protein expression level of Topo Ⅱ was detected by Western blot. Additionally, molecular docking approaches were used to predict the interaction between DAG and Topo Ⅱ. Results DAG exhibited potent antitumor activity in NCI-H460 cells, and inhibited cell proliferation persistently. DAG obviously induced nuclear morphological changes of NCI-H460 cells. Furthermore, DAG could down-regulate the mRNA and protein expression level of Topo Ⅱ detected by Real-time PCR analysis and Western blot, respectively. Molecular docking predicted that DAG could bind to Topo Ⅱ. Conclusion DAG can significantly inhibit the proliferation of NCI-H460 cells, and its underlying mechanisms may involve the down-regulation of Topo Ⅱ mRNA and direct binding to Topo Ⅱ, leading to cancer cell death.
dianhydrogalactitol; lung cancer; NCI-H460 cell; Topo Ⅱ; Topo Ⅱ inhibitor; molecular docking
2016-07-14,
2016-08-19
广西科学研究与技术开发计划项目(No 桂科能12237007);广西自然科学基金资助项目(No 2015GXNSFAA139194)
黄银妹(1990-),女,硕士生,研究方向:药物抗肿瘤,E-mail:492499884@qq.com;
蒋 霞(1974-),女,博士生,硕士生导师,研究方向:药物抗肿瘤、临床药学与中药药理学,通讯作者,E-mail:47240986@qq.com
时间:2016-10-20 10:29
http://www.cnki.net/kcms/detail/34.1086.R.20161020.1029.046.html
10.3969/j.issn.1001-1978.2016.11.023
A
1001-1978(2016)11-1601-07
R282.71;R329.24;R734.202.2;R977.3;R979.1
结果 CCK-8法检测结果显示,DAG对NCI-H460细胞的体外抗肿瘤活性明显。细胞克隆形成实验结果表明,DAG能持续抑制肿瘤细胞的增殖。Hoechst 33342检测细胞凋亡发现细胞核染色质发生明显改变。Real time PCR和Western blot检测结果显示Topo Ⅱ mRNA和蛋白表达量降低。计算机模拟分子对接显示DAG与Topo Ⅱ有相互结合作用。结论 DAG能明显抑制NCI-H460细胞的增值,作用机制研究表明DAG能降低Topo Ⅱ mRNA和蛋白水平,并与Topo Ⅱ结合,最终可能导致DNA双链断裂,引起细胞死亡。

