雷公藤红素抑制LDL及HAEC细胞氧化损伤作用
李 锋,李义嘉,李清仙,郭养浩
(福州大学药物生物技术与工程研究所,福建 福州 350116)
雷公藤红素抑制LDL及HAEC细胞氧化损伤作用
李 锋,李义嘉,李清仙,郭养浩
(福州大学药物生物技术与工程研究所,福建 福州 350116)
目的 考察雷公藤红素(celastrol)体外对低密度脂蛋白(LDL)氧化过程及动脉血管内皮细胞氧化损伤的抑制作用。方法 采用体外Cu2+诱导LDL氧化修饰的体外化学反应模型,设置阴性对照、模型对照及雷公藤各剂量组,测定Cu2+诱导氧化LDL的动力学曲线,分析比较各实验组的曲线下面积(AUC)、延滞期持续时间(lag time)及脂质过氧化物产生量(TBARS值);MTT法测定细胞活性,以确定雷公藤红素对正常细胞的安全剂量;建立AAPH诱导的人主动脉内皮细胞HAEC氧化损伤的细胞模型,设置阴性对照、模型对照及雷公藤各剂量组, 测定细胞的乳酸脱氢酶(LDH)漏出量、超氧化物岐化酶(SOD)及谷胱甘肽过氧化物酶(GPX)活性,Hoechst 33258荧光染色观察细胞核受损伤情况,RT-qPCR法分析Nrf2、HO-1 mRNA表达水平。结果 体外实验结果显示,celastrol在体外较低的剂量条件下(100 nmol·L-1~1 μmol·L-1)即能有效延长LDL氧化过程中的迟滞期,降低反应动力学曲线的AUC以及脂质过氧化物的生成,表明celastrol在体外能有效抑制Cu2+诱导的LDL氧化。细胞实验结果显示,在100~400 nmol·L-1剂量范围内,celastrol能有效降低AAPH所致HAEC细胞的LDH漏出量,维护细胞膜和细胞核的完整性;提高受损细胞的Nrf2和HO-1mRNA表达,提高受损细胞的SOD、GPX酶活,从而提升内皮细胞的抵抗氧化应激的能力。结论 celastrol可在体外有效抑制Cu2+诱导人LDL氧化损伤,在无细胞毒安全剂量下(100~400 nmol·L-1)可抑制AAPH所致的HAEC细胞氧化应激损伤。
雷公藤红素;低密度脂蛋白;血管内皮细胞;脂质过氧化;氧化应激;抗氧化;活性氧
雷公藤红素(celastrol,CL)又名南蛇藤素,是一种木栓烷型五环三萜酸,结构式见Fig 1。雷公藤最初提取自我国传统中药雷公藤的根皮,后又发现在南蛇藤属植物中也有存在[1]。研究表明,celastrol具有广泛的生物活性,具有抗炎[2]、抗肿瘤[3]、抵抗免疫抑制[4]、抑制肥胖[5-6]、抑制肝硬化[7]及降血糖[8]等多方面的药理作用,现在临床上主要用于治疗风湿性关节炎[9]和系统性红斑狼疮[10-11]等炎症性和免疫抑制方面的疾病。特别是Liu等[5]2015年报道了celastrol治疗小鼠肥胖症的研究工作之后,celastrol的相关药理活性引起了广泛关注,极具开发成为新一代降肥胖药物潜力。虽然雷公藤作为一种中药材毒性较强,但对celastrol单体化合物的研究表明,在正常的用药剂量范围内对小鼠并无毒性作用,其临床应用前景被看好。
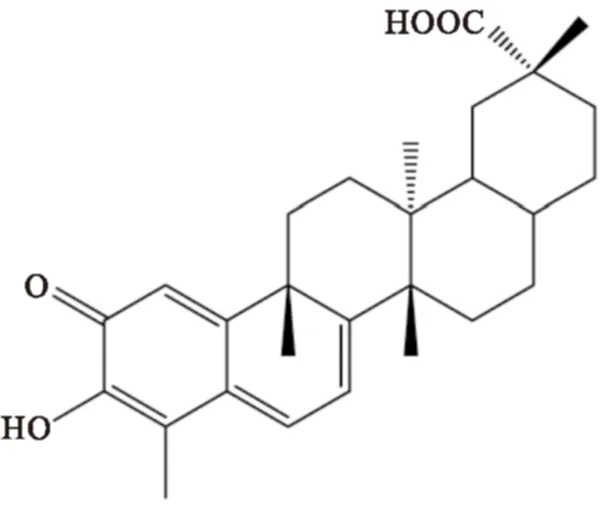
Fig 1 Chemical structure of celastrol
低密度脂蛋白(low density lipoprotein, LDL)是主要的血胆固醇运载工具,主要负责从肝向外周输送胆固醇。LDL在体内易经活性氧(reactive oxygen species,ROS)自由基氧化损伤作用而转变为氧化型低密度脂蛋白(oxidative low density lipoprotein, ox-LDL),而ox-LDL是致动脉粥样硬化(atherosclerosis,AS)的危险因素,故LDL的氧化损伤在AS的形成和发展中扮演着重要角色[12-13]。目前,对celastrol体外抑制LDL氧化及保护动脉内皮细胞的研究报道较少,本实验拟采用体外Cu2+诱导人源LDL氧化损伤模型及2,2-偶氮二(2-甲基丙基咪)二盐酸盐(AAPH)诱导人动脉内皮细胞(HAEC)氧化损伤细胞模型,考察celastrol对LDL氧化过程的抑制作用及对动脉血管内皮细胞氧化损伤的保护作用,并对其机制做初步研究。
1 材料与方法
1.1 试剂与细胞 人LDL,购自上海经科化学科技公司;雷公藤红素、AAPH购自Aladdin试剂有限公司;四乙氧基丙烷(TEP)、硫代巴比妥酸(TBA)、2,6-二叔丁基对甲酚(BHT)购自上海源叶生物科技公司;乳酸脱氢酶(LDH)、超氧化物岐化酶(SOD)和谷胱甘肽过氧化物酶(GPX)测定试剂盒购自南京建成生物工程研究所;碘化丙啶(PI)单染试剂盒购自上海贝博公司;TaqManTMqPCR试剂盒,赛默飞公司;引物合成,生工生物工程(上海)公司;人动脉内皮细胞(HAEC)细胞株,购自北京鼎国昌盛生物技术公司;其他试剂均为分析纯。
1.2 LDL的制备及Cu2+诱导氧化
1.2.1 LDL的制备 为了避免商品LDL中的保护剂EDTA对后续实验造成干扰,要通过透析法去除。采用磷酸缓冲液(10 mmol·L-1,pH7.4)4 ℃透析24 h,每隔6 h更换1次透析液。BCA法测定蛋白浓度,过滤除菌,4 ℃保存备用。
1.2.2 Cu2+诱导氧化 LDL氧化反应体系为:LDL终浓度100 mg·L-1,CuSO4终浓度10 μmol·L-1,混合均匀,于37 ℃避光反应,结束时,加入等体积含1 mmol·L-1EDTA和1 mmol·L-1BHT的混合液终止氧化反应[14]。本实验中,反应体系中加入不同浓度的雷公藤红素考察对LDL氧化过程的抑制效果。反应进行中,实时测定共轭二烯键的形成情况。反应结束后,测定共轭二烯键的生产,取样采用TBARS法分析LDL氧化物水平。
1.2.3 共轭二烯键测定 共轭二烯键是LDL氧化的早期产物,采用Xu等[15]方法,略有改动。1 mL LDL溶液(100 mg·L-1)与不同浓度雷公藤红素样品混合孵育,对照组同样条件但不加雷公藤红素。体系中加入终浓度为10 μmol·L-1的CuSO4启动氧化反应,岛津UV-1800分光光度计每10 min测定A234 nm吸光值,持续4 h,记录共轭二烯键的生产动力学曲线,并计算0~4 h的曲线下面积(AUC0-4 h)。
1.2.4 硫代巴比妥酸产物(TBARS)分析 采用分析TBARS的方法测定LDL氧化物[16]。1 mL的LDL溶液(100 mg·L-1)与终浓度为10 μmol·L-1的CuSO4混合均匀,在加入或不加入(对照组)20 μL不同浓度雷公藤红素样品的情况下进行氧化,37 ℃避光反应4 h。反应体系加入EDTA(终浓度1 mmol·L-1)终止氧化,分别加入1 mL 体积分数为0.2的乙酸和1 mL 0.67%TBA溶液,混合均匀,加热至95 ℃,反应30 min,冷至室温。1 500 r·min-1离心10 min去除沉淀,取上清532 nm测定吸光值。TEP 10 μmol·L-1作为标样,与测定样品同样处理。计算各组的TBARS浓度值:A532样品/A532标样×10,折算成相对含量为μmol·g-1Pro。
1.3 细胞培养及处理 HAEC用DMEM培养基(含体积分数0.15 FBS、20 kU·L-1bFGF、100 kU·L-1链霉素、100 kU·L-1青霉素),置于5% CO2、37 ℃培养箱中培养,每48 h换液1次。取对数生长期的细胞,用0.25%胰酶消化,制备细胞悬液,密度调整至1×108·L-1,每孔100 μL接种于12孔板,继续培养24 h,随后转换无血清培养基培养4 h。先进行实验确定celastrol对细胞不产生抑制的安全剂量,在安全剂量的范围内,考察celastrol对细胞氧化损伤的抑制作用。随机将培养孔分成3组:① 空白对照组:不加任何药物;② 模型刺激组:用含2 mmol·L-1AAPH无血清培养基氧化刺激;③ 药物组:用含不同浓度雷公藤红素和2 mmol·L-1AAPH无血清培养基处理。每组设3个复孔,用0.25%胰酶消化制备细胞悬液,用于后续实验。
1.4 MTT法分析细胞活力 培养板吸去培养基,加入含5 g·L-1MTT的无血清无酚红培养基,于37 ℃、5% CO2条件继续培养4 h,吸取MTT溶液,加入DMSO溶解所形成的甲臜晶体,570 nm测定吸光值。细胞活力/%=处理组吸光值/对照组吸光值×100%。
1.5 细胞ROS水平、LDH漏出量及SOD、GPX酶活性测定 细胞ROS测定:采用黑壁底透96孔板培养细胞,药物处理方法同前。弃上清,PBS清洗,每孔加入100 μL 10 μmol·L-1的DCFH-DA荧光染液,37 ℃避光染色30 min,PBS清洗2次,用SpectraMax i3x型荧光酶标仪测定荧光强度,其激发光波长为480 nm,发射光波长为520 nm;以最高组荧光强度为100%,计算其他各组的相对荧光强度(%)。LDH漏出测定:取细胞培养上清液,按照LDH试剂盒说明书操作,测定LDH酶活,表示为U·L-1。SOD、GPX酶活性测定:收集6孔培养板中细胞,冰浴超声波破碎,收集蛋白,BCA法测定蛋白浓度,样品采用SOD和GPX试剂盒测定酶活性。
1.6 细胞Hoechst 33258染色 将所需的细胞爬片和载玻片用乙醇浸泡后清洗干净,细胞爬片置于6孔板内,备用。取对数生长期细胞,以每孔1.0×105个接种于24孔板细胞爬片上,培养24 h。待细胞完全贴壁后,用不同浓度celastrol和2 mmol·L-1的AAPH一起处理细胞24 h。弃培养基,用PBS洗涤1次,加入0.5 mL固定液,固定15 min。PBS洗2次,每次3 min,加入Hoechst 33258染色液,避光染色5 min。PBS洗2次,每次3 min。加荧光淬灭封片液于载玻片上,盖上贴有细胞的盖玻片。激发波长350 nm,发射波长460 nm,荧光显微镜观察。

2 结果
2.1 Celastrol对Cu2+诱导LDL氧化的体外抑制作用 共轭二烯键的形成(测定234 nm吸光值)是反映LDL氧化的较合适的生物标志,其反映了LDL早期氧化阶段,而TBARS法分析的是晚期氧化阶段的产物。因此,本实验分别测定了这2项指标,如Fig 2所示。从Fig 2A中可以看出,Cu2+诱导LDL氧化的动力学曲线可以分为3个阶段:延滞期、快速反应期和减速期。Cu2+氧化LDL对照组的延滞期时间为89.24 min,经过celastrol处理可明显延长延滞期所持续的时间,呈剂量依赖性(Tab 1),100 nmol·L-1celastrol处理的延滞期时间延长到108.55 min(P<0.05),而1 μmol·L-1水平时迟滞期进一步延长(P<0.01)。同时,celastrol也能有效降低Cu2+氧化LDL动力学曲线的AUC值,500 nmol·L-1和1 μmol·L-1水平时,从对照的72.17分别降低到41.23和34.10,而在100 nmol·L-1和200 nmol·L-1水平时,AUC降低并无显著性。Fig 2B表明,celastrol能明显降低Cu2+氧化LDL过程中脂质过氧化物的水平,呈剂量依赖性。经过Cu2+氧化诱导后,LDL反应体系中脂质过氧化物明显增加到约12.4 μmol·g-1Pro,而celastrol 200 nmol·L-1能将TBARS值降低到约8.9 μmol·g-1Pro(P<0.05),1 μmol·L-1能更进一步降低到3.2 μmol·g-1Pro水平(P<0.01)。
Tab 1 Lag time and AUC0-4 hof LDL oxidative

GroupLagtime/minAUC0-4hCu2+inducedcontrol89.24±1.5472.17±8.45Cu2++CL100nmol·L-1108.55±2.67*71.71±10.7Cu2++CL200nmol·L-1119.37±1.93*71.67±9.10Cu2++CL500nmol·L-1154.71±2.16**41.23±4.74**Cu2++CL1μmol·L-1165.38±3.16**34.10±4.35**
*P<0.05,**P<0.01vsCu2+-oxidized LDL control. CL: celastrol
2.2 Celastrol对细胞活性的影响及对AAPH氧化损伤的抑制作用 由于考察celastrol是否具有抑制AAPH致HAEC细胞氧化损伤的前提是celastrol本身不对细胞产生损伤抑制作用,故需要先确定药物的安全剂量。Fig 3A表明,随着剂量的增加,celastrol会明显抑制HAEC细胞的增殖。在1 μmol·L-1及以上浓度时,相对细胞活性低于50%,抑制作用明显;而在500 nmol·L-1及以下浓度时,相对细胞活性接近100%,并无明显的抑制。故本实验所设定的celastrol细胞安全剂量上限为500 nmol·L-1,确定了50、100、200、400 nmol·L-14个浓度梯度,在此系列剂量下考察celastrol对细胞的保护作用。Fig 3B表明,与AAPH对照相比,celastrol在50 nmol·L-1剂量下对细胞活性无明显提高,而在100、200、400 nmol·L-1剂量下能明显提高细胞的活性,说明celastrol在一定的剂量范围能有效保护HAEC细胞免受AAPH的氧化损伤作用。后续实验主要在100、200、400 nmol·L-13个剂量下进行。
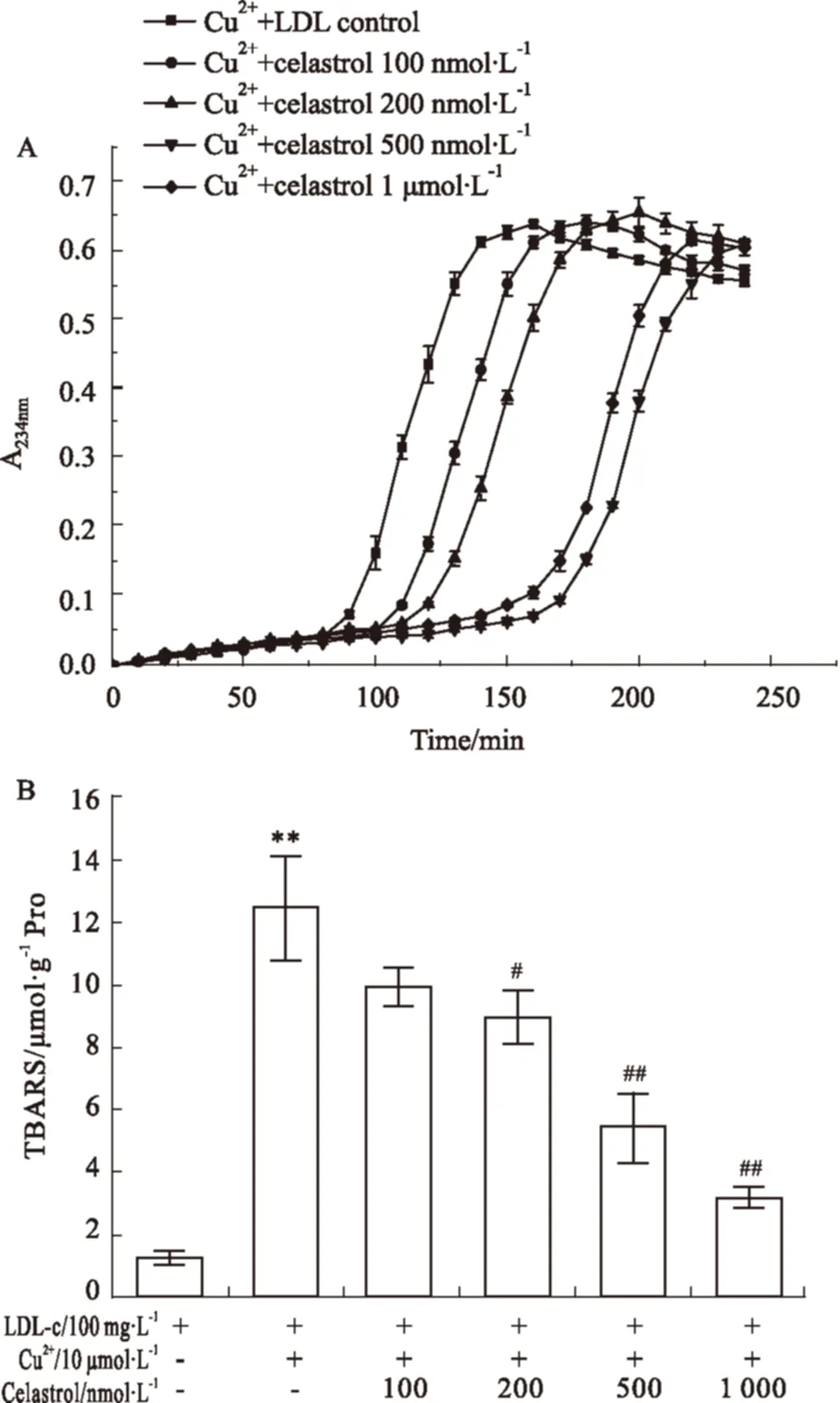
Fig 2 Inhibition effect of celastrol on human
A: Kinetic curves of celastrol against Cu2+mediated LDL oxidation; B: The TBARS values of LDL oxidation.**P<0.01vswithout Cu2+-oxidized LDL control;#P<0.05,##P<0.01vsCu2+-oxidized LDL control.
2.3 Celastrol对AAPH氧化细胞的LDH漏出率、ROS水平及SOD、GPX酶活性的影响 通过分析LDH的漏出率,可间接反映出细胞膜所受氧化损伤程度,结果如Tab 2所示。为了考察celastrol本身在实验剂量条件下是否会对细胞所释放的LDH产生抑制而发生假阳性,另用相应实验浓度的celastrol与经AAPH损伤的细胞孵育1 h后发现,与AAPH处理的模型细胞相比较,LDH漏出量并无明显差异,说明celastrol在本实验所设定剂量条件下并不抑制LDH。由Tab 2可知,与阴性对照组细胞相比,AAPH氧化组的LDH酶活性明显增加,漏出量增加到89.26 U·L-1,说明细胞膜受损伤严重,而celastrol能有效保护细胞膜,降低细胞LDH的漏出量,呈剂量依赖性。细胞ROS水平反映了细胞氧化应激的程度,celastrol也能明显降低AAPH所致细胞的ROS水平的增幅,在100 nmol·L-1剂量使相对ROS水平降至85.6%,随着剂量增加,能进一步降低至57.4%,表明celastrol能有效减轻损伤细胞的胞内氧化应激水平。SOD和GPX是机体重要的抗氧化酶,反映了细胞的抗氧化应激状态。结果表明,celastrol同样能提高AAPH所致损伤细胞的SOD、GPX酶活性,提升细胞的抵抗氧化应激能力。
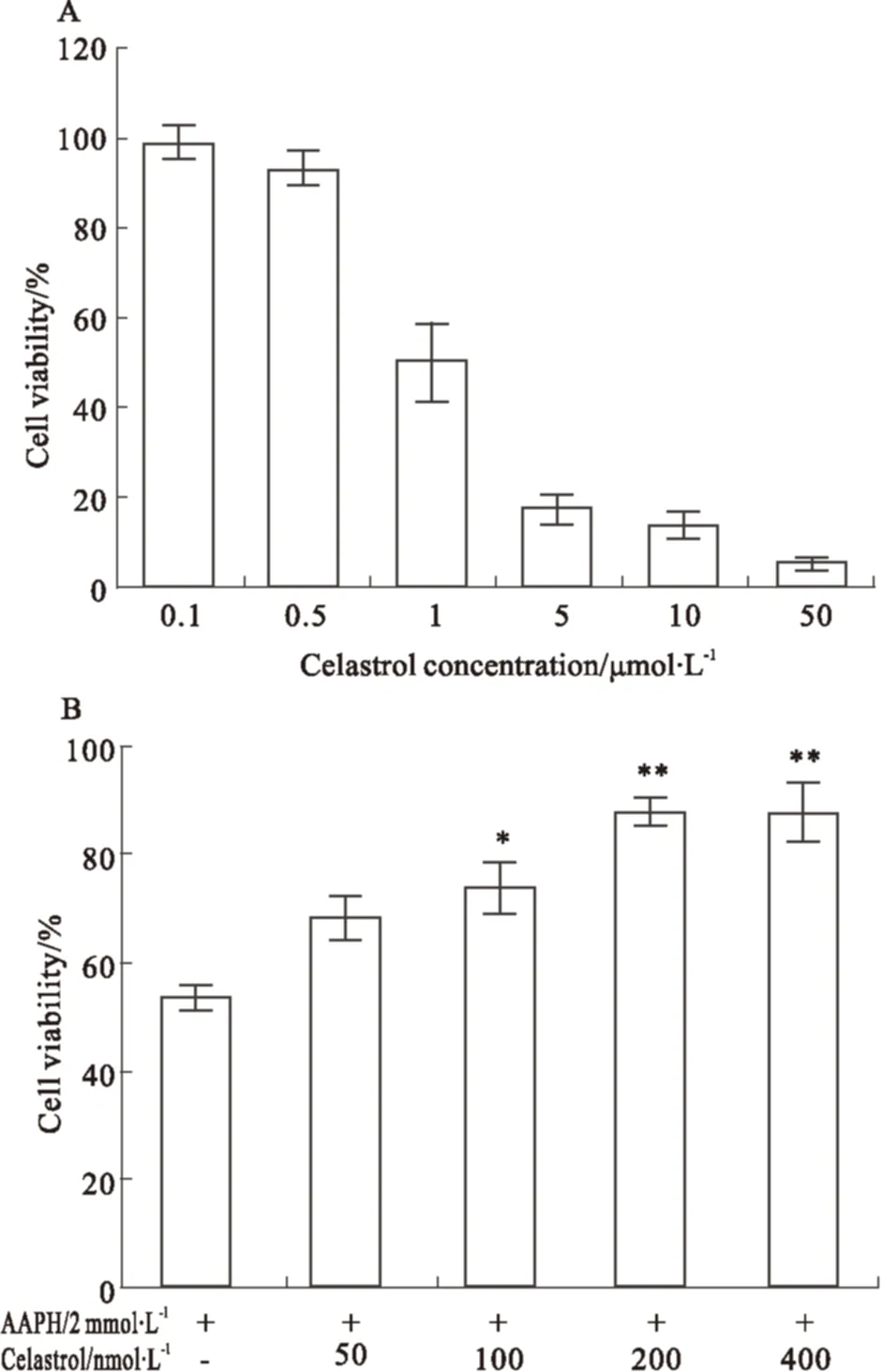
Fig 3 Celastrol effects on normal HAEC cells and its effects on AAPH-induced cell ±s,n=6)
*P<0.05,**P<0.01vsAAPH-oxidized control
Tab 2 Effects of celastrol on LDH,ROS,SOD and GPX of AAPH-induced damaged ±s,n=3)
**P<0.01vscontrol;#P<0.05,##P<0.01vsAAPH-oxidized control
2.4 Hochest 33258荧光染色分析celastrol对细胞核形态影响 细胞发生损伤时,往往伴随着一系列形态变化,其中细胞核形态的变化尤其明显,常出现染色质浓集、碎裂等特征。本实验采用Hoechst 33258荧光染料核染色法观察celastrol对AAPH所致细胞核损伤的影响,结果如Fig 4所示。阴性对照组细胞的细胞核中染色质分布均匀,呈蓝色(Fig 4A);AAPH损伤细胞的染色质明显浓集,染色体碎裂,细胞剥落(Fig 4B);celastrol能明显减轻细胞核的这种受损伤程度(Fig 4 C-E)。说明celastrol能保护HAEC细胞核免受AAPH的氧化损伤。

Fig 4 Effects of celastrol on nuclei morphology of AAPH-induced damaging cells
A: Normal control group; B: AAPH-induced model group; C: AAPH+CL 100 nmol·L-1; D: AAPH+CL 200 nmol·L-1; E: AAPH+CL 400 nmol·L-1. Exicitation wavelength, 350 nm; emission wavelength, 460 nm. Magnification×400.
2.5 Celastrol对AAPH损伤细胞Nrf2和HO-1 mRNA转录的影响 Nrf2主要介导细胞适应氧化应激和炎症反应,是机体重要的抗氧化防御系统,在对抗环境氧化因子致细胞损伤方面起重要作用。Nrf2信号通路的激活能上调HO-1的表达,对维持细胞氧化还原平衡具有重要意义。如Fig 5所示,celastrol在200、400 nmol·L-1剂量下能明显提高AAPH所致损伤细胞Nrf2和HO-1的mRNA表达,而在100 nmol·L-1剂量下有一定的提升作用,但并不明显。说明celastrol可通过增加Nrf2和HO-1的表达,从而提升细胞的抗氧化损伤能力。
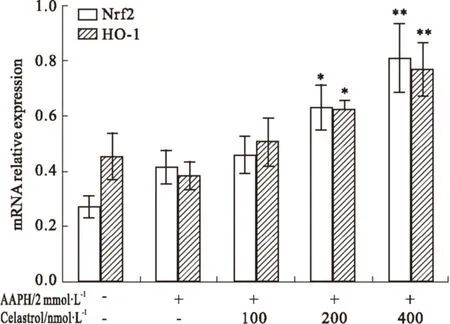
Fig 5 Effects of celastrol on Nrf2 and HO-1 mRNA expressin of AAPH-induced damaging ±s,n=3)
*P<0.05,**P<0.01vsAAPH-oxidized control
3 讨论
雷公藤(TripterygiumwilfordiiHook.F.)是中医传统药物,临床主要用于治疗风湿性关节炎、肺结核以及其他慢性疾病,但由于药物毒副作用较强,限制了其应用。提取自雷公藤根皮的celastrol具有多种药理活性,而在正常用药剂量条件下对实验动物无明显毒副作用[5],因此受到人们极大的关注。Celastrol具有多种药理活性与其化学结构密切相关,celastrol属于五环三萜类化合物。研究表明,其结构中A环C2和B环C6容易发生亲电反应[17],易与半胱氨酸的巯基发生迈克尔加成反应,形成共价键产物[18],这可能是celastrol能影响很多蛋白质功能的一个重要原因。
机体ROS所产生的LDL氧化损伤是导致血管内皮细胞损伤的关键因素之一[19],其产物ox-LDL能促进内皮细胞及单核细胞分泌黏附分子,易于形成泡沫细胞[20]。LDL在体外易受过渡态金属离子的诱导作用而发生氧化,故本实验采用体外Cu2+诱导LDL氧化来模拟体内的氧化过程。AAPH是常见的水溶性自由基诱导剂,能在生理条件下分解产生自由基,从而对细胞产生氧化损伤,且产生自由基的速度可控,因而被认为是研究体内抗氧化的理想模型[21]。故本实验采用体外Cu2+诱导人源LDL氧化损伤模型及AAPH诱导HAEC氧化损伤细胞模型,考察celastrol对LDL氧化过程及对动脉血管内皮细胞氧化损伤的抑制作用。
Celastrol作为一种木栓烷型三萜酸,具有较强的抗氧化及清除自由基的作用[6]。本实验结果也表明,celastrol在体外较低的剂量下(100 nmol·L-1~1 μmol·L-1)即能有效延长LDL氧化过程中的迟滞期(lag time),降低反应动力学曲线的曲线下面积(AUC)以及脂质过氧化物(TBARS值)的生成量,表明celastrol在体外能有效抑制Cu2+诱导的LDL氧化。
细胞正常条件下处于一种氧化/抗氧化平衡状态,当受外界氧化因子过度刺激时,会打破这种均衡状态,导致氧化应激增强,抗氧化系统严重受损。Nrf2主要介导细胞适应氧化应激和炎症反应,是机体重要的抗氧化防御系统,在对抗环境氧化因子致细胞损伤方面起重要作用[22]。Nrf2信号通路的激活,能上调细胞中HO-1、SOD、GPX等重要抗氧化酶的活性,对维持细胞氧化还原平衡具有重要意义。乳酸脱氢酶(LDH)是较为稳定的蛋白质,存在于绝大多数正常细胞的胞质中,不能分泌到胞外,而一旦细胞膜受损,LDH即被释放到细胞外。通过检测细胞培养液中的LDH活性(即LDH的漏出量),可判断细胞受损的程度。本研究结果表明,在一定的剂量范围内(100~400 nmol·L-1),celastrol能有效降低AAPH所致HAEC细胞的LDH漏出率,维护细胞膜的完整性;提高受损细胞的Nrf2和HO-1 mRNA表达,增加受损细胞的SOD、GPX酶活,从而提升内皮细胞的抵抗氧化应激的能力。张志强等[23]报道了celastrol在较高浓度2~10 μmol·L-1浓度能明显提升结肠癌细胞SW620活性氧水平,从而诱导细胞凋亡。本研究发现,celastrol在较低浓度不对细胞产生损伤条件下,反而能抑制氧化应激,降低细胞ROS水平,这与Gu等[24]的研究结果大体一致,该小组报道了celastrol可在较低浓度下(50~200 nmol·L-1)抑制ox-LDL对巨噬细胞的氧化损伤。推测celastrol可能在低浓度和较高浓度条件下通过不同的途径发挥截然不同的生物活性,低浓度下通过抗氧化降低氧化应激途径发挥细胞保护作用,而在较高浓度下通过诱导凋亡提升ROS水平从而产生细胞损伤作用。
综上所述,celastrol在体外能有效抑制Cu2+诱导的LDL氧化,抑制AAPH所致的HAEC细胞自由基氧化损伤,维护细胞膜结构和细胞核的完整性。其机制可能是通过增加Nrf2的表达,提高重要抗氧化酶HO-1、SOD及GPX的水平,从而提升细胞整体的抗氧化应激能力来实现。
[1] 张 立, 徐祖疆, 冯玉静, 等. 南蛇藤根的化学成分研究[J]. 中药材, 2013, 36(4):569-72.
[1] Zhang L, Xu Z J, Feng Y J, et al. Chemical constituents of roots ofcelastrusorbiculatus[J].JChinMedMater, 2013, 36(4): 569-72.
[2] Allison A C, Cacabelos R, Lombardi V R, et al. Celastrol, a potent antioxidant and anti-inflammatory drug, as a possible treatment for Alzheimer’s disease[J].ProgNeuro-Psychoph, 2001, 25(7): 1341-57.
[3] Zhou Y, Huang Y, Xu Q, et al. Several monomes fromTripterygiumwilfordiiinhibit proliferation of glioma cellsinvitro[J].ChinJCancer, 2002, 21(10): 1106-13.
[4] Ma J, Dey M, Yang H, et al. Anti-inflammatory and immunosuppressive compounds fromTripterygiumwilfordii[J].Phytochemistry, 2007, 68(8): 1172-8.
[5] Liu J, Lee J, Hernandez M A S, Mazitschek R, et al. Treatment of obesity with celastrol [J].Cell, 2015, 161(5): 999-1011.
[6] Wang C, Shi C, Yang X, et al. Celastrol suppresses obesity process via increasing antioxidant capacity and improving lipid metabolism[J].EurJPharmacol, 2014, 744:52-8.
[7] 何 伟, 宋莎莎, 袁平凡,等. 雷公藤红素对二乙基亚硝胺诱导的大鼠肝纤维化的治疗作用及机制[J]. 中国药理学通报, 2013, 29(4):519-24.
[7] He W, Song S S, Yuan P F, et al. Therapeutic effects of celastrol on DEN induced liver fibrosis rats and its mechanisms[J].ChinPharmacolBull, 2013, 29(4):519-24.
[8] Kim J E, Lee M H, Nam D H, et al. Celastrol, an NF-κB inhibitor, improves insulin resistance and attenuates renal injury in db/db mice [J].PLoSOne, 2013, 8(4): e62068.
[9] Tao X, Younger J, Fan F Z, et al. Benefit of an extract ofTripterygiumWilfordiiHook F in patients with rheumatoid arthritis: a double-blind, placebo-controlled study[J].ArthritisRheum, 2002, 46(7): 1735-43.
[10]Li H, Zhang Y Y, Huang X Y, et al. Beneficial effect of tripterine on systemic lupus erythematosus induced by active chromatin in BALB/c mice[J].EurJPharmacol, 2005, 512(2): 231-7.
[11]Xu X, Wu Z, Xu C, et al. Observation on serum anti-double stranded DNA antibodies of tripterine in systemic lupus erythematosus of (NZB× W) F1 mice[J].AnnRheumDis, 2003, 62(4): 377-8.
[12]Xu X H, Shah P K, Faure E, et al. Toll-like receptor-4 is expressed by macrophages in murine and human lipid-rich atherosclerotic plaques and upregulated by oxidized LDL[J].Circulation, 2001, 104(25): 3103-8.
[13]Jovinge S, Ares M P, Kallin B, et al. Human monocytes/macrophages release TNF-α in response to ox-LDL[J].ArteriosclerThrombVascBiol, 1996, 16(12):1573-9.
[14]Thilakarathna S H, Rupasinghe H V, Needs P W. Apple peel bioactive rich extracts effectively inhibitinvitrohuman LDL cholesterol oxidation [J].FoodChem, 2013, 138(1): 463-70.
[15]Xu B, Yuan S, Chang S. Comparative studies on the antioxidant activities of nine common food legumes against copper-induced human low-density lipoprotein oxidationinvitro[J].JFoodSci, 2007, 72(7): S522-7.
[16]Liu F, Ng T. Antioxidative and free radical scavenging activities of selected medicinal herbs[J].LifeSci, 2000, 66(8): 725-35.
[17]Hu H, Straub A, Tian Z, et al. Celastrol, a triterpene extracted fromTripterygiumwilfordiiHook F, inhibits platelet activation[J].JCardiovascPharm, 2009, 54(3): 240-5.
[18]Trott A, West J D, Klaic L, et al. Activation of heat shock and antioxidant responses by the natural product celastrol: transcriptional signatures of a thiol-targeted molecule[J].MolBiolCell, 2008, 19(3): 1104-12.
[19]褚现明, 王 妮, 孙雪霞,等. C-PC抑制ox-LDL诱导内皮细胞脂质过氧化损伤的机制研究[J]. 中国药理学通报, 2014,30(4):588-9.
[19]Chu X M, Wang N, Sun X X, et al. Effect of C-PC on ox-LDL-induced lipid peroxide injury of endothelial cells[J].ChinPharmacolBull, 2014,30(4):588-9.
[20]刘颖琳, 刘耕陶. 丹酚酸-A体外对人血清低密度脂蛋白氧化修饰的抑制作用[J]. 药学学报, 2002, 37(2):81-5.
[20]Liu Y L, Liu G T. Inhibition of human low-density lipoprotein oxidation by salvianolic acid-A[J].ActaPharmSin, 2002, 37(2): 81-5.
[21]陈建平, 李 琳, 苏健裕. 姜黄素的抗氧化及抗肿瘤活性研究[J]. 现代食品科技, 2014,30(12):11-5.
[21]Chen J P, Li L, Su J Y. Antioxidant and antitumor activities of curcumin [J].ModFoodSciTechnol, 2014, 30(12): 11-5.
[22]赵春阳, 王晓良, 彭 英. Nrf2在神经退行性疾病中的作用及激活剂的研究进展[J].药学学报, 2015, 50(4): 375-84.
[22]Zhao C Y, Wang X L, Peng Y. Role of Nrf2 in neurodegenerative diseases and recent progress of its activators[J].ActaPharmSin, 2015, 50(4):375-84.
[23]张志强, 高体云, 李 暐,等. 雷公藤红素通过活性氧诱导结肠癌SW620细胞凋亡[J]. 中国医院药学杂志, 2015, 35(17):1558-63.
[23]Zhang Z Q, Gao T Y, Li W, et al. Celastrol induce apoptosis in human colon cancer SW620 cells through species reactive oxygen[J].ChinJHospPharm, 2015, 35(17):1558-63.
[24]Gu L, Bai W, Li S, et al. Celastrol prevents atherosclerosis via inhibiting LOX-1 and oxidative stress[J].PLoSOne, 2013, 8(6): e65477.
The inhibitive effects of celastrol on LDL oxidation and HAEC cell oxidative damage
LI Feng, LI Yi-jia, LI Qing-xian, GUO Yang-hao
(InstituteofPharmaceuticalBiotechnologyandBioengineering,FuzhouUniversity,Fuzhou350116,China)
Aim To evaluate the inhibitive effects of celastrol on LDL oxidation and HAEC cell oxidative damage. Methods The Cu2+-induced LDL oxidation model was employed to evaluate celastrol inhibitive effect on LDL oxidationinvitro, the oxidative reaction kinetic curves were determined, and the AUC,lag time,TBARS value were assayed. The AAPH-induced HAEC damaging cellular model was employed to evaluate the effect of celastrol on oxidative cellular damage. The safe dose of celastrol on normal cells was determined by MTT method, and the effects of celastrol on HAEC oxidative damage were evaluated at the range of this safe dose. The LDH leakage,ROS level,SOD and GPX enzymatic activity,Nrf2 and HO-1 mRNA expression were determined. Results At the dose range of 100 nmol·L-1to 1 μmol·L-1, celastrol effectively extended the lag time of LDL oxidative process induced by Cu2+, reduced the AUC of oxidative reaction kinetic curve and reduced the generation of lipid peroxide in the LDL oxidative process. In the cellular experiment, celastrol effectively reduced the LDH leakage induced by AAPH, increased the integrity of cell membrane and nucleus, enhanced the antioxidative enzyme activities of cellular SOD,GPX and increased the expressions of Nrf2,HO-1 mRNA, celastrol also maintained the integrity of cellular structure. Conlusion Celastrol can effectively inhibit LDL oxidation induced by Cu2+, and can inhibit HAEC cell oxidative damage induced by AAPH at the dose range of 100 to 400 nmol·L-1.
celastrol; LDL; vascular endothelial cells; lipid peroxidation; oxidative stress; antioxidation; ROS
时间:2016-10-20 10:29
http://www.cnki.net/kcms/detail/34.1086.R.20161020.1029.038.html
2016-06-17,
2016-07-21
国家海洋公益性行业科研专项(No 201205022)
李 锋(1976-),男,硕士,助理研究员,研究方向:天然成分生物活性,E-mail:lifeng9676@aliyun.com;
郭养浩(1950-),男,硕士,教授,研究方向:药物生物技术,通讯作者,E-mail:yanghaoguo@aliyun.com
10.3969/j.issn.1001-1978.2016.11.019
A
1001-1978(2016)11-1578-07
R284.1;R322.12;R329.24;R341.35;R543.5;R977.3;R977.6

