胚胎脑组织成体神经干细胞的体外增殖分化及凋亡
魏 岚 赵晓彬
(中国疾病预防控制中心环境与健康相关产品安全所,北京 100021)
胚胎脑组织成体神经干细胞的体外增殖分化及凋亡
魏 岚 赵晓彬1
(中国疾病预防控制中心环境与健康相关产品安全所,北京 100021)
目的 观察小鼠胚胎成体神经干细胞(NSCS)体外增殖分化,探讨G蛋白偶联受体5(GRK5)与NSCS凋亡的关系。方法 分离孕14~16 d小鼠胚胎脑组织,体外培养NSCS,采用免疫荧光法对NSCS及其分化的细胞进行Nestin、β-Tublin和GFAP染色鉴定。联合RNA干扰沉默GRK5基因,以及PKA激动剂forskolin干预NSCS,采用Annexin V-FITC/PI双染法流式细胞术检测NSCS细胞凋亡比例。结果 体外分离培养的小鼠胚胎脑组织可形成典型的神经球并传代,细胞表达Nestin蛋白后可诱导分化为神经细胞和神经胶质细胞。GRK5 siRNA组早期凋亡细胞比例明显高于control siRNA对照组(P<0.01);尽管GRK5 siRNA+PKA激活组早期凋亡细胞比例明显低于GRK5 siRNA组(P<0.05),但早期凋亡细胞比例仍明显高于PKA激活组(P<0.01)。结论 小鼠胚胎NSCS可在体外适宜条件下大量增殖,具有多向分化潜能;GRK5基因高表达可有效抑制NSCS早期凋亡。
神经肝细胞;凋亡
成体神经干细胞(NSCS)具有高度的更新、分化能力,NSCS移植为中枢神经系统损伤和神经退行性疾病的治疗提供了新的途径。研究显示,多种凋亡因子的介导可促使NSCS细胞凋亡,有关NSCS细胞凋亡的研究已成为该领域的热点〔1〕。PKA作为cAMP水平的感受器,是cAMP信号传导的关键酶,对维持细胞存活具有重要作用〔2〕。G蛋白偶联受体(GRK)5可脱敏抑制M2受体活性〔3〕。最近研究发现,M2信号途径能够降低cAMP水平并下调PKA活性,进而促进细胞凋亡〔4〕。目前关于GRK5抑制NSCS凋亡方面的研究报道十分少见。本次研究分离并体外培养小鼠胚胎NSCS,观察GRK5基因沉默与NSCS凋亡的关系。
1 资料与方法
1.1 动物与试剂 雌性ICR小鼠,孕14~16 d,购于北京维通利华实验动物技术有限公司。主要试剂:DMEM细胞培养液(上海达豪生物科技有限公司);B27复合物、BFGF、EGF、胎牛血清(美国Sigma公司);多聚赖氨酸(深圳安泰生物科技有限公司);鼠抗人巢蛋白单克隆抗体、小鼠单克隆β-Tublin 内参抗体、鼠抗人胶原纤维酸性蛋白、GRK5抗体(上海酶联生物研究所);forskolin TM,RNAiMAX(美国Sigma公司);双染法细胞凋亡检测试剂盒(上海博谷生物科技有限公司)。
1.2 NSCS培养及检测
1.2.1 取材及分离细胞 将小鼠断髓处死后,放入75%乙醇溶液中消毒3 min,开腹暴露子宫。无菌条件下将胎鼠取出,分离脑组织,置于盛有D-Hank液的培养皿中清洗干净。在显微镜下分离脑组织表面的血管和蛛网膜。将脑组织转入盛有DMEM无血清细胞培养液的青霉素小瓶中,剪碎至直径为1 mm3的正方体小块,加入胰蛋白酶1 ml,37℃条件下消化10 min,加入含胎牛血清的DMEM细胞培养液终止消化。过200目筛,制备NSCS悬液。
1.2.2 细胞培养 ①原代细胞培养:1 000 r/min离心细胞悬液10 min,弃上清,加入含2% B27复合物的DMEM无血清细胞培养液,其中BFGF、EGF各20 ng/ml,细胞液密度调整至5×105个/ml,置于CO2孵箱中培养1 w。②传代培养:从细胞培养瓶中吸出细胞悬液,1 000 r/min离心5 min,弃上清,加入1 ml DMEM 无血清细胞培养液,加入1 ml 0.125%胰蛋白酶消化10 min终止消化,1 000 r/min离心5 min,弃上清,加入含2% B27复合物的DMEM无血清细胞培养液,细胞液密度调整至5×105个/ml,置于CO2孵箱中培养1 w。
1.2.3 细胞诱导分化及检测 将传代培养成的克隆球接种在多聚赖氨酸预处理的24孔板中,加入含10%胎牛血清的DMEM细胞培养液,培养2 h后取部分克隆球表达的干细胞行Nestin免疫细胞化学染色;另取部分克隆球加入含10%胎牛血清的DMEM细胞培养液贴壁培养,1 w后分别行β-Tublin免疫细胞化学染色和GFAP免疫细胞化学染色。
1.3 GRK5抗NSCS凋亡研究方法
1.3.1 GRK5 siRNA 将克隆球接种在多聚赖氨酸预包被的24孔细胞培养板中,加入DMEM 无血清细胞培养液进行siRNA转染实验。取5 μl RNAiMAX、20 μmol/L的siRNA分别加入100 μl opti-MEM培养基中静置10 min,两者混合后再静置10 min,加入细胞中混匀。Western印迹检测siRNA干扰率。GRK5 siRNA和control siRNA均由上海博光生物科技有限公司合成。
1.3.2 分组 按照RNA沉默GRK5,以及PKA激动剂forskolin干预,分为4组:control siRNA 处理的对照组、control siRNA+ forskolin的PKA激活组、GRK5 siRNA组、GRK5 siRNA组+ forskolin的GRK5 siRNA+PKA激活组。
1.3.3 NSCS凋亡检测 采用Annexin V-FITC/PI双染法流式细胞术检测细胞凋亡,Annexin V-FITC为绿色荧光,PI为红色荧光,Annexin V阳性 /PI阴性为早期凋亡细胞。使用IPP图像分析软件测定选择区域中Annexin V阳性 /PI阴性细胞数,并计算其占该区域总细胞数的比例。每份标本测定3个区域,每组检测5个标本。
1.4 统计学分析 使用SPSS15.0软件行t检验。
2 结 果
2.1 NSCS体外生长情况 DMEM无血清细胞培养液中加入BFGF、EGF和B27复合物条件下,培养24 h后观察可见细胞悬浮生长,聚集成团,团块周边细胞折光性良好;48 h后发展为数十个细胞组成的大小不一的细胞球,折光性良好,形态规则;1 w后细胞球大小基本一致,折光性明显增强。见图1。
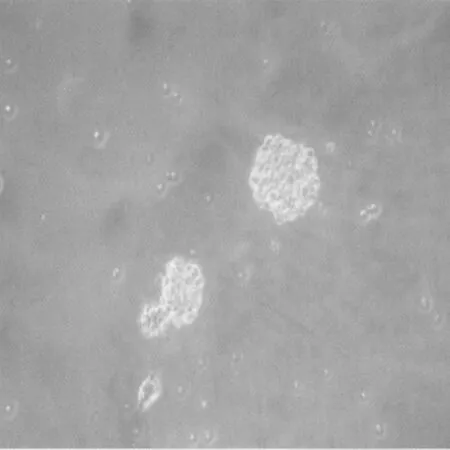
图1 NSCS体外培养24 h(×100)
2.2 NSCS的Nestin、β-Tublin、GFAP表达情况 免疫荧光染色法检测传代NSCS克隆球表达的干细胞均呈Nestin阳性,见图2A。NSCS单细胞悬液免疫荧光染色检测显示β-Tublin、GFAP均为阳性,见图2B、2C。

A:NSCS克隆球表达的干细胞Nestin表达;B:NSCS单细胞悬液β-Tublin表达;C:NSCS单细胞悬液GFAP表达图2 NSCS免疫荧光染色(×400)
2.3 RNA干扰沉默GRK5基因表达 GRK5基因沉默后NSCS中的GRK5蛋白表达量明显低于对照组。见图3。
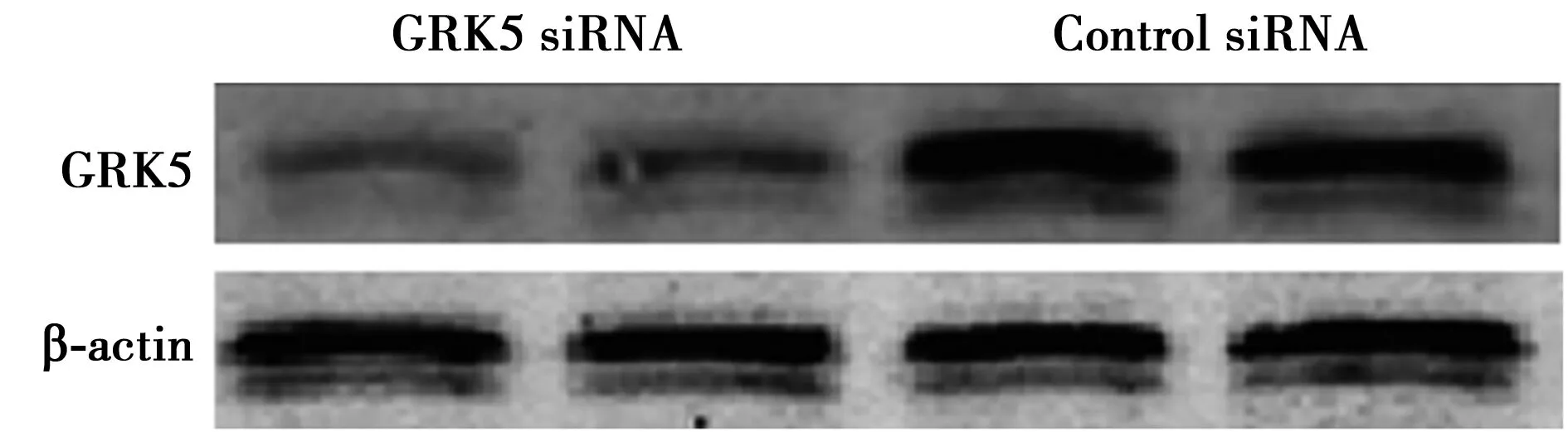
图3 Western印迹检测NSCS中的GRK5蛋白表达量
2.4 各组NSCS早期凋亡情况比较 GRK5基因沉默后的GRK5 siRNA组、GRK5 siRNA+PKA激活组表达早期凋亡细胞分别为(39.6±2.8)%、(30.1±1.5)%,见图4C、4D;对照组、PKA激活组表达早期凋亡细胞分别为(3.9±0.5)%、(3.0±0.5)%,见图4A、4B。GRK5 siRNA组早期凋亡细胞比例明显高于对照组(P<0.01);尽管GRK5 siRNA+PKA激活组早期凋亡细胞比例明显低于GRK5 siRNA组(P<0.05),但其早期凋亡细胞比例仍明显高于PKA激活组(P<0.01)。
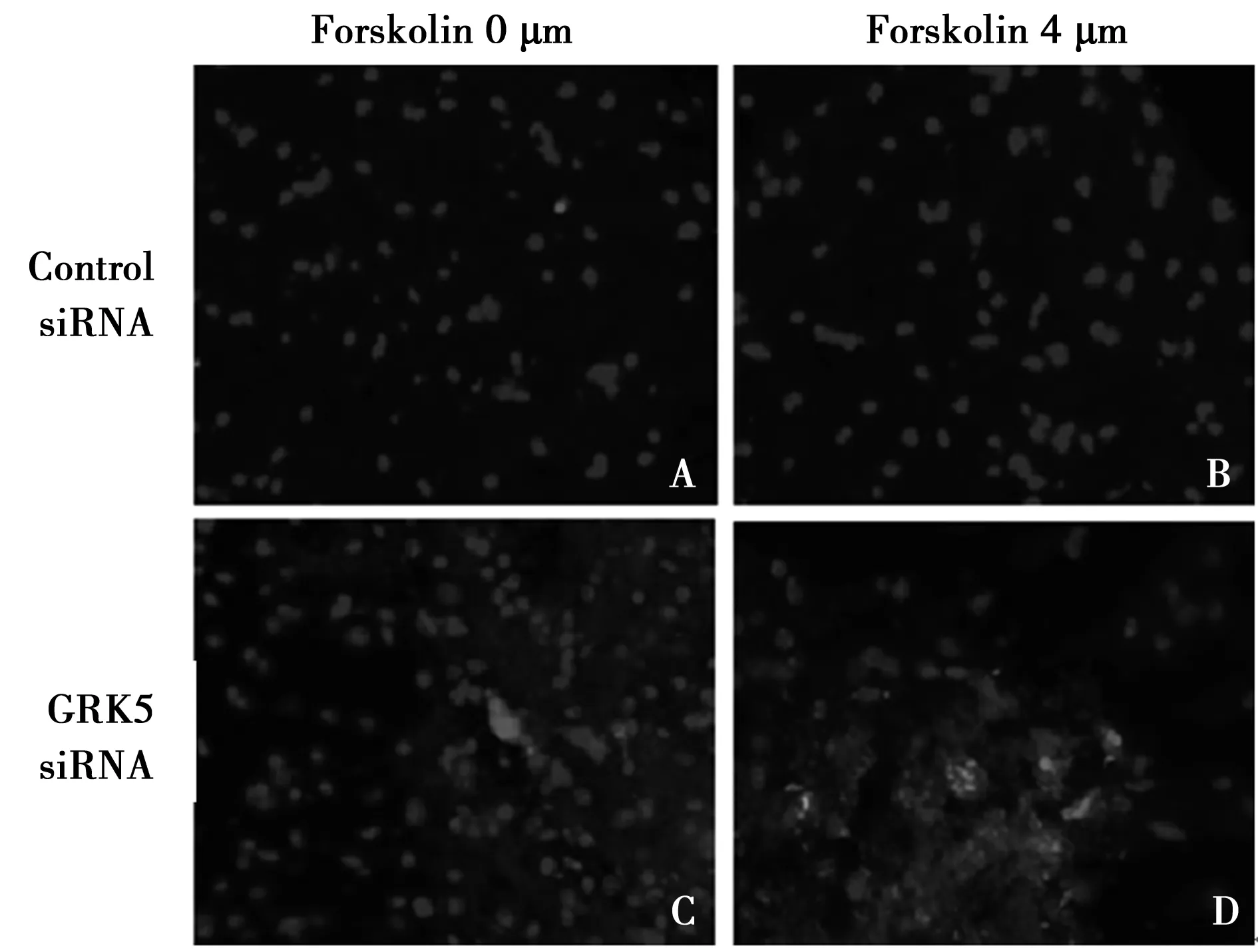
A:对照组;B:PKA激活组;C:GRK5 siRNA组;D:GRK5 siRNA+PKA激活组图4 Annexin V-FITC/PI双染法检测4组NSCS早期凋亡情况
3 讨 论
NSCS具有自我更新能力,能够分裂成与自身完全相同的子代细胞,体外环境下NSCS经多次传代后形成的子代仍与其自身完全相同。NSCS同时具有多向分化潜能,能够分化为神经元、星状胶质细胞、少突胶质细胞这三种重要的神经细胞。本次研究选用了胎龄14~16 d的胎鼠为研究材料,从胚胎发育过程来看,发育早期阶段易获得神经干细胞且其自身特征在体外培养时可保持较长时间,但在实验过程中发现,胎龄小于11 d的胚胎在具体操作时分离中枢神经系统较为困难,同时NSCS体外培养所必需的FGF受体表达峰值在胚胎发育中期出现,因此选择胎龄14~16 d的胚胎。本次研究中分离出的小鼠脑组织克隆球表达的肝细胞特征性标记物Nestin表达阳性,去除生长因子,加血清培养后克隆球逐渐贴壁分化,培养1 w后免疫荧光染色显示,神经元特异性标志物β-Tublin和星状胶质细胞特异性标志物GFAP表达均为阳性,说明胎龄14~16 d的胎鼠脑组织分离、培养的细胞具有NSCS基本属性。
多种细胞因子调控细胞凋亡过程,其分子机制尚未完全明确。研究显示,PKA可通过磷酸化bcl-2抗体、激活P38MAPK信号转导通路等机制调节bcl-2活性,从而影响caspase-3表达〔5〕。最新研究显示,M2信号途径能够降低cAMP水平,下调PKA活性,加速细胞凋亡,而GRK5能够抑制突触前M2受体活性,因此可推测GRK5与细胞凋亡密切相关〔6〕。本次研究显示,GRK5基因沉默后NSCS凋亡细胞比例明显增加,同时还能够抑制PKA对神经细胞的激活作用,减弱其抗凋亡作用。提示PKA激动剂forskolin无法完全纠正GRK5基因沉默引发的PKA活性抑制,GRK5 siRNA+PKA激活组中仍可观察到大量的Annexin V阳性 /PI阴性细胞;推测GRK5存在上调PKA基因表达之外的途径抑制NSCS细胞凋亡,GRK5抗NSCS凋亡的作用及机制仍需要进一步阐明。
1 Lu HX,Yang ZQ,Jiao Q,etal.Low concentration of serum helps to maintain the characteristics of NSCs/NPCs on alkalitreated phbhhx film in vitro〔J〕.Neurol Res,2014;36(3):207-14.
2 宋 杰.低剂量BDE-209单独和与BDE-47联合暴露对体外培养海马神经干细胞形态学及蛋白质组学的影响〔D〕.广州:广州医学院,2012.
3 Liu Q,Fan X,Zhu J,etal.Co-culturing improves the OGD-injured neuron repairing and NSCs differentiation via Notch pathway activation〔J〕.Neurosci Lett,2014;559:1-6.
4 Tao J,Chen B,Gao Y,etal.Electroacupuncture enhances hippocampal NSCs proliferation in cerebral ischemia-reperfusion injured rats via activation of notch signaling pathway〔J〕.Int J Neurosci,2014;124(3):204-12.
5 宋旭东.神经干细胞与替莫唑胺对脑胶质瘤大鼠生存状况影响的研究〔D〕.泸州:泸州医学院,2014.
6 Jiao Q,Xie WL,Wang YY,etal.Spatial relationship between NSCs/NPCs and microvessels in rat brain along prenatal and postnatal development〔J〕.Int J Dev Neurosci,2013;31(4):280-5.
〔2016-04-25修回〕
(编辑 郭 菁)
1 河北省人民医院眼科
魏 岚(1976-),女,硕士,副研究员,副教授,主要从事环境毒理学、组织形态学研究。
R74
A
1005-9202(2016)19-4717-03;
10.3969/j.issn.1005-9202.2016.19.020

