白藜芦醇对高糖诱导肾小管上皮细胞凋亡的保护作用及机制
宋碧辉 谢红萍
(南华大学附属第一医院肾内科,湖南 衡阳 421001)
白藜芦醇对高糖诱导肾小管上皮细胞凋亡的保护作用及机制
宋碧辉1谢红萍
(南华大学附属第一医院肾内科,湖南 衡阳 421001)
目的 探讨白藜芦醇抑制高糖诱导人近端肾小管上皮细胞株(HK-2)的凋亡及可能机制。 方法 MTT检测HK-2细胞活力;Hoechst染色法、caspase-3活性检测细胞凋亡;DCFH-DA检测细胞内活性氧水平;Real-time PCR检测Nrf2 mRNA表达;Western印迹法检测Nrf2蛋白表达。结果 30 mmol/L葡萄糖能显著降低HK-2细胞活力,诱导细胞凋亡,上调细胞内活性氧的水平,并下调Nrf2 mRNA和蛋白表达。10 μmol/L白藜芦醇预处理能部分逆转高糖的作用。结论 白藜芦醇对高糖诱导的HK-2凋亡的保护机制可能与抑制活性氧的生成和上调Nrf-2的表达有关。
白藜芦醇;糖尿病肾病;肾小管上皮细胞;Nrf2
糖尿病肾病(DN)在美国是导致终末期肾脏病(ESRD)的最常见病因,约占整个ESRD人群的40%〔1〕。DN早期表现为肾脏细胞外基质增生,肾小球高滤过和肾小管高灌注。随着病程的进展,引发肾小球和肾小管细胞进行性丢失,最终导致肾小球硬化和肾小管萎缩,肾间质纤维化。从代偿性细胞增生向细胞丢失、萎缩的过渡过程中,凋亡是诱导肾细胞进行性丢失的重要机制之一〔2〕。白藜芦醇具有显著降低蛋白尿和肾保护的功能〔3〕,本研究体外观察白藜芦醇对高糖诱导人近端肾小管上皮细胞细胞凋亡的保护作用及机制。
1 材料与方法
1.1 细胞、药物、主要试剂及仪器 人近端肾小管上皮细胞株(HK-2),购自中科院上海实验细胞中心(来源于美国ATCC细胞库)。白藜芦醇(Sigma,V900386),浓度≥98.0%。低糖DMEM细胞培养基、胎牛血清(Hyclone),葡萄糖溶液(Sigma,G8644),MTT(碧云天,ST316),活性氧(ROS)检测试剂盒(碧云天,S0033),Hoechst检测试剂盒(碧云天, C1017),Caspase-3活性检测试剂盒(碧云天,C1115),Trizol(Invitrogen),逆转录试剂盒(Takara),sybergreen realtime PCR试剂盒(Takara),Nrf2引物(上海生工),β-actin引物(上海生工),Nrf2一抗(Santa Cruz,sc-722),β-actin一抗(Santa Cruz,sc-47778),辣根过氧化物酶(HRP)标记的山羊抗兔二抗(Santa Cruz,sc-2491),辣根过氧化物酶(HRP)标记的山羊抗小鼠二抗(Santa Cruz,sc-2489),ECL化学发光试剂盒(碧云天, P0018),恒温细胞培养箱(Thermo),荧光倒置显微镜(Olympus),5810R低温高速离心机(Eppendorf),AB 7300 realtime PCR仪(ABI),Western印迹装置(Bio-Rad),ChemiDoc XRS+凝胶成像分析系统(Bio-Rad)。
1.2 细胞培养 HK-2接种于含10%胎牛血清的DMEM低糖培养基中,置于37℃、5% CO2的培养箱内培养。每隔2天换培养液1次,待细胞生长至融合后,用 0.25%胰蛋白酶消化传代。取对数生长期细胞进行实验。
1.3 实验分组及干预方法 对照组:细胞正常培养,不加任何处理;葡萄糖处理组:葡萄糖(30 mmol/L)处理HK-2;白藜芦醇处理组:预先加10 μmol/L白藜芦醇孵育1 h后加葡萄糖(30 mmol/L)处理24 h;甘露醇(30 mmol/L)对照组。
1.4 检测指标及方法
1.4.1 细胞存活率检测 MTT比色试验检测细胞存活率。按实验分组做不同处理后,在培养板中加入10×MTT 20 μl/孔,继续培养4 h,弃去培养基,加入200 μl DMSO,37℃孵育30 min,酶联免疫检测仪测定OD570。
1.4.2 细胞凋亡检测 ①采用Hoechst法检测。除去培养液,磷酸盐缓冲液(PBS)洗涤2次,加入固定液室温固定10 min。弃固定液,加入0.5 ml Hoechst 33258染色液,染色5 min。弃染色液,PBS洗涤3次。倒置荧光显微镜下观察并拍照。②caspase-3活性检测。收集细胞,PBS洗涤2次。吸尽上清后,按照每200万细胞加入100 μl裂解液的比例加入裂解液,冰浴裂解15 min。4℃,12 000 r/min,离心15 min。设置反应体系:检测缓冲液70 μl,待测样品20 μl,Ac-DEVD-pNA(2 mmol/L)10 μl。37℃孵育60~120 min。测定A405。用Bradford法检测待测样品中的蛋白浓度。计算出一个样品单位重量蛋白中所含的caspase-3的酶活力单位。
1.4.3 细胞内ROS检测 采用ROS检测试剂盒检测。去除培养液,PBS洗涤2次,加入1 ml稀释好的DCFH-DA(按1∶1 000用无血清培养液稀释DCFH-DA,终浓度为10 μmol/L),37℃细胞培养箱内孵育20 min。用无血清细胞培养液洗涤细胞3遍,倒置荧光显微镜下观察并拍照。
1.4.4 Nrf2 mRNA表达检测 Trizol抽提细胞总RNA,逆转录合成cDNA,引物序列:Nrf2正义链:TTCAGCAGCATCCTCTCCACAG,反义链:GCATGCTGTTGCTGATACTGG。β-actin 正义链:CCACACCTTCTACAATGAGC,反义链:GGTCTCAAACATGATCTGGG。荧光定量PCR扩增体系及条件:SYBR(2×)5.0 μl ,正义链引物(10 μmol/L)0.2 μl,反义链引物(10 μmol/L)0.2 μl,cDNA 2.0 μl ,RNase Free dH2O 2.4 μl。反应条件:预变性95℃ 20 s,(95℃ 5 s,60℃ 31 s),40个循环。反应结束后用7300 System SDS Software分析数据,统计ΔΔCt值,计算相应RQ值,比较各组 mRNA的表达。
1.4.5 Nrf2 蛋白表达检测 采用Western印迹检测。Western IP裂解液提取蛋白。取60 μg样品经10%SDS-PAGE电泳,用半干转膜法将凝胶上的蛋白转印至PVDF膜上。5 %脱脂牛奶封闭1 h。一抗(Nrf2 1∶1 000,β-actin 1∶1 000)4 ℃孵育过夜。二抗(山羊抗兔 1∶5 000,山羊抗小鼠 1∶5 000)室温孵育1 h。用ECL发光剂显影,采用ChemiDoc XRS+成像系统进行拍照,Image Lab软件进行灰度分析。
1.5 统计学方法 采用SPSS13.0统计学分析软件进行单因素方差分析。
2 结 果
2.1 高糖和白藜芦醇对HK-2活力的影响 与对照组相比,葡萄糖(30 mmol/L)处理HK-2 24 h,可显著抑制细胞活力(97.79%±3.51% vs 57.15%±2.51%,P<0.01),而30 mmol/L甘露醇对照组对细胞没有影响(90.01%±2.88%);预先用不同浓度白藜芦醇处理1 h后,白藜芦醇(10 μmol/L)能显著上调葡萄糖(30 mmol/L)诱导细胞活力下降(76.67%±4.97%,P=0.005)。
2.2 白藜芦醇对高糖诱导HK-2凋亡的影响 与对照组相比,葡萄糖(30 mmol/L)处理HK-2 24 h,caspase-3活性显著升高(96.89%±3.51% vs 246.02%±14.57%,P<0.01),Hoechst染色检测凋亡细胞明显增多,而甘露醇对照组对细胞没有影响(98.33%±10.92%);预先用白藜芦醇(10 μmol/L)处理1 h后,可抑制caspase-3活性(150.02%±15.27%,P<0.01),可减少HK-2细胞凋亡(图1)。
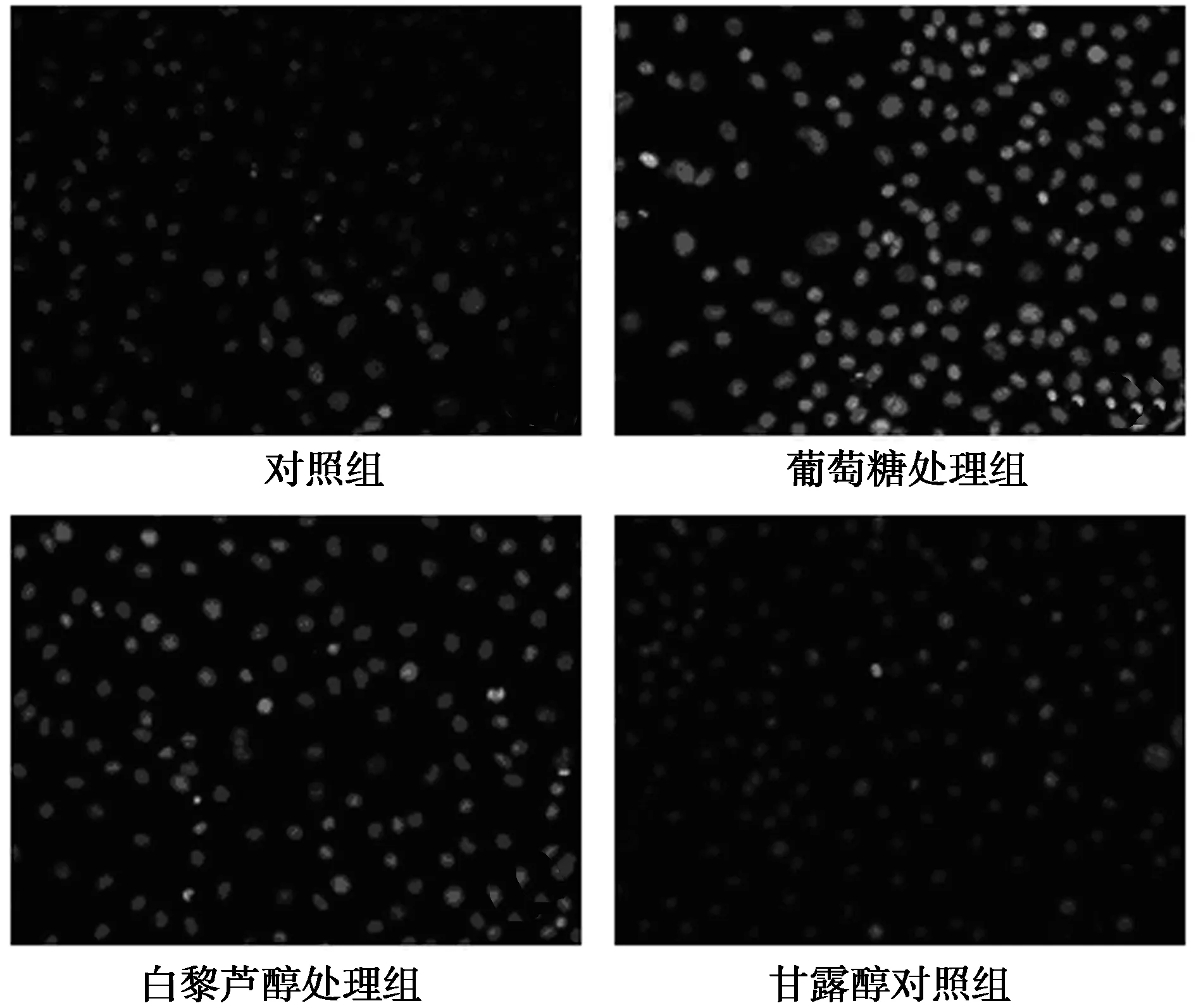
图1 白藜芦醇对高糖诱导HK-2凋亡的影响(Hoechst染色,×200)
2.3 白藜芦醇对高糖诱导HK-2细胞ROS的影响 与对照组相比,葡萄糖(30 mmol/L)处理HK-2 24 h,ROS的生成显著增加,而甘露醇对照组对细胞没有影响,预先用白藜芦醇(10 μmol/L)处理1 h后,可显著抑制葡萄糖(30 mmol/L)诱导的ROS生成(图2)。

图2 白藜芦醇对高糖诱导HK-2 ROS生成的影响(×200)
2.4 白藜芦醇对高糖诱导HK-2细胞Nrf2 mRNA和蛋白表达的影响 与对照组相比,葡萄糖(30 mmol/L)处理HK-2 24 h,Nrf2 mRNA表达显著降低(1.11±0.14 vs 0.46±0.057,P<0.01),而甘露醇对照组对细胞没有影响(1.13±0.16);预先用白藜芦醇(10 μmol/L)处理1 h后,可显著上调葡萄糖(30 mmol/L)抑制的Nrf2 mRNA水平(0.80±0.051,P<0.01)。Nrf2蛋白表达结果与mRNA一致,对照组1.01±0.10,葡萄糖处理组0.53±0.08,白藜芦醇处理组0.82±0.09,甘露醇对照组1.13±0.11(图3)。

1~4:对照组、葡萄糖处理组、白藜芦醇处理组、甘露醇对照组图3 白藜芦醇对高糖处理HK-2 Nrf2蛋白表达的影响(Western印迹)
3 讨 论
高血糖是公认的在DN中起关键作用的因子,本实验发现高糖刺激HK-2 24 h后,Hoechst染色发现凋亡细胞增加,caspase-3活性增加,证明高糖对肾小管上皮细胞的损伤。在高糖作用下,ROS产生过多,氧化应激损伤增强。ROS对肾小球和肾小管的多种细胞均有影响:①高糖可能以ROS为第二信使,上调纤溶酶原激活物抑制物(PAI)-1的表达,促进系膜基质和胶原堆积〔4〕。②ROS通过激活AngⅡ-转化生长因子(TGF)-β1-Smad 信号途径诱导系膜细胞分泌过量的TGF-β1,促进细胞外基质的沉积,并减少其降解〔5〕。③ROS通过激活蛋白激酶C(PKC),使核转录因子(NF)-κB发生磷酸化,活化后启动纤维连接蛋白、层黏连蛋白以及一些炎症因子的转录,增加细胞外基质的沉积〔6〕。④ROS在激活PKC、TGF-β1、AngⅡ等信号通路的同时,这些信号反过来也能诱导高糖状态下的ROS过度生成,这一正反馈的结果使得ROS成为一种信号放大器,导致了DN氧化应激损伤的恶性循环〔7〕。人类Nrf2基因位于2q31, Nrf2有一高度保守的碱性亮氨酸拉链(bZIP)结构。正常的生理状态下,Nrf2位于胞质中,与其抑制蛋白Keap1相互作用后降解、失活。当受到来源于活性氧或亲核剂的信号攻击后,Nrf2与Keap1解离从而使其泛素化减少并进入胞核,与其他的bzIP蛋白结合成异二聚体后,与抗氧化反应元件ARE靶向结合,使ARE相关的抗氧化酶基因的表达上调,启动Nrf2下游靶基因包括过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽硫转移酶(GST)、血红素加氧酶(HO-1)等表达,发挥保护作用〔8~10〕。在正常的生理状态下,HO-1的表达与活力较低,但过氧化氢、内毒素、重金属、紫外辐射、肺损伤、高氧/低氧等应激条件〔11~13〕,均可通过Nrf2启动HO-1的表达从而发挥抗氧化作用。本研究用高糖处理后,肾小管上皮细胞Nrf2表达下调,而且Nrf2表达降低与肾小管上皮细胞的凋亡增多一致。由此推测Nrf2可能是一种保护性的信号蛋白,在DN诱导的肾小管损伤中发挥了作用,但是其具体的致病机制、表达的调控以及参与调控诱导细胞凋亡的信号,有待进一步探讨。白藜芦醇是一种天然的多酚醇类化合物,广泛存在于葡萄籽,花生,虎杖等多种植物中,白藜芦醇对心血管〔14〕、肿瘤〔15〕、风湿性关节炎〔16,17〕等多种疾病有保护作用,并且能够通过抗氧化应激和炎症保护糖尿病大鼠的肾脏,具体机制为激活Nrf2-Keap1信号通路〔18〕,体外实验也证实白藜芦醇能通过活化Nrf2/ARE信号通路抑制肾脏系膜细胞的增殖〔19〕,白藜芦醇还可以通过下调谷胱甘肽转移酶改善早期大鼠肾功能〔20〕。同样我们的实验也证实,白藜芦醇能上调高糖处理后Nrf2的表达,减少ROS的生成,从而减少肾小管上皮细胞的凋亡。但目前白藜芦醇抑制高糖诱导的肾小管上皮细胞凋亡的分子机制及信号途径尚未完全阐明,而且对肾脏病模型动物及患者的肾小管上皮细胞凋亡的干预作用也不明确,需进一步探讨。
1 Collins AJ,Foley RN,Herzog C,etal.US Renal Data System 2010 Annual Data Report〔J〕.Am J Kidney Dis,2011;57(Suppl 1):A8,e1-526.
2 Hagiwara S,McClelland A,Kantharidis P.MicroRNA in diabetic nephropathy:renin angiotensin,AGE/RAGE,and oxidative stress pathway〔J〕.J Diabetes Res,2013;2013:173783.
3 Kim MY,Lim JH,Youn HH,etal.Resveratrol prevents renal lipotoxcity and inhibits mesangial cell glucotoxcity in a manner dependent on the AMPK-SIRT1-PGC1α axis in db/db mice〔J〕.Diabetologia,2013;56(1):204-17.
4 Lee EA,Seo JY,Jiang Z,etal.Reactive oxygen species mediate high glucose-induced plasminogen activator inhibitor-1 up-regulation in mesangial cells and in diabetic kidney〔J〕.Kidney Int,2005;67(5):1762-71.
5 Zhou TB,Qin YH,Lei FY,etal.Prohibitin is associated with antioxidative protection in hypoxia reoxygenation-induced renal tubular epithelial cell injury〔J〕.Sci Rep,2013;4(3):3123.
6 Yang J,Zeng Z,Wu T,etal.Emodin attenuates high glucose-induced TGF-β1 and fibronectin expression in mesangial cells through inhibition of NF-κB pathway〔J〕.Exp Cell Res,2013;319(20):3182-9.
7 Hsieh TJ,Fustier P,Wei CC,etal.Reactive oxygen species blockade and action of insulin on expression of angiotensinogen gene in proximal tubular cells〔J〕.J Endocrinol,2004;183(3):535-50.
8 Kumar H,Kim IS,More SV,etal.Natural product-derived pharmacological modulators of Nrf2/ARE pathway for chronic diseases〔J〕.Nat Prod Rep,2014;31(1):109-39.
9 Zhuang C,Miao Z,Sheng C,etal.Updated research and applications of small molecule inhibitors of Keap1-Nrf2 protein-protein interaction:a review〔J〕.Curr Med Chem,2014;21(16):186-90.
10 Chartoumpekis DV,Kensler TW.New player on an old field,the keap1/Nrf2 pathway as a target for treatment of type 2 diabetes and metabolic syndrome〔J〕.Curr Diabetes Rev,2013;9(2):137-45.
11 Na HK,Surh YJ.Oncogenic potential of Nrf2 and its principal target protein heme oxygenase-1〔J〕.Free Radic Biol Med,2014;67C:353-65.
12 Joo Choi R,Cheng MS,Shik Kim Y.Desoxyrhapontigenin up-regulates Nrf2-mediated heme oxygenase-1 expression in macrophages and inflammatory lung injury〔J〕.Redox Biol,2014;2:504-12.
13 Huang XS,Chen HP,Yu HH,etal.Nrf2-dependent upregulation of antioxidative enzymes:a novel pathway for hypoxic preconditioning-mediated delayed cardioprotection〔J〕.Mol Cell Biochem,2014;385(1-2):33-41.
14 Gu XS,Wang ZB,Ye Z,etal.Resveratrol,an activator of SIRT1,upregulates AMPK and improves cardiac function in heart failure〔J〕.Genet Mol Res,2014;13(1):323-35.
15 Zhou C,Ding J,Wu Y.Resveratrol induces apoptosis of bladder cancer cells via miR 21 regulation of the Akt/Bcl 2 signaling pathway〔J〕.Mol Med Rep,2014;9(4):1467-73.
16 Glehr M,Breisach M,Walzer S,etal.The influence of resveratrol on the synovial expression of matrix metalloproteinases and receptor activator of NF-kappaB ligand in rheumatoid arthritis fibroblast-like synoviocytes〔J〕.Z Naturforsch C,2013;68(7-8):336-42.
17 Tian J,Chen JW,Gao JS,etal.Resveratrol inhibits TNF-α-induced IL-1β,MMP-3 production in human rheumatoid arthritis fibroblast-like synoviocytes via modulation of PI3kinase/Akt pathway〔J〕.Rheumatol Int,2013;33(7):1829-35.
18 Palsamy P,Subramanian S.Resveratrol protects diabetic kidney by attenuating hyperglycemia-mediated oxidative stress and renal inflammatory cytokines via Nrf2-Keap1 signaling〔J〕.Biochim Biophys Acta,2011;1812(7):719-31.
19 Huang K,Huang J,Xie X,etal.Sirt1 resists advanced glycation end products-induced expressions of fibronectin and TGF-β1 by activating the Nrf2/ARE pathway in glomerular mesangial cells〔J〕.Free Radic Biol Med,2013;65:528-40.
20 Jiang B,Guo L,Li BY,etal.Resveratrol attenuates early diabetic nephropathy by down-regulating glutathione s-transferases Mu in diabetic rats 〔J〕.J Med Food,2013;16(6):481-6.
〔2014-12-09修回〕
(编辑 安冉冉/曹梦园)
1 衡阳市第一人民医院
谢红萍(1964-),女,主任医师,硕士,硕士生导师,主要从事肾内科疾病诊治研究。
宋碧辉(1985-),女,硕士,主治医师,主要从事肾内科疾病诊治研究。
R285.5
A
1005-9202(2016)19-4686-03;
10.3969/j.issn.1005-9202.2016.19.006

