FRAS1蛋白与非小细胞肺癌脑转移的关系*
秦 岭, 葛蒙晰, 周鑫莉, 黄若凡, 詹 琼, 季笑宇, 2, 赵月华, 2, 梁晓华△
(1复旦大学附属华山医院肿瘤科,上海 200040; 2复旦大学上海医学院肿瘤学系,上海 200032; 3芜湖市第二人民医院,安徽 芜湖 241000)
·短篇论著·
FRAS1蛋白与非小细胞肺癌脑转移的关系*
秦 岭1, 3, 葛蒙晰1, 周鑫莉1, 黄若凡1, 詹 琼1, 季笑宇1, 2, 赵月华1, 2, 梁晓华1△
(1复旦大学附属华山医院肿瘤科,上海 200040;2复旦大学上海医学院肿瘤学系,上海 200032;3芜湖市第二人民医院,安徽 芜湖 241000)
目的: 探讨FRAS1蛋白与非小细胞肺癌(NSCLC)脑转移的关系。方法: 采用qPCR检测FRAS1的mRNA在NSCLC脑转移组织和同期原发灶组织中的表达水平,采用SP免疫组化法检测FRAS1蛋白在肺癌组织和癌旁非肿瘤组织的表达水平,以及有脑转移和无脑转移NSCLC原发灶组织中FRAS1蛋白的表达水平。结果: FRAS1 mRNA 在肺癌脑转移灶中的表达量是肺癌原发灶中的近10倍,差异具有统计学显著性(P<0.05);FRAS1蛋白在肺癌组织内表达,但在癌旁非肿瘤组织内未见表达;FRAS1 蛋白在有脑转移NSCLC患者的肺癌组织中表达明显高于无脑转移NSCLC患者的肺癌组织,差异具有统计学显著性(P<0.01)。结论: NSCLC组织中FRAS1蛋白表达可能与肺癌发生有关,同时肺癌组织中FRAS1蛋白高表达可能与肺癌脑转移密切相关。
非小细胞肺癌; 脑转移; 细胞外基质; FRAS1
肺癌的发病率在男性和女性中均居于第1位,死亡率位居第2位[1]。肺癌死亡率高的主要原因是患者确诊时多已处于肿瘤晚期,其中相当一部分出现脑转移[2],并且常常缺乏有效的治疗方法。许多肿瘤都可能出现脑转移,然而将近2/3的成人脑转移瘤患者系由肺癌、乳腺癌、恶性黑色素瘤转移所致[3]。目前普遍认为肿瘤转移可能涉及多个步骤,包括肿瘤细胞从原发灶脱落, 黏附于细胞外基质(extracellular matrix, ECM),逐步降解而后穿透ECM进入循环系统,逃避宿主免疫系统,进入靶器官定植,形成新生血管并不断增殖形成转移灶。 Fraser syndrome 1 (FRAS1)蛋白是一种ECM蛋白,在表皮基底膜的黏附和器官发育过程中起着重要的调控作用,与 FREM1和FREM2同属一个家族[4]。FRAS1蛋白由FRAS1基因编码,基因定位于染色体4q21,它的突变可引起Fraser综合征,主要表现在呼吸、循环、生殖、神经系统等发育缺陷[5]。Xu等[6]研究发现子宫内膜癌患者血清中存在FRAS1蛋白,而健康人的血清中不存在。我们前期研究发现,FRAS1蛋白调控黏着斑激酶(focal adhesion kinase,FAK)信号,影响A459细胞的侵袭与转移。因此,FRAS1蛋白与肺癌脑转移可能有一定关系[7]。本研究我们检测肺癌和癌旁组织中FRAS1蛋白的表达水平,观察非小细胞肺癌(non-small-cell lung cancer,NSCLC)脑转移灶组织和同期肺癌原发灶组织中FRAS1 mRNA表达,以及有脑转移和无脑转移NSCLC肺癌组织中FRAS1蛋白表达水平的差异,探讨FRAS1蛋白与NSCLC脑转移的关系。
材 料 和 方 法
1 研究对象
收集自2008年1月1日~2013年10月31日在复旦大学附属华山医院因NSCLC手术切除的肺癌原发灶和/或脑转移灶标本。用于分析FRAS1的mRNA的肺癌新鲜肿瘤组织标本3例(男2例,女1例,年龄42~69岁,中位年龄59岁),肺癌脑转移灶新鲜肿瘤组织标本11例(男7例,女4例,年龄40~69岁,中位年龄58岁)。用于分析NSCLC原发灶及其癌旁组织(取自所切除肺叶距离病灶>5 cm的组织)FRAS1蛋白表达的新鲜组织标本12例(男5例,女7例,年龄40~68岁,中位年龄58岁)。用于分析有无脑转移的肺癌组织FRAS1蛋白表达的组织标本按1∶2分配,初诊时头颅增强磁共振成像(magnetic resonance imaging,MRI)未见颅内占位但原发灶确诊NSCLC后3年内头颅增强MRI发现颅内占位者归入脑转移组(男19例,女11例,48~71岁,中位年龄58.5岁);原发灶确诊NSCLC 3年后头颅增强MRI仍未发现颅内占位者归入无脑转移组(男38例,女22例,41~70岁,中位年龄58岁)。以上标本均经病理确诊为NSCLC或者NSCLC脑转移,同时排除其它恶性肿瘤病史,术前均未接受任何放化疗及靶向治疗。肿瘤组织病理类型均为非小细胞肺癌,其中肺腺癌65例,肺鳞癌28例,肺腺鳞癌6例,肺其它类型(大细胞癌、未分化癌等)6例,脑转移性腺癌8例,脑转移性鳞癌3例,平均随访时间 4.2 年。上述的新鲜组织标本为术后1 h内获得,获得后立即放液氮中保存;同时石蜡标本均在经过4%的甲醛溶液固定后,常规石蜡包埋,所有标本都经过两位高年资病理医师分别单独读片及复核。
2 主要试剂及仪器
组织RNA提取试剂盒(上海华舜生物工程有限公司);FRAS1和GAPDH引物(上海生工生物工程有限公司;序列详见表1);兔抗人 FRAS1 多克隆抗体(Abcam);II 抗(福州迈新生物技术开发公司);SYBR Green 荧光定量PCR试剂盒(Life Technologies)。PCR仪(Bio-Rad);7500 Real-Time PCR仪(ABI)。
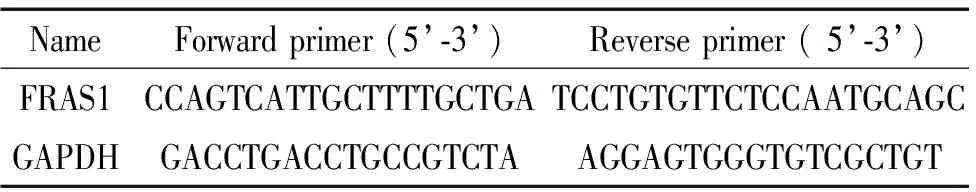
表1 qPCR扩增的引物序列
3 方法
3.1 实时荧光定量PCR (qPCR)检测 分别取肺癌组织和脑转移瘤组织,按RNA提取试剂盒说明书进行提取总RNA,使用紫外分光光度计检测RNA样品的A260/A280以确定RNA纯度,并计算出RNA浓度,并于-80 ℃冰箱保存备用;参照RT-PCR试剂盒说明书进行逆转录反应。qPCR反应用GAPDH作为内参照,按照说明书加入SYBR 荧光染料、引物序列和模板cDNA在荧光定量PCR仪中进行反应。qPCR反应体系为ddH2O 6 μL、样本模板cDNA 3 μL、荧光染料10 μL、上下引物各0.5 μL,配成20 μL 的体系。反应参数为 94 ℃ 5 min;94 ℃ 30 s、54℃ 30 s、72 ℃ 1 min,共32个循环;72 ℃ 8 min。每个样品3管重复。
3.2 免疫组织化学观察与结果判断 切片脱蜡置于湿盒中;用3%的过氧化氢去除过氧化物酶,静置10 min,后用蒸馏水冲洗,置于pH 7.2碱性缓冲液中;微波高温抗原修复10 min;随后加入目的基因 I 抗4 ℃孵育过夜,再加入 II抗,再进行DAB显色;后用苏木素复染;再脱水、透明,最后用中性树脂封片后显微镜下观察拍照。每张切片选择具有代表性的5个高倍视野(×400)进行观察,每个视野计数100个肿瘤细胞,并采用双盲法对染色结果进行评估。肿瘤细胞染色阳性比例≤5%为0分,阳性率5%~30%为1分,阳性率 30%~70%为 2 分,阳性率>70%为 3 分。染色强度:无染色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。肿瘤细胞染色阳性比例计分和染色强度计分之和作为评判免疫组化染色阳性结果的标准;0~1 分为阴性(-),2~3 分为弱阳性(+),4~5 分为中度阳性(++),6 分为强阳性(+++)。
3 统计学处理
使用SPSS 20.0统计分析软件进行统计学分析。FRAS1 mRNA表达的比较采用t检验,FRAS1蛋白表达量的比较采用秩和检验。以P<0.05 表示差异有统计学意义。
结 果
1 FRAS1蛋白在NSCLC肿瘤组织和癌旁组织中的不同表达
免疫组织化学方法检测结果发现,FRAS1蛋白在NSCLC肿瘤组织内表达呈阳性,癌旁非肿瘤组织内表达呈阴性,见图1。
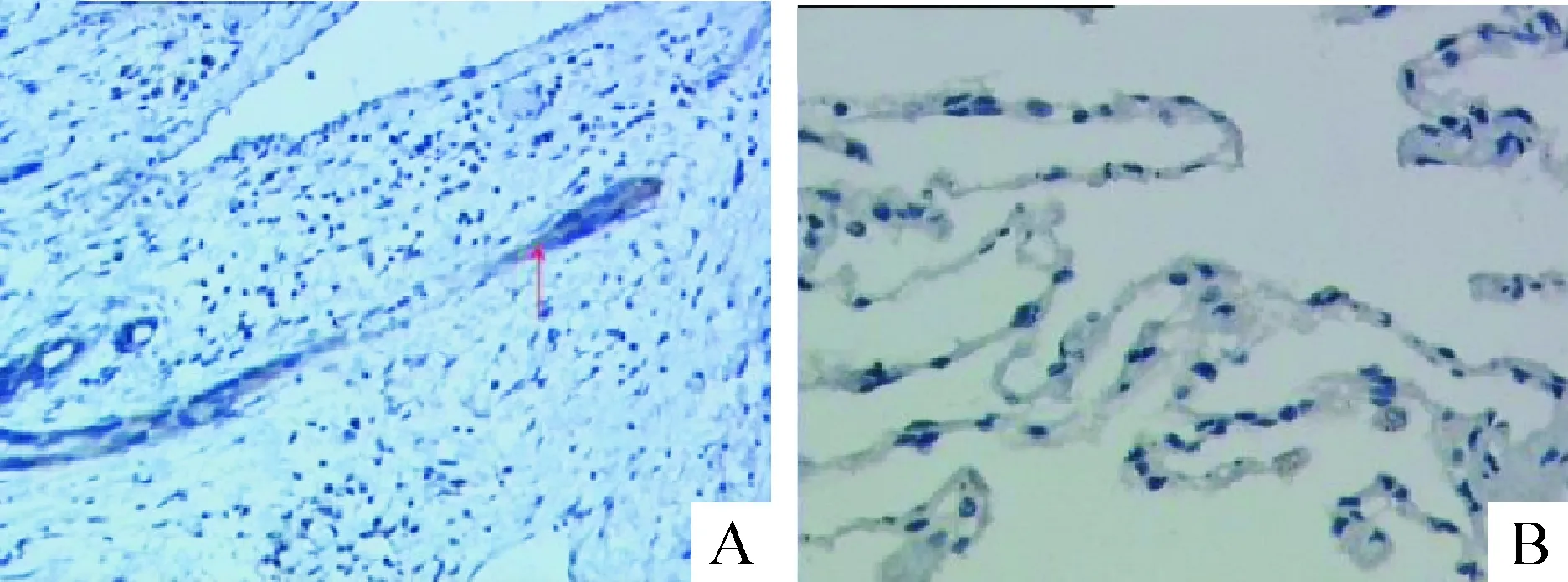
Figure 1.FRAS1 protein expression in the lung cancer tissue and tissue adjacent to carcinoma (×200). A: cytoplasmic protein expression in the tumor cells was positive, the arrow for lung cancer cells; B: FRAS1 protein expression was negative in the normal tissue adjacent to carcinoma.
图1 FRAS1 蛋白在肺癌组织及癌旁组织中的表达
2 FRAS1 mRNA在NSCLC脑转移瘤和原发灶组织中的表达
qPCR检测结果发现, FRAS1 mRNA在NSCLC脑转移样本中的表达量约是肺癌样本的10倍,两组间差异有统计学显著性(P<0.05),见图2。
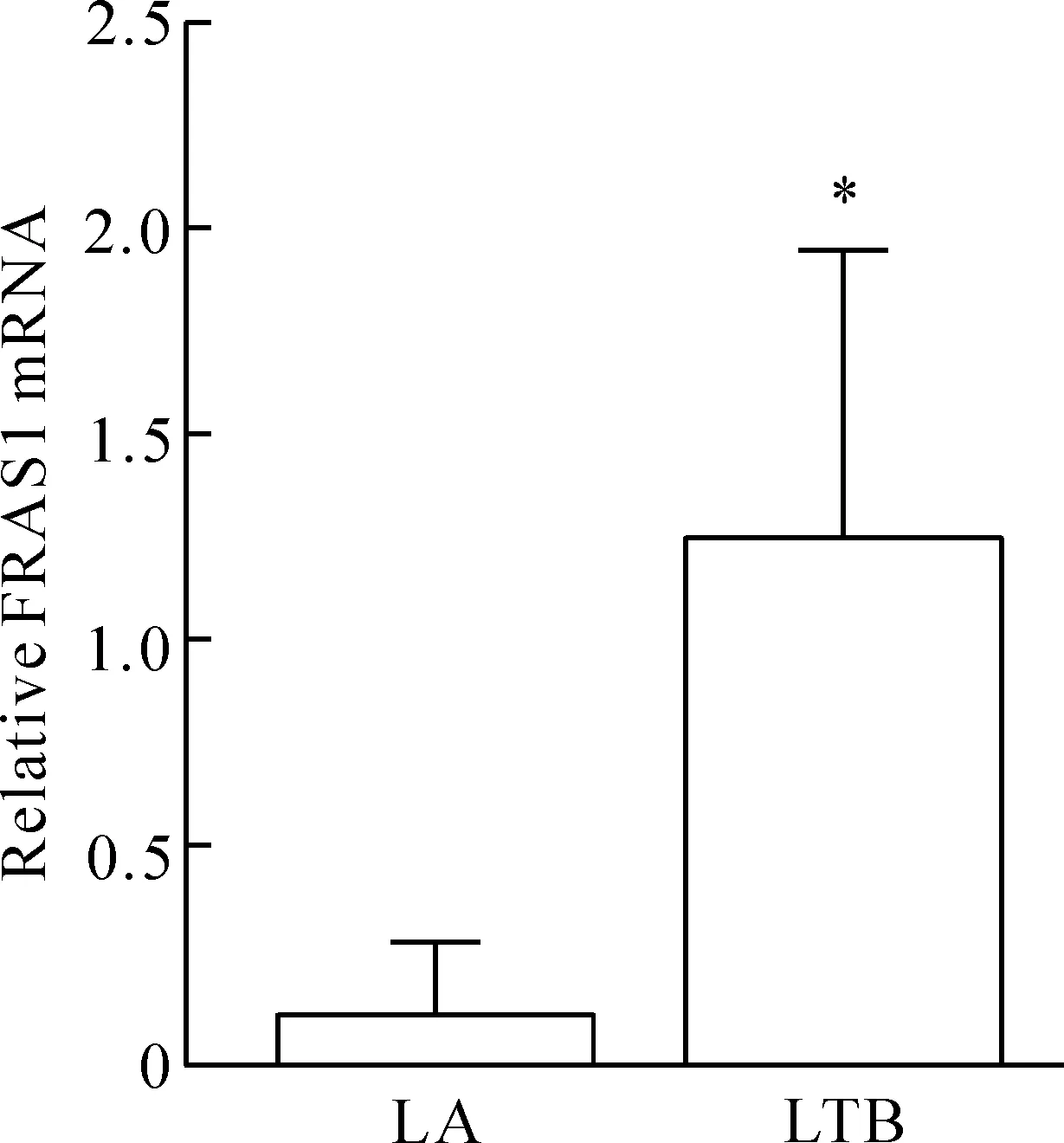
Figure 2.The mRNA expression of FRAS1 in the brain metastatic tumor tissues and the primary tumor zone of NSCLC. LA: the primary focal lung cancer samples (n=3); LTB: the lung cancer samples collected in brain metastatic zone (n=11). Mean±SD.*P<0.05vsLA group.
图2 FRAS1 mRNA在肺癌脑转移灶和原发灶组织中的表达情况
3 FRAS1蛋白在有脑转移和无脑转移的NSCLC肿瘤组织中的表达
免疫组织化学方法检测结果表明,FRAS1蛋白在有脑转移的NSCLC肿瘤组织组中表达明显高于无脑转移组,两组间差异有统计学显著性(P<0.01),见图3、表2。
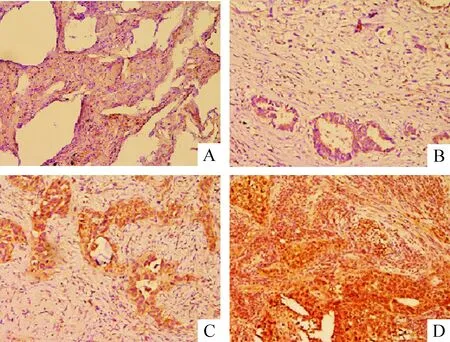
Figure 3.The protein expression of FRAS1 in the NSCLC tissues (×200). A:-; B:+; C:++; D:+++. FRAS1 protein was mainly expressed in the cytoplasm of the tumor cells.
图3 FRAS1蛋白在NSCLC患者肺癌组织中的表达
表2 FRAS1蛋白在有脑转移和无脑转移的NSCLC组织中的表达
Table 2.The protein expression of FRAS1 in the NSCLC tumor tissues with or without brain metastases
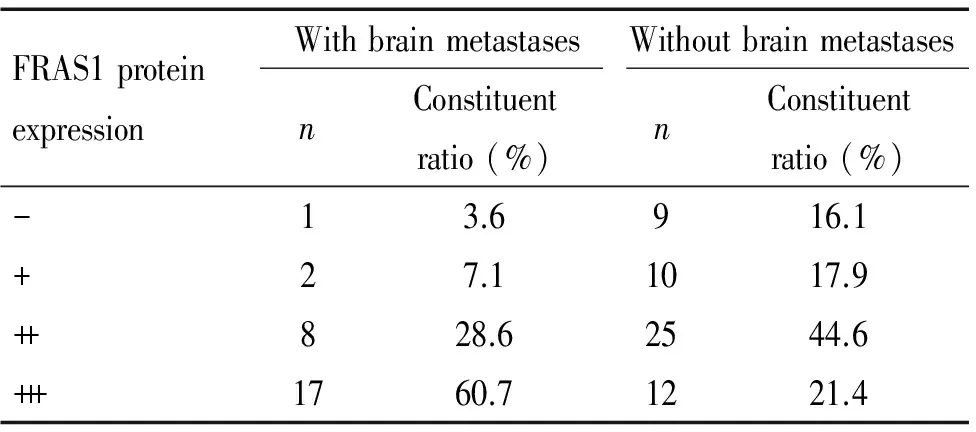
FRAS1proteinexpressionWithbrainmetastasesWithoutbrainmetastasesnConstituentratio(%)nConstituentratio(%)-13.6916.1+27.11017.9++828.62544.6+++1760.71221.4
讨 论
颅内转移瘤是成人最常见的颅内肿瘤,其发生率是颅内原发肿瘤的4~5倍[8]。脑转移瘤的3大原发恶性肿瘤依次为肺癌(40%~50%)[9]、乳腺癌(20%~30%)[10]、恶性黑色素瘤(10%~40%)[11]。非小细胞肺癌约占肺癌的80%,首次就诊时脑转移的发生率约10%,在整个病程过程中脑转移的发生率为40%~50%[12]。脑转移也是肺癌治疗失败的常见原因,且脑转移患者的生活质量和预后极差,即使经过手术、放化疗、分子靶向等治疗,脑转移患者生存时间仍不理想;因此寻找与肺癌脑转移特异性相关的生物标记物,在预测和治疗肺癌脑转移中显得尤为重要。ECM作为肿瘤细胞生长的微环境,在肿瘤的转移过程中发挥着“双刃剑”作用。一方面,ECM可作为天然屏障,控制肿瘤细胞转移;另一方面,重塑的ECM为肿瘤细胞创造适合生长的环境,导致肿瘤细胞转移[13]。各种肿瘤的体内外实验[14]表明,肿瘤细胞在黏附分子或基质成分诱导下激活或增强蛋白酶的活性,如金属蛋白酶、尿纤溶酶原激活物、组织蛋白酶、类肝素酶等。这些蛋白酶能够降解并重构ECM,调节肿瘤细胞与ECM的黏附,促进肿瘤新生血管形成,从而促进肿瘤细胞转移。FRAS1蛋白作为一种调控基底膜形成的ECM蛋白,目前其功能研究主要见于Fraser综合征和胚胎发育,在肿瘤中的作用仅限于其存在于子宫内膜癌患者血清中。
本研究发现肺癌组织中FRAS1蛋白表达阳性,而癌旁非肿瘤组织未表达,因此我们推测FRAS1蛋白表达可能与肺癌的发生具有相关性;目前FRAS1蛋白在恶性肿瘤组织中表达的相关研究甚少;因此FRAS1蛋白与肺癌有何关联有待进一步研究。同时我们检测FRAS1 的mRNA在脑转移组织中的表达明显高于肺癌原发灶组织;通过比较原发灶与转移灶中FRAS1的mRNA表达差异,我们推测FRAS1蛋白可能在肺癌发生脑转移过程中起着积极作用;并且经扩大样本在肺癌组织中验证发现:有脑转移的肺癌组织中FRAS1蛋白表达明显高于无脑转移组,差异具有统计学意义。因此,我们认为肺癌组织中FRAS1蛋白高表达很可能与肺癌脑转移密切相关。我们课题组之前研究发现FRAS1蛋白通过调控FAK信号来调控A549细胞的侵袭及转移[7];同时可能参与NF-κB和STAT3信号调控。并且体外实验[15]显示NF-κB和 STAT3可引起FREM1表达,增强肿瘤细胞的侵袭能力。这些可能只是FRAS1蛋白促进肺癌脑转移的部分机制。
其它很多因素可能也参与了肺癌脑转移的发生,例如神经-免疫调节因子在脑转移过程中发挥重要作用;炎症趋化因子可能定向引导脑转移发生以及MMPs通过细胞外基质与血管生成相互作用在脑转移过程中起到一定作用等。肺癌脑转移的分子机制可能非常复杂,还需要我们开展更多深入的研究。
[1] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013, 63(1):11-30.
[2] Barnholtz-Sloan JS, Sloan AE, Davis FG, et al. Incidence proportions of brain metastases in patients diagnosed (1973 to 2001) in the Metropolitan Detroit Cancer Surveillance System[J]. J Clin Oncol, 2004, 22(14):2865-2872.
[3] Taillibert S, Le Rhun E. Epidemiology of brain metastases[J]. Cancer Radiother, 2015,19(1):3-9.
[4] Pavlakis E, Chiotaki R, Chalepakis G. The role of Fras1/Frem proteins in the structure and function of basement membrane[J]. Int J Biochem Cell Biol, 2011, 43(4):487-495.
[5] Alazami AM, Shaheen R, Alzahrani F, et al. FREM1 mutations cause bifid nose, renal agenesis, and anorectal malformations syndrome[J]. Am J Hum Genet, 2009, 85(3):414-418.
[6] Xu J, Min W, Liu X, et al. Identification of FRAS1 as a human endometrial carcinoma-derived protein in serum of xenograft model[J]. Gynecol Oncol, 2012, 127(2):406-411.
[7] Zhan Q, Huang RF, Liang XH, et al. Fras1 knockdown reduces A549 cells migration and invasion through downregulation of FAK signaling[J]. Int J Clin Exp Med, 2014, 7(7):1692-1697.
[8] Hatiboglu AM, Wildrick DM, Sawaya R. The role of surgical resection in patients with brain metastases[J]. Ecancermedicalscience, 2013, 7:308.
[9] Hubbs JL, Boyd JA, Hollis D, et al. Factors associated with the development of brain metastases: analysis of 975 patients with early stage non-small cell lung cancer[J]. Cancer, 2010, 116(21):5038-5046.
[10]Kim HJ, Im SA, Keam B, et al. Clinical outcome of central nervous system metastases from breast cancer: differences in survival depending on systemic treatment[J]. J Neurooncol, 2012, 106(2):303-313.
[11]Bafaloukos D, Gogas H. The treatment of brain metastases in melanoma patients[J]. Cancer Treat Rev, 2004, 30(6):515 -520 .
[12]Schuette W. Treatment of brain metastases from lung can-cer: chemotherapy[J]. Lung Cancer,2004, 45(2):S253-S257.
[13]Wu XZ, Chen D, Xie GR. Extracellular matrix remodeling in hepatocellular carcinoma: effects of soil on seed?[J]. Med Hypotheses, 2006, 66(6):1115-1120.
[14]van Dijk M, Goransson SA, Stromblad S. Cell to extracellular matrix interactions and their reciprocal nature in cancer[J]. Exp Cell Res, 2013, 319(11):1663-1670.
[15]Yoon S, Woo SU, Kang JH, et al. NF-κB and STAT3 cooperatively induce IL-6 in starved cancer cells[J]. Oncogene, 2012, 31(29):3467-3481.
(责任编辑: 陈妙玲, 罗 森)
Relationship between FRAS1 protein and brain metastases of NSCLC
QIN Ling1, 3, GE Meng-xi1, ZHOU Xin-li1, HUNAG Ruo-fan1, ZHAN Qiong1, JI Xiao-yu1, 2, ZHAO Yue-hua1, 2, LIANG Xiao-hua1
(1DepartmentofOncology,HuashanHospital,FudanUniversity,Shanghai200040,China;2DepartmentofOncology,ShanghaiMedicalCollege,FudanUniversity,Shanghai200032,China;3TheSecondPeople’sHospitalofWuhu,Wuhu241000,China.E-mail:xhliang66@sina.com)
AIM: To explore the relationship between FRAS1 protein and brain metastases of non-small cell lung cancer (NSCLC). METHODS: The mRNA expression of FRAS1 in the brain metastatic tumor tissues and primary tumor tissues of NSCLC was detected by qPCR. The protein expression of FRAS1 in the tumor tissues and normal tissues adjacent to tumor tissues of NSCLC was measured by SP method of immunohistochemistry. The protein expression of FRAS1 in NSCLC primary tumor tissues with or without brain metastases was also determined.RESULTS: The mRNA expression of FRAS1 in the brain metastatic zone was nearly 10 times higher than that in the primary tumor tissues, and there was significant difference between the 2 groups (P<0.05). FRAS1 protein was expressed in the NSCLC primary tumor tissues, but was not found in the normal tissues adjacent to primary tumor tissues. The protein expression of FRAS1 in the NSCLC with brain metastases was significantly higher than that without brain metastases (P<0.01). CONCLUSION: FRAS1 protein may be associated with the occurrence of NSCLC. The over-expression of FRAS1 protein may be related to brain metastases with NSCLC.
Non-small-cell lung cancer; Brain metastasis; Extracellular matrix; FRAS1
1000- 4718(2016)10- 1892- 04
2015- 12- 28
2016- 08- 22
国家自然科学基金资助项目(No. 81302010);上海市科委自然科学基金资助项目(No. 13ZR1405000)
△通讯作者 Tel: 021-52888142; E-mail: xhliang66@sina.com
R734.2; R730.23
A
10.3969/j.issn.1000- 4718.2016.10.025
杂志网址: http://www.cjpp.net

