MicroRNA-494参与多种疾病发生发展的分子机制研究进展*
李广文, 赵海苹, 罗玉敏
(首都医科大学宣武医院脑血管病研究室, 北京 100053)
·综 述·
MicroRNA-494参与多种疾病发生发展的分子机制研究进展*
李广文, 赵海苹, 罗玉敏△
(首都医科大学宣武医院脑血管病研究室, 北京 100053)
Beijing100053,China.E-mail:yumin111@ccmu.edu.cn)
微小RNA-494; 肿瘤; 缺血; 缺氧
微小RNA(microRNA,miRNA,miR)是一种由20~22个核苷酸组成的内源性非编码小分子单链RNA,它可以在后转录水平通过以完全互补或不完全互补的形式与mRNA的3’UTR区结合调控细胞增殖、分化及凋亡等多个生理病理过程[1]。其中,miR-494是一种来源于染色体14q32.31的mi-RNA[2]。近年来的研究发现miR-494参与人体多个生理及疾病的发生发展过程,在肿瘤、缺血缺氧疾病中其表达水平发生上调或下调。本文就miR-494在多种疾病中的表达变化、作用及机制研究进行综述。
1 miR-494与消化系统肿瘤
目前有关miR-494与消化系统肿瘤关系的研究较多。Bartel等[1]发现在人类胃肠道间质瘤(gastrointestinal stromal tumors,GISTs)细胞内miR-494的表达水平与KIT的表达呈负相关,进一步研究发现miR-494通过与靶基因KIT的3’UTR处调节位点结合下调KIT的表达水平。在KIT基因位点突变(exon 13, K642E)的GIST882细胞系中,miR-494减少了KIT信号转导通路中下游分子的表达,包括磷酸化蛋白激酶B(p-Akt)和磷酸化信号转导及转录激活因子3(phosphorylatied signal transducer and activator of transcription 3,p-STAT3)。实验发现miR-494可抑制GISTs细胞增殖,这可能与miR-494的高表达影响细胞G1/S期的改变而促进细胞凋亡有关[3]。另外一项研究发现人类胃癌细胞中miR-494的表达水平降低,其降低水平与靶基因c-Myc的表达水平呈负相关,miR-494可以降低内源性c-Myc的表达水平,从而延迟细胞G1/S期分裂,抑制细胞增殖。同时,研究还发现miR-494的低表达和c-Myc的高表达预示胃癌患者预后较差[4]。
Li等[5]的研究发现在胰腺导管腺癌中SMAD4功能的降低可引起miR-494的表达下调,进一步调节靶基因叉头框蛋白M1(forkhead box M1,FoxM1)的表达。采用转基因技术上调miR-494的表达可以下调FoxM1的水平和抑制β连环蛋白发生转位,进而抑制肿瘤细胞的增殖、迁移和侵袭。同时,miR-494的表达水平越低,胰腺导管腺癌发生转移的风险就越高,患者的生存时间越短。同样的,另外一项研究发现miR-494在胰腺癌肿瘤组织内表达降低,这可促进肿瘤细胞向周围组织的扩散和侵袭力;反之,高表达的miR-494通过靶向c-Myc和抗衰老酶1(sirtuin type 1,SIRT1)能有效促进细胞衰老、凋亡和G1期分裂停滞,从而抑制肿瘤细胞的增殖与侵袭力。同时,临床研究发现肿瘤细胞内低表达的miR-494与肿瘤体积、恶性肿瘤国际临床病期分类(tumor node metastasis,TNM)分期、淋巴侵袭、远处转移及预后呈负相关。因此,miR-494可以用来评估胰腺肿瘤患者的严重程度,或通过下调c-Myc和SIRT1的表达起到治疗肿瘤的作用[6]。
研究还发现miR-494在肝癌细胞中的表达明显升高,其与肿瘤细胞的分化程度、TNM分级和淋巴转移呈正相关。miR-494可以直接与靶基因PTEN的mRNA 3’UTR区结合而抑制PTEN的表达,上调miR-494的表达可提高肿瘤细胞的活性、迁移力和侵袭性,降低细胞凋亡,有效抑制细胞停滞在G0/G1期。miR-494不仅能够抑制PTEN的表达,还能够增加肿瘤细胞内磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)和p-Akt的表达,从而促进细胞增殖能力、迁移力和侵袭性[7]。另外一项对肝癌细胞的研究发现miR-494可以通过直接作用于结直肠癌中的突变基因(mutated in colorectal cancer,MCC)调节肝癌细胞的G1/S周期[8]。因此,miR-494可能为肝癌提供一种新的治疗思路。
另外,多项研究发现miR-494在消化系统的其它肿瘤中同样出现表达的变化。食管鳞状细胞癌中miR-494的表达降低,其靶基因CLPTM1L的表达升高,且miR-494表达越低或CLPTM1L表达越高,其肿瘤的淋巴转移能力就越强,miR-494的表达升高时可以抑制食管鳞状癌细胞的增殖和侵袭能力,且促进肿瘤细胞的凋亡[9]。体内外实验证实在结肠直肠癌组织或细胞内miR-494的表达明显升高,且其升高程度与肿瘤的临床分期和远处转移有直接关系,肿瘤细胞内miR-494含量越高代表肿瘤的侵袭能力越强,其机制可能为miR-494与PTEN的3’UTR区直接结合抑制PTEN表达有关,因此miR-494的表达量可以作为一个独立的指标评估疾病进展情况及患者生存情况[10]。采用基因芯片技术对胆管上皮癌患者的miRNA 谱进行分析发现miR-494表达水平下调,其在胆管上皮癌细胞G2/M期起重要的抑制调节作用。萤光素酶报告载体发现miR-494通过直接与垂体瘤转化基因1(pituitary tumor-transforming gene 1,PTTG1)和拓扑异构酶2α(topoisomerase II alpha,TOP2α)的开放阅读框结合,下调两者的表达,并在细胞周期G2/S、G2/M转化过程中起着相应的调节作用[11]。
2 miR-494与呼吸系统肿瘤
miR-494可通过调控靶基因N-乙酰氨基半乳糖转移酶-7 (GalNAc-transferase-7,GALNT7)的表达调节鼻咽癌细胞的增殖和肿瘤新生。体外实验证实当敲除GALNT7后,肿瘤细胞的增殖、迁移及侵袭能力显著降低。体内实验证实miR-494表达升高时,鼻咽癌肿瘤的生长速度减慢,其潜在的机制可能与miR-494下调GALNT7的表达有关[12]。miR-494在支气管上皮或肺癌细胞中同样发生显著变化,人支气管上皮细胞系16HBE恶变后,细胞内miR-494的表达上升,而其靶基因PTEN的表达下调[13]。升高miR-494的表达水平可以降低caspase-3/7的活性;而降低miR-494的表达水平,可以增加caspase-3/7的活性,有效降低细胞恶变可能性[13]。体外实验证实miR-494可以通过调控靶基因细胞周期素依赖性激酶6(cyclin-dependent kinase 6,CDK6)的水平调控支气管上皮细胞的细胞周期。苯并芘预处理支气管上皮细胞导致细胞内miR-494的表达呈时间依赖性的上调,从而下调CDK6的表达抑制细胞G1/S期进程,细胞停留在G1期的数量明显增多;在苯并芘处理的同时抑制miR-494的表达,CDK6表达上调,细胞分化过程趋于正常[14]。在小细胞肺癌(small-cell lung cancer, SCLC)中,miR-494可以通过结合靶基因促泌素(secretagogin, SCGN)的 mRNA 3’UTR区,调控靶基因SCGN的表达;应用miR-494类似物引起SCGN的mRNA和蛋白水平降低,引起肿瘤细胞凋亡增加,反之应用miR-494抑制剂后增加SCGN的表达,而SCGN表达水平越高,SCLC患者的预后越差[15]。另有研究发现miR-494-BIM通路受到细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)表达水平的影响,PEDS104G(phosphoprotein enriched in diabetes)通过ERK1/2通路调节BIM的表达,阻断ERK1/2通路可使转录启动位点的活性降低。在非小细胞肺癌(non-small-cell lung cancer,NSCLC)细胞中检测miR-494对肿瘤坏死因子相关凋亡配体(TNF-related apoptosis-inducing ligand,TRAIL)的抵抗作用,对TRAIL抵抗作用敏感的人大细胞肺癌H460细胞系中miR-494通过下调 BIM增强了TRAIL抵抗引起的凋亡[16]。研究表明,miR-494可能通过作用于PTEN及下游的Akt/内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)通路提高血管内皮细胞的迁移能力和血管新生能力。体外实验显示,与血管内皮细胞共培养的肺癌细胞系A549可以产生miR-494,并以微泡的形式向内皮细胞介导运输,增强细胞的迁移能力和血管新生能力。还有,低氧环境可以促进miR-494表达,可能与低氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)有关。相反,miR-494表达降低时,血管新生能力和肿瘤的转移能力明显下降。因此通过调控miR-494的表达可以干预呼吸系统肿瘤的进展,为临床治疗提供理论依据[17]。
3 miR-494与生殖系统肿瘤
卵巢上皮癌是妇科常见的恶性肿瘤之一,研究发现在卵巢上皮癌组织和肿瘤细胞内miR-494的表达较正常卵巢组织的表达有所下降,下降程度与国际妇产科联盟的肿瘤分级、病理学分级、淋巴转移呈负相关。在卵巢上皮癌组织中低表达miR-494促进肿瘤细胞向远处转移,而miR-494可以通过靶基因c-Myc抑制肿瘤细胞的生长和迁移[18]。另外一项研究发现miR-494同样能够明显抑制卵巢上皮癌细胞的增殖、迁移和侵袭能力并诱导肿瘤细胞的凋亡,进一步的研究发现胰岛素样生长因子1受体(rinsulin-like growth factor 1 receptor,IGF1R)是miR-494在卵巢上皮癌细胞中的直接作用靶点,miR-494可以通过抑制IGF1R及其下游蛋白如p-Akt、p-ERK等的表达从而抑制肿瘤细胞增殖[19]。因此,miR-494可以通过c-Myc、IGF1R等相关靶基因起到抑制卵巢上皮癌的作用,可能成为治疗此病的一种新方法。
4 miR-494与乳腺癌
研究发现miR-494的表达变化与乳腺癌有着密切的关系。miR-494可以通过靶向抑癌基因PTEN和激活Akt通路,调节骨髓来源的抑制性细胞(myeloid-derived suppressor cells,MDSCs)的增殖和活性。miR-494靶向下调PTEN增强了Akt通路的活性,上调了基质金属蛋白酶(matrix metalloproteinases,MMPs)的表达,最终增强了肿瘤细胞的侵袭和转移能力。同样,在动物实验发现,小鼠体内乳腺癌细胞中低表达的miR-494明显地抑制了MDSCs的活性,抑制了肿瘤的生长和转移[20]。另外一项研究发现乳腺癌细胞中miR-494的表达下调引起CXC族趋化因子受体 4(CXC chemokine receptor 4,CXCR4)表达的提高,反之引起CXCR4表达降低。研究发现miR-494可以直接与CXCR4的mRNA 3’UTR区结合从而抑制其表达。同时,miR-494也能够抑制β-连环蛋白、淋巴样增强子结合因子1(lymphoid enhancer-binding factor 1,LEF1)、CD44和细胞周期蛋白D1的转录。因此,可推断miR-494可以通过CXCR4介导的Wnt/β-连环蛋白通路而调控乳腺癌的进展[21]。最新一项体外研究证实miR-494可以直接结合到组织因子途径抑制物(tissue factor pathway inhibitor,TFPI)的mRNA 3’UTR区,从而参与雌激素对乳腺癌细胞内TFPI mRNA水平的调节,下调TFPI及其蛋白的表达。而抑制miR-494的表达后,雌激素下调乳腺癌细胞中TFPI的mRNA水平的作用将被削弱。这表明miR-494在乳腺癌细胞内起到重要的调节作用[22]。
5 miR-494与神经系统肿瘤
胶质瘤是中枢神经系统最常见的肿瘤之一,研究显示miR-494可通过下调细胞分裂周期蛋白20的表达水平,抑制肿瘤生长。高表达miR-494可在72 h内降低肿瘤细胞的活性而抑制肿瘤生长;反之,抑制miR-494的表达可恢复肿瘤细胞的增殖活性[23]。在神经胶质瘤细胞系U-251中,miR-494可以通过启动基质金属蛋白酶2(matrix metalloproteinase -2,MMP-2)来增强肿瘤细胞的侵袭能力,其潜在的机制可能与靶基因表皮生长因子受体(epidermal growth factor receptor,EGFR)的上调有关,miR-494通过上调EGFR的表达抑制溶酶体蛋白的表达;进一步的研究发现miR-494可直接作用于p190B的mRNA 3’UTR,调控p190B的表达,进一步调控EGFR的表达、MMP-2的分泌和肿瘤的侵袭力。因此,p190B的敲除对miR-494的促侵袭能力起决定性作用[24]。另有动物研究发现MMP-9可以抑制颅内肿瘤细胞内 miR-494的表达。实验发现对颅内肿瘤的小鼠采用MMP-9特异性沉默RNA治疗导致miR-494的高表达,进一步分析发现MMP-9和miR-494 水平之间的负相关关系与miR-494的一个启动相关CpG岛区域(-186到-20)的甲基化形式有关[25]。
6 miR-494与其它肿瘤细胞的关系
此外,miR-494可以抑制前列腺癌、软骨肉瘤、颈部肿瘤、黑色素瘤的增殖和转移。在前列腺癌细胞中miR-494可以直接作用于靶基因CXCR4,降低其mRNA及蛋白的表达,miR-494的表达升高可以抑制肿瘤生长、迁移和侵袭力,促进肿瘤细胞的凋亡。miR-494可用于治疗前列腺癌新型疗法的研究[26]。近期一项研究发现miR-494在软骨肉瘤细胞内的表达下调,有利于肿瘤细胞的增殖和向周围组织的侵袭,且肿瘤细胞内miR-494的表达越低,患者预后越差,生存率越低。另外,体内和体外的实验同时证实miR-494可以通过直接靶向SOX9基因而抑制肿瘤细胞迁移和侵袭。因此,miR-494可作为治疗软骨肉瘤的一种新的治疗方法,以及判断患者预后的生物学标记物[27]。miR-494也与颈部肿瘤的生长及转移能力有关。与颈部临近组织相比,颈部肿瘤组织内miR-494的表达明显下调,而其靶基因PTTG1的表达上调。miR-494可以通过与PTTG1的mRNA 3’UTR区结合而降低PTTG1的表达水平,从而降低肿瘤转移能力,利于颈部肿瘤患者的恢复[28]。miR-494可以下调Ⅱ型多磷酸肌醇4-磷酸酶(inositol polyphosphate 4-phosphatase type II,INPP4B)的表达,降低血清及糖皮质激素调节激酶3(serum-regulated and glucocorticoid-regulated kinase 3,SGK3)的激活,进而抑制黑色素瘤细胞的增殖;反之,降低miR-494的表达能够上调INPP4B的表达,提高SGK3的激活,进而促进黑色素瘤的增殖[29]。
7 miR-494与器官/细胞低氧/低灌注的关系
多项研究显示miR-494在器官或细胞缺血、缺氧时表达发生改变,这种改变对不同的器官产生截然不同的影响。肝脏细胞处于低氧环境时miR-494的表达水平逐渐上升,并于缺氧4 h后达到高峰。进一步研究发现在低氧和正常氧环境下,miR-494的高表达可引起p-Akt、HIF-1α和血红素加氧酶1(heme oxygenase-1,HO-1)的表达升高;而Akt抑制剂LY294002干预的细胞消除了miR-494高表达对p-Akt、HIF-1α和HO-1的影响。另外,miR-494的表达升高时可以降低低氧导致的细胞凋亡,也可以引起caspase-3/7的活性降低。miR-494通过PI3K/Akt通路上调HIF-1α的表达[30]。miR-494既可以激活促凋亡蛋白如PTEN、ROCK1和钙调素依赖性蛋白激酶II(calmodulin-dependent protein kinase II,CaMKII),也可以激活抗凋亡蛋白[如成纤维细胞生长因子2(fibroblast growth factor receptor 2,FGFR2)和白血病抑制因子(leukaemia inhibitory factor, LIF)]的表达,但其最终结果为激活Akt-线粒体通路,最后保护缺血再灌注损伤引起的心肌损害[31]。大鼠脑缺血再灌注模型的基因芯片分析发现,在脑组织缺血24 h后miR-494的表达上调,进一步的研究预测miR-494可能通过调控Bcl-2参与调控神经细胞的凋亡过程[32]。在肾脏细胞中,miR-494可直接作用于转录激活因子3(activating transcription factor 3,ATF3)的3’UTR区降低其转录。肾脏缺血再灌注损伤后,miR-494的表达升高,进而下调ATF3的表达,引起炎症因子IL-6、单核细胞趋化因子1、P-选择蛋白的表达量升高,进一步损伤肾脏功能[33]。一项最新研究显示miR-494对颈动脉粥样硬化斑块的形成和稳定性起到重要作用。miR-494在不稳定斑块的表达较稳定型斑块的表达高。基因沉默寡核苷酸(gene silencing oligonucleotides,GSO)-494预处理可以降低小鼠颈动脉内miR-494的表达,GSO-494处理的小鼠颈动脉斑块比未处理小鼠的斑块小65%,且更加稳定(中心的坏死区小80%而外周由平滑肌细胞和胶原蛋白构成的纤维帽更厚),抑制miR-494还可以减低胆固醇及极低密度脂蛋白的含量。因此,抑制miR-494的表达可能减少颈动脉狭窄患者行颈动脉内膜剥脱术(carotid endarterectomy,CEA)手术的必要性,并降低手术并发症的风险[2]。另外,对一侧股动脉结扎的小鼠前1 d注射GSO-494,发现降低miR-494表达可以提高缺血肢体的血流量,增加缺血部位侧枝循环动脉的直径和新生毛细血管的密度。体外实验证实,下调miR-494的表达可使内皮细胞增殖,促进血管形成和动脉肌成纤维细胞的增殖[34]。在神经变性病中miR-494可以与靶基因DJ-1的3’UTR区结合,下调DJ-1的表达水平,在 1-甲基-4-苯基-1、2、3、6-四氢吡啶诱导的帕金森动物模型中,miR-494可以通过下调DJ-1的表达水平加重动物神经变性的程度,还能够加重氧化应激反应引起神经元死亡,进而加重神经变性疾病的症状[35]。
8 miR-494的其它作用
在一些非肿瘤疾病中发现miR-494同样起到重要作用。miR-494可以调节胰岛素的活性和敏感性。Lee等[36]研究发现在C2C12肌细胞中miR-494可下调GSK-3α/β、AS160、p70S6K及下游Akt的表达,抑制胰岛素的活性。miR-494可以通过上调或下调多个基因的表达来调控胰岛素敏感性,为了研究miR-494对胰岛素信号通路的影响,通过PCR技术分析了84个与胰岛素信号通路有关的调控基因,高表达的miR-494引起25%的基因上调,11%的基因下调。这说明miR-494的上调加重胰岛素抵抗,我们可以通过调控miR-494的表达治疗胰岛素抵抗。
研究还发现,miR-494可以通过下调mtTFA和Foxj3的表达抑制线粒体的生成[37]。在肌原细胞分化过程中,miR-494的表达量显著下调,伴随mtDNA表达的上调,以及mtTFA和Foxj3的表达上调。敲除miR-494引起线粒体数量的增加,以及mtTFA和Foxj3蛋白的增加[37]。miR-494参与雌激素介导的S蛋白1(protein S alpha,PROS1)的表达过程,miR-494可以直接作用于PROS1的3’UTR区调控其表达,雌激素处理的HuH-7的肝脏细胞引起miR-494表达的升高,进而下调PROS1的表达和S蛋白(protein S,PS)的表达水平[38]。miR-494也参与TNF-α引起的髓核细胞凋亡的过程,miR-494的表达与TNF-α表达呈正相关且具有浓度和时间依赖性,而敲除miR-494基因后可以降低髓核细胞的死亡率。进一步的机制研究发现miR-494可通过JunD激活线粒体凋亡信号通路而引起细胞凋亡;反之,敲除miR-494基因可上调JunD的表达而抑制细胞色素C的释放,从而保护髓核细胞[39]。在胚胎成纤维细胞中,miR-494表达上调时可以引起靶基因胰岛素样生长因子1的表达下降,进而引起相应蛋白的降低。同时miR-494升高可以导致细胞的活力降低[40]。
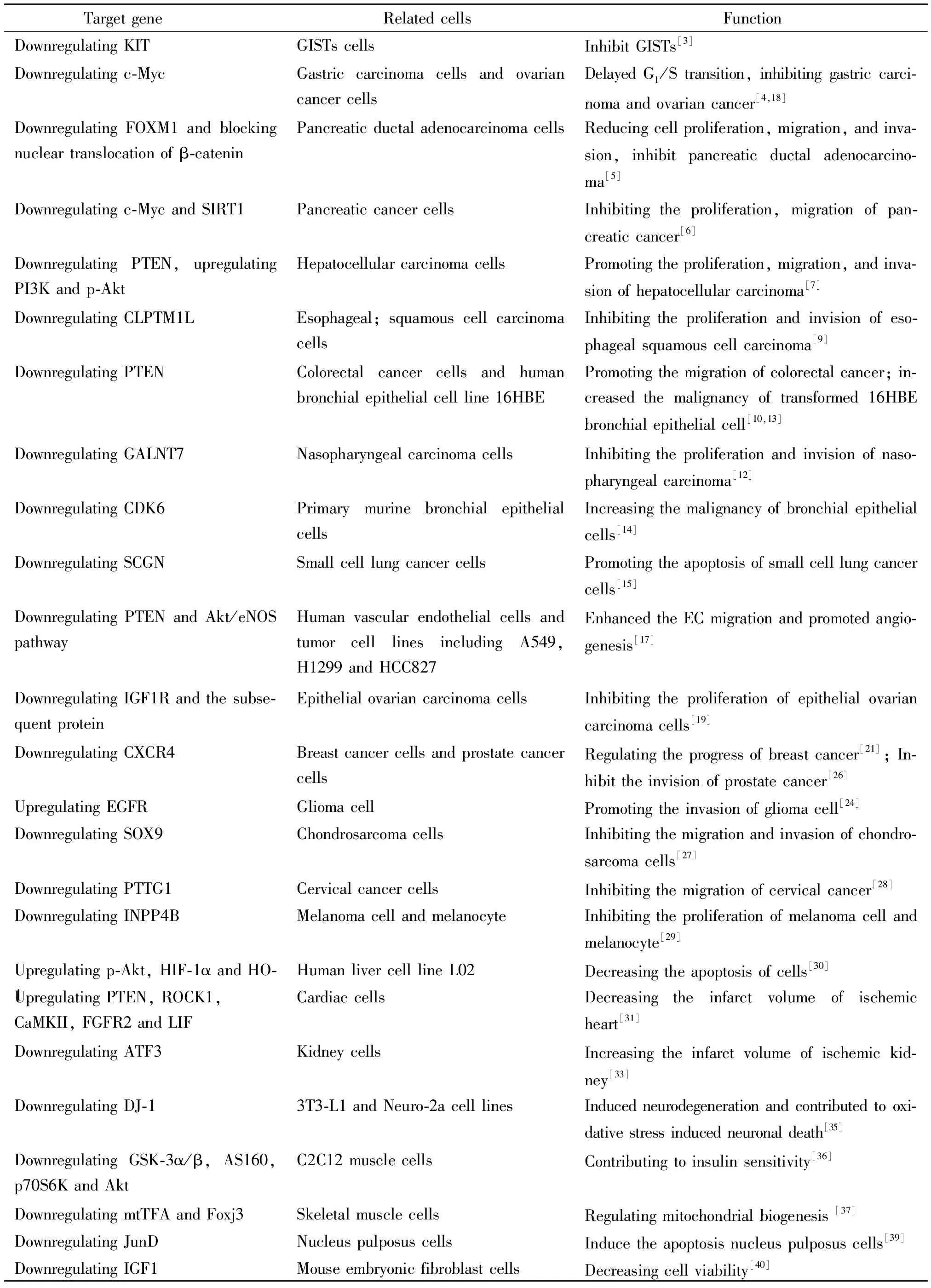
表1 MicroRNA-494的靶基因及其调节后对相关细胞功能的影响
9 结论和展望
研究表明miR-494在多种肿瘤及缺血缺氧性疾病的组织及细胞中均发生显著的改变,miR-494可能成为诊断某些疾病较为特异、敏感的生物标志物。对不同疾病及生理状态下miR-494的表达、靶向基因及下游分子表达变化,及miR-494受调控的机制等的研究发现其具有广泛的调节功能(总结见表1),为新的药物设计与针对性治疗提供了潜在靶点。目前对miR-494的研究主要集中于肿瘤方面的研究,对其它疾病的研究相对较少,且其作用机制也不是十分明确,在多种疾病(尤其肿瘤)发病过程中,局部组织中有特异性表达的miR-494是否会在血清或血浆中有所体现尚缺乏证据证实;不同miRNAs在机体中的调控是否会相互影响,这些都将是今后miRNAs 的进一步研究方向。
[1] Bartel DP. MicroRNAs: target recognition and regulatory functions[J]. Cell, 2009, 136(2):215-233.
[2] Wezel A, Welten SM, Razawy W, et al. Inhibition of microRNA-494 reduces carotid artery atherosclerotic lesion development and increases plaque stability[J]. Ann Surg, 2015, 262(5):841-847.
[3] Kim WK, Park M, Kim YK, et al. MicroRNA-494 downregulates KIT and inhibits gastrointestinal stromal tumor cell proliferation[J]. Clin Cancer Res, 2011, 17(24):7584-7594.
[4] He W, Li Y, Chen X, et al. miR-494 acts as an anti-oncogene in gastric carcinoma by targeting c-myc[J]. J Gastroenterol Hepatol, 2014, 29(7):1427-1434.
[5] Li L, Li Z, Kong X, et al. Down-regulation of microRNA-494 via loss of SMAD4 increases FOXM1 and beta-catenin signaling in pancreatic ductal adenocarcinoma cells[J]. Gastroenterology, 2014, 147(2):485-497.
[6] Liu Y, Li X, Zhu S, et al. Ectopic expression of miR-494 inhibited the proliferation, invasion and chemoresistance of pancreatic cancer by regulating SIRT1 and c-Myc[J]. Gene Ther, 2015, 22(9):729-738.
[7] Liu K, Liu S, Zhang W, et al. miR-494 promotes cell proliferation, migration and invasion, and increased so-rafenib resistance in hepatocellular carcinoma by targeting PTEN[J]. Oncol Rep, 2015, 34(2):1003-1010.
[8] Lim L, Balakrishnan A, Huskey N, et al. MicroRNA-494 within an oncogenic microRNA megacluster regulates G1/S transition in liver tumorigenesis through suppression of mutated in colorectal cancer[J]. Hepatology, 2014, 59(1):202-215.
[9] Zhang R, Chen X, Zhang S, et al. Upregulation of miR-494 inhibits cell growth and invasion and induces cell apoptosis by targeting cleft lip and palate transmembrane 1-like in esophageal squamous cell carcinoma[J]. Dig Dis Sci, 2015, 60(5):1247-1255.
[10]Sun HB, Chen X, Ji H, et al. miR494 is an independent prognostic factor and promotes cell migration and invasion in colorectal cancer by directly targeting PTEN[J]. Int J Oncol, 2014, 45(6):2486-2494.
[11]Yamanaka S, Campbell NR, An F, et al. Coordinated effects of microRNA-494 induce G2/M arrest in human cholangiocarcinoma[J]. Cell Cycle, 2012, 11(14):2729-2738.
[12]Nie GH, Luo L, Duan HF, et al. GALNT7, a target of miR-494, participates in the oncogenesis of nasopharyn-geal carcinoma[J]. Tumour Biol, 2016, 37(4):4559-4567.
[13]Liu L, Jiang Y, Zhang H, et al. Overexpressed miR-494 down-regulates PTEN gene expression in cells transformed by anti-benzo(a)pyrene-trans-7,8-dihydrodiol-9,10-epoxide[J]. Life Sci, 2010, 86(5-6):192-198.
[14]Duan H, Jiang Y, Zhang H, et al. MiR-320 and miR-494 affect cell cycles of primary murine bronchial epithe-lial cells exposed to benzo[a]pyrene[J]. Toxicol In Vitro, 2010, 24(3):928-935.
[15]Bai Y, Sun Y, Peng J, et al. Overexpression of secretagogin inhibits cell apoptosis and induces chemoresistance in small cell lung cancer under the regulation of miR-494[J]. Oncotarget, 2014, 5(17):7760-7775.
[16]Romano G, Acunzo M, Garofalo M, et al. MiR-494 is regulated by ERK1/2 and modulates TRAIL-induced apoptosis in non-small-cell lung cancer through BIM down-regulation[J]. Proc Natl Acad Sci U S A, 2012, 109(41):16570-16575.
[17]Mao G, Liu Y, Fang X, et al. Tumor-derived microRNA-494 promotes angiogenesis in non-small cell lung cancer[J]. Angiogenesis, 2015, 18(3):373-382.
[18]Yuan J, Wang K, Xi M. MiR-494 inhibits epithelial ovarian cancer growth by targeting c-Myc[J]. Med Sci Monit, 2016, 22:617-624.
[19]Li N, Zhao X, Wang L, et al. miR-494 suppresses tumor growth of epithelial ovarian carcinoma by targeting IGF1R[J]. Tumour Biol, 2016, 37(6):7767-7776.
[20]Liu Y, Lai L, Chen Q, et al. MicroRNA-494 is required for the accumulation and functions of tumor-expanded myeloid-derived suppressor cells via targeting of PTEN[J]. J Immunol, 2012, 188(11):5500-5510.
[21]Song L, Liu D, Wang B, et al. miR-494 suppresses the progression of breast cancerinvitroby targeting CXCR4 through the Wnt/beta-catenin signaling pathway[J]. Oncol Rep, 2015, 34(1):525-531.
[22]Ali HO, Arroyo AB, Gonzalez-Conejero R, et al. The role of microRNA -27a/b and microRNA-494 in oestrogen mediated downregulation of tissue factor pathway inhibitor alpha[J]. J Thromb Haemost, 2016, 14(6):1226-1237.
[23]Zhang L, Niu T, Huang Y, et al. Compound 331 selectively induces glioma cell death by upregulating miR-494 and downregulating CDC20[J]. Sci Rep, 2015, 5:12003.
[24]Kwak SY, Yang JS, Kim BY, et al. Ionizing radiation-inducible miR-494 promotes glioma cell invasion through EGFR stabilization by targeting p190B rhoGAP[J]. Biochim Biophys Acta, 2014, 1843(3):508-516.
[25]Asuthkar S, Velpula KK, Nalla AK, et al. Irradiation-induced angiogenesis is associated with an MMP-9-miR-494-syndecan-1 regulatory loop in medulloblastoma cells[J]. Oncogene, 2014, 33(15):1922-1933.
[26]Shen PF, Chen XQ, Liao YC, et al. MicroRNA-494-3p targets CXCR4 to suppress the proliferation, invasion, and migration of prostate cancer[J]. Prostate, 2014, 74(7):756-767.
[27]Li J, Wang L, Liu Z, et al. MicroRNA-494 inhibits cell proliferation and invasion of chondrosarcoma cellsinvivoandinvitroby directly targeting SOX9[J]. Oncotarget, 2015, 6(28):26216-26229.
[28]Chen B, Hou Z, Li C, et al. MiRNA-494 inhibits metastasis of cervical cancer through Pttg1[J]. Tumour Biol, 2015, 36(9):7143-7149.
[29]Chi MN, Guo ST, Wilmott JS, et al. INPP4B is upregulated and functions as an oncogenic driver through SGK3 in a subset of melanomas[J]. Oncotarget, 2015, 6(37):39891-39907.
[30]Sun G, Zhou Y, Li H, et al. Over-expression of micro-RNA-494 up-regulates hypoxia-inducible factor-1 alpha expression via PI3K/Akt pathway and protects against hypoxia-induced apoptosis[J]. J Biomed Sci, 2013, 20:100.
[31]Wang X, Zhang X, Ren XP, et al. MicroRNA-494 targeting both proapoptotic and antiapoptotic proteins protects against ischemia/reperfusion-induced cardiac injury[J]. Circulation, 2010, 122(13):1308-1318.
[32]Zhai F, Zhang X, Guan Y, et al. Expression profiles of microRNAs after focal cerebral ischemia/reperfusion injury in rats[J]. Neural Regen Res, 2012, 7(12):917-923.
[33]Lan YF, Chen HH, Lai PF, et al. MicroRNA-494 reduces ATF3 expression and promotes AKI[J]. J Am Soc Nephrol, 2012, 23(12):2012-2023.
[34]Welten SM, Bastiaansen AJ, de Jong RC, et al. Inhibition of 14q32 microRNAs miR-329, miR-487b, miR-494, and miR-495 increases neovascularization and blood flow recovery after ischemia[J]. Circ Res, 2014, 115(8):696-708.
[35]Xiong R, Wang Z, Zhao Z, et al. MicroRNA-494 reduces DJ-1 expression and exacerbates neurodegeneration[J]. Neurobiol Aging, 2014, 35(3):705-714.
[36]Lee H, Jee Y, Hong K, et al. MicroRNA-494, upregulated by tumor necrosis factor-alpha, desensitizes insulin effect in C2C12 muscle cells[J]. PLoS One, 2013, 8(12):e83471.
[37]Yamamoto H, Morino K, Nishio Y, et al. MicroRNA-494 regulates mitochondrial biogenesis in skeletal muscle through mitochondrial transcription factor A and Forkhead box j3[J]. Am J Physiol Endocrinol Metab, 2012, 303(12):E1419-E1427.
[38]Tay JW, Romeo G, Hughes QW, et al. Micro-ribonucleic acid 494 regulation of protein S expression[J]. J Thromb Haemost, 2013, 11(8):1547-1555.
[39]Wang T, Li P, Ma X, et al. MicroRNA-494 inhibition protects nucleus pulposus cells from TNF-alpha-induced apoptosis by targeting JunD[J]. Biochimie, 2015, 115:1-7.
[40]Lin CW, Jan MS, Kuo JH. Exploring microRNA expression profiles related to the mTOR signaling pathway in mouse embryonic fibroblast cells treated with polyethylenimine[J]. Mol Pharm, 2015, 12(8):2858-2868.
(责任编辑: 卢 萍, 罗 森)
Progress in functions of microRNA-494 and related mechanism
LI Guang-wen, ZHAO Hai-ping, LUO Yu-min
(CerebrovascularDiseasesResearchInstituteandDepartmentofNeurology,XuanWuHospitalofCapitalMedicalUniversity,
MicroRNA-494 (miR-494) is one of the microRNAs from 14q32.31 miR-gene cluster. Recently, miR-494 was found to closely relate with tumors and other diseases. This article reviews the expression changes, roles and possible regulatory mechanisms of miR-494 in multiple tumors and other hypoxia/ischemia diseases. Recent studies demonstrate that the expression of miR-494 is affected by many factors, and miR-494 could be a biomarker of diagnosis, staging and prognosis in tumors and other diseases, and a target of therapy in future.
MicroRNA-494; Tumor; Ischemia; Hypoxia
1000- 4718(2016)10- 1909- 07
2016- 06- 30
2016- 07- 22
国家自然科学基金资助项目(No. 81571280; No. 81271461)
△通讯作者 Tel: 010-83133862; E-mail: yumin111@ccmu.edu.cn
R363
A
10.3969/j.issn.1000- 4718.2016.10.029
杂志网址: http://www.cjpp.net

