依维莫司对大鼠实验性IgA肾病的作用
周 敏, 唐惠玲
(江苏食品药品职业技术学院药学院,江苏 淮安 223003)
依维莫司对大鼠实验性IgA肾病的作用
周 敏, 唐惠玲△
(江苏食品药品职业技术学院药学院,江苏 淮安 223003)
目的: 观察依维莫司对大鼠实验性IgA肾病的作用并初步探讨其机制。方法: 建立实验性IgA肾病大鼠模型,实验共分为正常对照(control)组、模型组(IgA组)和依维莫司给药组;测定给药后各组大鼠尿红细胞、尿蛋白和尿N-乙酰-β-D-氨基葡萄糖苷酶(NAG)的含量;免疫荧光染色检测肾组织中IgA沉淀情况;Western blot法检测髓样分化因子88(MyD88)、TLR4、NF-κB、IL-4和IL-13的蛋白表达水平;实时荧光定量PCR检测IL-4与IL-13的mRNA表达水平。结果: 依维莫司能够抑制实验性IgA肾病大鼠尿红细胞、尿蛋白和尿NAG含量的升高, 抑制MyD88、TLR4、NF-κB和IL-4和IL-13蛋白表达水平的上调,以及抑制IL-4和IL-13 mRNA表达水平的上调。结论: 依维莫司能降低IgA肾病大鼠尿红细胞、尿蛋白和尿NAG含量,其作用可能与其调节MyD88、TLR4、NF-κB、IL-4与IL-13的表达有关。
依维莫司; IgA肾病; 髓样分化因子88; NF-κB; TLR4; IL-4; IL-13
IgA肾病是临床上最常见的一种原发性肾小球肾炎,主要表现在肾小球系膜区有IgA或以IgA为主的免疫球蛋白颗粒样或团块状沉积引起的病理性变化,主要有无症状性血尿、肾病综合征、急性肾炎及肾功能不全等临床症状,以往认为IgA肾病的预后良好,但仍有约25%~30%的患者发展为终末期肾病[1]。目前,IgA肾病还缺乏特异性的治疗方法,主要根据患者不同的临床表现和病状采取不同的治疗措施。
依维莫司(everolimus,Eve)是一种口服哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抑制剂,是mTOR 的选择性抑制剂。肾移植后长期慢性损伤的发病率和死亡率较高,而依维莫司具有抗增殖和抗迁移能力,这使它应用于肾移植受者时,具有潜在的保护肾功能和抗恶性肿瘤作用[2]。Budde等[3]进行了一项多中心的随机对照试验,154 例患者于肾移植术后使用依维莫司,发现依维莫司比环孢素更有效改善患者的肾小球滤过率,证实依维莫司有改善肾功能的作用。但尚未有文献报道依维莫司用于IgA肾病的治疗,本实验通过建立IgA肾病大鼠模型,观察依维莫司对IgA肾病大鼠的尿液中红细胞、尿蛋白和尿N-乙酰-β-D-氨基葡萄糖苷酶(N-acetyl-β-D-glucosaminidase,NAG)的影响,并初步探讨相关机制。
材 料 和 方 法
1 实验动物和试剂
健康Sprague-Dawley(SD)大鼠36只,SPF级,体重(220±20) g,10周龄,雌雄各半,购自南京君科生物工程有限公司,室温22 ℃±2 ℃,昼夜12 h,定时定量饮水喂食。
依维莫司(瑞士诺华制药有限公司);牛血清蛋白、脂多糖、四氯化碳(Sigma);蓖麻油(上海化学试剂厂);荧光定量PCR试剂盒(大连宝生物公司);髓样分化因子88(myeloid differentiation factor 88,MyD88)、Toll样受体4(Toll-like receptor 4,TLR4)、核因子κB(nuclear factor-κB,NF-κB)、IL-4和IL-13抗体(Santa Cruz)。
2 实验方法
2.1 动物造模与分组 将SD大鼠进行为期7 d的常规饲养,实验共分为正常对照(control)组、IgA肾病模型组(IgA组)和Eve给药组,每组12只,按照汤颖等[4]的方法建立实验性IgA肾病大鼠模型,除正常对照组外,其它各组大鼠以10% BSA灌胃(400 kg·kg-1·d-1)共6周;于第6周和第8周末尾静脉注射0.05 mg脂多糖(每只1次);皮下注射蓖麻油0.5 mL与四氯化碳0.1 mL,每周1次共9周。于第9周末,心脏取血处死4只模型组大鼠,取肾脏组织做免疫荧光检查。正常对照组在相应时间给予等体积蒸馏水灌胃,生理盐水皮下注射和尾静脉注射。第10周开始,给药组大鼠灌胃依维莫司1.5 kg·kg-1·d-1,共30 d。
2.2 尿红细胞、尿蛋白和尿NAG含量水平的测定 给药结束后,将各组大鼠置于代谢笼中饲养,自由饮食,收集24 h尿液,送淮安市食品药品检验所检验科测量尿红细胞、尿蛋白和尿NAG的水平。2.3 免疫荧光染色 给药结束后处死大鼠,摘除肾脏,用组织包埋剂OCT包埋,放入-80 ℃冰箱中冷冻,切片,晾干,PBS缓冲液洗涤 5 min 3次,滴加FITC标记的IgA抗体(1∶50),放入37 ℃恒温箱中孵育30 min,PBS洗涤5 min 3次,滴入甘油进行封片,于荧光显微镜观察IgA的沉淀情况与绿色荧光的强度,-为无荧光;±为弱荧光;+荧光弱但清晰;++荧光明亮;+++强荧光。
2.4 Western blot法检测MyD88、TLR4、NF-κB、IL-4和IL-13蛋白的表达水平 采用蛋白裂解液裂解各组大鼠肾组织细胞,收集蛋白后定量,调整蛋白量。取适量裂解产物,上样后进行SDS-PAGE。完成电泳后,将蛋白转移至PVDF膜,加入5%脱脂奶粉的TBST溶液,室温封闭1 h,孵育相应 I 抗,4 ℃过夜,室温孵育相应 II 抗1 h, 化学发光法显色,成像扫描分析系统测定蛋白条带的积分吸光度。
2.5 实时荧光定量PCR(qPCR)检测IL-4与IL-13的mRNA表达水平 严格按照TRIzol说明书要求,提取大鼠肾脏组织细胞的总RNA,蛋白定量后逆转录合成cDNA,采用PCR仪进行扩增。IL-4的上游引物序列为5’-GCTGTCACCCTGTTCTG-3’,下游引物序列为5’-GAGCGTGGACTCATTCA-3’;IL-13的上游引物序列为5’-CTCGCTTGCCTTGGTG-3’,下游引物序列为5’-TGATGTTGCTCAGCTCCTC-3’;β-actin的上游引物序列为5’-GTGGGGCGCCCCAGGCACCA-3’,下游引物序列为5’-CTCCTTAATGTCACGCACGATTTC-3’。扩增条件为94 ℃ 30 s,60 ℃ 30 s,72 ℃ 40 s,共35个循环;72 ℃ 7 min。实验结果在荧光定量操作系统中进行分析对比,采用2-ΔΔCt对IL-4和IL-13 mRNA表达进行相对定量。
3 统计学处理
采用SPSS 13.0软件进行统计分析,结果以均值±标准差(mean±SD)表示,组间均数比较采用单因素方差分析(one-way ANOVA),各组均数间两两比较采用Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结 果
1 各组大鼠尿红细胞、尿蛋白与尿NAG含量水平的变化
模型组大鼠尿液中的红细胞、蛋白与NAG含量均显著高于正常对照组(P<0.05),给予依维莫司后,大鼠尿液中红细胞、蛋白与NAG含量显著低于模型组(P<0.05),但未到达正常水平,见表1。

表1 尿红细胞、尿蛋白与尿NAG含量的变化
*P<0.05vscontrol;#P<0.05vsIgA.
2 免疫荧光检测肾组织的IgA沉积
正常对照组中不出现绿色荧光的IgA沉积,强度为-;模型组可见团块状或弥漫性颗粒状沉淀,呈强绿色荧光,强度为+++,提示造模成功;给予依维莫司后,IgA沉淀绿色荧光显著减弱,强度为+,见图1。
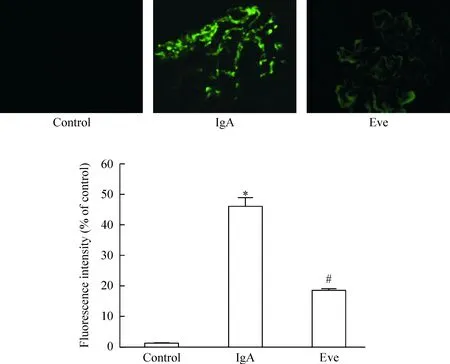
Figure 1.The level of IgA precipitation in each group. Mean±SD.n=6.*P<0.05vscontrol;#P<0.05vsIgA.
图1 各组大鼠肾组织IgA沉淀的免疫荧光结果
3 大鼠肾组织细胞中MyD88与TLR4蛋白表达的变化
模型组大鼠的肾组织细胞中MyD88和TLR4蛋白表达显著高于正常对照组(P<0.05);与模型组相比,给药组的MyD88和TLR4蛋白表达显著下降(P<0.05),但仍显著高于正常对照组(P<0.05),见图2。
4 大鼠肾组织细胞中NK-κB蛋白表达的变化
模型组大鼠的肾组织细胞中NK-κB蛋白表达显著高于正常对照组(P<0.05);与模型组相比,给药组的NK-κB蛋白表达显著下降(P<0.05),但仍显著高于正常对照组(P<0.05),见图3。
5 大鼠肾组织细胞中IL-4与IL-13 蛋白表达的变化
模型组大鼠的肾组织细胞中IL-4与IL-13 蛋白表达显著高于正常对照组(P<0.05);与模型组相比,给药组的IL-4与IL-13蛋白表达显著下降(P<0.05),但仍显著高于正常对照组(P<0.05),见图4。
6 大鼠肾组织细胞中IL-4与IL-13 mRNA表达的变化
模型组大鼠的肾组织细胞中IL-4与IL-13的mRNA表达显著高于正常对照组(P<0.05);与模型组相比,给药组IL-4与IL-13的mRNA表达显著下降(P<0.05),但仍显著高于正常对照组(P<0.05),见图5。
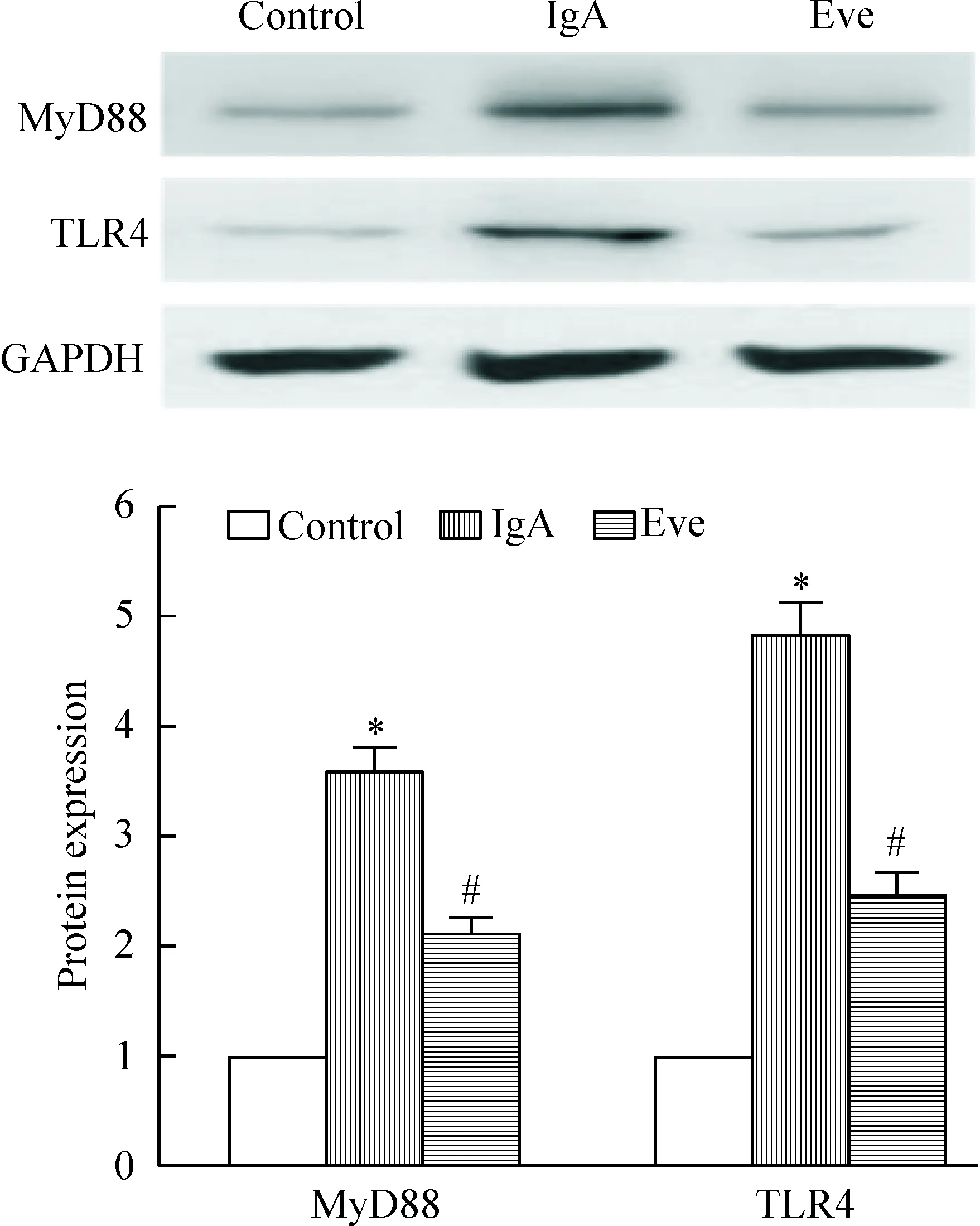
Figure 2.The protein expression of MyD88 and TLR4. Mean±SD.n=6.*P<0.05vscontrol;#P<0.05vsIgA.
图2 MyD88与TLR4蛋白表达的变化
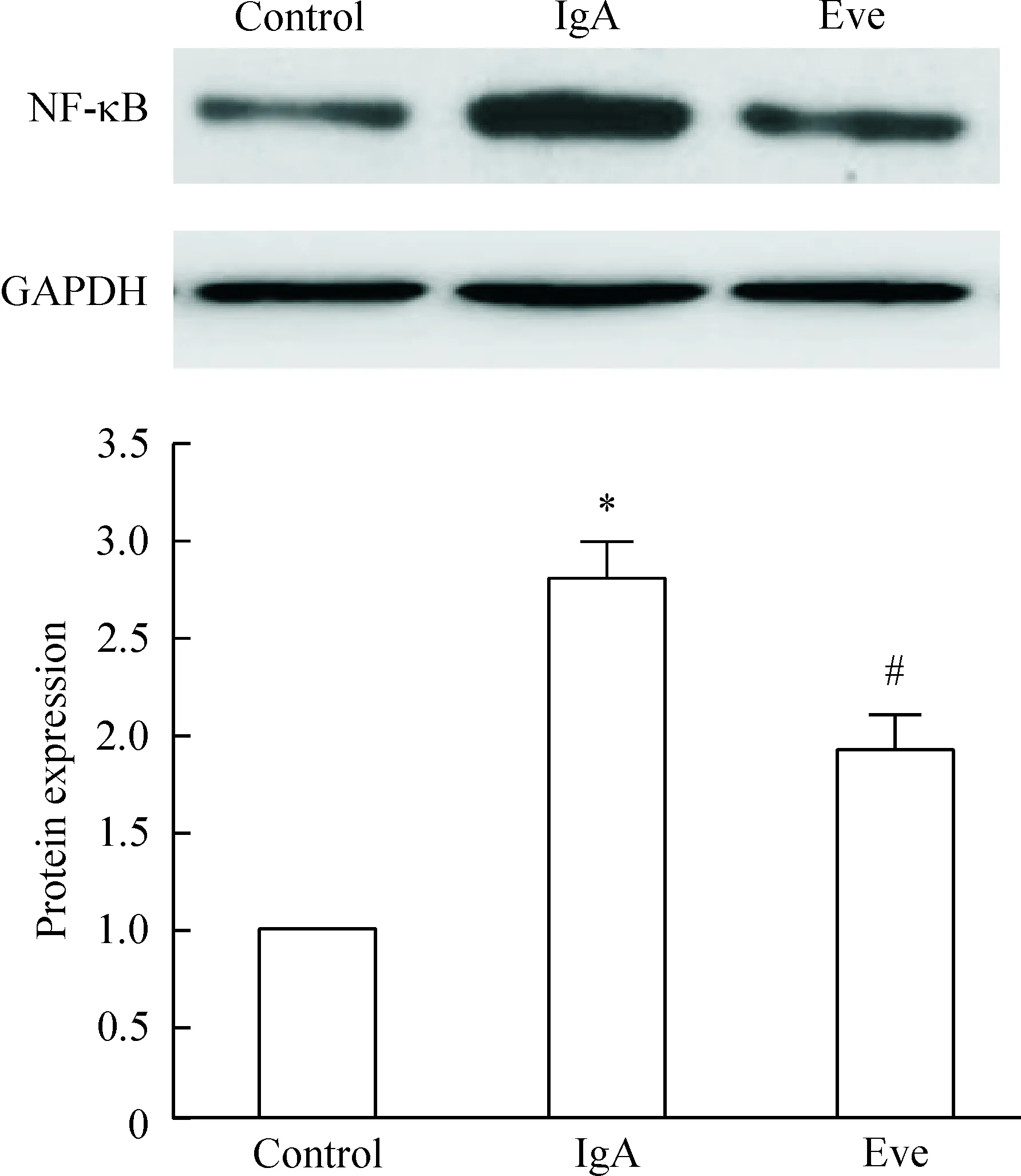
Figure 3.The protein expression of NK-κB. Mean±SD.n=6.*P<0.05vscontrol;#P<0.05vsIgA.
图3 NK-κB蛋白表达的变化
讨 论
本实验通过建立IgA肾病大鼠模型,免疫荧光结果显示造模组大鼠肾小球系膜区出现团块状或弥漫性颗粒状沉淀,呈强绿色荧光,符合IgA肾病的病理变化,提示IgA肾病大鼠模造模成功。血尿是IgA
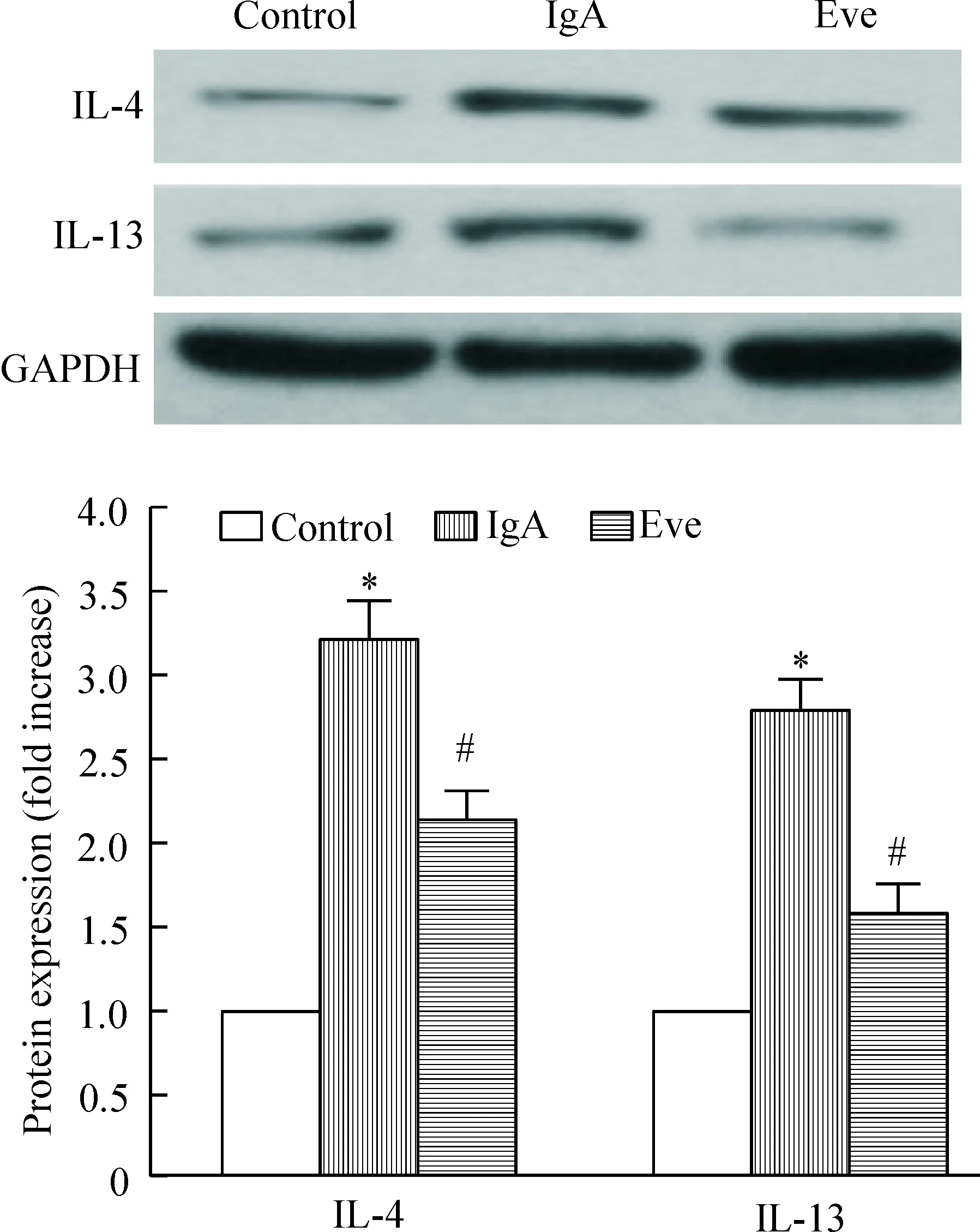
Figure 4. The protein expression of IL-4 and IL-13. Mean±SD.n=6.*P<0.05vscontrol;#P<0.05vsIgA.
图4 IL-4与IL-13 蛋白表达的变化
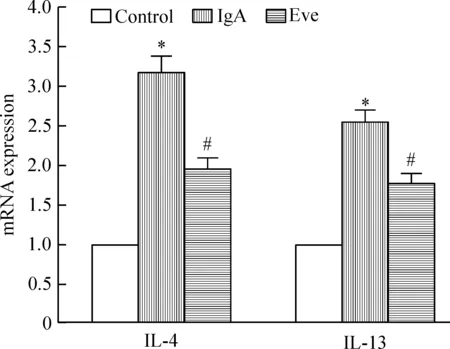
Figure 5.The mRNA expression of IL-4 and IL-13. Mean±SD.n=6.*P<0.05vscontrol;#P<0.05vsIgA.
图5 IL-4与IL-13的mRNA表达的变化
肾病最常见的临床症状,常为首发症状,为系膜区出现基质和细胞增生。蛋白尿是引起肾小管间质损害的因素之一,使肾小管细胞缺氧导致肾小管上皮细胞萎缩[5]。本实验结果显示依维莫司具有抑制IgA肾病大鼠的尿红细胞、尿蛋白和尿NAG水平异常升高的作用,提示依维莫司可能具有减少IgA肾病对肾小管间质损害的作用。
TLR4是TLR家族的重要成员之一,在天然免疫反应中发挥不可或缺的作用,研究发现TLR4的表达在纤维化过程和炎症反应中具有重要作用。Asea等[6]研究发现肾小管上皮细胞通过TLR4信号途径完成热休克蛋白识别结合配体。近来研究表明TLR4在IgA肾病患者中外周单核细胞的表达增加,并推测TLR的激活可能影响IgM转化为IgA,从而参与IgA肾病的发展[7]。MyD88是Toll样受体信号通路中的一个关键因子,在传递上游信息和疾病发生发展中具有重要作用。本实验中依维莫司干预后能够抑制IgA肾病大鼠肾组织中TLR4蛋白表达的升高,提示MyD88与TLR4可能是依维莫司作用于IgA肾病的一个靶点。
NF-κB几乎存在于所有细胞,主要参与免疫反应、细胞内信号传导并参与调控多种基因的表达,如IL-2、IL-8、MCP-1等具有调控肾脏多种疾病发生发展的作用[8-9]。NF-κB的亚基p65在蛋白C末端含有转录激活区域,研究指出此区域在IgA肾病慢性炎症中起重要作用[10]。NF-κB通过调控细胞因子的转录,使得单核巨噬细胞浸润以及肾小管上皮细胞分化,从而参与肾小管间质损害的过程。本试验发现IgA肾病大鼠肾组织细胞中NF-κB的蛋白表达显著高于正常大鼠,依维莫司干预后NF-κB的蛋白表达显著下降,提示依维莫司能够很好地抑制IgA肾病肾组织中NF-κB的活化,减少其在肾组织细胞中的表达,同时说明NF-κB的活化可作为评价治疗IgA肾病的靶点之一。
IL-4与IL-13由活化Th2细胞产生,可促进抗体的生成,介导体液免疫应答。研究表明IL-4与IL-13对肾小管上皮细胞的形态和功能具有调节作用,并对肾小管上皮细胞造成损伤[11]。报道指出IL-13对足细胞有直接损伤作用,造成功能异常,进而导致肾小球滤过屏障损伤[12]。依维莫司通过抑制IgA肾病大鼠肾组织中IL-4与IL-13的表达,从而对肾脏产生保护作用。
综上所述,本研究发现依维莫司对大鼠IgA肾病具有一定的疗效,并为以后用于临床治疗IgA肾病提供了实验基础。
[1] Barratt J, Feehally J. IgA nephropathy[J]. J Am Soc Nephrol, 2005, 16(7):2088-2097.
[2] Lieberthal W, Levine JS. The role of the mammalian target of rapamycin (mTOR) in renal disease[J]. J Am Soc Nephrol, 2009, 20(12):2493-2502.
[3] Budde K, Becker T, Arns W, et al. Everolimus-based, calcineurin-inhibitor-free regimen in recipients of de-novo kidney transplants: an open-label, randomized, controlled trial[J]. Lancet, 2011, 377( 9768):837-847.
[4] 汤 颖,娄探奇,成彩联,等. 实验性 IgA 肾病模型的改进[J]. 中山大学学报:医学科学版, 2006, 27(2):184-187.
[5] Paolo C, Giuseppe R. Pathophysiology of proteinuria and its value as an outcome measure in chronic kidney disease[J]. Br J Clin Pharmacol, 2013, 76(4):516-523.
[6] Asea A, Rehli M, Kabingu E, et al. Novel signal transduction path way utilized by extracellular HSP 70: role of Toll-like receptor (TLR)2 and TLR4[J]. J Biol Chem, 2002, 277(17):15028-15034.
[7] Coppo R, Camilla R, Amore A, et al. Toll-like receptor 4 expression is increased in circulating mononuclear cells of patients with immunoglobulin a nephropathy[J]. Clin Exp Immunol, 2010, 159(1):73-81.
[8] Kim J, Cha YN,Surh YJ. A protective role of nuclear factor-erythroid 2-related factor-2 (Nrf2) in inflammatory disorders[J]. Mutat Res, 2010, 690(1-2):12-23.
[9] Antunes F, Han D. Redox regulation of NF-κB: from ba-sic to clinical research[J]. Antioxid Redox Signal,2009, 11(9):2055-2056.
[10]Rangan G, Wang Y, Harris D. NF-kappaB signaling in chronic kidney disease[J]. Front Biosci (Landmark Ed), 2009, 14:3496-3522.
[11]芦怡舟,刘志红,陈朝红,等. 肾小管上皮细胞白细胞介素13和白细胞介素4受体的表达及其在肾小管损伤中的作用[J]. 肾脏病与透析肾移植杂志,2009, 18(1):27-34.
[12]亦 眉,刘志红,陈朝红,等. 白细胞介素13诱导足细胞损伤及其作用机制[J]. 肾脏病与透析肾移植杂志,2009, 18(2):140-147.
(责任编辑: 林白霜, 罗 森)
Everolimus prevents experimental IgA nephropathy in rats
ZHOU Min, TANG Hui-ling
(PharmaceuticalCollege,JiangsuFood&PharmaceuticalScienceCollege,Huai’an223003,China.E-mail:tanghuiling1985@126.com)
AIM: To investigate the effects of everolimus on the experimental IgA nephropathy in rats and its possible mechanisms. METHODS: The rat model of experimental IgA nephropathy was established. The rats were randomly divided into control group, IgA group and everolimus treatment group. After the corresponding treatments were gi-ven, urinary red blood cells, protein andN-acetyl-β-D-glucosaminidase (NAG) were examined. Immunofluorescence staining was used to analyze the level of IgA precipitation in the renal tissues. Additionally, the protein expression of myeloid differentiation factor 88 (MyD88), TLR4, NF-κB, IL-4 and IL-13 was determined by Western blot. The mRNA levels of IL-4 and IL-13 were detected by qPCR. RESULTS: Everolimus significantly inhibited the increases in the urinary levels of red blood cells, protein and NAG in experimental IgA nephropathy rats. Furthermore, IgA nephropathy-induced increases in the protein expression of MyD88, TLR4, NF-κB, IL-4 and IL-13 were attenuated after everolimus treatment. Similar results were obtained in the mRNA levels of IL-4 and IL-13 by qPCR detection.CONCLUSION: Everolimus improves the impairments of renal function in experimental IgA nephropathy rats as evidenced by decreasing urinary red blood cells, protein and NAG, which may be related to the inhibition of MyD88, TLR4, NF-κB, IL-4 and IL-13 expression.
Everolimus; IgA nephropathy; Myeloid differentiation factor 88; NF-κB; TLR4; IL-4; IL-13
1000- 4718(2016)10- 1887- 05
2016- 04- 19
2016- 06- 01
△通讯作者 Tel: 0517-87088188; E-mail: tanghuiling1985@126.com
R363
A
10.3969/j.issn.1000- 4718.2016.10.024
杂志网址: http://www.cjpp.net

