血管紧张素-(1-7)通过抑制TLR4激活和坏死性凋亡的相互作用对抗高糖引起的H9c2心肌细胞损伤*
梁伟杰, 陈美姬, 何洁仪, 李健豪, 陈 君, 余盛龙, 程 飞, 兰 军△
(1广州市番禺区中心医院心血管内科, 2广州市番禺区心血管疾病研究所,广东 广州 511400; 3中山大学附属第一医院黄埔院区儿科,广东 广州 510700; 4东莞市第三人民医院心血管内科, 5东莞市心血管疾病研究所,广东 东莞 523326)
血管紧张素-(1-7)通过抑制TLR4激活和坏死性凋亡的相互作用对抗高糖引起的H9c2心肌细胞损伤*
梁伟杰1, 2, 陈美姬3, 何洁仪1, 2, 李健豪1, 2, 陈 君1, 2, 余盛龙1, 2, 程 飞4, 5, 兰 军4, 5△
(1广州市番禺区中心医院心血管内科,2广州市番禺区心血管疾病研究所,广东 广州 511400;3中山大学附属第一医院黄埔院区儿科,广东 广州 510700;4东莞市第三人民医院心血管内科,5东莞市心血管疾病研究所,广东 东莞 523326)
目的: 研究血管紧张素-(1-7)[Ang-(1-7)]能否通过抑制Toll样受体4(TLR4)激活和坏死性凋亡的相互作用对抗高糖(HG)引起的H9c2心肌细胞损伤。方法: 应用Western blot检测心肌细胞受体相互作用蛋白3(RIP3; 反映坏死性凋亡的指标)和TLR4 的表达水平;CCK-8法测定心肌细胞存活率;用试剂盒检测细胞培养液中乳酸脱氢酶(LDH)的活性;ELISA检测细胞培养液中白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)的分泌水平;双氯荧光素染色法测定细胞内活性氧簇(ROS)水平;罗丹明123 染色法测定线粒体膜电位(MMP)。结果: HG(35 mmol/L葡萄糖)作用H9c2心肌细胞24 h可使RIP3的表达水平明显升高,应用30 μmol/L TAK-242(TLR4抑制剂)和HG共处理心肌细胞24 h可抑制HG对RIP3的上调;另一方面,HG可上调TLR4的表达,100 μmol/L坏死性凋亡的特异性抑制剂necrostatin-1(Nec-1)和HG共处理心肌细胞24 h可抑制HG对TLR4的上调;而1 μmol/L Ang-(1-7)和HG共处理心肌细胞24 h能同时抑制HG对RIP3 和TLR4 的上调。此外,1 μmol/L Ang-(1-7)、30 μmol/L TAK-242 或100 μmol/L Nec-1与HG 共处理心肌细胞均能对抗HG引起的心肌细胞损伤,细胞存活率升高,LDH活性降低,ROS生成和MMP丢失减少,同时IL-1β和TNF-α的分泌减少。结论: Ang-(1-7)通过抑制TLR4激活和坏死性凋亡的相互作用对抗高糖引起的H9c2心肌细胞损伤。
血管紧张素-(1-7); Toll样受体4; 坏死性凋亡; 高糖; 心肌细胞
高血糖是糖尿病的一个重要始动因素,可导致糖尿病心血管并发症如冠心病、糖尿病心肌病(diabetic cardiomyopathy,DCM)等的发生[1],也是导致心肌细胞死亡的一个直接原因[2]。坏死性凋亡也称为程序性坏死,是Degterev等[3]于2005年首次报道的一种细胞死亡方式,广泛参与心血管、神经、消化等多个系统疾病的发生。坏死性凋亡有独特的信号通路,通常由死亡诱导因子如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等诱导发生[3]。Toll样受体(Toll-like receptors,TLRs)是一种跨膜信号转导受体,参与炎症反应和特异性免疫应答[4]。近年来有报道指出,TLRs如TLR3、TLR4 也可介导坏死性凋亡发生[5-6]。最近,我们实验证实,高糖可引起心肌细胞坏死性凋亡的发生[7],但是,在高糖损伤H9c2 心肌细胞模型中,坏死性凋亡的发生能否由TLR4 介导,其两者之间的关系及其在高糖引起心肌细胞损伤和炎症中的作用如何,目前仍缺乏深入的研究。
另一方面,血管紧张素-(1-7) [angiotensin-(1-7),Ang-(1-7)]是一种内源性多肽激素,可由心肌细胞产生[8]。Ang-(1-7)是肾素-血管紧张素系统中的一个重要的信号分子,已被证实具有舒张血管、降血压及保护血管内皮等心血管保护作用[9]。最近,我们证实,Ang-(1-7)可保护心肌细胞对抗高糖引起的H9c2 心肌细胞损伤[10]。然而,Ang-(1-7)能否抑制坏死性凋亡和TLR4 的活化从而实现心肌保护作用,目前国内外仍未见报道。
为此,本研究在高糖损伤H9c2心肌细胞模型[11]中探讨如下几点:(1) TLR4激活和坏死性凋亡之间是否存在相互作用;(2) TLR4激活和坏死性凋亡之间的相互作用与高糖诱导的心肌细胞损伤和炎症的关系;(3) Ang-(1-7)能否通过抑制TLR4和坏死性凋亡的相互作用对抗高糖诱导的心肌细胞损伤和炎症。
材 料 和 方 法
1 材料
受体相互作用蛋白3 (receptor-interacting protein 3,RIP3; 反映坏死性凋亡的指示)抗体购自CST;TLR4 抗体购自Abcam;坏死性凋亡抑制剂necrostatin-1(Nec-1)、罗丹明123(rhodamine 123, Rh123)、Ang-(1-7)、双氯荧光素(2’, 7’-dichlorfluorescein diacetate,DCFH-DA)和乳酸脱氢酶(lactate dehydroge-nase,LDH)检测试剂盒购自Sigma;TAK-242(TLR4 抑制剂)购自Invivogen;CCK-8购自Dojindo;特级胎牛血清(fetal bovine serum,FBS)购自Gibco;DMEM培养基(其葡萄糖浓度为5.5 mmol/L)由HyClone供应;IL-1β和TNF-α ELISA试剂盒由武汉华美生物工程有限公司提供。H9c2 心肌细胞来源于胚胎期大鼠心脏组织的亚克隆细胞系,由中山大学实验动物中心细胞库供应。
2 方法
2.1 细胞培养 H9c2心肌细胞置于含10% FBS的DMEM培养基中,于5% CO2、37 ℃的条件下传代培养,待细胞生长至约80%的融合状态可用于实验。
2.2 实验分组 实验分为8组:对照(control)组:DMEM培养基作用心肌细胞24 h;高糖(high glucose,HG)组:35 mmol/L葡萄糖处理心肌细胞24 h;Ang-(1-7)+HG组:1 μmol/L Ang-(1-7)与35 mmol/L葡萄糖共处理心肌细胞24 h;TAK-242+HG组:30 μmol/L TAK-242 与35 mmol/L葡萄糖共处理心肌细胞24 h;Nec-1+HG组:100 μmol/L Nec-1 与35 mmol/L葡萄糖共处理心肌细胞24 h;Ang-(1-7)组:1 μmol/L Ang-(1-7)与DMEM培养基共处理心肌细胞24 h;TAK-242 组:30 μmol/L TAK-242 与DMEM培养基共处理心肌细胞24 h;Nec-1组:100 μmol/L Nec-1 与DMEM培养基共处理心肌细胞24 h。
2.3 Western blot 检测RIP3 和TLR4 的表达 在60 mm培养皿中种植H9c2 心肌细胞,待细胞生长至约80%融合度时,根据分组给予相应处理后,加入细胞裂解液,4 ℃摇床上处理30 min,14 000×g高速离心10 min,BCA法测定蛋白质含量。等量的蛋白经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,转移至PVDF膜上,5%脱脂奶粉封闭1 h,加入 I 抗,即兔抗鼠RIP3、TLR4 或GAPDH抗体(浓度均为1∶1 000),4 ℃过夜后加入浓度为1∶2 500的 II 抗,室温下孵育1.5 h。ECL法使PVDF膜显色,暗室中曝光到X线片上,凝胶成像扫描系统分析结果。实验重复5次。
2.4 CCK-8法测定心肌细胞存活率 于96孔培养板中种植H9c2 心肌细胞,待细胞融合度达到大约80%时,按照设定的分组分别处理后,弃去上清液,用PBS冲洗3次,于每孔中加入DMEM 90 μL和CCK-8 溶液10 μL,将培养板放置于培养箱内孵育2.5 h,在酶标仪上读取450 nm处的吸光度(A)值。细胞存活率按照以下公式计算:细胞存活率(%)=处理组A/对照组A×100%。实验重复5次。
2.5 试剂盒检测细胞培养液中LDH活性 于96孔板中种植H9c2心肌细胞,待细胞融合度达到约80%时,按照设定的分组分别处理后,严格按照LDH试剂盒说明书步骤,检测并计算出培养液中LDH的活性。实验重复5次。
2.6 ELISA检测细胞培养液中IL-1β和TNF-α的水平 于96孔板中种植H9c2心肌细胞,待细胞融合度达到大约80%时,按照分组给予不同处理后,收集培养基作待测标本。ELISA操作流程根据试剂盒说明书进行,在终止显色反应后,用酶标仪(λ=450 nm)测定各孔吸光度(A)值。取5孔A值的平均数,根据公式(处理组A/对照组A×100%)计算IL-1β和TNF-α的诱导释放率。实验重复5次。
2.7 DCFH-DA染色荧光显微镜照相法测定胞内活性氧簇(reactive oxygen species,ROS)水平 用24孔板培养H9c2心肌细胞,待细胞融合度达到约80%时,按照分组给予相应处理后,加入DCFH-DA染液,细胞培养箱中孵育30 min,荧光显微镜下随机照片记录5个高倍镜视野,应用ImageJ 1.47i软件计算出绿色荧光的平均荧光强度(mean fluorescence intensity,MFI),再对每组数据进行统计分析。实验重复5次。
2.8 Rh123 染色荧光显微镜照相法检测线粒体膜电位(mitochondrial membrane potential,MMP) 用24孔板培养H9c2心肌细胞,当细胞融合度为80%左右时,按照分组给予相应的处理后,加入Rh123缓冲液,细胞培养箱中孵育45 min,荧光显微镜下随机照片记录5个高倍镜视野,应用图像分析软件计算出绿色荧光的MFI,再对每组数据进行统计分析。实验重复5次。
3 统计学处理
应用SPSS 17.0软件进行统计数据处理和分析,
计量资料采用均数±标准误(mean±SEM)表示,单因素方差分析(one-way ANOVA)用于多个样本均数间的比较,SNK-q检验用于多个样本均数间的两两比较,以P<0.05为差异有统计学意义。
结 果
1 TAK-242 抑制HG诱导的心肌细胞RIP3 表达增加
高糖作用H9c2 心肌细胞24 h可使RIP3 表达水平明显升高;30 μmol/L TAK-242和HG共处理心肌细胞24 h可减少RIP3 的表达,与HG组比较,差异具有统计学显著性(P<0.01)。TAK-242 本身对心肌细胞RIP3 的基础表达无明显影响,见图1。
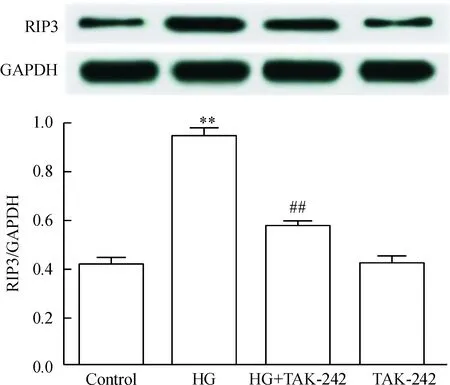
Figure 1.TAK-242 (an inhibitor of TLR4) attenuated high glucose (HG)-induced up-regulation of RIP3 expression in H9c2 cardiac cells. Mean±SEM.n=5.**P<0.01vscontrol group;##P<0.01vsHG group.
图1 TAK-242减弱HG对心肌细胞RIP3表达的上调作用
2 Nec-1 抑制HG诱导的TLR4 表达增加
图2显示,HG作用心肌细胞24 h可使TLR4 表达明显增加;应用100 μmol/L Nec-1和HG共处理心肌细胞24 h,TLR4 表达水平有所下降,与HG组比较,差异具有统计学显著性(P<0.01)。Nec-1 本身对心肌细胞TLR4 基础表达无明显的影响。
3 Ang-(1-7)抑制HG对RIP3 和TLR4 表达的上调 如前所述,HG处理心肌细胞24 h可明显促进RIP3和TLR4 表达,应用1 μmol/L Ang-(1-7)和HG共处理心肌细胞24 h,RIP3 和TLR4 的表达均明显减少,分别与HG组比较,差异均有统计学显著性(P<0.01)。单纯应用100 μmol/L Ang-(1-7)处理心肌细胞对RIP3 和TLR4 的基础表达无明显影响,见图3。
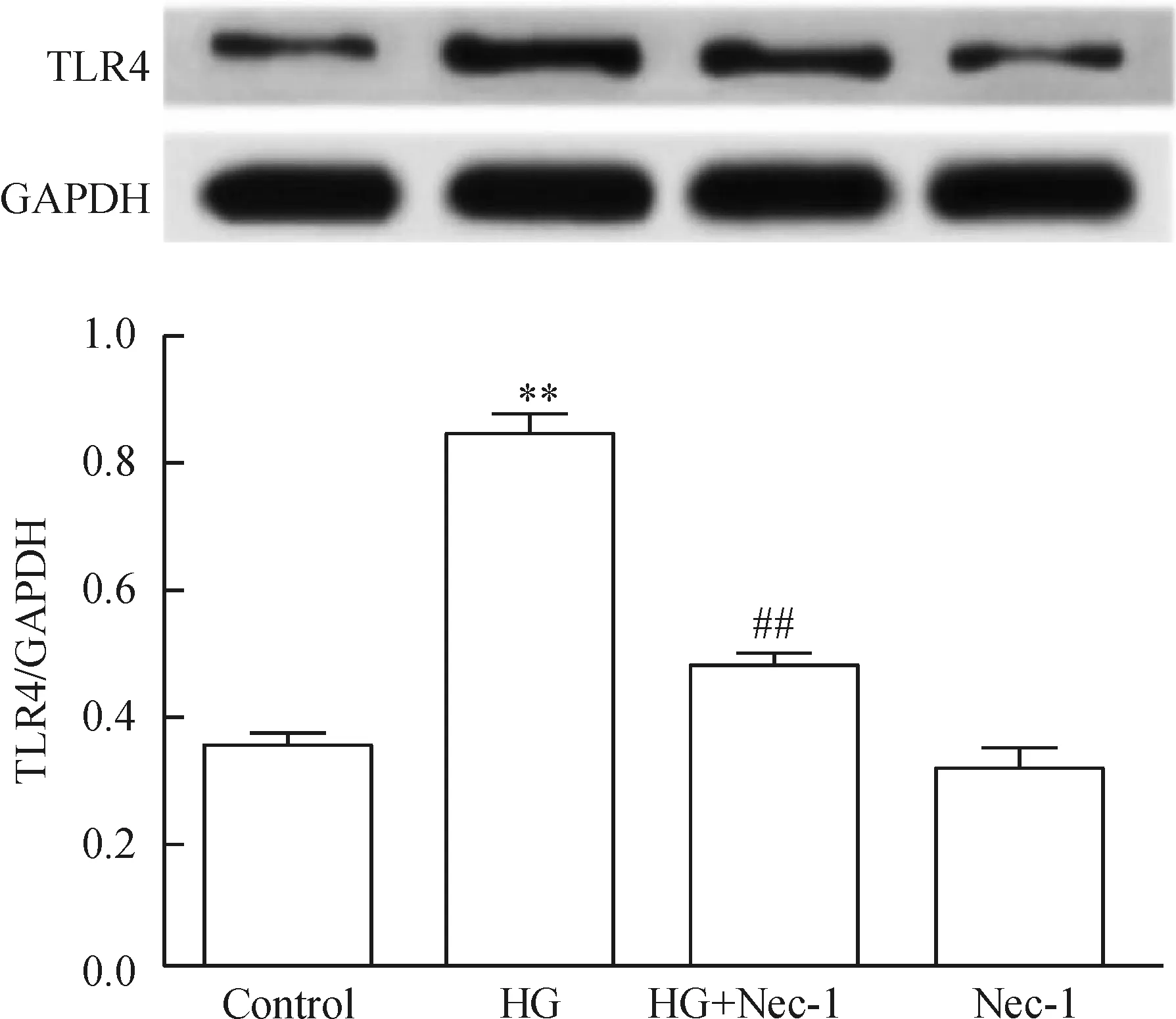
Figure 2.Nec-1 (a specific inhibitor of necroptosis) attenuated high glucose (HG)-induced up-regulation of TLR4 expression in H9c2 cardiac cells. Mean±SEM.n=5.**P<0.01vscontrol group;##P<0.01vsHG group.
图2 Nec-1减弱HG对心肌细胞TLR4 表达的上调作用
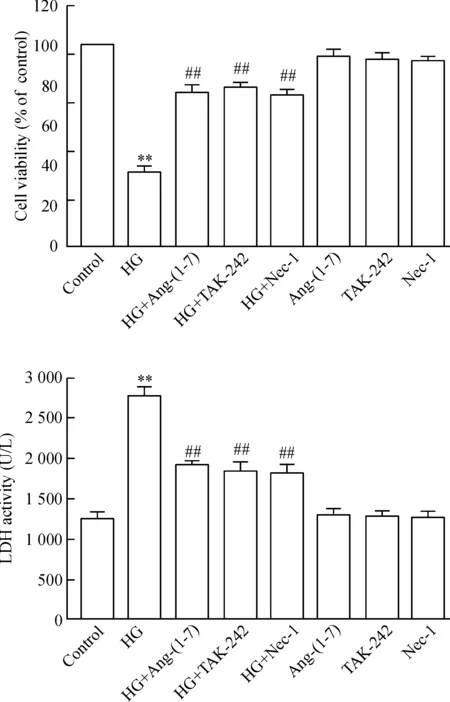
Figure 3.Ang-(1-7) attenuated high glucose (HG)-induced up-regulation of TLR4 and RIP3 expression in H9c2 cardiac cells. Mean±SEM.n=5.**P<0.01vscontrol group;##P<0.01vsHG group.
图3 Ang-(1-7)抑制HG对心肌细胞TLR4 和RIP3 表达的上调作用
4 Ang-(1-7)、TAK-242 和Nec-1 抑制HG引起的心肌细胞毒性
HG作用心肌细胞24 h可诱导明显的心肌细胞毒性,使心肌细胞存活率下降,培养液中的LDH活性增加。应用1 μmol/L Ang-(1-7)和HG共处理心肌细胞24 h,细胞存活率有明显的上升,LDH活性明显降低,与HG组分别比较,差异均有统计学显著性(P<0.01)。与Ang-(1-7)作用类似,30 μmol/L TAK-242 或100 μmol/L Nec-1 和HG共处理心肌细胞24 h也能提高细胞存活率,降低LDH活性,分别与HG组比较,差异均有统计学显著性(P<0.01)。Ang-(1-7)、TAK-242 和Nec-1本身没有产生明显的细胞毒性,见图4。

Figure 4.Ang-(1-7), TAK-242 (an inhibitor of TLR4) and Nec-1 (a specific inhibitor of necroptosis) attenuated HG-induced decrease in cell viability and increase in the activity of lactate dehydrogenase (LDH) in the culture medium. Mean±SEM.n=5.**P<0.01vscontrol group;##P<0.01vsHG group.
图4 Ang-(1-7)、TAK-242 和Nec-1 抑制HG引起的细胞存活率降低和细胞培养液中LDH活性增加
5 Ang-(1-7)、TAK-242 和Nec-1 抑制HG引起的心肌细胞内ROS堆积
H9c2心肌细胞经HG作用24 h,胞内DCFH-DA的MFI明显增强,与control组相比,差异有统计学显著性(P<0.01)。然而,在HG作用前,应用1 μmol/L Ang-(1-7)和HG共处理心肌细胞24 h,可使MFI明显降低,与HG组比较,差异具有统计学显著性(P<0.01)。与Ang-(1-7)作用类似,30 μmol/L TAK-242或100 μmol/L Nec-1和HG共处理心肌细胞24 h也能使DCFH-DA的MFI明显降低,分别与HG组比较,差异均有统计学显著性(P<0.01)。1 μmol/L Ang-(1-7)、30 μmol/L TAK-242 或100 μmol/L Nec-1 本身对心肌细胞ROS的生成无明显的影响,见图5。
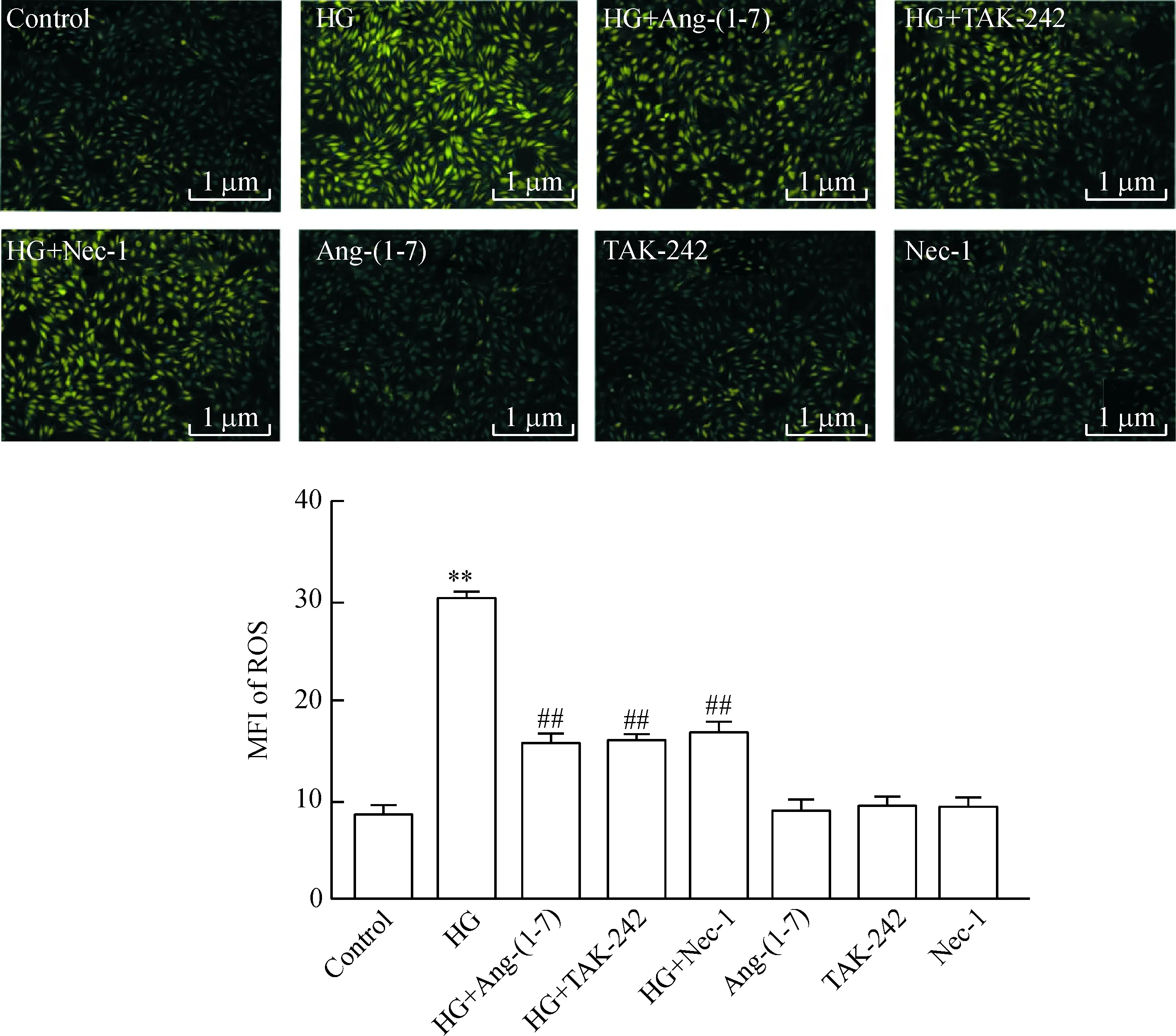
Figure 5.Ang-(1-7), TAK-242 (an inhibitor of TLR4) and Nec-1 (a specific inhibitor of necroptosis) attenuated HG-induced increase in intracellular ROS generation in H9c2 cardiac cells. Mean±SEM.n=5.**P<0.01vscontrol group;##P<0.01vsHG group.
图5 Ang-(1-7)、TAK-242 和Nec-1 抑制HG引起的心肌细胞内ROS堆积
6 Ang-(1-7)、TAK-242 和Nec-1 抑制HG引起的心肌细胞MMP丢失
HG可使心肌细胞内Rh123 的MFI从(28.50±1.36)%降低至(7.70±0.90)%(P<0.01)。采用1 μmol/L Ang-(1-7)和HG共处理心肌细胞24 h,可使MFI升高至(18.70±1.24)%,与HG组比较,差异有统计学显著性(P<0.01)。与Ang-(1-7)作用类似,30 μmol/L TAK-242或100 μmol/L Nec-1和HG共处理心肌细胞24 h也能使MFI明显升高,分别与HG比较,差异均有统计学显著性(P<0.01)。1 μmol/L Ang-(1-7)、30 μmol/L TAK-242 或100 μmol/L Nec-1 本身对心肌细胞MMP无明显的影响,见图6。
7 Ang-(1-7)、TAK-242 和Nec-1 抑制HG引起的炎症细胞因子分泌
如图7所示,HG作用心肌细胞24 h可使炎症细胞因子IL-1β和TNF-α的分泌水平明显升高,与control组比较,差异具有统计学显著性(P<0.01)。1 μmol/L Ang-(1-7)和HG共处理心肌细胞24 h可使IL-1β和TNF-α的分泌水平明显降低,与HG组比较,差异均有统计学显著性(P<0.01)。与Ang-(1-7)的作用相类似,30 μmol/L TAK-242 或100 μmol/L Nec-1 共处理心肌细胞24 h也能使IL-1β和TNF-α的分泌水平降低,分别与HG组比较,差异均具有统计学显著性(P<0.01)。1 μmol/L Ang-(1-7)、30 μmol/L TAK-242 或100 μmol/L Nec-1 本身不影响炎症细胞因子的基础分泌水平。
讨 论
在本研究中,我们观察到HG可引起心肌细胞RIP3 表达水平升高,再次证实HG可引起心肌细胞坏死性凋亡的发生,这与我们之前[7]的报道相一致。

Figure 6.Ang-(1-7), TAK-242 (an inhibitor of TLR4) and Nec-1 (a specific inhibitor of necroptosis) attenuated HG-induced dissipation of mitochondrial membrane potential (MMP) in H9c2 cardiac cells. Mean±SEM.n=5.**P<0.01vscontrol group;##P<0.01vsHG group.
图6 Ang-(1-7)、TAK-242 和Nec-1 抑制HG引起的心肌细胞MMP丢失
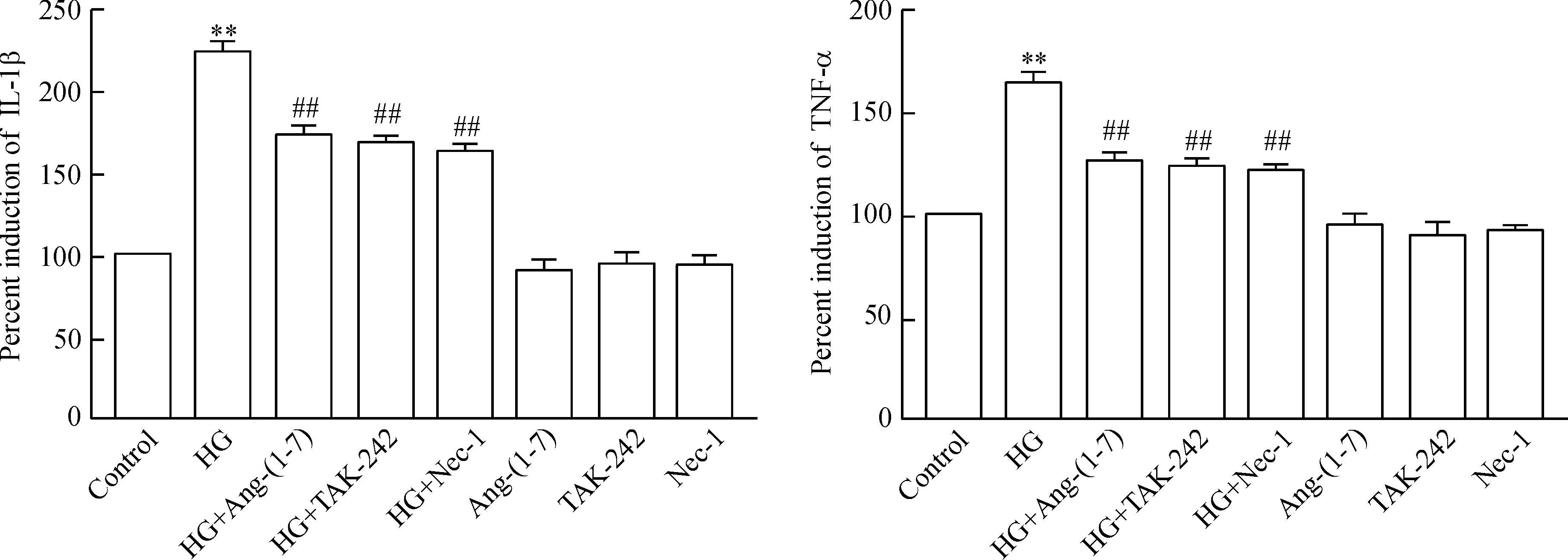
Figure 7.Ang-(1-7), TAK-242 (an inhibitor of TLR4) and Nec-1 (a specific inhibitor of necroptosis) attenuated HG-induced secretion of inflammatory cytokines in H9c2 cardiac cells. Mean±SEM.n=5.**P<0.01vscontrol group;##P<0.01vsHG group.
图7 Ang-(1-7)、TAK-242 和Nec-1 抑制HG引起的炎症细胞因子分泌
坏死性凋亡通常是由TNF-α诱导而启动,但近期有报道指出,在小鼠的巨噬细胞模型中,TLR4 也可介导坏死性凋亡的发生[5-6]。TLR4 是第一个被发现的TLR相关蛋白,在心肌细胞中有大量的表达[12],是介导炎症反应的一种重要的上游信号分子。在本研究中,我们首先观察了TLR4 的抑制剂TAK-242 对HG上调RIP3 表达的影响,结果表明TAK-242 能明显抑制HG对RIP3 表达的上调,提示在HG损伤心肌细胞的模型中,TLR4 可诱导坏死性凋亡的发生。另一方面,坏死性凋亡和细胞炎症反应的关系非常密切,有研究指出,坏死性凋亡可介导细胞的炎症反应[13],而TLR4 是炎症反应的重要信号分子,因此我们推测坏死性凋亡对TLR4 可能有调控作用。在本研究中,我们观察到HG可引起TLR4 表达增多,而坏死性凋亡的特异性抑制剂Nec-1 可抑制HG对TLR4 表达的上调,表明HG可激活TLR4 通路,其作用机制之一可能与坏死性凋亡有关。此外,应用TAK-242 和Nec-1 共处理心肌细胞均能对抗HG引起的心肌细胞损伤和炎症,表现为细胞存活率升高,LDH活性降低,ROS生成、MMP丢失及炎症细胞因子分泌减少。上述结果清晰地提示TLR4 激活和坏死性凋亡之间存在正反馈作用,一方面,HG引起TLR4 激活后可诱导坏死性凋亡发生,另一方面,坏死性凋亡反过来可引起TLR4 的激活。TLR4 激活和坏死性凋亡之间的相互作用可能是HG引起心肌细胞损伤和炎症的一种新的作用机制,这为寻找防治糖尿病心血管并发症的作用靶点提供了新颖的实验依据。
重要的是,我们还证实了Ang-(1-7)可通过抑制TLR4 激活和坏死性凋亡的相互作用对抗HG引起的心肌细胞损伤和炎症。Ang-(1-7)是一个由7个氨基酸组成的多肽,主要分布于血管、心脏、肾脏等处和血液中,在心血管系统的病理生理过程中发挥重要的作用[9, 14-15]。最近,我们证实了Ang-(1-7)可通过调控核因子-κB(nuclear factor κB, NF-κB)通路对抗高糖引起的H9c2 心肌细胞损伤[10],但Ang-(1-7)的心肌保护机制是非常复杂的,还可能涉及更多未知的作用机制。本研究中我们重点探讨了Ang-(1-7)对HG激活的TLR4 和坏死性凋亡的影响。研究结果表明,Ang-(1-7)能抑制HG对心肌细胞TLR4 和RIP3 表达的上调作用,并可抑制HG诱导的细胞毒性、氧化应激、线粒体损伤和炎症反应,而Ang-(1-7)的上述心肌保护作用,与TAK-242 阻断TLR4 通路及Nec-1 阻断坏死性凋亡所产生的心肌保护作用是相类似的。因此,上述结果有力地证实,抑制TLR4 激活和坏死性凋亡之间的正相互作用,可能是Ang-(1-7)保护H9c2 心肌细胞对抗HG引起的损伤和炎症的重要机制之一。
综上所述,本研究在HG损伤H9c2 心肌细胞的模型中,首次证实TLR4 激活和坏死性凋亡之间的正相互作用介导HG引起的心肌细胞损伤和炎症;抑制TLR4 活化和坏死性凋亡之间的正相互作用可能是Ang-(1-7)对抗HG引起的心肌细胞损伤和炎症的重要作用机制之一。
[1] Kengne AP, Turnbull F, MacMahon S. The Framingham Study, diabetes mellitus and cardiovascular disease: tur-ning back the clock[J]. Prog Cardiovasc Dis, 2010, 53(1):45-51.
[2] Cai L, Kang YJ. Cell death and diabetic cardiomyopathy[J]. Cardiovasc Toxicol, 2003, 3(3):219-228.
[3] Degterev A, Zhou W, Maki JL, et al. Assays for necroptosis and activity of RIP kinases[J]. Methods Enzymol, 2014, 545:1-33.
[4] Montecucco F, Braunersreuther V, Burger F, et al. Anti-apoA-1 auto-antibodies increase mouse atherosclerotic plaque vulnerability, myocardial necrosis and mortality triggering TLR2 and TLR4[J]. Thromb Haemost, 2015, 114(2):410-422.
[5] He S, Liang Y, Shao F, et al. Toll-like receptors activate programmed necrosis in macrophages through a receptor-interacting kinase-3-mediated pathway[J]. Proc Natl Acad Sci U S A, 2011, 108(50):20054-20059.
[6] Kaiser WJ, Sridharan H, Huang C, et al. Toll-like receptor 3-mediated necrosis via TRIF, RIP3, and MLKL[J]. J Biol Chem, 2013, 288(43): 31268-31279.
[7] 梁伟杰,何洁仪,张稳柱,等. 硫化氢通过抑制坏死性凋亡对抗高糖引起的H9c2心肌细胞损伤[J]. 中国病理生理杂志, 2016, 32(3):385-391.
[8] Tallant EA, Ferrario CM, Gallagher PE. Angiotensin-(1-7) inhibits growth of cardiac myocytes through activation of the mas receptor[J]. Am J Physiol Heart Circ Physiol, 2005, 289(4):H1560-H1566.
[9] Jarajapu YP, Bhatwadekar AD, Caballero S, et al. Activation of the ACE2/angiotensin-(1-7)/Mas receptor axis enhances the reparative function of dysfunctional diabetic endothelial progenitors[J]. Diabetes, 2013, 62(4): 1258-1269.
[10]梁伟杰,陈景福,宋明才,等. 血管紧张素-(1-7)/Mas受体轴通过调控NF-κB通路保护心肌细胞对抗高糖诱导的损伤[J]. 中国病理生理杂志, 2015, 31(2):267-273.
[11]Xu W, Wu W, Chen J, et al. Exogenous hydrogen sulfide protects H9c2 cardiac cells against high glucose-induced injury by inhibiting the activities of the p38 MAPK and ERK1/2 pathways[J]. Int J Mol Med, 2013, 32(4): 917-925.
[12]Dasu MR, Devaraj S, Park S, et al. Increased toll-like receptor (TLR) activation and TLR ligands in recently diagnosed type 2 diabetic subjects[J]. Diabetes Care, 2010, 33(4):861-868.
[13]Liu ZY, Wu B, Guo YS, et al. Necrostatin-1 reduces intestinal inflammation and colitis-associated tumorigenesis in mice[J]. Am J Cancer Res, 2015, 5(10):3174-3185.
[14]杜 军,陈长勋. 血管紧张素(1-7)的心血管效应[J]. 中国药理学通报, 2007, 23(5):572-574.
[15]Loot AE, Roks AJ, Henning RH, et al. Angiotensin-(1-7) attenuates the development of heart failure after myocardial infarction in rats[J]. Circulation, 2002, 105(13):1548-1550.
(责任编辑: 陈妙玲, 罗 森)
Angiotensin-(1-7) protects H9c2 cardiac cells against high glucose-induced injury and inflammation by inhibiting the interaction between TLR4 activation and necroptosis
LIANG Wei-jie1, 2, CHEN Mei-ji3, HE Jie-yi1, 2, LI Jian-hao1, 2, CHEN Jun1, 2, YU Sheng-long1, 2, CHENG Fei4, 5, LAN Jun4, 5
(1DepartmentofCardiology,CentralHospitalofPanyuDistrict,2CardiovascularInstituteofPanyuDistrict,Guangzhou511400,China;3DepartmentofPediatrics,HuangpuDivisionofTheFirstAffiliatedHospitalofSunYat-senUniversity,Guangzhou510700,China;4DepartmentofCardiology,TheThirdPeople’sHospitalofDongguanCity,5CardiovascularInstituteofDongguanCity,Dongguan523326,China.E-mail:dgsdsrmyylj@126.com)
AIM: To investigate whether angiotensin-(1-7) [Ang-(1-7)] protects H9c2 cardiac cells against high glucose (HG)-induced injury and inflammation by inhibiting the interaction between Toll-like receptor 4 (TLR4) activation and necroptosis.METHODS: The expression levels of receptor-interacting protein 3 (RIP3; an indicator of necroptosis) and TLR4 were determined by Western blot. Cell viability was measured by CCK-8 assay. The activity of lactate dehydrogenase (LDH) in the culture medium was measured with a commercial kit. The releases of interleukin-1β (IL-1β) and tumor necrosis factor-α (TNF-α) were measured by ELISA. The intracellular level of reactive oxygen species (ROS) was analyzed by 2’, 7’-dichlorfluorescein-diacetate (DCFH-DA) stating followed by photofluorography. Mitochondrial membrane potential (MMP) was examined by rhodamine 123 staining followed by photofluorography.RESULTS: After the H9c2 cardiac cells were treated with HG (35 mmol/L glucose) for 24 h, the expression of RIP3 was obviously increased. Co-treatment of the cells with 30 μmol/L TAK-242 (an inhibitor of TLR4) attenuated the up-regulation of RIP3 induced by HG. Furthermore, the expression of TLR4 was significantly increased after the cells were exposed to HG for 24 h, and co-treatment of the cells with 100 μmol/L necrostatin-1 (Nec-1; a specific inhibitor of necroptosis) and HG for 24 h attenuated the up-regulation of TLR4 expression induced by HG. Moreover, 1 μmol/L Ang-(1-7) simultaneously blocked the up-regulation of the RIP3 and TLR4 induced by HG. On the other hand, co-treatment of the cells with 1 μmol/L Ang-(1-7), 30 μmol/L TAK-242 or 100 μmol/L Nec-1 and HG for 24 h attenuated HG-induced injuries and inflammatory response, leading to the increase in the cell viability, and the decreases in the activity of LDH, ROS generation, MMP loss as well as the releases of IL-1β and TNF-α.CONCLUSION: Ang-(1-7) protects H9c2 cardiac cells against HG-induced injury and inflammation by inhibiting the interaction between TLR4 activation and necroptosis.
Angiotensin-(1-7); Toll-like receptor 4; Necroptosis; High glucose; Cardiomyocytes
1000- 4718(2016)10- 1750- 07
2016- 05- 09
2016- 06- 30
广东省自然科学基金资助项目(No. 2015A030313690);番禺区中心医院青年基金资助项目(No. 2014-Q-01)
△通讯作者 Tel: 0769-81368315; E-mail: dgsdsrmyylj@126.com
R363
A
10.3969/j.issn.1000- 4718.2016.10.004
杂志网址: http://www.cjpp.net

