线粒体单倍群亚型分布与特发性癫痫的关系
张颖
(西安市第九医院神经内科,陕西 西安 710054)
·论著·
线粒体单倍群亚型分布与特发性癫痫的关系
张颖*
(西安市第九医院神经内科,陕西 西安 710054)
目的研究线粒体DNA(mtDNA)单倍群亚型与特发性癫痫易感的关系。方法收集特发性癫痫患者尿液标本45例,健康对照组尿液标本31例,提取尿液脱落细胞基因组,采用聚合酶链式反应(PCR)、Sanger测序法进行线粒体全基因组测序,测序结果与美国国立生物技术信息中心(NCBI)数据库中正常人线粒体基因组(NC_012920.1)比对,使用MitoTool软件分析患者线粒体单倍群。结果单倍群分析结果显示45例特发性癫痫患者中23(51.1%)例为mtDNA单倍群N型,22(48.9%)例为mtDNA单倍群M型。31例健康对照中14(45.2%)例为mtDNA单倍群N型,17(54.8%)例为mtDNA单倍群M型。两组mtDNA单倍群M和N的频率无显著差异(Plt;0.05)。结论本研究中全部个体单倍群类型符合亚洲地区线粒体单倍群分布特点,尚不能明确线粒体单倍群亚型分布与特发性癫痫易感有相关性。
癫痫; 线粒体; 单倍群
癫痫是最常见的神经系统疾病之一,影响了世界上2%的人口[1]。特发性癫痫(idiopathic epilepsies,IE),又称原发性癫痫,与遗传因素有密切关系。自1963年Nass等人发现线粒体DNA(mitochondrial DNA, mtDNA)以来,已有大量的研究证实线粒体基因突变与多种疾病相关,包括癫痫在内的许多神经系统疾病。很多线粒体DNA突变所致疾病都会伴有癫痫发作,Leber遗传性视神经病(leber hereditary optic neuropathy, LHON)就是最早被证实的线粒体疾病,还有较常见的线粒体脑肌病并发乳酸酸中毒及中风样发作(mitochondrial myopathy, encephalopathy, lactic acidosis and a stroke-like episode, MELAS)、肌阵挛性癫痫和破碎红纤维(myoclonic rpilepsy and ragged red fibers, MERRF)和KSS综合征(kearns-sayre syndrome)等[2]。除此之外还有很多其他的综合征也合并癫痫发作[3]。线粒体DNA呈母系遗传,在不同民族间mtDNA的多态性频率有差异,在遗传学上依据mtDNA的差异而定义出一些单倍型,可使研究者追索母系遗传的人类起源[4]。因此我们从线粒体基因入手,探讨线粒体单倍型与特发性癫痫易感性的关系。
对象与方法
一、病例及标本
在2014年9月至2015年6月,于我院癫痫专科门诊就诊,经临床症状、影像学检查及MRI确诊为特发性癫痫的患者45例,采集其尿液为检测标本。同时选取本院同期接受体检的正常人群31例,无癫痫家族史,经规范检查确定排除神经系统疾病,采集其尿液标本为对照组。本研究所有研究对象均来自汉族人群,均签署知情同意书。
二、基因检测方法
采用全基因组DNA提取试剂盒(TIANamp Micro DNA Kit),提取尿道脱落细胞中的DNA,参照文献设计24对引物[5],使用聚合酶链反应扩增线粒体基因组全部序列,共16519个碱基,扩增产物以Sanger测序法直接测序。
三、测序结果分析
测序结果与NCBI数据库中正常人线粒体基因组(NC_012920.1)比对,参照人类线粒体基因组数据库寻找突变位点。线粒体单倍群分析使用MitoTool软件。
四、统计分析
统计学分析采用SPSS 19.0 统计软件包的t检验和卡方检验,以Plt;0.05为差异有统计学意义。
结 果
45例特发性癫痫患者中,男性30例,女性15例,年龄为5~41岁,病史为3~8年,31例健康对照中,男性19例,女性12例,年龄为8~45岁,均为汉族,两组人群在性别、年龄等方面比较差异无统计学意义(Pgt;0.05)(性别的比较行χ2检验,年龄的比较行t检验),具有可比性(表1)。单倍群分析结果显示,本研究中所有个体均可明确地归属为单倍群M及N的亚群(表2,3),群N在病例组中的频率为51.1%,在对照组中的频率为45.2%,群M在病例组中的频率为48.9%,在对照组中的频率为54.8%,两组mtDNA单倍群M和N的频率无显著差异(Pgt;0.05)(行χ2检验)(表4)。
讨 论
线粒体是真核生物进行氧化代谢的部位,是糖类、脂肪和蛋白质最终氧化释放能量的场所[6],线粒体是真核细胞的重要细胞器,正常细胞内有多个线粒体,每个线粒体拥有2~10个DNA分子[7]。mtDNA分子为环状双链DNA分子,包含16569个碱基,组成37个基因,编码的22个tRNA和2个rRNA参与细胞内蛋白质的合成,编码的13个多肽参与线粒体ATP的合成。mtDNA中各基因排列紧密,没有内含子,利用率极高,任何区域的突变都可能会影响线粒体功能,mtDNA与核基因组DNA不同,mtDNA缺乏内含子和组蛋白的保护,更易发生氧化性损伤,其突变率较核DNA高10~20倍[8],线粒体细胞内氧化应激的平衡会影响mtDNA的生物合成,导致mtDNA突变和水平的改变,使细胞能量生成不足,甚至诱导细胞凋亡,最终出现器官功能障碍而致病[9,10]。
线粒体DNA呈母系遗传,在不同人群间mtDNA的多态性频率有差异,在遗传学上依据mtDNA的差异而定义出一些单倍型,Torroni等将共享有某个或某些稳定位点突变的所有单倍型的集合定义为单倍群[11]。Walace等构建了完整的mtDNA亚洲系统发生树,这一系统发生树显示所有的亚洲人mtDNA都可利用10 394位点上多态造成的Dde I酶切位点和在10 397位点上的Alu I酶切位点存在与否分成两大类,如果这两个位点都存在,单倍型组就称为M聚类,包括C、D、E、G单倍群,而同时缺乏这两个酶切位点的mtDNA为另一聚类N,包括单倍群A、B、F[12]。2014年mtDNA系统发生树被更新完善,M群及N群也增加了Q、H等很多新的亚型。本研究中单倍群分析结果显示,病例组及对照组的全部个体中不存在单倍群N和M以外的类型,符合亚洲地区线粒体单倍群分布特点。
本试验研究对象均来源于中国西北地区的汉族人群,要检测一个人群,一个种族的单倍型频率,需要进行大样本试验,而我们的研究对象仅局限于本院门诊患者以及体检者,总例数才76例,远远达不到要求,而且由于样本量太少,Pgt;0.05,差异无统计学意义,更无法进行年龄以及性别分层统计。因此,需要进一步扩大样本研究来证实mtDNA单倍型与特发性癫痫致病危险的关系。目前,特发性癫痫的发病机理中,mtDNA突变在不同种族、人群、性别中作用的差异,是原发还是继发,以及与环境暴露、年龄老化等因素的作用等仍未能阐明。因此,还需要大量研究来逐渐弄清这些机理。
表1 45例特发性癫痫患者基本信息
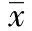

GroupSexMaleFemale AgeDurationofseizure Idiopathicepilepsy30(66.7%)15(33.3%)16.82±8.748.38±4.19 Control19(61.3%)12(38.7%)a17.73±8.13b⁃
aPgt;0.05,vsidiopathic epilepsy;bPgt;0.05,vsidiopathic epilepsy.
表2 45例特发性癫痫患者线粒体单倍群分析结果
Tab 2 mtDNA haplogroup analysis of 45 cases of patients with idiopathic epilepsy

mtDNAhaplogroupCase(%)mtDNAhaplogroupCase(%) N M R1M72 R111M81 B47M91 B51M201 B61C11 F15C71 F23G22 F31Z31 J11D48 N92D54 Total23(48.9)22(51.1)
表3 31例健康对照者线粒体单倍群分析结果
Tab 3 mtDNA haplogroup analysis of 31 cases of control group

mtDNAhaplogroupCase(%)mtDNAhaplogroupCase(%) N M R12M73 R51M101 B43M132 B81M171 T21M271 F11C41 F41C71 J11E11 N51G31 N91D43 A11D51 D61 Total14(45.2)17(54.8)
表4 mtDNA单倍群与特发性癫痫易感性的关联研究
Tab 4 The association between mtDNA haplogroup and idiopathic epilepsy
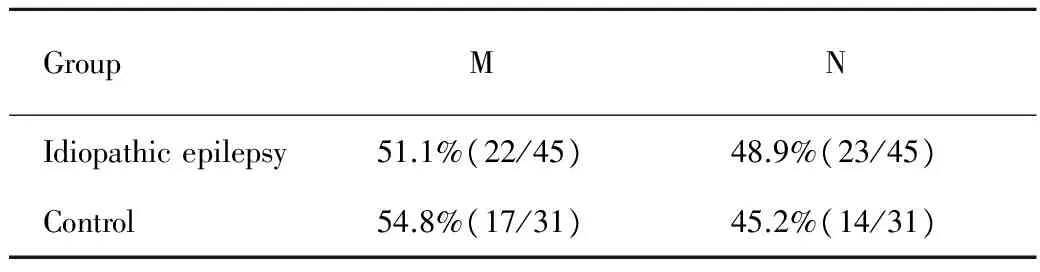
GroupMN Idiopathicepilepsy51.1%(22/45)48.9%(23/45) Control54.8%(17/31)45.2%(14/31)
1Thurman DJ, Beghi E, Begley CE, et al. Standards for epidemiologic studies and surveillance of epilepsy [J]. Epilepsia, 2011, 52 Suppl 7: 2-26.
2Liolitsa D, Rahman S, Benton S, et al. Is the mitochondrial complex I ND5 gene a hot-spot for MELAS causing mutations ? [J]. Ann Neurol, 2003, 53(1): 128-132.
3Lee YM, Kang HC, Lee JS, et al. Mitochondrial respiratory chain defects: underlying etiology in various epileptic conditions [J]. Epilepsia, 2008, 49(4): 685-690.
4Cao Y, Wan LH, Gu LG, et al. Heteroplasmy in human mtDNA control region [J]. Fa Yi Xue Za Zhi, 2006, 22(3): 190-192.
5Rieder MJ, Taylor SL, Tobe VO, et al. Automating the identification of DNA variations using quality-based fluorescence re-sequencing: analysis of the human mitochondrial genome [J]. Nucleic Acids Res, 1998, 26(4): 967-973.
6Picard M, Taivassalo T, Gouspillou G, et al. Mitochondria: isolation, structure and function [J]. J Physiol, 2011, 589(Pt 18): 4413-4421.
7Detmer SA, Chan DC. Functions and dysfunctions of mitochondrial dynamics [J]. Nat Rev Mol Cell Biol, 2007, 8(11): 870-879.
8White DJ, Wolff JN, Pierson M, et al. Revealing the hidden complexities of mtDNA inhentance [J]. MoI Ecol, 2008, 17(23): 4925-4942.
9Martinc B, Grabnar I, Vovk T. The role of reactive species in epileptogenesis and influence of antiepileptic drug therapy on oxidative stress [J]. Curr Neuropharmacol, 2012, 10(4): 328-343.
10Sack GJ. Introduction to the mini-review series on mitochondrial matters in epilepsy [J]. J Bioenerg Biomembr, 2010, 42(6): 441-442.
11Wallace DC, Brown MD, Lott MT. Mitochondrial DNA variation in human evolution and disease [J]. Gene, 1999, 238(1): 211-230.
12Torroni A, Schurr TG, Cabell MF, et al. Asian affinities and continental radiation of the four founding Native American mtDNAs [J]. Am J Hum Genet, 1993, 53(3): 563-590.
Correlationbetweenmitochondriahaplogroupsubtypedistributionandidiopathicepilepsy
ZHANGYing
DepartmentofNeurology,NinthHospitalofXi'an,Xi'an710054, China
ObjectiveThe correlation between mitochondrial DNA (mtDNA) haplogroup subtype and idiopathic epilepsy susceptibility was studied.MethodsUrine specimens from 45 idiopathic epilepsy patients and 31 samples from healthy controls were collected and then urine exfoliated cells genome was extracted to make sequencing for complete mitochondrial genome by polymerase chain reaction (PCR) and Sanger sequencing. The sequencing results were compared with normal mitochondrial genome (NC_012920.1) in National Center for Biotechnology Information (NCBI) database, and mitochondrial haplogroup of patients was analyzed with software MitoTool.ResultsAnalysis result of haplogroup showed 23 (51.1%) of 45 idiopathic epilepsy patients were mtDNA haplogroup N type, and 22 (54.8%) cases were mtDNA haplogroup M type; 14 (45.2%) cases of 31 healthy controls were mtDNA haplogroup N type, and 17 (54.8%) were mtDNA haplogroup M type. The frequency of two groups-mtDNA haplogroup M and N had no significant difference (Plt;0.05).ConclusionIn the study, all individual haplogroup type is consistent with the distribution characteristics of mitochondria haplogroup in Asia region, and it is not clear yet that there is a correlation between mitochondria haplogroup subtype distribution and idiopathic epilepsy susceptibility.
Epilepsy; Mitochondria; Haplogroup
1671-2897(2016)15-414-03
R 971.6
A
张颖,主治医师,E-mail:1968494628@qq.com
*通讯作者:张颖,主治医师,E-mail:1968494628@qq.com
2016-05-01;
2016-09-10)

