胶质母细胞瘤患者外周血中miRNA特异性表达研究
董伦 宿建辉 王晓东* 张恒柱 韩崇旭 魏民
(扬州大学临床医学院: 1神经外科; 2医务处; 3中心实验室, 江苏 扬州 225001)
·脑胶质细胞瘤研究·
胶质母细胞瘤患者外周血中miRNA特异性表达研究
董伦1宿建辉2王晓东1*张恒柱1韩崇旭3魏民1
(扬州大学临床医学院:1神经外科;2医务处;3中心实验室, 江苏 扬州 225001)
目的检测GBM患者和健康人外周血中miRNA的异常表达。方法利用基因芯片分析GBM患者和正常对照者血清中miRNA的表达量,然后进一步进行靶基因的生物信息学分析。结果miRNA芯片表明在血清中15例GBM组和15例正常对照组的外周血miRNA表达有明显差异。752种miRNA中,GBM组有95种miRNA表达上调,22种表达下调。(倍数≥2.0,Plt;0.01)。通过深入分析,我们发现GBM患者miR-576-5p、miR-340和miR-626过表达,但 miR-320、let-7g-5p、miR-7-5p低表达。进一步相关生物信息学分析,我们发现,他们在脑胶质瘤信号通路的调控中发挥重要的作用。结论与正常人比较,以上6种miRNA在GBM患者外周血中有显著差异。外周血中的miRNA表达谱中一些特异性表达的miRNA可能作为高特异性和灵敏度诊断胶质瘤的新靶向标志物。
胶质瘤; 微小RNA; 基因芯片; 外周血
脑胶质瘤是神经外科临床工作中最常见的原发性颅内恶性肿瘤。其发病机制不明确,迄今仍缺乏早期准确、客观、系统的诊断指标。胶质瘤的形成与发展是一个复杂的过程[1]。美国在2010对胶质母细胞瘤分子分型进行了报告。但在胶质瘤的研究领域内的早期诊断领域的研究仍极其薄弱。目前已经证实,miRNA在组织和细胞中的表达表现为显著的肿瘤相关性、组织特异性和表达稳定性。将健康人外周血中的miRNA(microRNA微小RNA)视为正常miRNA作为参照, miRNA在外周血中的表达同样具有肿瘤相关性和组织特异性,同时与RNA比较,其表达稳定性更为显著[2]。恶性胶质母细胞血液中miRNA检测罕见报告[3]。因此,对开展对该领域的研究对胶质瘤的早期诊断及治疗有及其重要的意义。我们拟应用miRNA芯片筛选出血液系统与恶性胶质母细胞发生可能相关的候选miRNA,提出表达差异最大的miRNA作为恶性胶质母细胞标志物的假设,为确立胶质瘤的无创诊、治疗及预后评估诊断提供新方法。
材料与方法
一、样品制备和RNA的提取
胶质母细胞瘤(glioblastoma, GBM)患者15例循环血液样本, 15例年龄和性别匹配的健康自愿者作为对照组。患者签署知情同意书,样本收集并保存在液氮中。用19号针头采集血浆制备含0.129柠檬酸钠( 1体积的抗凝血和9体积全血)抗凝血浆标本2 000 g在真空采血管22℃离心15 min,转移到在1 ml等分的无菌冷冻管并储存于-70℃直至进一步分析。利用miRNeasy Mini Kits从血浆中提取RNA。样品通过氯仿提取,乙醇沉淀,转移至的RNeasy Mini试管,根据制造商说明书洗脱。RNA洗脱液在50 μl无RNA酶的水中。
二、MicroRNAs实时荧光定量PCR阵列标记及杂交
基因芯片采用Ⅰ+Ⅱ v3(752 miRNA)miRCURY LNATM普通的RT miRNA PCR阵列。它们用于分析低水平表达miRNA的血浆样品的敏感性有特殊的优势。DS-cDNA(双链cDNA)序列的合成。利用miRCURY LNATM普通的RT microRNA PCR试剂盒 (Exiqon, Vedbaek公司, 丹麦)进行反转录。按说明取10 μl样品进行PCR。对照组包括六个参照基因,其中包括3小microRNA[hsa-miR-103, hsa-miR-191 and hsa-miR-423-5p, 3个small RNA,U6, 核仁小分子38B (SNORD38B)and核仁小分子RNAD49(SNORD49)]。芯片杂交温度42℃,16~20 h。杂交后,使用NimbleGen(NimbleGen公司, 美国)的洗涤缓冲液试剂盒洗涤。
三、图像采集和数据分析
基因Pix4000B芯片扫描仪进行扫描,在5 μm/像素分辨率,GenePix4000B扫描仪(分子设备公司)扫描荧光强度,然后将扫描图像TIFF格式(Tagged Image File Format, TIFF)输入基因Pix PRO 6.0软件进行表达数据分析。然后导入NimbleScan(Nimble扫描器),通过分位数标准化并将数据进行规范。所有的mRNA水平数据然后导入到Agilent GeneSpring GX软件(版本11.0)作进一步分析[4]。
四、统计分析
所有的结果表示为平均值±标准差。比较两个芯片组的t检验。Plt;0.05被认为有统计学意义。
结 果
一、胶质瘤患者miRNA的差异表达
使用微阵列定量分析752种成熟miRNA。通过分位数标准化。所有表达强度低于100的miRNA被认为是表达量稀少而去除。剩余的117种miRNA显著异常(倍数≥2.0)。与对照组相比,胶质母细胞瘤外周血中,95的miRNA表达上调(81%) ,而22种miRNA表达下调(19%)。在其中经进一步筛选,发现20种有显著表达差异的miRNA(图1)。表达上调的11种miRNA (hsa-miR-4726-5p, hsa-miR-1255b-2-3p, hsa-miR-340-5p, hsa-miR-4275, hsa-miR-4712-3p, hsa-miR- 576-5p, hsa-miR-1299, hsa-miR-4268, hsa-miR-3591-5p, hsa-miR-626, hsa-miR- BART18-3p, hsa-miR-3169)表达下调的11种miRNA (hsa-miR-320b, hsa-let-7g-5p, hsa-miR-486-5p, hsa-miR-7-5p, hsa-miR-4524b-5p, hsa-miR-3171, hsa-miR-1246, hsa-miR-1273g-3p)。经分析其中上调及下调前3位的分别有:miR-576-5p、miR-340、miR-626 miRNA显著上调,而miR-320,let-7g-5p,miR-7-5p显著下调。其中,在6种miRNA中,miR-576-5p表达增加4.05倍。miR-7-5p的表达水平下降0.57倍。
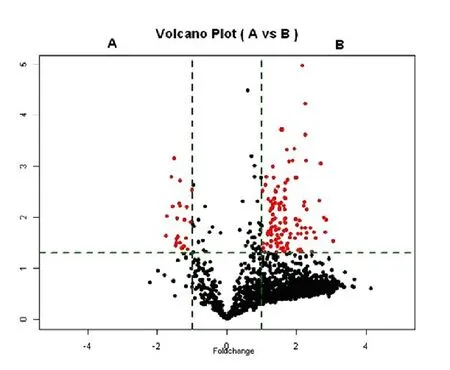
图1 火山散点图分析外周血中胶质母细胞患者与正常人miRNA表达差异
Fig 1 Comparison of miRNA expression between GBM patients and normal controls by Scatter plots
A: The normal brain sample from human total serum; B: The GBM sample from human total serum.
二、预测GBM患者外周血miRNA差异表达的和功能注释
为了进一步探讨这20种miRNA潜在靶基因的功能,我们选择的表达上调的11种miRNA(hsa-miR-4726-5p, hsa-miR-1255b-2-3p, hsa-miR-340-5p, hsa-miR -4275, hsa-miR-4712-3p, hsa-miR-576-5p, hsa-miR-1299, hsa-miR-4268, hsa-miR-3591-5p, hsa-miR-626, hsa-miR-BART18-3p, hsa-miR-3169)和表达下调的11种miRNA (hsa-miR-320b, hsa-let-7g-5p, hsa-miR-486-5p, hsa-miR-7-5p, hsa-miR- 4524b-5p, hsa-miR-3171, hsa-miR-1246, hsa-miR-1273g-3p)进行,功能注释和同源分析(Gene Ontology分析, GO分析)及pathway信号通路分析。期望了解异常表达的miRNA在GBM患者外周血的潜在功能,通过使用生物信息学方法预测各种生物过程基因,分析了明显表达异常的20种miRNA作为胶质母细胞瘤患者外周血中的潜在靶标的可能性。结果表明,靶基因涵盖了这的三个领域:细胞代谢过程,细胞结构及分子功能。其中细胞结构方面包括:膜周围的细胞器,细胞内的细胞器,细胞质和细胞外器。分子功能方面:调节肌球蛋白结合、蛋白质转运活性、血清素受体活性、组蛋白甲基转移酶活性、转录因子结合转录因子的活性、视黄酸受体结合、蛋白结合转录因子活性、蛋白结合、转录辅因子活性、蛋白激酶激活剂活性、乙酰氨基活动等。
为了检测这种20种miRNA信号通路,通过pathway分析我们寻找可能干预的信号转导通路可能有:嘧啶代谢,细胞质DNA的检测途径,血清素突触联系,碱基切除修复,钙信号转导通路,糖胺聚糖的生物合成,硫酸角质素,人类T型细胞淋巴病毒Ⅰ型(human T-cell lymphotropic virus-Ⅰ, HTLV-Ⅰ)感染,嘌呤代谢等。其中明显上调miR-576-5p、miR-340、miR-626,明显下调的miR-320、let-7g-5p和miR-7-5p均极有可能通过靶向,影响相应的分子通路生物活性。
讨 论
肿瘤的早期发现、早期诊断、早期治疗是降低死亡率,改善预后的关键所在。外周血肿瘤标志物的检测具有无创伤、可重复、可于同一时间点进行检测多项指标等优点,是肿瘤诊断和随访的理想手段。最近,不少学者将关注点投向了外周血miRNA,有大量研究探讨了外周血miRNA作为肿瘤标志物的可行性。目前已经证实,miRNA在组织和细胞中的表达表现为显著的肿瘤相关性、组织特异性和表达稳定性。有趣的是,miRNA在外周血中的表达同样具有肿瘤相关性和组织特异性,同时与RNA比较,其表达稳定性更为显著。
本课题GBM外周血中检测miRNA表达结果与patrick Roth等人的有一定的差异[3]。在比较了胶质母细胞瘤患者和健康对照组310个miRNA,他们观察到的52 miRNA的一个显著异常表达,占分析miRNA的16.8%。其中,27个miRNA的表达上调(52%),而25的miRNA表达下调(48%)。而我们发现GBM血清中20种miRNA显著异常表达,与一些学者研究结果有差异。差异的形成的原因可能有:首先,由于经济原因,我们主要分析了显著不同的20种miRNA。其次,因为列入的多100多个miRNA的不同,非常难以评估一个观察到的变化是否是真正的显著或只是由于偶然性,因此,我们仅选择表达量最多的20种miRNA表现出的表达变化。在这20个miRNA中,只有miR-576-5p、miR-340、miR-626、miR-320、let-7g-5p和miR-7-5p失调最为显著。另外一个因素是, 全血中RNA提取并从全血中纯化的流程不同, miRNA的水平在血浆中正常的生物变化和经过处理样品的步骤差异,即从采血到的逆转录酶-多聚酶链反应(reverse transcriptase-polymerase chain reaction, RT-PCR),可能影响观察miRNA的表达[5]。此外,大部分miRNA在血清和血细胞中被检测到。然而,只有少数miRNA是独特地存在于血清或血细胞,这表明大多数血清的miRNA可以从循环血细胞衍生的[6,7]。最后,本研究用于检测已知血浆miRNA的miRCURY LNA的RT-qPCR的系统已经被发现是比第一代微阵列系统更灵敏[8]。
我们发现miR-576-5p、miR-340、miR-626、miR-320、let-7G-5p和miR-7-5p在GBM的血液中表达显著异常,表明在外周血中某些microRNA在胶质瘤细胞生长和增殖的可能有一定的生物学作用,以上6种miRNA在外周血中的潜在功能迄今至今尚未有人深入研究。例如,miR-342-3p,迄今还没有在胶质瘤组织中进行研究。Li等人的实验结果表明了miR-576-5p的过度表达发生在脑转移癌[9]。在其他疾病领域中,miR-576-5p在骨关节炎(OA)下调[10], 但在胶质瘤中的表达仍无报告。最近的一些研究已经证明了miR-7抑制胶质母细胞瘤细胞迁移和转移[11,12]。在miRNA领域最新进展表明,miRNA用 miR-7-5p的替代治疗可能是一个治疗癌症的可行方法[13]。有学者认为与原发性黑色素瘤细胞相比,在转移性黑色素瘤衍生的细胞系中miR-7-5p的表达减少,异位表达的miR-7-5p显著抑制黑色素瘤细胞迁移和侵袭。此外,一些作者报告,胰岛素受体底物-2(insulin receptor substrate 2, IRS-2)是的miR-7-5p在黑色素瘤细胞的目标。通过使用RNA干扰(RNAi),它们证明IRS-2激活蛋白激酶B(protein kinase B, AKT),并促进黑色素瘤细胞的迁移。推测miR-7-5p的可能是一种新的肿瘤抑制型miRNA,在黑素瘤中通过其部分抑制IRS-2表达与致癌Akt信号发挥作用[14]。在本报告中的在GBM患者外周血中miR-7-5p显著失调,其原因有待进一步探讨。
以往的研究确定血清miRNA的生物标志物一般集中个的miRNA。然而,基于单个miRNA的生物标志物的特异性通常是有争议的。本项研究中表明,血清中6种异常表达的miRNA可能是GBM的诊断更全面的指标。它尚未在神经胶质瘤患者的组织或血清中被精确地研究。但在我们的研究中仍有几个限制。
miRNA检测研究存在以下几个方面的问题:首先,样本量较小,尚缺乏追踪随访资料,因此对于外周血肿瘤相关miRNA与转移、复发和生存率之间的关系尚不明确。其次,这六种血清miRNA是否可以建立一个常规的生物标志物诊断将需要更多的检测,目前已通过实验筛选出的可能用作诊断指标的外周血肿瘤相关miRNA尚缺乏进一步的实验论证。要求大量的临床样品的测试证明本研究的结果。再次,检测方法仍比较繁琐,且价格昂贵,不利于临床应用。最后,作为肿瘤标志物的外周血miRNA的参考值范围还未确定。我们目前只能评估部分失调的miRNA 的差异表达,我们期望在未来的探索研究中发现新的miRNA被认定为GBM诊断的血清生物标志物。
1董伦, 李健, 武永康, 等. mir-7-3基因慢病毒表达载体的构建及对人胶质瘤细胞生长抑制作用的研究 [J]. 中华神经医学杂志, 2014, 13(1): 2-6.
2Molina-Pinelo S, Suarez R, Pastor MD, et al. Association between the miRNA signatures in plasma and bronchoalveolar fluid in respiratory pathologies [J]. Dis Markers, 2012, 32(4): 221-230.
3Roth P, Wischhusen J, Happold C, et al. A specific miRNA signature in the peripheral blood of glioblastoma patients [J]. J Neurochem, 2011, 118(3): 449-457.
4董伦, 韩磊, 康春生, 等. 长链非编码RNA在胶质母细胞瘤中异常表达研究 [J]. 中国神经肿瘤杂志, 2013, 11(3): 160-164.
5McDonald JS, Milosevic D, Reddi HV, et al. Analysis of circulating microRNA: preanalytical and analytical challenges [J]. Clin Chem, 2011, 57(6): 833-840.
6Kosaka N, Iguchi H, Ochiya T. Circulating microRNA in body fluid: a new potential biomarker for cancer diagnosis and prognosis [J]. Cancer Sci, 2010, 101(10): 2087-2092.
7Jorde R, Svartberg J, Joakimsen RM, et al. Plasma profile of microRNA after supplementation with high doses of vitamin D3 for 12 months [J]. BMC Res Notes, 2012, 5: 245.
8Chen Y, Gelfond JA, McManus LM, et al. Reproducibility of quantitative RT-PCR array in miRNA expression profiling and comparison with microarray analysis [J]. BMC Genomics, 2009, 10: 407.
9Li Z, Gu X, Fang Y, et al. microRNA expression profiles in human colorectal cancers with brain metastases [J]. Oncol Lett, 2012, 3(2): 346-350.
10Diaz-Prado S, Cicione C, Muinos-Lopez E, et al. Characterization of microRNA expression profiles in normal and osteoarthritic human chondrocytes [J]. BMC Musculoskelet Disord, 2012, 13: 144.
11Giles KM, Brown RA, Epis MR, et al. miRNA-7-5p inhibits melanoma cell migration and invasion [J]. Biochem Biophys Res Commun, 2013, 430(2): 706-710.
12Dong L, Han C, Zhang H, et al. Construction of a recombinant lentivirus containing human microRNA-7-3 and its inhibitory effects on glioma proliferation [J]. Neural Regen Res, 2012, 7(27): 2144-2150.
13Bader AG, Brown D, Winkler M. The promise of microRNA replacement therapy [J]. Cancer Res, 2010, 70(18): 7027-7030.
14Giles KM, Brown RA, Epis MR, et al. miRNA-7-5p inhibits melanoma cell migration and invasion [J]. Biochem Biophys Res Commun, 2013, 430(2): 706-710.
miRNAmicroarrayrevealsspecificexpressionintheperipheralbloodofglioblastoma
DONGLun1,SUJianhui2,WANGXiaodong1,ZHANGHengzhu1,HANChongxu3,WEIMin1
1DepartmentofNeurosurgery;2DepartmentofMedicalAffairs;3DepartmentofCenterLaboratory,ClinicalMedicalCollege,YangzhouUniversity,Yangzhou225001, China
ObjectiveThe expression profile variation of miRNA in the blood of both healthy and patients was investigated.MethodsmiRNA in serum of patients with GBM and normal controls were analyzed by microarray analysis. Then their relevant bioinformatic analysis of the predicted target genes (gene ontology, pathway, gene network analysis) was done for further research.ResultsThe miRNA microarray revealed that there were significant difference in the expression of miRNAs in serum between the GBM and normal controls. Among 752 miRNAs, 95 miRNAs were up-regulated in the GBM group, and 22 miRNAs were down-regulated (fold change≥2.0,Plt;0.01). By further analysis, miR-576-5p, miR-340, and miR-626 were significantly over-expressed, but miR-320, let-7g-5p, and miR-7-5p were significantly lowly expressed in GBM patients. By further relevant bioinformatic analysis, they possibly played the important roles in the regulation of glioma signaling pathways.ConclusionThe six miRNAs are significant differentially expressed in the peripheral blood of patients with GBM pathologies. These data suggest that the miRNA profile of the peripheral blood may serve as a new biomarker for glioma diagnosis with high specificity and sensitivity.
Glioblastoma; miRNA; microarray; Peripheral blood
1671-2897(2016)15-401-04
R 341
A
董伦,博士,E-mail: dongluen@163.com
*通讯作者: 王晓东,博士,E-mail: lundongu571@163.com
2015-05-08;
2015-11-20)

