异甘草素联合替莫唑胺对SHG44人脑胶质瘤干细胞增殖的影响
孙红军 林瑜亮 党莹 马占峰 铁兴华 屈晓东 荔志云
(兰州军区兰州总医院神经外科,甘肃 兰州 730050)
·脑胶质细胞瘤研究·
异甘草素联合替莫唑胺对SHG44人脑胶质瘤干细胞增殖的影响
孙红军 林瑜亮 党莹 马占峰 铁兴华 屈晓东 荔志云*
(兰州军区兰州总医院神经外科,甘肃 兰州 730050)
目的探讨异甘草素联合替莫唑胺对SHG44人脑胶质瘤干细胞增殖的影响。方法采用含无血清达尔伯克氏改良伊格尔氏培养基(DMEM/F12)(含表皮生长因子(EGF)、成纤维细胞生长因子(FGF)、B27)的悬浮细胞培养板培养、纯化胶质瘤干细胞,并通过CD133联合Nestin标记进行免疫荧光鉴定;实验分为对照组[含二甲基亚砜(DMSO)]、异甘草素(5~160 μmol/L)组、替莫唑胺(12.5~200 μmol/L)组、异甘草素+替莫唑胺组(160 μmol/L+12.5~200 μmol/L),通过细胞增殖-毒性检测(CCK-8)法、流式细胞术、免疫荧光染色法分别检测细胞抑制率、细胞周期及干细胞表面相关分化蛋白表达情况。结果异甘草素随着浓度增加细胞抑制作用越强,且160 μmol/L时抑制率达32%,替莫唑胺随着浓度增加抑制作用越强,且200 μmol/L时抑制率达40%;异甘草素联合替莫唑胺组随着浓度增加抑制作用越强,且160 μmol/L+200 μmol/L时抑制率达72%;随着异甘草素浓度增加G0/G1期细胞比例增加,细胞周期阻滞于G0/G1期;随着异甘草素浓度增加干细胞分化越多,且分化细胞的死亡越多。结论异甘草素能诱导SHG44人脑胶质瘤干细胞向星形胶质细胞和神经元细胞分化,且能抑制增殖,同时增强替莫唑胺化疗敏感性。
异甘草素; 替莫唑胺; SHG44人脑胶质瘤干细胞; 诱导分化; 抑制增殖; 化疗敏感性
胶质瘤是最常见的神经上皮源性颅内肿瘤,约占中枢神经系统肿瘤的40%,占中枢神经系统恶性肿瘤的81%[1]。目前手术、化疗、放疗等治疗效果均不佳,其主要原因是胶质瘤细胞耐放化疗。2003年Singh等[2]采用无血清神经干细胞培养基分离出了脑肿瘤干细胞,2004年李铭初等[3]也相继成功分离出了脑肿瘤干细胞,这些发现为胶质瘤的治疗指明了方向。胶质瘤干细胞是脑胶质瘤组织的起源细胞,是肿瘤转移复发的源泉,是肿瘤各种治疗包括化学药物治疗的靶标,理论上,只有有效杀灭脑胶质瘤干细胞,才能达到治愈肿瘤的目的。传统化疗仅针对脑肿瘤细胞,而对于脑胶质瘤干细胞的作用及机制的研究较少。异甘草素(isoliquiritigenin, ISL)是一种异黄酮类化合物,主要存在于甘草中,具有抗肿瘤、抗病毒、抗自由基、松弛血管、抑制血小板聚集、抑制脂质过氧化等生物活性[4]。近年来,研究发现ISL具有促进肿瘤细胞分化,并抑制其生长的特点。替莫唑胺(temozolomide,TMZ)抗胶质瘤的临床应用已公认。本实验以SHG44人脑胶质瘤干细胞为研究对象,研究通过ISL联合TMZ对胶质瘤干细胞增殖的影响,进一步为ISL抑制胶质瘤干细胞提供实验依据。
材料与方法
一、实验材料与试剂
人脑胶质瘤SHG44细胞系(ATCC公司);胰蛋白酶(Sigma公司);胎牛血清( Hyclone公司);达尔伯克氏必需基本培养基(Dulbecco's Modified Eagle Media, DMEM)培养基( Gibco公司);达尔伯克氏改良伊格尔氏培养基(Dulbecco's Modified Eagle Media: Nutrient Mixture F-12, DMEM/F12)(1 ∶1)(Gibco公司);重组人表皮生长因子(epidermal growth factor, EGF)、B27、重组人碱性成纤维生长因子(basic fibroblast growth factor, bFGF)(Invitrogen公司);小鼠抗人Nestin抗体(Abcam公司);兔抗人CD133抗体(Abnova公司);异硫氰酸荧光素(fluoresceine isothiocyanate, FITC)标记的山羊抗兔二抗(Abcam公司);藻红蛋白 (phyloerythrin, PE)标记的兔抗小鼠二抗(Abcam公司);免疫染色封闭液、抗荧光淬灭封片液(碧云天生物科技研究所);悬浮细胞培养板6孔和96孔(Cyagen公司);碘化丙啶(propidine iodide, PI)和细胞增殖-毒性检测(cell counting Kit-8, CCK-8)试剂盒(Sigma-Aldrich公司);异甘草素(上海源叶生物科技有限公司)。
二、细胞培养
1.SHG44人脑胶质瘤细胞培养:人脑胶质瘤SHG44细胞以105个/ml接种于含10%胎牛血清高糖型DMEM培养基中。于37℃、5%CO2、100%湿度培养箱中培养,每2~3 d换液一次。待细胞长满培养皿底约80%时传代。
2.SHG44人脑胶质瘤干细胞培养及鉴定:将培养在含10%胎牛血清DMEM培养基中的对数生长期的SHG44胶质瘤细胞,弃去培养液,0.25%胰蛋白酶2 ml置于100 mm培养皿中消化约1 min,用无血清神经干细胞培养基DMEM/F12(内含2% B27、EGF 20 μg/L、bFGF 20 μg/L)终止消化,将其移至15 ml离心管中,反复吹打成单细胞悬液。1 500 rpm 离心8 min。弃去上清液,加入5 ml无血清神经干细胞培养液洗涤沉淀,1 500 rpm 离心5 min。弃去上清液,无血清神经干细胞培养液再次悬浮沉淀,形成1×104个细胞/ml 的悬浮细胞液。取其1 ml接种于悬浮细胞六孔板,加入1 ml无血清培养基,每天添加400 μl培养基。待胶质瘤干细胞生长至7 d后再次收集离心,消化吹打悬浮成单个细胞后,再次接种于悬浮细胞六孔板。经3次纯化培养后进行实验。取良好活力的胶质瘤干细胞球,接种于经多聚赖氨酸包被的玻片上,37℃晾干,磷酸盐缓冲液(phosphate buffered saline, PBS)漂洗3×5 min,室温4%多聚甲醛固定15 min,弃去多聚甲醛,PBS漂洗3×5 min,0.5% TritonX-100 37℃透膜10 min;加免疫染色封闭液,室温孵育30 min;滴加稀释好的一抗:CD133 (1 ∶200),Nestin (1 ∶200),放入湿盒4℃孵育过夜 。弃去一抗孵育液,PBS漂洗3×5 min,加1 ∶100稀释的PE标记的兔抗小鼠二抗及1 ∶1 000稀释的FITC标记的山羊抗兔二抗,37℃孵育40min;PBS漂洗3×5 min;4',6 二脒基-2-苯吲哚盐酸( 4',6-diamidino-2-phenylindole, DAPI) 封片,荧光显微镜下观察并拍照。
三、CCK-8法检测细胞增殖和细胞抑制
调整细胞密度至2.5×103个/孔(100 μl)接种到96孔悬浮细胞培养板中并进行预培养。对照组和ISL每个浓度均设6个复孔。37℃、5%CO2、100%湿度培养24 h,每孔加入CCK-8液8 μl,继续孵育3 h后使用酶标仪读取450 nm处吸光度值。重复3次。
四、细胞周期测定
经ISL(0 μmol/L、10 μmol/L、40 μmol/L、160 μmol/L)加药作用72 h后,收集细胞至10 ml离心管,1 000 r/min 离心5 min,弃上清液;用0.01 mol/L PBS清洗细胞3次,PBS 500 μl重悬细胞后转移至1.5 ml离心管,1 ml 70%冰乙醇4℃固定过夜。1 200 r/min离心5 min,0.01 mol/L PBS 1 ml重悬,50 mg/ml RNase A 37℃作用1 h;用50 μg/ml碘化丙啶避光染色30 min,200目细胞筛过滤后进行流式细胞仪上样检测。实验重复3次。
五、免疫荧光染色标记胶质瘤干细胞分化情况
取纯化、培养活力良好的胶质瘤干细胞400 μl(150个细胞/400 μl)接种于放置有多聚赖氨酸包被的玻片的悬浮细胞24孔板,并加ISL至终浓度(10~160 μmol/L),至72 h。PBS 漂洗3×5 min,室温4%多聚甲醛固定15 min,弃去多聚甲醛,PBS漂洗3×5 min,0.5%TritonX-100 37℃透膜10 min;加免疫染色封闭液,室温孵育30 min;滴加稀释好的一抗:Nestin ( 1 ∶200),β-Tubulin Ⅲ(1 ∶1 000),GFAP(1 ∶50),放入湿盒4℃孵育过夜。弃去一抗孵育液,PBS漂洗3×5 min,加1 ∶100稀释的PE标记的兔抗小鼠二抗,37℃孵育40 min;PBS漂洗3×5 min;4',6二脒基-2-苯吲哚盐酸(4',6-diamidino-2-phenylindole, DAPI) 封片,荧光显微镜下观察并拍照。
六、统计学分析
结 果
一、胶质瘤干细胞镜下形态及鉴定
1.胶质瘤干细胞倒置显微镜形态:SHG44胶质瘤干细胞经Cyagen 6孔悬浮细胞培养板3次纯化、培养至第7天,通过倒置显微镜观察,胶质瘤干细胞呈大小不等悬浮克隆球样生长(图1B),而胶质瘤细胞呈贴壁样生长,且胞体伸出较长突起(图1A)。
2.胶质瘤干细胞鉴定:荧光染色后,荧光显微镜下观察胶质瘤干细胞球的干细胞标记物Nestin、CD133表达呈阳性(图2),其中绿色是FITC标记,红色是PE标记,DAPI染核呈蓝色。
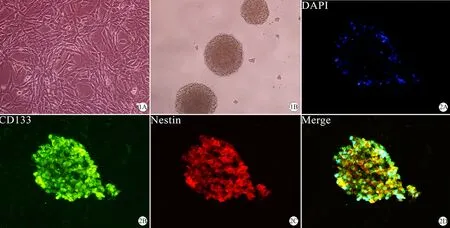
图1 SHG44胶质瘤细胞及其干细胞形态(光镜下,×200)
Fig 1 The morphology of SHG44 glioma cells and their stem cells (Light microscope, ×200)
A: Glioma cells showed adherent growth, and the cell body extended longer processes (×200); B: Glioma stem cells clustered in regular shape (×200) Bar=50 μm.
图2 胶质瘤干细胞球表达特异标记物 Nestin、CD133 (×200)
Fig 2 These neurosphere were CD133- and Nestin-positive staining (×200)
A: Cellular nucleus stained by DAPI (blue); B: Neurospheres monoclonal-derived expressed positive Nestin (green); C: Neurospheres monoclonal-derived expressed positive CD133 (green).
二、ISL联合替莫唑胺对SHG44人脑胶质瘤干细胞抑制的影响
ISL随着浓度增加细胞抑制作用越强,且160 μmol/L时抑制率达32%(图3A),替莫唑胺随着浓度增加抑制作用越强,且200 μmol/L时抑制率达40%(图3B);ISL联合替莫唑胺组随着浓度增加抑制作用越强,且160 μmol/L+200 μmol/L时抑制率达72%(图3C)。
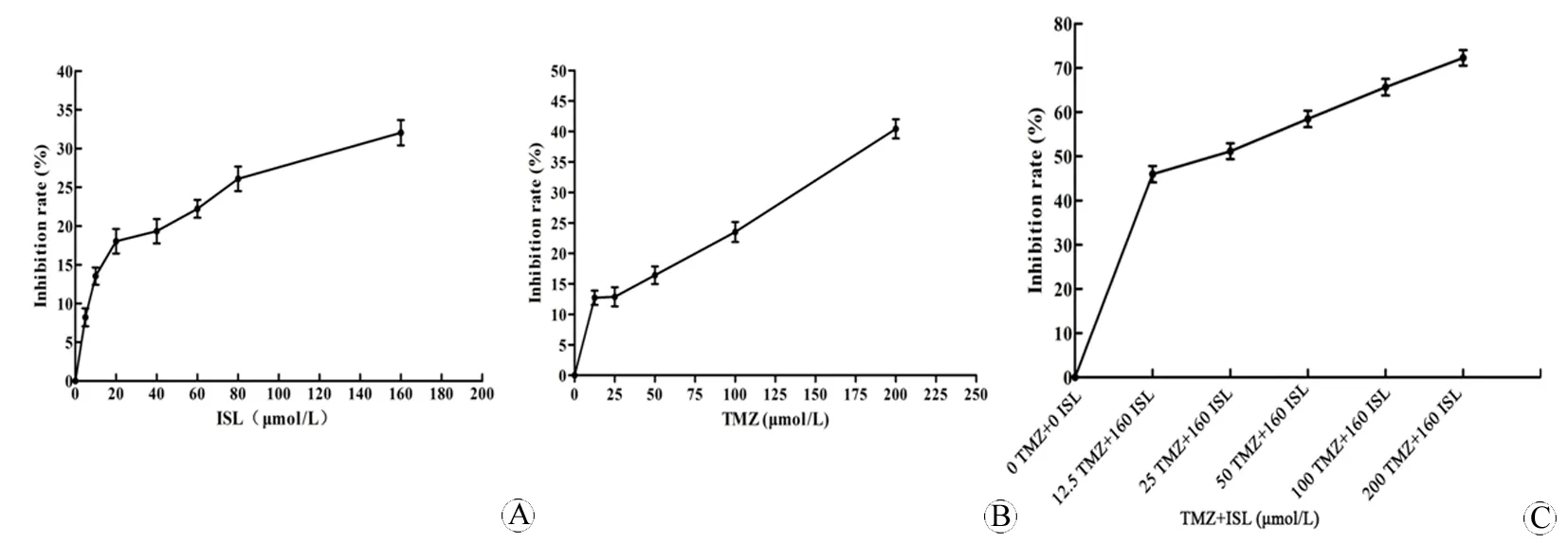
图3 不同浓度ISL及TMZ对胶质瘤干细胞增殖的影响
Fig 3 Effects of different concentrations of ISL and TMZ on the proliferation of glioma stem cells
A: Inhibitory rate of ISL on glioma stem cells; B: Inhibitory rate of TMZ on glioma stem cells; C: Inhibitory rate of ISL combination with TMZ on glioma stem cells.
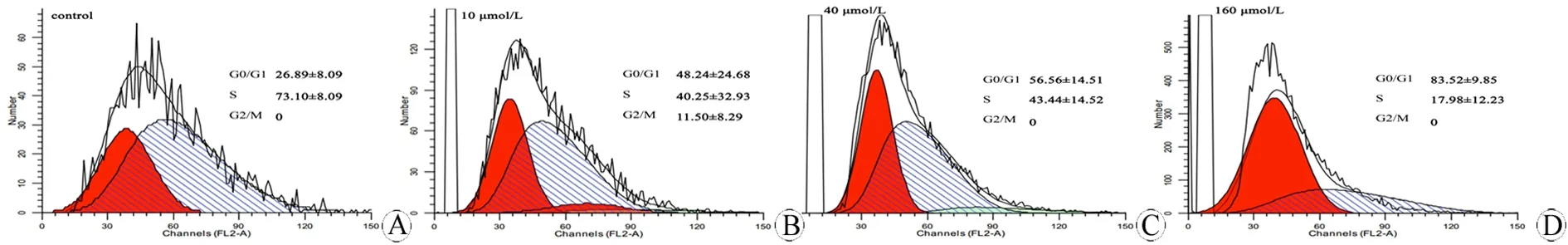
图4 不同浓度ISL对SHG44胶质瘤干细胞周期的影响
Fig 4 Effects of different concentrations of ISL on the cell cycle of SHG44 glioma stem cells
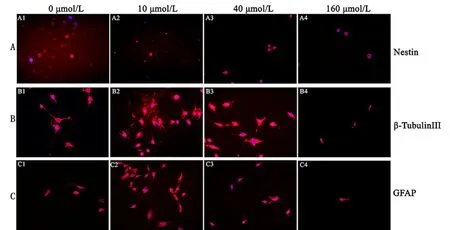
图5 不同浓度ISL诱导SHG44胶质瘤干细胞分化情况(IF, ×400)
Fig 5 Induced differentiation of SHG44 glioma stem cells by different concentrations of ISL (IF, ×400)
A: Glioma stem cells generated free-floating neurosphere-like, and Nestin protein were expressed in glioma stem cells; B: Neurons emited long processes, which were fiber mesh-like, and β-TubulinⅢ protein were expressed in neurons; C: Astrocytes emited many long and branching projections, whose end formed foot-like, and GFAP protein were expressed in astrocytes.
三、不同浓度ISL对胶质瘤干细胞细胞周期的影响
ISL作用72 h时,10 μmol/L组与对照组相比,G2/M期细胞比例由0%增加至11.50%±8.29%(Plt;0.05),当浓度增加至40 μmol/L及160 μmol/L,G2/M期细胞比例下降至0%;与对照组相比,G0/G1期细胞比例由26.89%±8.09%增加至:10 μmol/L组48.24%±24.68%,40 μmol/L组56.56%±14.51%,160 μmol/L组83.52%±9.85%(图4)。
四、ISL诱导胶质瘤干细胞分化情况
各浓度组随机选取5个视野拍照发现(图5),对照组胶质瘤干细胞无明显分化,且呈球形,72 h后,随着浓度增加分化细胞及干细胞同时减少,且高浓度时分化细胞较小且突起较短。其中未分化胶质瘤干细胞呈悬浮球样(图5A);分化的神经元细胞发出长突起,呈纤维网状(图5B);分化的星形胶质细胞胞体发出许多长而分支的突起,且突起的末端膨大形成脚板(图5C)。
讨 论
胶质瘤干细胞是胶质瘤细胞克隆源性细胞[6],是胶质瘤耐化疗、抗拒放疗以及胶质瘤进展和复发的根源[7]。胶质瘤干细胞可分化为神经元、星形胶质细胞、少突胶质细胞以及小胶质细胞。CD133是胶质瘤干细胞最重要的标记物,Nestin是神经干细胞的标志物,目前也被广泛作为胶质瘤干细胞标志物应用。另外,小部分CD133阴性细胞也具有胶质瘤干细胞特性,但CD133阳性筛选是目前唯一可靠的评估方法[8]。本研究通过CD133联合Nestin进行免疫荧光鉴定,呈阳性表达,证实此类神经球具有胶质瘤干细胞的特性。
ISL是甘草黄酮类化合物中主要的药用活性成分之一,具有广谱抗肿瘤、抗氧化、解痉、抗心律失常等作用[9],近年来,国内外学者对此已进行了大量的研究。其中ISL抗肿瘤机制是目前研究的热点之一。前期实验研究发现ISL具有抑制SHG44胶质瘤细胞增殖的作用,且呈时间和剂量依赖性,经ISL处理的SHG44胶质瘤细胞,其细胞内自噬体和自噬溶酶体明显增加,自噬相关分子LC3-Ⅱ/Ⅰ比值显著增加,且ISL可通过抑制抗凋亡分子 Bcl-2和增加凋亡相关分子 Caspase-3促发SHG44胶质瘤细胞凋亡,从而抑制和杀伤胶质瘤细胞。景治涛等[10]研究发现TMZ可通过下调TGF-β2 的表达来抑制胶质瘤干细胞和分化胶质瘤细胞的侵袭,并降低他们的免疫抑制作用。本研究发现ISL和TMZ分别作用72 h时对胶质瘤干细胞抑制作用呈剂量依赖性,而且ISL联合TMZ可明显增强抑制作用。同时研究发现ISL能诱导胶质瘤干细胞向星形胶质细胞和神经元分化,且随浓度增加诱导作用增强。TMZ联合ISL抑制作用明显强于ISL或TMZ单药的抑制作用,可能是由于ISL诱导胶质瘤干细胞进入分化状态并增强了TMZ的化疗敏感性。李雅娟等[11]研究发现ISL能抑制大鼠 C6 胶质瘤细胞的增殖,并能诱导C6细胞向星形胶质细胞分化,且呈时间、剂量依赖性,可能是通过调控细胞内氧化还原状态诱导C6胶质瘤分化,但具体机制尚不清楚。
本研究发现,不同浓度ISL作用于SHG44胶质瘤干细胞时,与对照组相比,ISL组G0/G1期细胞比例显著增加,且随着浓度增加G0/G1细胞比例也随着增加,说明ISL能使细胞发生G0/G1阻滞。
综上所述,本研究证明ISL能抑制胶质瘤干细胞增殖,且能改变其细胞周期,可明显增强TMZ化疗敏感性。因此,继续深入研究ISL对胶质瘤干细胞的作用机制,ISL可能是更具选择性、有效性以及低毒的新型抗胶质瘤干细胞药物,与目前的治疗方式相结合,可能将大大改善胶质瘤患者的预后和延长其寿命。
1Chen J, McKay RM, Parada LF. Malignant glioma: lessons from genomics, mouse models, and stem cells [J]. Cell, 2012, 149(1): 36-47.
2Singh SK, Clarke ID, Terasak IM, et al. Identification of a cancer stem cell in human brain tumors [J]. Cancer Res, 2003, 63(18): 5821-5828.
3李茗初. 脑肿瘤干细胞的分离培养、鉴定与移植致瘤实验研究 [D]. 长沙: 中南大学, 2005: 1-112.
4Li D, Wang Z, Chen H, et al. Isoliquiritigenin induces monocytic differentiation of HL-60 cells [J]. Free Radic Biol Med, 2009, 46(6): 731-736.
5Ye L, Gho WM, Chan FL, et al. Dietary administration of the licorice flavonoid isoliquiritigenin deters the growth of MCF-7 cells overexpressing aromatase [J]. Int J Cancer, 2009, 124(5): 1028-1036.
6Cruceru ML, Neagu M, Demoulin JB, et al. Therapy targets in glioblastoma and cancer stem cells: lessons from haematopoietic neoplasms [J]. J Cell Mol Med, 2013, 17(10): 1218-1235.
7Schonberg DL, Lubelski D, Miller TE, et al. Brain tumor stem cells: Molecular characteristics and their impact on therapy [J]. Mol Aspects Med, 2014, 39(5): 82-101.
8Venere M, Fine HA, Dirks PB, et al. Cancer stem cells in gliomas: identifying and understanding the apex cell in cancer's hierarchy [J]. Glia, 2011, 59(8): 1148-1154.
9陈日来, 李玉珍, 李成. 异甘草素的研究进展 [J]. 临床医药实践, 2008, 1(13): 462-466.
10景治涛, 张东勇, 吴安华, 等. 替莫唑胺通过TGF-β2影响胶质瘤干细胞的侵袭性研究 [J]. 中华神经外科疾病研究杂志, 2014, 13(1): 13-17.
11李雅娟, 甘露, 王占洋, 等. 异甘草素对大鼠C6胶质瘤细胞增殖和分化的影响 [J]. 中国药理学通报, 2015, 31(9): 1298-1303.
EffectsofIsoliquiritigeninincombinationwithTemozolomideoncellproliferationofSHG44humanbraingliomastemcells
SUNHongjun,LINYuliang,DANGYing,MAZhanfeng,TIEXinghua,QUXiaodong,LIZhiyun
DepartmentofNeurosurgery,LanzhouGeneralHospitalofLanzhouMilitaryCommandofPLA,Lanzhou730050, China
ObjectiveThe effect of Isoliquiritigenin in combination with Temozolomide on cell proliferation of SHG44 human glioma stem cells are investigated.MethodsGlioma stem cells were cultured in serum-free medium supplemented with epidermal growth factor (EGF), fibroblast growth factor (FGF) and B27, and the suspension cell culture plate was used. CD133 and Nestin were detected using immunofluorescence analysis. The experiment included control group (dimethyl sulfoxide, DMSO), different concentration of isoliquiritin group (5~160 μmol/L), temozolomide group (12.5~200 μmol/L), isoliquiritin+temozolomide group (160 μmol/L+12.5~200 μmol/L). The cell inhibition rates, the cell cycle and stem cell surface differentiated protein expression were detected by cell counting Kit-8 (CCK-8) method, flow cytometry and immunofluorescence.ResultsThe cell inhibition rate was increased with the isoliquiritin concentration increasing, and the inhibition rate was 32% when the concentration reached 160 μmol/L. The cell inhibition rate was increased with the temozolomide concentration increasing, and the inhibition rate was 40% when the concentration reached 200 μmol/L. The cell inhibition rate was increased with the increase of concentration of isoliquiritin in combination with temozolomide, and the inhibition rate reached 72% when the concentration reached 160+200 μmol/L. The cell cycle G0/G1phase was increased with the increase of the concentration of isoliquiritin, and the cell cycle was arrested in G0/G1phase. With the increase of the isoliquiritin concentration, the more stem cell differentiation, the more cell death.ConclusionIsoliquiritigenin can induce SHG44 glioma stem cells into astrocytes and neuron cell differentiation, and can inhibit the proliferation of glioma stem cells, and increase the chemotherapy sensitivity to temozolomide.
Isoliquiritigenin; Temozolomide; SHG44 human glioma stem cells; Induced differentiation; Inhibition of proliferation; Chemotherapy sensitivity
1671-2897(2016)15-405-05
R 739
A
孙红军,硕士研究生,E-mail: tcmsunhj@163.com
*通讯作者:荔志云,教授、主任医师,E-mail: lizhiyun456@163.com
2016-04-21;
2016-08-20)

