RNA干扰AKT2的表达对胶质瘤裸鼠移植瘤替莫唑胺敏感性的影响
崔勇 张风林 鲍晶 应奇* 胡国汉 骆纯 卢亦成
(1解放军第411医院神经外科,上海 200081; 2第二军医大学附属长征医院,上海市神经外科研究所,上海 200003)
·脑胶质细胞瘤研究·
RNA干扰AKT2的表达对胶质瘤裸鼠移植瘤替莫唑胺敏感性的影响
崔勇1张风林1鲍晶1应奇1*胡国汉2骆纯2卢亦成2
(1解放军第411医院神经外科,上海 200081;2第二军医大学附属长征医院,上海市神经外科研究所,上海 200003)
目的研究RNA干扰丝/苏氨酸蛋白激酶2 (AKT2)对脑胶质瘤移植瘤的替莫唑胺疗效的改变。方法构建胶质瘤裸鼠成瘤模型,瘤内注射和腹腔内给替莫唑胺(TMZ)药物,以替莫唑胺化疗药物和AKT2短发夹结构RNA(AKT2-shRNA)表达载体对成瘤后的裸鼠瘤体进行联合干预治疗,进而观察并测量各组裸鼠肿瘤体积大小。DNA断裂的原位末端标记法(TUNEL)测定并计算分析各组裸鼠成瘤后肿瘤组织细胞的凋亡的变化。结果空白对照组、替莫唑胺化疗组、TMZ+阴性对照组、TMZ+AKT2干扰组裸鼠瘤体体积分别为:(669.34±98.73)mm3、(399.86±55.26)mm3、(383.81±34.01)mm3、(297.72±41.49)mm3;瘤体质量分别为:(1.25±0.26)g、(0.72±0.11)g、(0.69±0.07)g、(0.52±0.07)g。TMZ+AKT2干扰组其肿瘤体积及瘤体质量都明显小于空白对照组、替莫唑胺组和TMZ+阴性对照组,有显著性差异(Plt;0.05)。TUNEL实验结果显示:空白对照组、替莫唑胺化疗组、TMZ+阴性对照组、TMZ+AKT2干扰组裸鼠瘤体凋亡指数分别为:7.15%±1.04%、25.26%±2.71%、26.63%±3.46%、42.81%±5.97%。TMZ+AKT2干扰组其肿瘤凋亡情况明显高于空白对照组、替莫唑胺组和TMZ+阴性对照组,结果有显著性差异(Plt;0.05)。结论RNA干扰AKT2能够显著提高裸鼠胶质母细胞瘤对TMZ化疗的敏感性。
丝/ 苏氨酸蛋白激酶2; 胶质瘤; 替莫唑胺
替莫唑胺(temozolomide, TMZ)已成为临床上脑胶质瘤一线化疗药物。联用替莫唑胺与生物靶向药物以提高疗效和降低毒性反应是近年来最为活跃的研究领域之一。通过不同途径联合作用于胶质瘤细胞可能提高化疗敏感性。本研究先将前期实验构造的丝/苏氨酸蛋白激酶2 (serine/ threonine kinase β, AKT2)短发夹结构RNA(AKT2-shRNA)通过瘤内注射的方式转染U251细胞株,在裸鼠体内环境中以研究转染AKT2-shRNA能否提高胶质瘤细胞株对化疗药物替莫唑胺敏感性。为后续研究AKT2改变TMZ对脑胶质瘤化疗疗效的分子机理打下理论和实验基础。
材料与方法
一、主要实验材料和试剂
慢病毒介导的AKT2-shRNA表达载体由中科院上海生命科学院协助构建。脑胶质瘤U251细胞购自中科院上海生化与细胞所细胞库,以含10%新生胎牛血清的细胞培养液(Dulbecco's modified Eagle's medium, DMEM)中培养。shRNA试剂盒购于Invitrogen公司。兔抗人AKT2单克隆抗体购自台湾Abnova公司。替莫唑胺药物由天士力公司提供。
二、细胞的培养和转染
将处于对数生长期的U251细胞接种于6孔培养板,37℃,5% CO2培养箱培养。当细胞融合达70%,将AKT2-shRNA转染U251细胞。同时转染绿色荧光蛋白(green fluorescent protein, GFP)特异性的shRNA(GFP-shRNA)作阴性对照。
三、裸鼠培养及成瘤
使用无特定病原体(specefic pathogen free, SPF)动物实验环境中的繁殖,在室温下对裸鼠适用的是26~28℃,相对温度保持在40%~60%。每天保持10 h,14 h,无光暗周期。2 w后观察40只裸鼠约0.7 cm2肿瘤结节直径为标准。
四、细胞接种、药物干预
在SPF环境超净工作台内,充分混匀细胞悬液,用无菌注射器吸取0.2 ml细胞悬液(U251细胞1×107/ml)。将裸鼠固定,75%酒精常规消毒裸鼠腹股沟皮肤,皮下注射。接种第20天左右开始,选取成瘤大小0.7 cm左右成瘤标准裸鼠24只,随机分组分四组。每3天给药1次,共6次。具体分组及操作方法如下:①空白对照组:每只裸鼠注射入300 μl生理盐水。②替莫唑胺药物组:按40 mg/kg/d/剂量,每只裸鼠注射入300 μl替莫唑胺稀释液。③替莫唑胺药物+阴性对照病毒共同作用组:按40 mg/kg/d/剂量,每只裸鼠注射入300 μl替莫唑胺稀释液和阴性病毒液稀释液。④替莫唑胺药物+AKT2-shRNA共同作用组:按40 mg/kg/d/剂量,每只裸鼠注射入300 μl替莫唑胺稀释液和AKT2-shRNA病毒液。裸鼠腹腔部位局部皮肤碘伏消毒。将稀释液缓慢注射入腹腔,连续3次。裸鼠成瘤后重新计算时间,第1天按组给药,每3天药物干预1次并用游标卡尺测量一次肿瘤长径及短径,做好记录。共药物干预6次,16 d。停药1 w后,即药物干预后第23天处死所有实验裸鼠,并取出瘤体,肿瘤测量大小,称重。同时将瘤体按分组编号放好拍照。肿瘤抑制率=(对照组瘤体体积-处理组瘤体体积)/对照组瘤体体积。瘤体积增长率=(瘤体终体积-瘤体初体积)/瘤体初体积。肿瘤体积立方毫米(= 0.5236×长×短径×宽)。
五、TUNEL实验步骤
将组织切片置于染色缸中,用二甲苯洗两次,每次5 min。用无水乙醇洗两次,每次3 min。用95%和75%乙醇各洗一次,每次3 min。用磷酸盐缓冲液(phosphate buffered saline, PBS)洗5 min 加入蛋白酶K溶液(20 μg/ml),于室温水解15 min,去除组织蛋白。用蒸馏水洗4次,每次2 min。在样本上滴加100 μl DNase I反应液,室温条件下反应30 min后,PBS冲洗5 min,冲洗3次。每个样品再滴加50 μl末端脱氧核苷酸转移酶(terminal deoxynucleotidyl transferase, TdT) 反应液,放入湿盒内,室温37℃条件避光反应1 h。反应后1X PBS漂洗三次,避光操作,每次5 min。每个样品上滴加50 μl四甲基异硫氰酸罗丹明 (tetramethyl rhodamin isothiocyanate, TRITC)标记的链霉素亲和素(streptavidin)工作液,放入湿盒内,室温37℃条件反应1 h。反应后再次1×PBS漂洗5 min,重复漂洗3次。4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole, DAPI)染色复染细胞核,10 min,室温条件下。洗去DAPI染液后滴加适量体积比封片剂(甘油:PBS=6:4),荧光显微镜下观察并拍照。
六、统计学处理
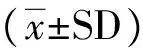
结 果
一、裸鼠成瘤实验结果
实验中处死裸鼠时,测量体积称重,数据显示:空白对照组、替莫唑胺化疗组、TMZ+阴性对照组、TMZ+AKT2干扰组裸鼠瘤体体积分别为:(669.34±98.73)mm3、(399.86±55.26)mm3、(383.81±34.01)mm3、(297.72±41.49)mm3;质量分别为:(1.25±0.26)g、(0.72±0.11)g、(0.69±0.07)g、(0.52±0.07)g。TMZ+AKT2干扰组其肿瘤体积、质量都小于其他三组,有显著性差异(Plt;0.05)(图1, 2)。
二、TUNEL检测结果
TUNEL实验结果显示:空白对照组、替莫唑胺药物组、TMZ+阴性对照组、TMZ+AKT2干扰组裸鼠瘤体凋亡指数分别为:7.15%±1.04%、25.26%±2.71%、26.63%±3.46%、42.81%±5.97%。TMZ+AKT2干扰组其肿瘤凋亡情况明显高于空白对照组、替莫唑胺化疗组和TMZ+阴性对照组,有显著性差异(Plt;0.05)。
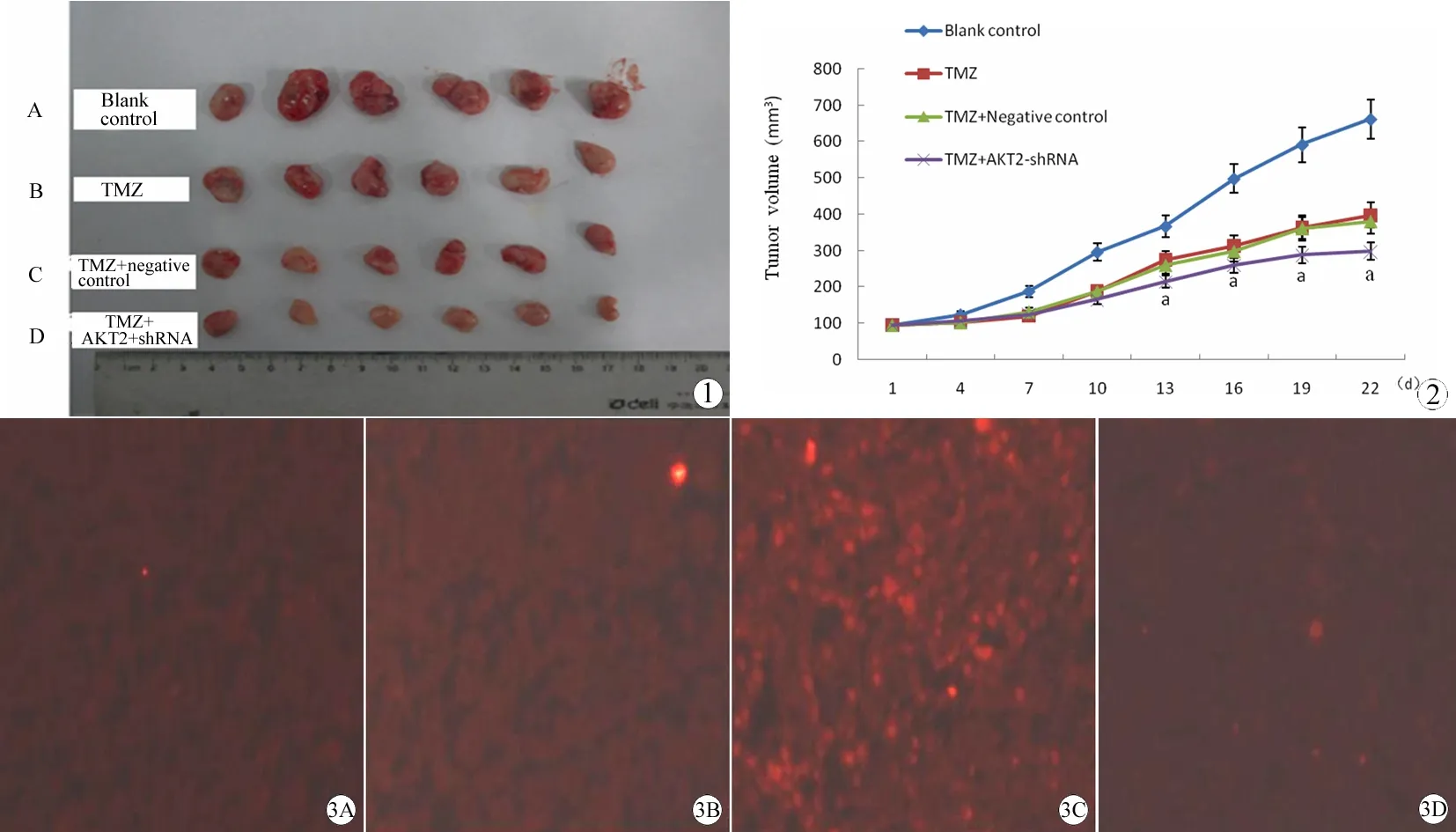
图1 药物干预后裸鼠瘤体的变化
Fig 1 Growth of implanted tumor cells was monitored by tumor volume
A: Blank control groups; B: TMZ groups; C: TMZ+Negative control groups; D: TMZ+AKT2-shRNA groups.
图2 瘤体体积增长曲线变化图
Fig 2 The changes of tumor volume
aPlt;0.05,vscontrol groups.
图3 TUNEL检测各组细胞凋亡情况
Fig 3 The apoptosis of each groups detected by TUNEL
A: Blank control groups; B: TMZ groups; C: TMZ+Negative control groups; D: TMZ +AKT2-shRNA groups.
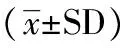
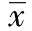

GroupsTumormass(g)Tumorvolume(mm3)Inhibitionrate(%)Apoptosisindex(%) Blankcontrolgroups1.25±0.26669.34±98.737.15±1.04 TMZgroups0.72±0.11399.86±55.2641.72±0.7125.26±2.71 TMZ+Negativecontrol0.69±0.07383.81±34.0144.67±2.8226.63±3.46 TMZ+AKT2⁃shRNA0.52±0.07a297.72±41.49a58.14±3.13a42.81±5.97a
aPlt;0.05,vsControl groups.
讨 论
人脑胶质瘤是中枢神经系统中最为常见的原发性恶性脑肿瘤,发病率在所有脑瘤中达到70%以上[1]。胶质母细胞瘤(glioblastoma, GBM),是一种高度恶性的中枢神经系统肿瘤,是人类最具有侵袭性的肿瘤之一,在WHO肿瘤临床分级中定为IV级,其恶性级别最高。新一代烷化剂替莫唑胺是目前对脑瘤GBM的标准化疗药物,在GBM的化疗治疗中发挥着重要作用[2~4]。并已被证明有着良好的临床治疗效果。但由于传统的手术治疗,及术后的化疗和放疗仍存在很大的局限性,所以GBM患者的中位生存时间只有14.6个月左右[5]。当下研究并寻求针对胶质瘤更好的治疗策略改善提高患者生活质量并延长患者生存时间显得尤为重要。
有研究表明AKT2基因在脑胶质瘤细胞生长、增殖、转移、侵袭等多个方面起着很重要的作用[6,7]。同时,还有研究研究报告AKT2基因的表达程度和胶质瘤恶性程度正相关,并且与患者的生存时间呈负相关性[8]。近年来有研究者实验发现,AKT活化可能参与肿瘤放射治疗的抵抗,研究结果表明AKT似乎是一个有效的克服胶质瘤治疗抵抗重要靶标[9]。在过去的几十年里,不断研究PI3K/AKT信号通路和参与在胶质瘤和其他癌症过程中的各种生物制剂,许多PI3K抑制剂已被开发。他们中的一部分已经被用来探索克服癌细胞的抗放疗和化疗能力。
本部分实验中,我们通过TUNEL实验观察到TMZ化疗+AKT2-shRNA干扰组较其他组相比,裸鼠胶质瘤瘤体体积、瘤体质量指标、肿瘤抑制率和凋亡指数都发生了相应的变化。实验结果可以看出替莫唑胺药物化疗联合转染AKT2-shRNA与单纯替莫唑胺化疗相比可进一步减缓肿瘤的生长增殖速度并能促进肿瘤凋亡,因而在一定程度上提高了替莫唑胺化疗的敏感性,部分的克服了U251细胞对替莫唑胺的化疗耐药。
本研究只是为将来临床上胶质瘤患者替莫唑胺化疗提供了一个新的思路,实验研究中AKT2表达下调的程度仍远未达到神经外科临床的标准,这可能与转染慢病毒载体半衰期短、转染进入裸鼠移植瘤和肿瘤细胞的不均一性等原因有关。还有慢病毒转染到患者身上的毒副作用等因素。这些实验研究要真正投入到神经外科临床应用可能还有很多事情要去做。
1Ricard D, Idbaih A, Ducray F, et al. Primary brain tumours in adults [J]. Lancet, 2012, 379(9830): 1984-1996.
2Hart MG, Grant R, Garside R, et al. Temozolomide for high grade glioma [J]. Cochrane Database Syst Rev, 2013, 4: CD007415.
3Kim YH, Kim T, Joo JD, et al. Survival benefit of levetiracetam in patients treated with concomitant chemoradiotherapy and adjuvant chemotherapy with temozolomide for glioblastoma multiforme [J]. Cancer, 2015, 121(17): 2926-2932.
4赵莺, 丁文秀, 尹小祥, 等. 替莫唑胺联合调强放疗治疗胶质母细胞瘤术后残留临床研究 [J]. 中华神经外科疾病研究杂志, 2015, 14(4): 334-337.
5Van Meir EG, Hadjipanayis CG, Norden AD, et al. Exciting new advances in neuro-oncology:the avenue to a cure for malignant glioma [J]. CA Cancer J Clin, 2010, 60(3): 166-193.
6Pu P, Kang C, Li J, et al. The effects of antisense AKT2 RNA on the inhibition of malignant glioma cell growth in vitro and in vivo [J]. J Neurooncol, 2006, 76(1): 1-11.
7Zhang J, Han L, Zhang A, et al. AKT2 expression is associated with glioma malignantprogression and required for cell survival and invasion [J]. Oncol Rep, 2010, 24(1): 65-72.
8Wang G, Kang C, Pu P. Increased expression of Akt2 and activity of PI3Kand cell proliferation with the ascending of tumor grade of human gliomas [J]. Clin Neurol Neurosurg, 2010, 112(4): 324-327.
9Narayan RS, Fedrigo CA, Stalpers LJ, et al. Targeting the Akt-pathway to improve radiosensitivity in glioblastoma [J]. Curr Pharm Des, 2013, 19(5): 951-957.
AKT2-shRNAaffectsthesensitivityofhumangliomacelllineU251xenograftinnudemicetoTMZ
CUIYong1,ZHANGFenglin1,BAOJing1,YINGQi1,HUGuohan2,LUOChun2,LUYicheng2
1DepartmentofNeurosurgery, 411HospitalofPLA,Shanghai200081;2DepartmentofNeurosurgery,ChangzhengHospital,SecondMilitaryMedicalUniversity,Shanghai200003, China
ObjectiveThe effects of the expression of AKT2 on sensitivity of glioma cell line U251 to Temozolomide (TMZ) are discussed.MethodsU251 cell implanted tumor model in nude mice was established. By the intratumoral injection and intraperitoneal administration, the nude mice tumor was treated with TMZ chemotherapy drugs and AKT2-shRNA expression vector. The nude mice tumor accumulation conditions were observed. DNA in situ end labeling method (TUNEL) was used to analyze the apoptosis of tumor cells in each group.ResultsIn the blank control group, TMZ chemotherapy group, TMZ+ negative control group, and TMZ+AKT2 interference group, nude mice tumor volume were (669.34±98.73)mm3, (399.86±55.26)mm3, (383.81±34.01)mm3, (297.72±41.49)mm3, respectively; tumor weight were (1.25±0.26)g, (0.72±0.11)g, (0.69±0.07)g, (0.52±0.07)g, respectively. In TMZ+AKT2 interference group, the tumor volume and tumor weight were significantly less than those of the blank control group and negative control group, and there was significant difference (Plt;0.05). TUNEL experimental results showed that in blank control group, TMZ chemotherapy group, the TMZ+negative control group, TMZ+AKT2 interference body apoptosis index group of tumor were (7.15±1.04)%, (25.26±2.71)%, (26.63±3.46)%, (42.81±5.97)%, respectively. In TMZ+AKT2 interference group the apoptosis was significantly higher than that of the blank control group and negative control group, and there was significant difference (Plt;0.05).ConclusionRNA interference of AKT2 can significantly improve the sensitivity of glioma chemotherapy to TMZ.
AKT2; Glioblastoma; TMZ
1671-2897(2016)15-393-04
R 739
A
国家自然科学基金资助项目(30930094)
崔勇,主治医师,博士,E-mail: ben_cuiyong@126.com
*通讯作者: 应奇,副主任医师, E-mail: yingqi411@126.com
2016-01-30;
2016-04-05)

