ClC-3与BK离子通道在胶质瘤细胞侵袭性生长中的作用研究
曹敬正 卢培刚 董元 李博 梁媛 郝振强 李育鑫
(济南军区总医院神经外科,山东 济南 250031)
·脑胶质细胞瘤研究·
ClC-3与BK离子通道在胶质瘤细胞侵袭性生长中的作用研究
曹敬正 卢培刚*董元 李博 梁媛 郝振强 李育鑫
(济南军区总医院神经外科,山东 济南 250031)
目的观察3型氯离子通道(ClC-3通道)与大电导钙激活K+通道(BK通道)在胶质瘤细胞中的表达;研究ClC-3离子通道与BK离子通道在胶质瘤细胞侵袭性生长中的作用。方法Western blot实验检测ClC-3与BK通道分别在C6及U251胶质瘤细胞中的蛋白表达,免疫荧光技术检测两种通道蛋白在胶质瘤细胞中的形态学分布情况;采用Transwell侵袭实验检测应用ClC-3通道特异性阻滞剂氯代毒素(ClTX)以及BK通道特异性阻滞剂伊比蝎毒素(IBTX)后胶质瘤细胞侵袭能力的变化情况。结果U251及C6胶质瘤细胞系均高度表达ClC-3离子通道,而BK离子通道在两种胶质瘤系中的表达相对较低;应用ClTX 后U251细胞的侵袭性显著降低(Plt;0.05),且呈剂量依赖关系;应用IBTX后U251细胞的侵袭性无明显变化。结论ClC-3离子通道在胶质瘤侵袭性生长发挥重要作用,可作为未来治疗胶质瘤的新靶标。
神经胶质瘤; ClC-3与BK离子通道; 侵袭; 靶向治疗
近年来,离子通道在胶质瘤基础生物学中的作用日益受到广泛关注[1]。ClC-3属于电压门控氯通道家族(voltage-gated chloride channnel, CICs),参与“调节性细胞容积回缩(regulatory volume decrease, RVD)”,是“容积敏感性外向整流性(volume sensitive outwardly rectifying, VSOR)”氯通道的主要成员[2],并参与介导细胞氯离子外流,在胶质瘤细胞侵袭性生长过程中发挥重要作用[3]。大电导钙激活K+通道(big mediate-conductance Ca2+-activated K+channel, BK通道)又称KCa1.1通道,它受细胞内Ca2+浓度以及细胞去极化的双重调控[4],对细胞内钙离子浓度变化尤为敏感,因此能够参与包括胶质瘤细胞在内的多种细胞的行为学改变。本研究旨在进一步验证ClC-3以及BK通道在胶质瘤细胞系中的表达情况,并在此基础之上探讨它们在胶质瘤细胞侵袭过程中的重要作用,以期获得直接的体外实验证据。
材料与方法
一、材料
C6大鼠胶质瘤细胞株、U251人胶质瘤细胞株购自中国科学院上海细胞库。胎牛血清购自Gibco公司, ClC-3通道特异性阻断剂氯代毒素(Chlorotoxin, ClTX)购自Anaspec公司,BK通道特异性阻断剂伊比蝎毒素(Iberiotoxin, IBTX)购自Alomone Labs公司。Matrigel胶、Transwell侵袭小室(24孔8 μm孔径)购自Corning公司, ClC-3与BK通道蛋白一抗工作液为 Abcam公司产品。
二、细胞培养
两种胶质瘤细胞系均培养于含10%胎牛血清的DMEM(Dulbecco's modified eagle medium)培养基中(抗生素浓度为100 U/ml青霉素和100 μg/ml链霉素)在37℃、5%CO2、饱和湿度下培养,细胞汇合度达80%~90%时进行传代。
三、Western blot检测ClC-3与BK离子通道在胶质瘤细胞系的蛋白表达
取对数期生长的胶质瘤细胞,使用100 μl预冷的RIPA裂解液(RIPA Lysis Buffer )充分裂解,离心后提取总蛋白,8%的聚丙烯酰胺凝胶电泳分离蛋白质,300 mA转膜1 h,封闭液封闭1 h,洗涤后,加入一抗(ClC-3兔多克隆抗体1 ∶300,BK兔单克隆抗体1 ∶1 000)稀释后4℃孵育过夜,加入辣根过氧化物酶(Horseradish Peroxidase, HRP)标记的二抗,37℃摇床震摇孵育1 h;结果采用凝胶成像分析系统扫描。β-actin作为内参对照。
四、免疫荧光检测ClC-3与BK离子通道在胶质瘤细胞系的形态学分布情况
细胞爬片后,预温的磷酸盐缓冲液(Phosphate Buffered Saline, PBS)清洗3次,4%的多聚甲醛室温固定20 min,PBS清洗3次,加0.4%Triton X-100透化20 min,山羊血清室温封闭30 min,倾去血清,滴加一抗工作液(ClC-3兔多克隆抗体1 ∶100,BK兔单克隆抗体1 ∶100),4℃湿盒中过夜,PBS漂洗3次。加入异硫氰酸荧光素(fluorescein isothiocyanate, FITC)标记二抗工作液(1 ∶50)避光孵育30 min,弃二抗,滴加4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole, DAPI)染料工作液(1 ∶1 000),室温孵育10 min,95%甘油封片,用PBS替代一抗工作液作为阴性对照,荧光显微镜下观察拍照并分析结果。
五、Transwell侵袭实验
Transwell 小室上层均匀铺50 μl基质胶(无血清培养基:Matrigel为4 ∶1),静置于37℃培养箱中1 h使胶凝固,事先将对数生长期的胶质瘤细胞换用无血清培养基饥饿培养24 h,消化并用无血清培养基重悬,调整细胞密度至5×105/ml。小室内加入含1% BSA上述细胞悬液200 μl,下室加入600 μl含10%胎牛血清的DMEM培养基,1 h后待细胞贴壁,对照组不做处理,实验组分别在上下两室加入特定浓度的ClC-3通道抑制剂ClTX 1、5 μmol/L[5]及BK通道抑制剂IBTX 10、50 nmol/L[3],继续培养24 h。取出小室弃去上室内液体,4%多聚甲醛室温下固定15 min,用棉签轻轻擦去小室内面的基质胶与细胞,0.1%结晶紫避光染色10 min,200倍光学显微镜下随机选择6个视野观察并计数。每组实验重复3次。
六、统计学方法
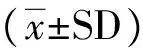
结 果
一、ClC-3与BK在胶质瘤细胞系中的表达情况
Western blot检测发现,U251及C6胶质瘤细胞系均高度表达ClC-3离子通道蛋白,BK离子通道蛋白在两种胶质瘤系中的表达相对较低,如图1所示。免疫荧光实验进一步检测证实ClC-3在 C6和U251两种胶质瘤系中均呈高表达,集中分布于细胞质和胞膜上,而BK在两种胶质瘤系中的表达均相对较低,如图2 所示。
二、应用ClC-3与BK通道阻断剂后胶质瘤细胞侵袭性的变化情况
通过Transwell侵袭实验研究ClC-3 通道特异性阻滞剂ClTX以及BK通道阻滞剂IBTX对胶质瘤细胞侵袭性的影响。U251胶质瘤细胞孵育24 h后,细胞均匀分布于Transwell小室,与对照组相比(158 17.5/视野),应用1 μmol/L ClTX后,透过小孔的U251胶质瘤细胞数目显著减少(111±11.3/视野),应用5 μmol/L ClTX后,透过小孔的U251胶质瘤细胞数目进一步减少(76 9.3/视野);而应用不同梯度浓度的IBTX后透过小孔的U251胶质瘤细胞数目虽略有下降趋势(IBTX 10 nmol/L ∶145±23.8/视野,IBTX 50 nmol/L ∶133±19.4/视野),但尚未达到统计学意义,如图3所示。此结果说明,相对BK通道,ClC-3 通道在胶质瘤侵袭性生长过程中发挥更重要的作用,抑制ClC-3 通道可有效降低胶质瘤侵袭性。
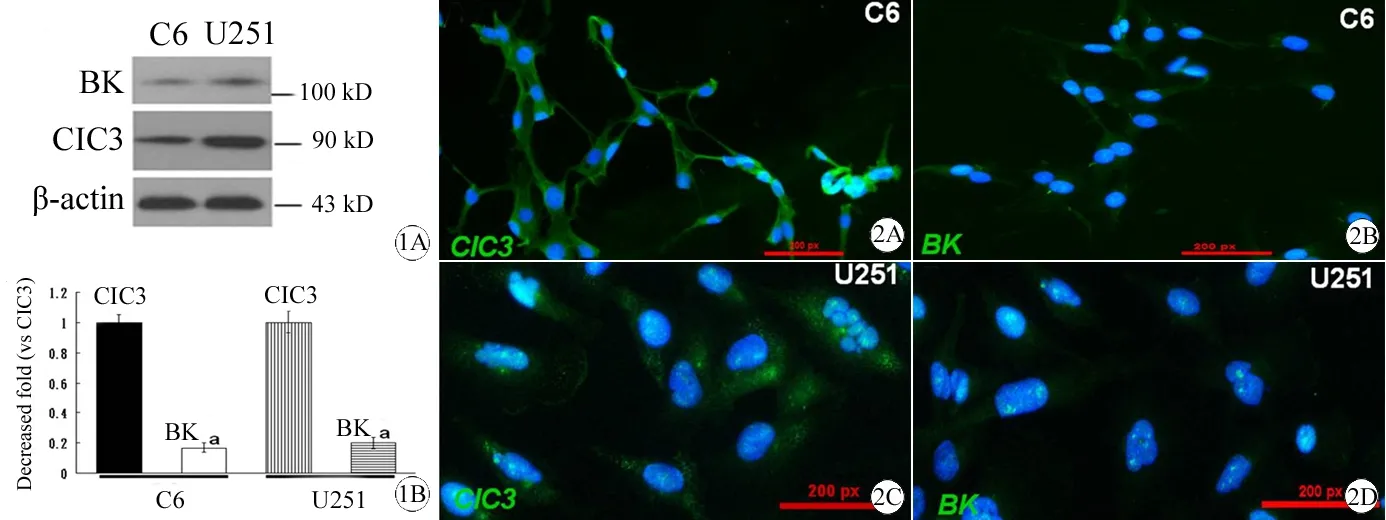
图1 ClC-3与BK在U251及C6胶质瘤细胞系中的蛋白表达情况
Fig 1 Expression of ClC-3 and BK in U251 and C6 glioma cell lines
A: Western blot for ClC-3 and BK expression in U251 and C6 cell lines; B: Statistical representation for the expression of ClC-3 and BK in U251 and C6 cell lines.
aPlt;0.05,vsClC-3 expression.
图2 ClC-3与BK在U251及C6胶质瘤细胞系中的形态分布情况
Fig 2 The morphological distribution of ClC-3 and BK in U251 and C6 glioma cell lines
A: The expression of ClC-3 in C6 cells; B: The expression of BK in C6 cells; C: The expression of ClC-3 in U251 cells; D: The expression of BK in U251 cells.
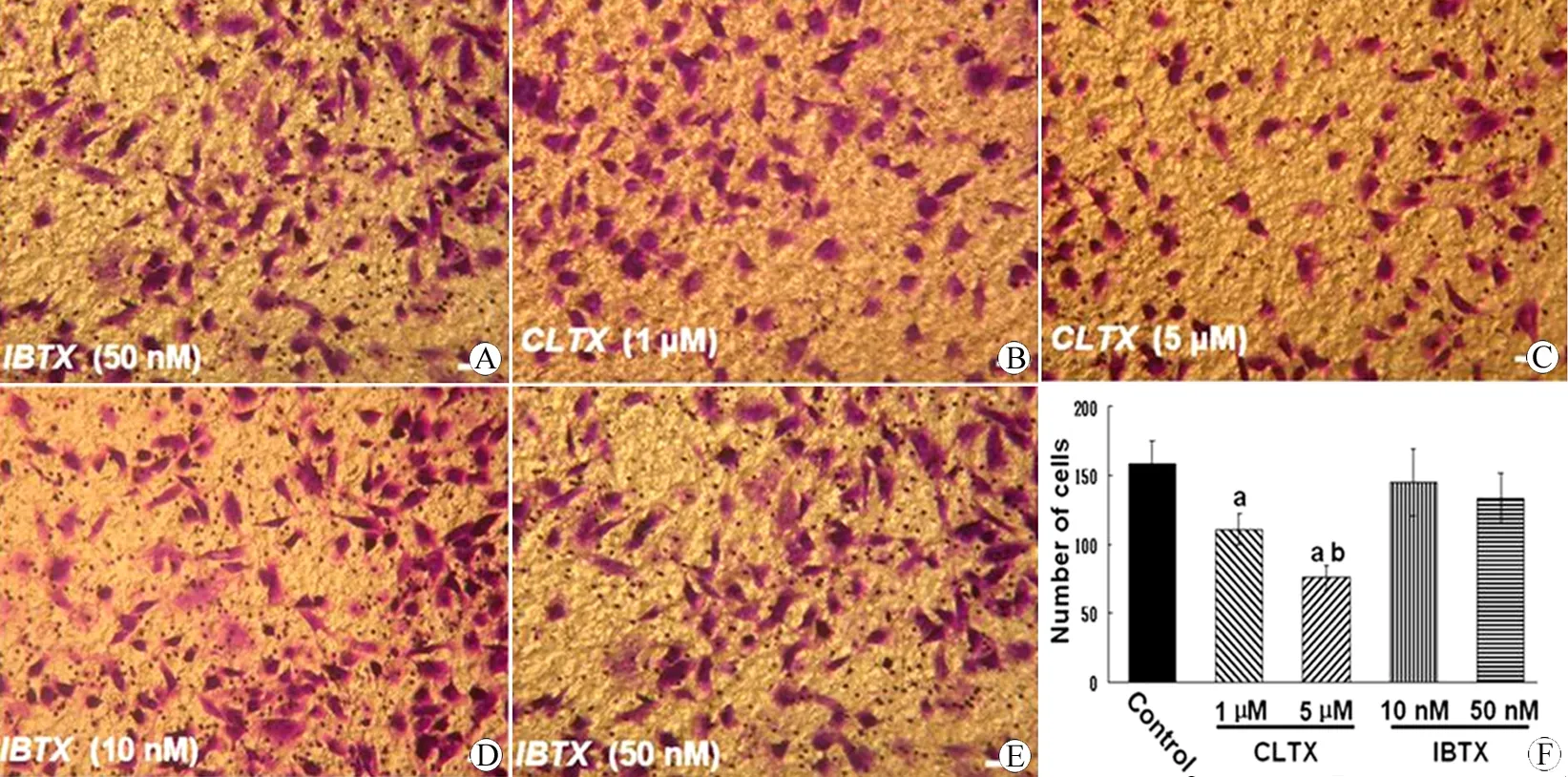
图3 应用ClC-3与BK通道阻断剂后胶质瘤细胞侵袭性的变化情况
Fig 3 The changes of glioma cells invasion after application of ClC-3 and BK channel inhibitor
A: The penetrated U251 cells in control Transwells; B: The penetrated U251 cells in ClTX (1 μM)-treated Transwells; C: The penetrated U251 cells in ClTX (5 μM)-treated Transwells; D: The penetrated U251 cells in IBTX (10 nM)-treated Transwells; E: The penetrated U251 cells in IBTX (50 nM)-treated Transwells; F: The comparison of number of penetrated cells in different groups.
aPlt;0.05, ClTX (1 μM) and ClTX (5 μM) groupvsControl group;bPlt;0.05, ClTX (5 μM) groupvsCLTX (1 μM) group.
n=6, Bar=10 μm.
讨 论
恶性胶质瘤是一种致死性极高且最为常见的原发性脑肿瘤,约占颅内肿瘤的33.3%~58.6%[6]。近年来,虽然恶性脑胶质瘤的治疗效果有一定的提高,但是中位生存期仍仅为9~12个月,5年生存期仍不能超过10%[7]。影响患者生存期的主要原因是胶质瘤在中枢神经系统呈侵袭性生长,肿瘤界限不清,使手术切除程度受限。因此,脑胶质瘤治疗的进展在很大程度上仍有赖于针对其侵袭性生长的临床治疗研究。目前认为,影响脑胶质瘤侵袭性生长的因素主要包括:胶质瘤自身的生物学特性[8],各种生长因子及其相关信号通路,血管生成[9]以及胶质瘤与机体免疫系统间的相互作用[10,11]等。尽管胶质瘤高度侵袭的生物学行为已被广泛接受,但目前大多数药物针对的是"胶质瘤侵袭微环境的变化“而不是针对具有侵袭性的胶质瘤细胞本身结构功能变化”的特异“靶点”。因此,探索和筛选针对侵袭瘤细胞本身结构功能变化特征的新靶点,将在整个恶性胶质瘤侵袭性治疗中发挥关键作用。胶质瘤细胞在侵袭周围正常脑组织时,其容积会大大缩减,形成狭窄的梭形,这有助于其在狭窄的细胞外空间中侵袭性生长,在这一过程中,会伴随着大量K+、Cl-及随之而来的水分子的流出[12],因此,介导上述溶质成分流动变化的各种离子通道在胶质瘤侵袭性生长中的作用便凸显出来。迄今为止,已经证实的与侵袭胶质瘤细胞形态变化密切相关的K+、Cl-离子通道主要为钙激活的钾离子通道(Ca2+-activated K+channels)和2,3型氯离子通道(ClC-2,ClC-3)[12~14]。
本实验中,我们主要选择BK(大电导钙激活钾离子通道)和ClC-3作为研究对象,首先观察二者在C6及U251胶质瘤细胞系的蛋白表达及形态分布情况,然后分别运用BK通道特异性阻滞剂IBTX以及ClC-3特异性阻滞剂ClTX,观察胶质瘤细胞侵袭性的变化情况。研究结果显示,U251及C6胶质瘤细胞系均高度表达ClC-3离子通道蛋白,BK离子通道蛋则表达相对较低。Transwell侵袭实验进一步证实运用ClC-3 通道特异性阻滞剂ClTX后,U251胶质瘤细胞侵袭性生长特性显著降低。上述结果表明,相对BK通道,ClC-3 通道在胶质瘤侵袭性生长过程中发挥更重要的作用,抑制ClC-3 通道可有效降低胶质瘤侵袭性。就BK通道而言,本实验结果表明其在胶质瘤细胞侵袭性生长中的作用有限,其与某些研究报道结果并不完全相符,分析原因如下:①在不同的胶质瘤细胞系中,BK通道表达及功能可能存在差异;②其它类型钙激活钾离子通道,如IK(大电导钙激活钾离子通道)[15],可能在胶质瘤细胞侵袭性生长中发挥更重要的作用,其有待我们进一步研究。总之,紧紧围绕上述侵袭相关性离子通道,探寻以它们为靶标的新型治疗策略将在恶性胶质瘤侵袭性治疗中具有重要意义。
1Huber SM. Oncochannels [J]. Cell Calcium, 2013, 53(4): 241-255.
2Lambert IH, Hoffmann EK, Pedersen SF. Cell volume regulation: physiology and pathophysiology [J]. Acta Physiol (Oxf), 2008, 194(4): 255-282.
3Weaver AK, Bomben VC, Sontheimer H. Expression and function of calcium-activated potassium channels in human glioma cells [J]. Glia, 2006, 54(3): 223-233.
4D'Amico M, Gasparoli L, Arcangeli A, et al. Potassium channels: novel emerging biomarkers and targets for therapy in cancer [J]. Recent Pat Anticancer Drug Discov, 2013, 8(1): 53-65.
5Liu VC, Lung SS, Pu JK, et al. Invasion of human glioma cells is regulated by multiple chloride channels including ClC-3 [J]. Anticancer Res, 2010, 30(11): 4515-4524.
6Preusser M, de Ribaupierre S, Wohrer A, et al. Current concepts and management of glioblastoma [J]. Ann Neurol, 2011, 70(1): 9-21.
7Arribas Alpuente L, Menendez Lopez A, Yaya Tur R. Glioblastoma: changing expectations? [J]. Clin Transl Oncol, 2011, 13(4): 240-248.
8Teodorczyk M, Martin-Villalba A. Sensing Invasion: cell surface receptors driving spreading of glioblastoma [J]. Cell Physiol, 2010, 222(1): 1-10.
9Onishi M, Ichikawa T, Kurozumi K, et al. Angiogenesis and invasion in glioma [J]. Brain Tumor Pathol, 2011, 28(1): 13-24.
10Sciume G, Santoni A, Bernardini G. Chemokines and glioma: invasion and more [J]. Neuroimmunol, 2010, 224(1-2): 8-12.
11Yi L, Xiao H, Xu M, et al. Glioma-initiating cells: a predominant role in microglia/macrophages tropism to glioma [J]. J Neuroimmunol, 2011, 232(1-2): 75-82.
12Sontheimer H. An unexpected role for ion channels in brain tumor metastasis [J]. Exp Biol Med (Maywood), 2008, 233(7): 779-791.
13Weaver AK, Olsen ML, McFerrin MB, et al. BK channels are linked to IP3-receptors via lipid rafts: a novel mechanism for coupling [Ca2+] to ion channel activation [J]. Biol Chem, 2007, 282(43): 31558-31568.
14Parkerson KA, Sontheimer H. Contribution of chloride channels to volume regulation of cortical astrocytes [J]. Am J Physiol Cell Physiol, 2003, 284(6): C1460-C1467.
15Turner KL, Honasoge A, Robert SM, et al. A Proinvasive role for the Ca21- Activated K Channel KCa3.1 in Malignant Glioma [J]. Glia, 2014, 62(6): 971-981.
TherolesofClC-3andBKionchannelingliomacellsinvasion
CAOJingzheng,LUPeigang,DONGYuan,LIBo,LIANGYuan,HAOZhenqiang,LIYuxin
DepartmentofNeurosurgery,JinanGeneralHospitalofPLA,Jinan,Shandong250031, China
ObjectiveThe expressions of voltage-gated chloride channel-3 (ClC-3 channel) and big mediate-conductance Ca2+-activated K+channel (BK channel) in glioma cells are observed and the roles of ClC-3 and BK ion channel on invasion of glioma cells are investigated.MethodsThe expressions of ClC-3 and BK ion channel in two glioma cell lines (C6 and U251) were evaluated by Western blot; immunofluorescence staining was used to detect the distribution of the two channels in C6 and U251 glioma cell lines; Transwell invasion assay was used to determine the effects of chlorotoxin (ClTX, a ClC-3 inhibitor) and iberiotoxin (IBTX, a BK inhibitor) on the invasion of the two glioma cell lines.ResultsU251 and C6 glioma cell lines were highly expressed in ClC-3 ion channel, but the expression of BK ion channel in two glioma lines was relatively lower; U251 glioma invasion was decreased significantly after the application of ClC-3 specific blocker chlorotoxin in a dose-dependent manner, but the BK channel specific blocker iberiotoxin showed no obvious effect in U251 glioma invasion.ConclusionClC-3 ion channels play an important role in the invasive growth of glioma, suggesting that ClC-3 ion channels might be a new target for the future therapy of glioma.
Glioma; ClC-3 and BK ion channel; Invasion; Targeted therapy
1671-2897(2016)15-389-04
R 739.41
A
曹敬正,硕士研究生,E-mail:cz-12345@163.com
*通讯作者: 卢培刚,主任医师,E-mail: pglu912@126.com
2015-01-04;
2015-03-20)

