多聚左旋赖氨酸对大脑皮层星形胶质细胞体外培养的影响
何玲 刘露 陈国俊
1.贵州省黔南州人民医院神经内科,贵州都匀558000;
2.重庆医科大学附属一;神经病学重点实验室,重庆400016
多聚左旋赖氨酸对大脑皮层星形胶质细胞体外培养的影响
何玲1,2刘露2陈国俊2
1.贵州省黔南州人民医院神经内科,贵州都匀558000;
2.重庆医科大学附属一;神经病学重点实验室,重庆400016
目的探讨不同浓度多聚左旋赖氨酸(PLL)对体外培养大脑皮层星形胶质细胞(AS)的影响。方法采用酶消法、差速贴壁获得大脑皮层AS细胞,细胞分为四组,分别种植于对照组(未包被PLL)、25μg/mL PLL包被组、50μg/mL PLL包被组、100μg/mL PLL包被组包被的培养瓶或板内,运用细胞计数检测细胞贴壁率及CCK检测法绘制原代细胞生长曲线;待细胞铺满瓶底,予振荡及传代法去除其他类型细胞。第三代AS,通过胶质纤维酸性蛋白(GFAP)兔疫荧光计数细胞纯度及CCK检测细胞活性。结果细胞贴壁率随PLL包被浓度的增加而增加;原代AS生长曲线显示对照组生长速度较三组PLL包被组慢;除100μg/mL PLL包被组[(90±0.53)%]外,其余各组细胞纯化率均大于95%;对照组第4、6天细胞活性均明显低于各PLL包被组,差异均有高度统计学意义(P<0.01)。结论PLL能有效地促进AS的贴壁和生长,适宜包被浓度为25~50μg/mL。
星型胶质细胞;体外培养;多聚左旋赖氨酸;免疫荧光;胶质纤维酸性蛋白
随着近年对大脑皮层星形胶质细胞(AS)的研究发现,AS以积极主动的方式参与调控突触传递,在突触重塑及学习记忆过程中起着重要的作用[1-2]。电生理技术的发展,也让人们了解到,AS存在着许多离子通道[3],与神经元之间进行着积极的双向信息交流[4]。因此,对AS的深入研究在神经退行性疾病如阿尔茨海默病中得到了进一步的重视[5-6]。多聚左旋赖氨酸(PLL)是常用的包被基质之一,可促进细胞黏附、增生、分化[7]。对体外培养AS中是否使用PLL等促细胞黏附的包被基质,以及PLL工作浓度,各文献报道差异较大,本研究比较了文献中PLL几种常用包被浓度[8-10],并通过检测细胞贴壁率、纯度、活性以进一步探讨其对体外培养AS的影响。
1 材料与方法
1.1 实验动物
新生1~3日龄斯普拉格-杜勒鼠(SD)大鼠(动物合格证号:SCXK渝:2012-0001),雌雄不限,由重庆医科大学动物实验中心提供。
1.2 仪器及试剂
CO2恒温敷箱(Thermo fisher science,美国),倒置显微镜(Olympus,日本),多功能酶标仪(Tecan,奥地利),恒温摇床振荡仪(上海天呈科技有限公司),激光扫描共聚焦显微镜(Leica,德国),荧光显微镜(Olympus,日本);DMEM高糖培养液(Gibco,美国),胎牛血清(Gibco,美国),多聚赖氨酸(Sigma,美国),Primocin(Invitrogen,美国),胶质纤维酸性蛋白(GFAP)兔抗大鼠多克隆抗体(Sigma,美国),FITC山羊抗兔二抗(北京中杉金桥生物技术有限公司),CCK-8检测试剂盒(上海酶联生物科技有限公司)。
1.3 方法
1.3.1 实验分组实验设为对照组(无PLL包被)、25μg/mL PLL包被组、50μg/m L PLL包被组、100μg/m L PLL包被组。原代前1 d将不同浓度PLL包被于25 cm2培养瓶或不同规格孔板中,次日吸出PLL放于无菌超净台备用。
1.3.2 星型胶质细胞的分离培养参照文献[11]的方法并适当改进。新生1~3日龄SD大鼠,消毒后断头取脑,剪碎脑组织,加入0.25%胰蛋白酶,37℃下消化18 min,加入含10%胎牛血清的培养基终止胰酶反应,轻轻反复吹打成细胞悬液,400目筛过滤,收集该单细胞悬液,800 r/min离心5min,按2.5×105个/mL密度接种至未涂PLL的75 cm2的培养瓶中,移入CO2敷箱,37℃、5%CO2下培养20 min[12],轻轻翻转培养瓶。吸出细胞悬液按密度1.5×105个/mL分别接种到不同浓度PLL包被的25 cm2培养瓶中。自第3天起,予15%胎牛血清培养基(含primocin 100μg/mL),每3 d换液1次,培养至9~12 d,细胞铺满瓶底,置于37℃恒温摇床中,200 r/min振荡18 h[13]。另按上述细胞接种密度接种于不同浓度PLL包被的24孔板及96孔板中。
1.3.3 台盼蓝活细胞计数检测原代各PLL包被组细胞的贴壁率培养3 d后的细胞,消化获得单细胞悬液,0.4%台盼蓝染色后计数细胞,每孔重复3次,取平均值。贴壁率=(贴壁细胞数/接种细胞数)×100%。
1.3.4 CCK检测法绘制原代细胞生长曲线初次分离的原代细胞,按密度为1×104个/孔接种于96孔板中。分别在2、4、6、8、10、12 d,加入10μL的CCK-8溶液,混匀,孵育2 h后,后用酶标仪在450 nm处扫描吸光度,记录OD450值。连续12 d于同一时间点进行观察,每组设3个复孔。
1.3.5 传代培养过夜振荡细胞予0.25%的胰酶消化,按5×104个/m L接种后放入敷箱中孵育达85%融合度后再次传代。
1.3.6 免疫荧光鉴定GFAP是AS的标志性蛋白[14],第三代AS以2.5×104个/mL接种于放有细胞爬片的24孔板中,孵育48 h,4%多聚甲醛4℃固定30min,山羊血清37℃封闭1 h,滴加一抗兔抗大鼠GFAP多抗(1∶100),4℃过夜,另设PBS代替一抗作为阴性对照。次日,1∶200山羊抗兔FITC荧光二抗,37℃避光孵育1 h,PBS冲洗3次,每次5 min,予DAPI复染细胞核3min。抗荧光淬灭液封片,激光共聚焦显微镜观察AS形态;在荧光显微镜下观察,每组各取4张爬片,每张爬片4个象限分别随机选取3个200倍视野计数,取均值,计算绿色荧光阳性细胞百分比,即AS的纯化率。
1.4 传代情况及CCK法检测不同浓度PLL包被组第三代AS细胞活性
同样用CCK法检测传至第三代各PLL包被组细胞活性,每2天检测1次,连续6 d于同一时间点进行观察,每组设3个复孔。
1.5 统计学方法
采用SPSS 19.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两组间比较采用t检验;计数资料用率表示,组间比较采用x2检验;多组间比较采用单因素方差分析;采用Student-Neuman-Keuls(SNK)法进行多重比较;以P<0.05为差异有统计学意义。
2 结果
2.1 原代细胞贴壁率
对照组细胞贴壁率[(75.15±0.07)%]显低于25μg/mLPLL包被组[(91.87±0.10)%]、50μg/mL PLL包被组[(94.44±0.07)%]、100μg/mL PLL包被组[(97.79±0.11)%],差异均有高度统计学意义(P<0.01);25μg/mL PLL包被组细胞贴壁率与50μg/mL PLL包被组比较,差异无统计学意义(P>0.05);100μg/mL PLL包被组贴壁率最高,与25μg/mL PLL包被组及50μg/mL PLL包被组比较,差异均有统计学意义(P<0.05),提示细胞贴壁率随PLL包被浓度的升高而增大。
2.2 原代培养生长情况及各组细胞生长曲线
初次分离的AS接种后24 h后即可见折光度较好的贴壁细胞,接种后4 d内生长缓慢,第6天,25μg/m L PLL包被组、50μg/mL PLL包被组、100μg/mL PLL包被组细胞进入对数生长期。而对照组在第8天左右进入对数生长期,各PLL包被组细胞生长曲线见图1。接种后8~12 d,镜下见AS呈“毛毡毯”样,处于底层,其他类型细胞呈点状分布在该层上。经摇床过夜振荡,AS与其他细胞分离,以梭状及多角形为主,细胞边缘较模糊,突起不明显。见图2。

图1 不同浓度PLL包被组AS的生长曲线
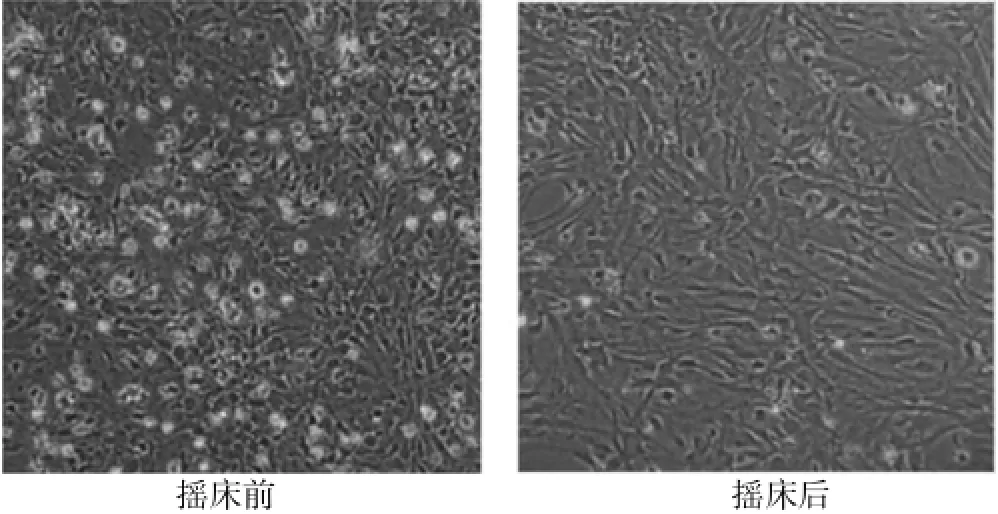
图2 普通光学显微镜下的原代星型胶质细胞(200×)
2.3 免疫荧光鉴定AS及不同浓度PLL包被组AS纯度的比较
第三代AS,倒置显微镜下可见细胞形态不规则,胞浆丰富且密度较低,核/浆比例小,胞核呈椭圆形,偏向于胞体一侧;GFAP细胞兔疫荧光法鉴定,激光共聚集显微镜下见AS胞质呈绿色荧光,核蓝染,见图3。各PLL包被组AS纯化率见图4,100μg/mL PLL包被组纯化率[(90.00±0.53)%]低于对照组[(96.00± 0.63)%]、25μg/m L PLL包被组[(97.00±0.57)%]、50μg/m L PLL包被组[(98.00±0.77)%],差异均有统计学意义(P<0.05);对照组、25μg/mL PLL包被组、50μg/mL PLL包被组AS纯化率两两比较,差异均无统计学意义(P>0.05)。
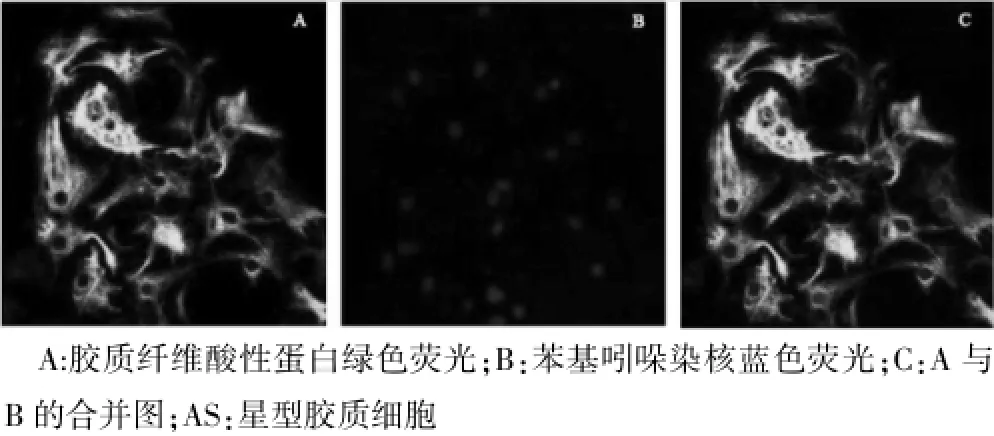
图3 AS免疫荧光染色(400×)
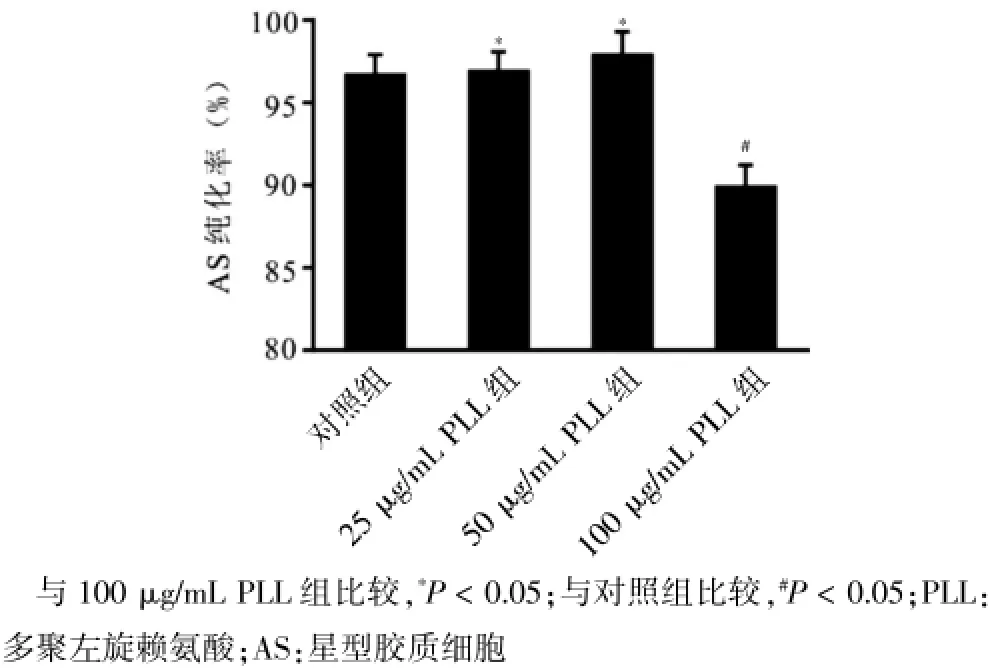
图4 不同浓度PLL包被组AS纯化率比较
2.4 AS传代情况及不同浓度PLL包被组第三代AS细胞活性
传代后细胞生长速度较原代快,第一代及第二代AS,各PLL包被组细胞均能在4 d进入对数生长期,6 d达85%~90%的融合度。传至第三代,对照组细胞贴壁后生长缓慢,各PLL包被组细胞仍保持前两代的增殖速度。各PLL包被组第三代AS在第2、4、6天活性比较见图5、表1。

图5 不同浓度PLL包被组第三代AS活性的比较
表1 不同浓度PLL包被组第三代AS活性的比较,n=3)

表1 不同浓度PLL包被组第三代AS活性的比较,n=3)
注:与对照组同期比较,*P<0.01;PLL:多聚左旋赖氨酸;AS:星型胶质细胞
组别第2天第4天第6天对照组25μg/m L PLL包被组50μg/mLPLL包被组100μg/m L PLL包被组P值0.49±0.07 0.51±0.05 0.50±0.07 0.50±0.05>0.05 0.64±0.06 0.99±0.06*1.00±0.06*1.04±0.08*<0.01 0.72±0.06 1.02±0.07*1.04±0.08*1.06±0.07*<0.01
3 讨论
体外培养AS是进行神经科学研究的基础。本实验中选取出生1~3 d的新生鼠,一方面因为出生后的神经元不再分裂,从而可减少神经元的污染[15],另一方面因出生1~3 d的新生鼠,脑沟脑回形成不明显,其脑膜及血管较易剥离。实验中尽可能剥离血管及脑膜,是减少成纤维细胞污染的关键环节[16]。
预包被PLL后,细胞贴壁率高且原代生长周期少于无PLL包被组,在8~9 d即呈“毛毡毯”样铺满底层,与文献中提到的较适宜的时间相一致[17]。原代细胞在前4 d生长缓慢,所需营养相对较少,故本实验接种血清浓度为10%,以减少对细胞贴壁的影响,3 d后第1次换液,则改为15%血清浓度培养细胞,以满足快速增殖细胞的营养。
激光共聚焦显微镜下清楚的观察到第三代AS的细胞形态,与其他文献中报道的AS形态一致[18]。通过荧光显微镜计算各PLL包被组细胞AS纯度,除100μg/mL PLL包被组外,其余三组细胞均能达95%的纯化率,其主要原因考虑为高浓度PLL让原代大脑皮层各类细胞均牢固贴壁,导致在振荡环节中,AS单层上的杂细胞不易被去除。有文献报道[19],在每次传代前均进入摇床,加速振荡及增加传代次数也可进一步去除杂细胞。
利用AS较强的增殖活性,多次传代可去除少突胶质细胞和小胶质细胞等细胞,通常用于实验的AS为传至第三代及第四代的细胞[20]。本实验研究发现,对照组细胞前2次传代,尚能保持和其他PLL包被组的传代速率,在传至第三代时,对照组细胞增殖缓慢且活性较低。因此,通过包被PLL来促进细胞早期贴壁,对传代后AS细胞活性有着重要的作用。
本研究结果表明,PLL预包被能提高AS贴壁和生长状态,其中25~50μg/mL PLL包被浓度为适宜浓度,无PLL包被可影响细胞的存活率及活性,较大浓度PLL包被可影响AS的纯化率。
[1]Chung W,Clarke LE,Wang GX,et al.Astrocytesmediate synapse elimination through MEGF10 and MERTK pathways[J].Nature,2013,504(7480):394-400.
[2]Han X,Chen M,Wang F,et al.Forebrain engraftment by human glial progenitor cells enhances synaptic plasticity and learning in adultmice[J].Cell Stem Cell,2013,12(3):342-353.
[3]D'Ascenzo M,Vairano M,Andreassi C,et al.Electrophysiological and molecular evidence of L-(Cav1),N-(Cav2.2),and R-(Cav2.3)type Ca2+channels in rat cortical astrocytes[J].Glia,2004,45(4):354-363.
[4]Dallerac G,Chever O,Rouach N.How do astrocytes shape synaptic transmission?Insights from electrophysiology[J]. Front Cell Neurosci,2013,7(159):1-19.
[5]Tian C,Zheng JC.Reprogrammed Astrocytes as a Potential therapy for neurodegenerative disorders[J].Science,2011,334(6063 Suppl):53-54.
[6]Birch AM.The contribution of astrocytes to Alzheimer's disease[J].Biochem Soc Trans,2014,42(5):1316-1320.
[7]Cai L,Lu J,Sheen V,et al.Optimal poly(L-lysine)grafting density in hydrogels for promoting neural progenitor cell functions[J].Biomacromolecules,2012,13(5):1663-1674.
[8]Ronco V,Grolla AA,Glasnov TN,et al.Differential deregulation of astrocytic calcium signalling by amyloid-β,TNF-α,IL-1βand LPS[J].Cell Calcium,2014,55(4):219-229.
[9]Ma Y,Qin P,Feng D,et al.Estrogen regulates the expression of Ndrg2 in astrocytes[J].Brain Research,2014,4(1569):1-8.
[10]Guo J,Duckles SP,Weiss JH,et al.17β-Estradiol prevents cell death and mitochondrial dysfunction by an estrogen receptor-dependentmechanism in astrocytes after oxygen-glucose deprivation/reperfusion[J].Free Radical Biology and Medicine,2012,52(11-12):2151-2160.
[11]Mccarthy KD,de Vellis J.Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue[J].JCell Biol,1980,85(3):890-902.
[12]周欣,明晓云,康颂建,等.差速贴壁技术对大鼠脑皮质星形胶质细胞纯化率的影响[J].中国组织工程研究与临床康复,2007,11(15):2829-2831.[13]Chen C,Kuo J,Wong A,etal.Estradiolmodulates translocator protein(TSPO)and steroid acute regulatory protein(StAR)via protein kinase A(PKA)signaling in hypothalamic astrocytes[J].Endocrinology,2014,155(8):2976-2985.
[14]Yang Z,Wang KK.Glial fibrillary acidic protein:from intermediate filament assembly and gliosis to neurobiomarker[J].Trends Neurosci,2015,38(6):364-374.
[15]Imura T,Kornblum HI,Sofroniew MV.The predominant neural stem cell isolated from postnatal and adult forebrain butnotearlyembryonic forebrain expressesGFAP[J]. JNeurosci,2003,23(7):2824-2832.
[16]Ullian EM,Sapperstein SK,Christopherson KS,et al. Control of synapse number by glia[J].Science,2001,291(5504):657-661.
[17]Kuo J,Hamid N,Bondar G,et al.Membrane estrogen receptors stimulate intracellular calcium release and progesterone synthesis in hypothalamic astrocytes[J].Journal of Neuroscience,2010,30(39):12 950-12 957.
[18]周曼,杨万超,刘翔,等.大鼠脑星形胶质细胞体外培养方法的改进及鉴定[J].哈尔滨医科大学学报,2014,48(2):91-94.
[19]Talia FR,Sigal FB.Protein synthesis dependent effects of kinins on astrocyte prostaglandin synthesis[J].Peptides,2010,31(4):651-656.
[20]钱腾达,张斌,刘彦,等.再程序化星形胶质细胞的制备及体外定向分化为神经元的研究[J].临床神经外科杂志,2015,12(4):256-264.
Effection of poly-L-lysine on cultures of cerebral cortical astrocytes in vitro
HE Ling1,2LU Liu2CHEN Guojun2
1.Department of Neurology,the People's Hospital of Qiannan,Guizhou Province,Duyun 558000,China;2.Key Laboratory of Neurology,the First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China
Objective To investigate the effects of different concentrations of poly-L-lysine(PLL)on the cultures of cerebra lcorticalastrocytes(AS)in vitro.M ethods Astrocytes were dissociated from cerebra lcorticeswith themethods of trypsinization and differential adherence.They were divided into four groups and respectively planted in culture flasks or plateswhich coated PLL of different concentrations:control group(non-PLL),25μg/mL PLL envelop group,50μg/mL PLL envelop group,100μg/mL PLL envelop group.Adherent rates were detected by counted number and cell growth curveswere drawn with CCK-8 colorimeter.To remove other cell types,the cellswere shaken and passaged when they were confluent in amonolay on the bottom.Puritieswere assessed by immune of luorescence analysis of glial fibrillate acidic protein(GFAP)and cell viabilitiesweremeasured by CCK-8 colorimeter in the third generation astrocytes.Results Adherent rates were increased in a dose-dependent manner.Growth curves showed that the growth speed of control group was significantly slower than three PLL envelop groups.The purities of all groups were over 95%except 100μg/mL PLL envelop group[(90.00±0.53)%].The cell activities of control group on the fourth day and the sixth day both were lower than three PLL envelop groups,the differences were statistially signifiant(P<0.01). Conclusion PLL-coated technique can effectively promote adhesion and growth of AS,and the best coated concentrations are 25-50μg/mL.
Astrocyte;In vitro;Poly-L-lysine;Immunofluorescence;Glial fibrillary acidic protein
Q 421
A
1673-7210(2016)05(a)-0004-05
2016-02-05本文编辑:任念)
国家自然科学基金资助项目(812101097)。
何玲(1979-),女,博士;研究方向:阿尔茨海默病。

