猪链球菌2、7、9型多重PCR检测方法的建立及应用
刘 琪,王 娟,周如月,甘振磊,贾爱卿,王贵平
(广东海大畜牧兽医研究院,广州 511400)
猪链球菌2、7、9型多重PCR检测方法的建立及应用
刘琪,王娟,周如月,甘振磊,贾爱卿,王贵平
(广东海大畜牧兽医研究院,广州 511400)
根据GenBank中猪链球菌(Streptococcus suis,Ss)2、7、9血清型的荚膜多糖基因簇中的斜基因序列,分别设计3对引物,在完成最佳条件筛选、特异性、敏感性试验的基础上,建立了一种快速区分猪链球菌2、7、9三种血清型的多重PCR检测方法,并对我国广东省分离鉴定的猪链球菌进行分型鉴定。结果表明,建立的多重PCR检测方法分别对猪链球菌血清2型、7型和9型扩增出特异性片段,片段大小分别是360、600、800 bp。该方法特异性良好,与副猪嗜血杆菌(Haemophilus parasuis,Hps)、多杀性巴氏杆菌(Pasteurellamultocida,Pm)、波氏杆菌(Brodetella bronchiseptica,Bb)、沙门氏菌(Salmonella,Sal)、大肠杆菌(Escherichia coli,E.coli)以及猪链球菌其他29个血清型均无交叉反应。用建立的多重PCR方法对临床分离的341株猪链球菌菌株进行血清型分型鉴定,并与传统的血清凝集分型结果进行比较,二者符合率为97.36%。与传统的血清凝集方法相比,本研究建立的PCR方法具有快速、灵敏、特异等特点,可应用于实验室的快速诊断以及猪链球菌的流行病学调查。
猪链球菌;多重PCR;血清型;鉴定
猪链球菌(Streptococcus suis,Ss)是一种重要的人畜共患病的病原,感染猪可导致脑膜炎和败血症等[1],感染人可引起脑膜炎和中毒性休克综合症等,严重的可导致人畜死亡[2]。根据荚膜多糖(capsular polysaccharide,CPS)基因抗原性的差异,猪链球菌被分为33个血清型(1~31型,1/2型和33型)[3],另有部分菌株未定型[4]。
Ss通常在猪的扁桃体定居,在致病性血清型中2型Ss的致病力最强,发病率高,流行范围广,其次是7型和9型。猪链球菌2型是一种重要的人畜共患病原菌,1998~1999年在江苏省部分地区发生流行,不仅对这些地区的养猪业造成了巨大的损失,而且引起接触病猪的从业人员发病,并造成14人死亡,因此引起国内外学者广泛关注[5]。随着集约化养殖的发展,猪链球菌感染在我国的流行不容忽视,但由于Ss血清型多,毒力因子复杂,且各毒力因子的相互作用与联系及致病机理仍未明确,目前对于该病的防治缺乏有效手段。积累流行病学资料,建立快速、敏感、特异的检测方法及制备高保护率的疫苗是当务之急。本研究建立了一种能快速鉴别猪链球菌2、7、9血清型的检测方法,为现阶段猪链球菌流行病学分析及血清学检测提供了一种有效方法。
1 材料与方法
1.1材料TSA、TSB培养基购自BD公司;DNA Maker(DL2000)、dNTPs、rTaq酶、pMD18-T载体均购自TaKaRa公司;凝胶回收试剂盒及质粒提取试剂盒购自广州速研生物科技有限公司。
1.2菌株副猪嗜血杆菌、沙门氏菌、波氏杆菌、巴氏杆菌、大肠杆菌、猪链球菌2型、7型和9型参考菌株以及341份猪链球菌菌株均由本实验室分离保存;猪链球菌2、7、9血清型阳性血清由南京农业大学兽医微生物实验室提供。
1.3引物根据GenBank中公布的猪链球菌2、7、9血清型的荚膜多糖基因序列,设计和筛选出3对引物用于建立多重PCR检测方法,分别扩增出猪链球菌血清2型、7型和9型,分别为360、600、800 bp的特异性片段,由Invitrogen(上海)公司合成。引物序列见表1。
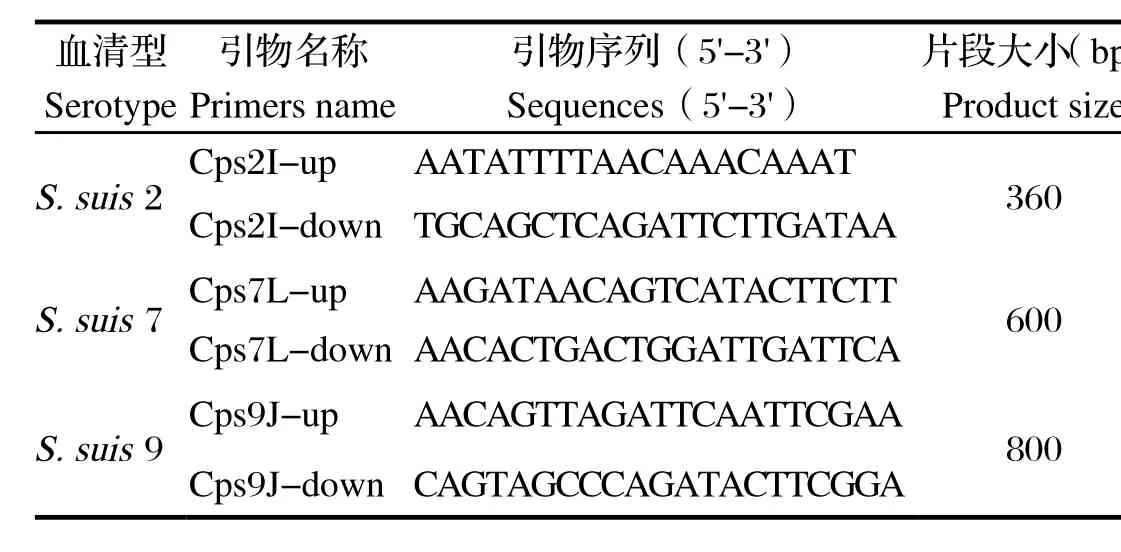
表1 多重PCR引物序列Table 1 The primers sequences for multiplex PCR
1.4多重PCR反应条件及反应体系PCR反应体系为20 μL,2型引物(5 μmol/mL)各0.4 μL、7型引物(5 μmol/mL)各0.8 μL、9型引物(3 μmol/ mL)各0.4 μL、rTaq酶0.5 μL、dNTPs(5 μmol/ mL)2μL、模板1 μL,然后加ddH2O调整至20 μL。PCR反应程序:94℃预变性10 min;94℃变性30 s,60℃退火60 s,72℃延伸90 s,35个循环后,72℃再延伸10 min。PCR扩增后的产物,用1%的琼脂糖凝胶在130V电压下电泳20 min,观察结果。
1.5PCR产物的克隆和序列的测定将扩增的PCR产物切胶后,按照Axygen凝胶回收试剂盒的说明书进行纯化回收,分别克隆至pMD18-T载体中,转化感受态细胞DH5α,选取阳性克隆重组质粒送Invitrogen公司进行序列测定。
1.6PCR方法的特异性、敏感性试验分别以猪链球菌血清1、3~6、8、10~31、33型的基因组以及副猪嗜血杆菌(Haemophilus parasuis,Hps)、巴氏杆菌(Pasteurellamultocida,Pm)、多杀性波氏杆菌(Brodetella bronchiseptica,Bb)、沙门氏菌(Salmonella,Sal)、大肠杆菌(E.coli)的菌液为模板进行多重PCR扩增,以检测该方法的特异性。分别将猪链球菌2型、7型和9型参考菌株于37℃下振荡培养16 h后,涂平板计数,计算原菌液浓度;再取100 μL原菌液加入到含900 μL PBS的1.5 mL EP管中,分别按照10倍梯度稀释9个梯度,取稀释菌液2 μL为模板,进行PCR扩增,以检测该方法的敏感性。
1.7PCR检测方法的临床应用2011~2015年,本实验室从广东省各地发病猪组织中分离鉴定猪链球菌341株。按1.4所述的方法对341份样本进行血清分型,并与血清凝集方法的分型结果进行比较分析,计算二者的符合率。
2 结果
2.1多重PCR扩增对猪链球菌血清2型、7型、9型扩增出大小约为360、600、800 bp的3条片段,均与预期目的片段大小一致,证明建立的多重PCR方法能有效鉴别猪链球菌2、7、9三种血清型(图1)

图1 猪链球菌2型、7型、9型 PCR扩增结果Fig.1 Amplifi cation of S.suis serotype 2, 7 and 9 by PCR
2.2PCR产物克隆和序列测定分别将猪链球菌2、7、9型的PCR产物克隆至pMD18-T载体中,将酶切鉴定正确的克隆质粒送Invitrogen公司进行序列测定,测序结果进行BLAST分析。与已报道的猪链球菌2、7、9血清型的荚膜多糖基因序列的同源性分别为99%~100%、99%~100%和98%~100%,证实所扩增的片段分别为猪链球菌2、7、9三个血清型的荚膜多糖基因。
2.3特异性试验分别对猪链球菌其他29个血清型的基因组以及副猪嗜血杆菌(Hps)、巴氏杆菌(Pm)、波氏杆菌(Bb)、沙门氏菌(Sal)、大肠杆菌(E.coli)为模板进行多重PCR扩增试验,结果显示以上菌株均未得到有效的扩增,阴性对照也没有出现任何条带(图2),证实该方法具有良好的特异性。

图2 多重PCR特异性试验结果Fig. 2 Specifi city test of the multiplex PCR
2.4敏感性试验结果证实,该方法对猪链球菌2型的最低检出限为5 CFU(图3),7型最低检出限4 CFU(图4),9型最低检出限为3 CFU(图5)。

图3 多重PCR对血清2型猪链球菌敏感性试验结果Fig. 3 Sensitivity test of the multiplex PCR to S.suis serotype 2

图4 多重PCR对血清7型猪链球菌敏感性试验结果Fig. 4 Sensitivity test of the multiplex PCR to S.suis serotype 7
2.7PCR检测方法的临床应用本研究采用已建立的多重PCR方法,对2011~2015年分离纯化的341份猪链球菌阳性样本进行了多重PCR分型鉴定。结果显示,2型菌株46株,7型菌株17株,9型菌株16株,分别占总样本数的13.5%、5.0%和4.7%(图6)。

图6 多重PCR临床样本检测结果Fig. 6 The detection results of S.suis in clinical samples by multiplex PCR
血清凝集检测结果显示,2型菌株为42株,7型菌株为16株,9型菌株为16株,分别占样本数的12.3%、4.7%和4.7%,与建立的多重PCR方法比较,血清2型、7型和9型的符合率分别为98.83%、99.12%、99.41%。在总的样本数中,3种血清型的PCR分型结果与血清凝集结果的符合率为97.36%(表2)。

表2 多重PCR方法与血清凝集检测符合率比较Table 2 The coincidence rate of mPCR and serum agglutination for serotyping S.suis
3 讨论
猪链球菌病是一种常见的猪传染病,世界各国均有发生,也是一直困扰我国养猪业的重要传染病之一。猪链球菌据其荚膜多糖抗原差异,至少有34个血清型(1~31、33、1/2)[6,7]。但主要以2型、7型、9型的致病力最强,其中2型不仅可引起猪关节炎、脑膜炎、败血症、心内膜炎及关节脓肿,而且还可感染人并致死,是一种重要的人畜共患病病原。1998~1999年夏季,在我国江苏省部分地区猪群中爆发流行Ss2,导致相关从业人员感染致死[8,9]。2005年再度在四川省爆发Ss2感染,并导致人员死亡[9]。近来,也出现了人感染9型和31型链球菌的相关报道[10,11]。7型链球菌虽然没有相关感染人致死的报道,但是由于其具有潜在的危害性,也应该加以诊断[12-14]。为了更好的了解猪链球菌2型、7型和9型菌株的流行病学情况,建立一种快速准确的检测分型方法非常必要。
本研究建立的多重PCR方法,可同时检测猪链球菌2、7、9型,经验证该方法具有较好的特异性和敏感性。传统的猪链球菌分型方法为血清凝集,阳性血清制备较为困难和复杂[15,16],血清型之间容易出现交叉反应,而商品化的标准阳性血清价格昂贵,一般实验室无力购买,同时临床上许多链球菌菌株有自凝现象[17,18],大大影响了结果的判断。本研究建立的多重PCR方法与传统的血清凝集分型结果比较发现,二者的符合率为97.36%,且PCR方法更加灵敏、快速、操作简单,价格低廉,避免了菌株自凝现象对结果的影响,常规实验室均可进行,因此更适合于临床中大样本的使用[19]。
本研究为猪链球菌的检验检疫、流行病学研究和病原传播、控制研究提供了有效方法,对防止疫情扩散和维护国内外贸易的正常秩序有较大的现实意义和应用价值。同时,该多重PCR方法的建立为更好地了解临床上2、7、9型猪链球菌的流行情况,预防控制这3种病原菌的传播与流行奠定了基础。
[1] Baums C G, Verkuhlen G J, Rehm T, et al. Prevalence of Streptococcus suis Genotypes in wild boars of Northwestern Germany[J]. Appl Environ Microbiol, 2007, 73(3): 711-717.
[2] Arends J P, Zanen H C. Meningitis caused by Streptococcus suis in humans[J]. Rev Infect Dis, 1988, 10(1): 131-137.
[3] Hill J E, Gottschalk M, Brousse A U R, et al. Biochemical analysis, cpn60 and 16S-rDNA sequence data indicate that Streptococcus suis serotypes 32 and 34, isolated from pigs, are Streptococcus orisratti[J]. Vet Microbiol, 2005, 107(1-2): 63-69.
[4] 陆承平. 兽医微生物学[M]. 4版. 北京: 中国农业出版社, 2007: 91-92.
[5] 姚火春, 陈国强, 陆承平. 猪链球菌1998分离株病原特性鉴定[J]. 南京农业大学学报, 1999, 22(2): 67-70.
[6] Staats J J, Feder I, Okwumabua O, et al. Streptococcus suis: past and present[J]. Vet Res Commun, 1997, 21(6): 381-407.
[7] 姜艳华, 孙乾, 王楷宬, 等. 猪链球菌35个血清型标准抗血清的制备及应用[J]. 中国动物检疫, 2008, 25(9): 19-21.
[8] 何家惠, 王继春, 林继煌. 猪链球菌2型-人畜共患病新病原菌的研究概况[J]. 畜牧与兽医, 2001, 33(4): 38-40.
[9] 刘伦皓, 罗湘蜀, 杨长虹, 等. 2005-2009年四川省法定传染病网络直报质量评价[J]. 预防医学情报杂志, 2011, 27(3): 193-196.
[10] Kerdsin A, Hatronqjit R, Gottschalk M, et al. Emergence of Streptococcus suis serotype 9 infection in humans[J]. J Microbiol Immunol Infect, 2015. pii: S1684-1182(15)00822-1.
[11] Hatronqjit R, Kerdsin A, Gottschalk M, et al. First human case report of sepsis due to infection with Streptococcus suis serotype 31 in Thailand[J]. BMC Infect Dis, 2015, 15: 392.
[12] Unterweger C, Baums C G, Höcher M, et al. Clinical situation, diagnosis and prevention of a Streptococcus suis serotype 7 problem on a farm[J]. Berl Munch Tierarztl Wochenschr, 2014, 127(5-6): 194-201.
[13] Dong W, Ma J, Zhu Y, et al. Virulence genotyping and population analysis of Streptococcus suis serotype 2 Isolates fron China[J]. Infect Genet Evol, 2015, 36: 483-489.
[14] 马清霞, 何孔旺, 陆承平. 猪链球菌2型及其毒力因子检测多重PCR的建立[J]. 中国兽医学报, 2006, 26(1): 28-31.
[15] 王蓉蓉, 孙卫东, 蒋蔚, 等. 猪链球菌2型主要毒力因子三重荧光定量PCR检测方法的建立[J]. 中国动物传染病学报, 2014, 22(6): 25-31.
[16] 朱静, 张锦海, 胡丹, 等. 高致病性猪链球菌2型多重实时荧光定量PCR检测方法的建立[J]. 中国病原生物学杂志, 2012, (5): 325-328.
[17] 孙洋, 刘军, 郭学军, 等. 荧光实时定量PCR方法检测猪链球菌2型[J]. 中国兽医学报, 2008, (1): 55-57.
[18] 马清霞, 何孔旺, 陆承平. 猪链球菌病双重PCR诊断方法的建立[J]. 中国兽医科学, 2007, 37(8): 700-704.
[19] Nutraconq T, Anqkititrakul S, Jiwakanon N, et al. Identification of major Streptococcus suis serotype 2, 7, 8 and 9 isolated from pig and humans in upper northeastern Thailand[J]. SoutheastAsian J Trop Med Public Health, 2014, 45(5): 1173-1181.
DEVELOPMENT AND UTILIZATION OF A MULTIPLE PCR ASSAY FOR IDENTIFICATION OF SEROTYPES 2, 7 AND 9 OF STREPTOCOCCUS SUIS
LIU Qi, WANG Juan, ZHOU Ru-yue, GAN Zhen-lei, JIA Ai-qing, WANG Gui-ping
(Guangdong Haid Institute of Animal Husbandry & Veterinary, Guangzhou 511400, China)
Three pairs of primers were designed for development of a multiple PCR assay according to the sequences of capsular polysaccharide synthesis loci of Streptococcus suis serotypes 2, 7 and 9 published in GenBank. The clinical isolates of Streptococcus suis obtained from Guangdong province were used to test the specifi city, sensibility and stability of the multiple PCR. The results showed this multiple PCR identifi ed serotypes 2, 7 and 9. The specifi c PCR fragments for serotypes 2, 7 and 9 were 360, 600 bp and 800 bp, respectively. Specifi city of the multiple PCR was determined using the clinical isolates of Haemophilus parasuis, Pasteurella multocida, Brodetella bronchiseptica, Salmonella, Escherichia coli and reference strains of other 29 serotypes of Streptococcus suis. Total 341 clinical isolates of serotypes 2, 7 and 9 of Streptococcus suis were tested using the multiple PCR and traditional serum agglutination and the agreement of these two methods was 97.36%. As compared with the traditional method, the multiplex PCR assay developed in this study was a rapid, sensitive and specifi c method, therefore it was suitable for the diseases surveillance and epidemiological diagnosis of Streptococcus suis.
Streptococcus suis; multiple PCR; serotype; identifi cation
S852.611
A
1674-6422(2016)03-0035-06
2015-12-25
农业部行业公益性专项项目(201303041)
刘琪,男,动物医学专业
贾爱卿,E-mail:aiqingjia1123@sohu.com

