马源抗犬瘟热病毒免疫球蛋白的制备
严 妍,张锦霞,王东方,郑光来,张守峰,扈荣良
(1. 吉林农业大学动物科学技术学院,长春 130118;2. 军事医学科学院军事兽医研究所 吉林省人兽共患病预防与控制重点实验室,长春 130122)
马源抗犬瘟热病毒免疫球蛋白的制备
严妍1,2,张锦霞2,王东方1,2,郑光来2,张守峰2,扈荣良2
(1. 吉林农业大学动物科学技术学院,长春 130118;2. 军事医学科学院军事兽医研究所 吉林省人兽共患病预防与控制重点实验室,长春 130122)
将犬瘟热病毒(Canine distemper virus,CDV)疫苗株接种Vero细胞,连续培养至TCID50为10-4.625/mL。采用肋间肌多点注射方法免疫马,4周后每2周采集血液,分离血清,病毒中和试验测定血清中中和抗体效价,最高值达到212.5。以硫酸铵沉淀法纯化IgG,病毒中和试验测定其中和抗体效价可达214。通过肌注犬观察,无明显不良反应。研究结果证明,本试验制备的马源免疫球蛋白可用于犬的抗体治疗,为犬瘟热的治疗制剂研发开辟了新方向。
犬瘟热病毒;纯化;免疫球蛋白;马
犬瘟热(canine distemper,CD)是由犬瘟热病毒(Canine distemper virus,CDV)感染动物引起的致死性全身性疾病,危害严重。CDV主要通过发病动物的带毒排泄物经呼吸道感染,通过淋巴系统迅速传播[1],引起严重的免疫抑制从而引起疾病。部分动物出现神经症状(包括行为的改变、肌肉抽搐和痉挛),感染后可能长期散毒。CDV对食肉动物普遍易感[2]。不同感染动物临床症状严重程度差异很大,在某些物种能引起严重的全身性疾病从而导致死亡。
犬瘟热可以通过免疫接种预防,常用疫苗包括五联苗或六联苗等弱毒活疫苗或灭活疫苗[3]。目前尚无特效的药物治疗方法,临床上可采用皮下注射高免血清[4]或单克隆抗体治疗。高免血清多为犬源血清,制备过程需宰杀免疫犬,而单克隆抗体价格昂贵且供应量不足。本实验室通过用犬瘟热病毒免疫马获得异源高免血清并经传统方法纯化,可为犬瘟热治疗制剂的制备和生产提供新的途径。
1 材料和方法
1.1毒株和细胞CDV疫苗株3株、Vero细胞为本实验室保存;细胞培养基为含 5%胎牛血清(购自FBS)的DMEM(购自Gibco公司)。
1.2病毒TCID50测定使用Vero细胞在96孔细胞培养板中进行,结果按Käber法计算[5]。
1.3抗CDV血清制备健康马2匹,两侧肋间肌多点注射接种CDV病毒细胞培养物(104.625TCID50/0.1mL),80 mL/匹,每周免疫1次,连续免疫4周后,从第6周开始颈静脉采血,每2周采集1次,每次采集3 L。采集的血液样品,4℃过夜后,7000 ×g离心20 min分离血清。
1.4抗CDV血清中和抗体效价的测定在96孔微型培养板中加入100μL 5% DMEM培养基,将待测血清56℃灭活30 min后,吸取50μL待测血清加入第1列孔内,进行倍比稀释,设立4个重复,6个梯度。每孔加入100 TCID50CDV(50μL),37℃中和1 h后,每孔加20 000个(50μL)Vero细胞,继续培养48 h,观察细胞病变情况。设立正常Vero细胞为阴性对照,阳性对照为接毒Vero细胞。
1.5硫酸铵沉淀法粗纯化血清IgG按文献[6]的方法适当改进。400 mL血清中加入等体积生理盐水溶液,边搅拌边逐滴加入2倍体积的饱和硫酸铵溶液,4℃静置90 min后,4℃、5000 ×g离心30 min,弃上清,保留沉淀。沉淀重新溶于400 mL生理盐水溶液,边搅拌边滴加1/2体积饱和硫酸铵溶液,4℃静置90 min,4℃、5000 ×g离心30 min,弃上清,保留沉淀,重复此步骤2次。将沉淀溶于100 mL生理盐水溶液中,放入透析袋中于生理盐水中充分透析。
1.6纯化IgG中和抗体效价的测定方法同步骤1.4。
1.7SDS-PAGE 凝胶电泳分析纯化的IgG用SDSPAGE鉴定其纯度[7]。
1.8IgG安全性实验健康3月龄比格犬5只,每只犬肌注两倍剂量[8](2 mL)纯化免疫球蛋白,观察1周。
2 结果
2.1病毒培养病毒接种于Vero细胞中,48 h细胞开始出现典型病变(图1),细胞大量融合,产生颗粒样变性、空泡。72 h后细胞逐渐脱落。
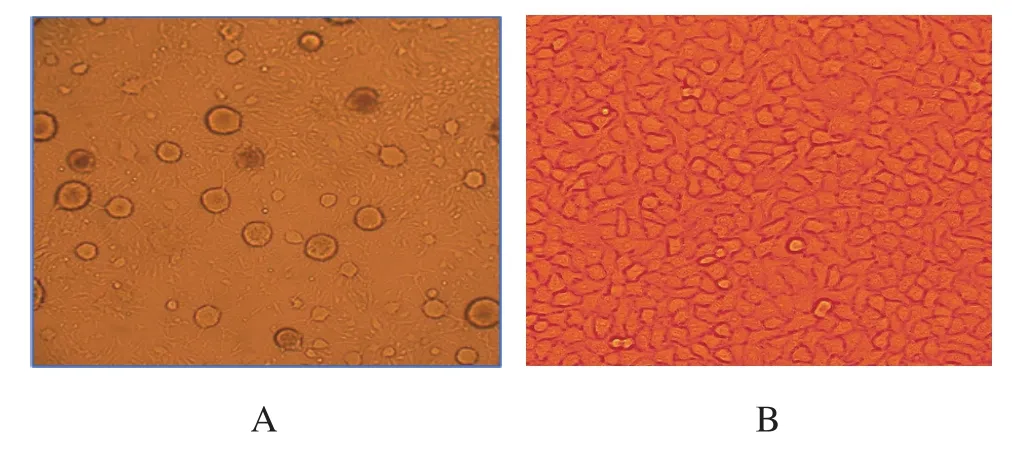
图1 犬瘟热病毒在Vero细胞中的培养结果Fig. 1 Culture results of Canine distemper virus in Vero cells
2.2病毒TCID50测定病毒连续培养至第9代,按Käber法计算病毒滴度,CDV病毒最高滴度为TCID50=10-4.625/mL。
2.3抗CDV血清中和抗体效价的测定马抗CDV血清中和抗体效价最高为212.5/mL,表明以CDV免疫制备的马血清能够有效中和CDV,具备纯化应用条件。
2.4纯化IgG中和抗体效价的测定病毒中和试验测定粗提IgG中和抗体效价最高为214/mL,表明粗提的免疫球蛋白能够有效中和CDV。
2.5SDS-PAGE 凝胶电泳分析将盐析法纯化的免疫球蛋白与蛋白A提取IgG相比较,结果显示两种方法获得的免疫球蛋白纯度均较高,白蛋白去除比较彻底,电泳均呈现清晰的重链和轻链条带[9](图2)。

图2 纯化IgG的SDS-PAGE检测Fig. 2 Identifi cation of purifi ed IgG by SDS-PAGE
2.6IgG安全性实验结果对5只健康比格犬肌注IgG后1周内,注射部位无红肿、发热、明显压痛等炎症反应。所有受试犬均未出现发热、寒战、食欲减退等不良反应,皮肤未出现过敏症状。结果表明单次肌注该免疫球蛋白不会引起犬的过敏反应,对犬是安全的,可以用于犬的犬瘟热治疗。
3 讨论
犬瘟热是由CDV感染引起的一种致死性的全身性疾病。CDV可引起幼小动物的高死亡率[10]。目前小动物通过疫苗可以预防犬瘟热,但是没有可行有效地药物治疗方法。本实验将测定滴度为TCID50=10-4.625/mL的CDV免疫马,在马体内免疫反应良好,能持续稳定产生一定水平的抗体。制备的抗CDV血清中和抗体效价最高可达212.5,该滴度血清可以达到治疗犬瘟热的效果。
本研究最初选用市售国产五联苗和进口三联苗进行免疫,由单次免疫1支疫苗增加到单次免疫3支,但均未有抗体产生或抗体水平很低。原因可能是疫苗在保存过程中,病毒逐渐失活,实际免疫效率有所降低。疫苗中病毒含量无法定量,很难确定免疫毒量,选用细胞培养物可精确计算免疫毒量,利于后期实验结果评价。本研究所得细胞培养物病毒滴度高,成本低廉,可刺激机体产生高水平抗体,并且持续稳定,具有广阔的发展前景。
马源血清对于犬来说属于异源蛋白,多次注射可能引起机体过敏反应。本研究获得的IgG效价较高,单次注射即可能实现对犬瘟热病情的控制,这在一定程度上避免了多次注射可能引起的不良反应,对比格犬进行肌注试验,结果显示该免疫球蛋白安全性良好,对犬是安全适用的。
分离纯化通常采用综合技术,其中盐析沉淀法常用于IgG粗制品的提取。蛋白质在不同浓度的盐溶液中相对溶解度不同,血清免疫球蛋白主要为γ-球蛋白,在一定浓度中性盐溶液中易于沉淀,而其他蛋白质组分不易沉淀,通过离心可将两者分离。经硫酸铵沉淀法粗提所得到的IgG,病毒中和试验测定其中和抗体效价可达214,此效价的IgG可有效中和犬瘟热病毒,达到预期的治疗效果,对犬进行了免疫治疗,结果也比较理想。鉴于异源蛋白仍存在导致不良反应的风险,后续研究中将进一步进行IgG抗体Fc片段的切除,并进行高度纯化,以期获得高质量的马源抗犬瘟热病毒免疫球蛋白。
[1] Ludlow M, Rennick L J, Nambulli S, et al. Using the ferret model to study morbillivirus entry, spread,transmission and cross-species infection[J]. Curr Opin Virol, 2014, 4: 15-23.
[2] Gavier Widén D, Meredith A, Duff J P, et al. Infectious diseases of wild mammals and birds in Europe[M]. Blackwell Publishing Ltd, 2012: 101-105.
[3] 孔庆波. 犬瘟热免疫预防研究进展[J]. 动物医学进展, 2007, 28(6): 69-75.
[4] 王允海, 张久贵, 于永军. 犬瘟热免疫血清制备和防治应用研究[J]. 黑龙江畜牧兽医, 1993, (2): 28.
[5] 殷震, 刘景华. 动物病毒学[M]. 北京: 科学出版社, 1997: 329-331.
[6] 刘生杰, 朱茂英, 顾士彬, 等. 免疫球蛋白 G(IgG)三种提取方法比较[J]. 畜牧兽医科学, 2007, 23(11): 38-43.
[7] 陶钧辉, 陶力, 李俊, 等. 生物化学实验[M]. 3版. 北京: 科学技术出版社, 2005, 4: 110-114.
[8] 王建梅, 杨娇, 罗继芬, 等. 抗犬瘟热高免卵黄抗体的制备及效价的检测[J]. 石河子大学学报(自然科学版), 2012, 30(3): 327-332.
[9] McKinney M M, Parkinson A. A simple, non-chromatographic procedure to purify immunoglobulins from serum and ascites fluid[J]. J Immunol Methods, 1987, 96(2): 271-278.
[10] Gregers-Jensen L, Agger J F, Hammer A S, et al. Associations between biosecurity and outbreaks of canine distemper on Danish mink farms in 2012-2013[J]. Acta Vet Scand, 2015, (57): 66.
PREPARATION OF HORSE IMMUNOGLOBULINS AGAINST CANINE DISTEMPER VIRUS
YAN Yan1,2, ZHANG Jin-xia2, WANG Dong-fang1,2, Zheng Guang-lai2, ZHANG Shou-feng2, HU Rong-liang2
(1. College of Animal Science and Technology, Jilin Agriculture University, Changchun 130118, China; 2.Key Laboratory of Jilin Province for ZoonosisPrevention and Control, Military Veterinary Research Institute, Academy of Military Medical Sciences, Changchun 130122,China)
In the present study, the antiserum containing neutralizing antibodies produced in horses provided a feasible treatment for canine distemper. Production of Canine distemper viruses (CDVs) were conducted by inoculating and passaging the commercial CDV vaccine onto Vero cells until the virus titers reached to TCID50of 10-4.625/mL. Four weeks after immunization of horses with CDVs, antiserum samples were obtained and afterwards harvested every two weeks. The immunoglobulins (IgGs) were purifi ed by ammonium sulfate precipitation. The pure IgGs were titrated to be 1:214as measured for virus neutralizing activity. Five Beagle dogs were injected with the IgG preparation and no side-effects were observed, indicating its safety for canines.
Canine distemper virus; purifi cation; immunoglobulin; horse
S852.659.5
A
1674-6422(2016)03-0012-04
2016-01-20
新型动物疫病诊断技术应用研究(201203056)
严妍,女,硕士研究生,预防兽医学专业
扈荣良,E-mail:ronglianghu@hotmail.com

