不同种源流苏幼苗的耐热性评价1)
欧阳敦君 张鸽香
(南京林业大学,南京,210037)
不同种源流苏幼苗的耐热性评价1)
欧阳敦君 张鸽香
(南京林业大学,南京,210037)
以山东青州、山西运城和河南安阳3个种源地的流苏1年生实生苗为试材,比较不同种源流苏幼苗的耐热能力,设置25、30、35、40 ℃等温度梯度各胁迫10 d,测定热害指数、叶片含水量、游离脯氨酸质量分数、丙二醛质量摩尔浓度、超氧化物歧化酶活性等指标。结果表明:随着温度升高,3个种源流苏幼苗的热害指数、游离脯氨酸质量分数、丙二醛质量摩尔浓度和超氧化物歧化酶活性增加,叶片含水量减少,丙二醛质量摩尔浓度和超氧化物歧化酶活性在40 ℃胁迫后下降。河南种源的流苏幼苗经过40 ℃胁迫后热害指数最小,游离脯氨酸质量分数、叶片含水量和丙二醛质量摩尔浓度变化幅度最小,超氧化物歧化酶活性在不同温度胁迫中均高于山东和山西种源。应用Fuzzy方法,对不同种源高温胁迫过程中的生理生化指标进行综合评价,得到不同种源流苏幼苗耐高温能力从大到小依次为河南种源、山西种源、山东种源。
不同种源;流苏幼苗;耐热性;综合评价
In order to study the heat resistance of differentChionanthusretususprovenances, with 1-year potted oldC.retususseedlings of Qingzhou Shandong, Yuncheng Shanxi and Anyang Henan in 25, 30, 35 and 40 ℃ stress for 10 d, we observed the changes of heat injury index, leaf water content, free proline content, malondialdehyde content (MDA) and superoxide dismutas activity (SOD) after high temperature stress, respectively. During the development of heat stress, heat injury index, free proline content, MDA and SOD were enhanced, and leaf water content was decreased in the three provenances. The MDA content and activities of SOD were increased at the beginning of stress conditions but decreased at the end of the heat stress. Compared with Shanxi and Shandong provenances, Henan provenances had the ability to maintain physiological and biochemical indexes, changed smoothly, and had greater activities of SOD. Using fuzzy synthetic evaluation of physiological and biochemical indexes, the level of heat tolerance among the three provenances was decreased in the descending order of Henan provenance, Shanxi provenance, and Shandong provenance.
流苏(Chionanthusretusus)是木犀科流苏树属(Chionanthus),落叶灌木或乔木,广泛分布于我国黄河中下游及其以南地区,是国家二级保护植物[1]。流苏树形高大优美,枝叶茂盛,初夏时满树白花,如覆霜盖雪,清丽宜人,是优良的园林观赏树种[2]。它生长速度较慢,寿命长,抗性较强,是优良的盐碱地和工矿区绿化树种[3]。同时,该植物具有较高的药用价值和经济价值[4-6]。
全球气温变暖,持续的高温不但影响农作物生产,还波及城市园林绿地系统的健康发展。流苏一般生长在稀疏混交林、灌丛或向阳的山坡、河边等,将其用于城市绿化的引种驯化栽培必然会面临高温等环境因子的制约。因此,开展流苏高温胁迫的研究具有十分重要的意义。迄今为止,国内外有关流苏的研究主要集中在繁殖方法[7]、所含化学物质成分的分析[8-9]、抗病虫害能力[10]、群落生长环境[11-12]和耐盐[13]、耐阴[14]方面,有关流苏耐高温能力的研究还存在空白。本试验以山东青州、山西运城和河南安阳的1年生流苏实生苗为材料,研究高温胁迫下其形态和生理生化指标的变化情况,探讨不同高温条件下3个种源地幼苗的耐热性差异,为城市园林绿化筛选优良的抗高温树种提供依据。
1 材料与方法
1.1 材料
供试材料选用山东青州、山西运城和河南安阳的1年生流苏实生苗,于2015年4月份移栽于南京林业大学园林实验中心。盆栽土壤含水量为69.75%、pH=6.97,主要有机质N、P、K的质量分数分别为103、64、71 mg·kg-1。2015年7月份选择生长一致、无病虫害的流苏幼苗开始处理。
1.2 方法
设置25(对照)、30、35、40 ℃ 4个温度梯度,每个种源3次重复,共36个处理;每个处理15盆,均放入人工气候箱。各处理采用阶段变温,昼夜温差为7 ℃。昼(7:00—19:00)温度维持在25 ℃,夜(19:00—7:00)温度维持在18 ℃。每个温度持续时间均为10 d,空气相对湿度为70%。光照度为3 000 lx。处理前,通过控制浇水使盆中土壤湿度基本保持一致;试验中,每天晚上补充水分,保持盆土湿润。每2 d观察1次,记录其外观形态特征变化,取植株上部第4—第6叶序的叶片进行各项生理指标的测定。
1.3 指标测定
热害指数参照尹贤贵[15]的方法,将高温伤害程度分级为0级:无热伤害症状;1级:叶片变黑;2级:叶片变黄;3级:2片叶枯死;4级:2片叶以上枯死;5级:整株枯死。通过公式计算热害指数。
热害指数=(各级株数×级数)÷(最高级数×
总株数)×100%。
(1)
生理生化指标参照李合生[16]的方法,叶片含水量采用称量法,游离脯氨酸质量分数用酸性茚三酮法测定;丙二醛质量摩尔浓度采用硫代巴比妥酸显色法测定;超氧化物歧化酶活性测定用四唑氮蓝法测定。
1.4 数据统计与分析
试验数据采用Excel2013和SPSS13.0进行统计、分析。采用隶属函数法[17]对测定的各项指标进行综合评价,将每个种源各指标的隶属度的平均值作为种源耐热能力综合评判标准,进行比较。对与耐热性呈正相关的参数采用式(2)计算。
U(Xijk)=(Xijk-Xkmin)/(Xkmax-Xkmin)。
(2)
式中:U(Xijk)为第i个种源第j个温度胁迫阶段第k项指标隶属度,且U(Xijk)∈[0,1];Xijk表示第i个种源第j个温度胁迫阶段第k个指标测定值;Xkmax、Xkmin为所有参试种源中第k项指标的最大值和最小值。对与耐热性呈负相关的参数采用式(3)计算。
U(Xijk)=1-(Xijk-Xkmin)/(Xkmax-Xkmin)。
(3)
2 结果与分析
2.1 高温胁迫对不同种源幼苗流苏热害指数的影响
当植株遭受高温胁迫时,植株的外部形态会产生一系列显著变化。对多数植物而言,叶片失绿变黄乃至枯萎是高温热害的主要症状。随着温度升高,处理时间增加,流苏幼苗受害程度加剧。30 ℃处理时,流苏幼苗均长势良好,与对照相比无明显热害症状的变化。35 ℃胁迫处理时,山东种源在第2天叶面出现黄斑,山西和河南种源则在第4天和第6天叶面相继出现黄斑;第10天时,山东种源部分萎蔫的叶片枯死;山西和河南种源均是叶片边缘和叶片尖端开始变黄。40 ℃处理时,山东种源第2天就有少量植株死亡,到第8天时,死亡率接近50%;山西种源则在第4天时出现植株死亡,而河南种源受害程度较轻。
由表1知,不同种源在35和40 ℃处理水平间的热害程度(级)、热害指数、萎蔫枯死率均达显著水平(p<0.05)。高于30 ℃时,温度和时间与流苏幼苗的热害指数呈正相关,山西和山东种源的热害指数上升趋势基本一致,河南种源上升较缓。可知,河南种源最耐热,山西次之,山东最差。

表1 不同种源流苏幼苗热害指数测定结果
注:表中数值为平均值±标准差。
2.2 高温胁迫对不同种源流苏幼苗生理生化指标的影响
2.2.1 对叶片含水量的影响
由表2可知,3个种源在不同水平处理后,叶片含水量显著下降。30和35 ℃处理时,3个种源的叶片含水量,随时间的延长变化幅度不大。40 ℃处理的3个种源叶片含水量显著低于对照组,且3个种源地之间亦差异极显著(p<0.01),河南种源含水量最大,山西次之,山东最小,下降幅度分别为29.20%,57.11%,64.67%。河南种源的含水量在不同高温胁迫处理时始终保持最大,其余两个种源叶片含水量较为接近,说明河南种源的含水量较高且失水率较慢。
2.2.2 对游离脯氨酸质量分数的影响
从表3可知,高温胁迫时,流苏幼苗游离脯氨酸质量分数显著增加,且温度越高,增加的幅度越大。这说明高温能促使流苏幼苗游离脯氨酸的积累,且胁迫程度越大,积累量越多。与对照相比,30 ℃处理的流苏幼苗游离脯氨酸的质量分数均无明显变化。35 ℃时,游离脯氨酸的质量分数均呈上升的趋势。在40 ℃处理时,山东、山西种源游离脯氨酸质量分数先增加后减少,第8天达到最大值,分别为对照的5.346倍和4.76倍;河南种源游离脯氨酸的质量分数呈持续增长趋势,最终为对照的3.65倍,且3个种源在40 ℃温度胁迫下差异均达到极显著水平(p<0.01)。

表2 不同种源流苏幼苗叶片相对含水量
注:表中数值为平均值±标准差。
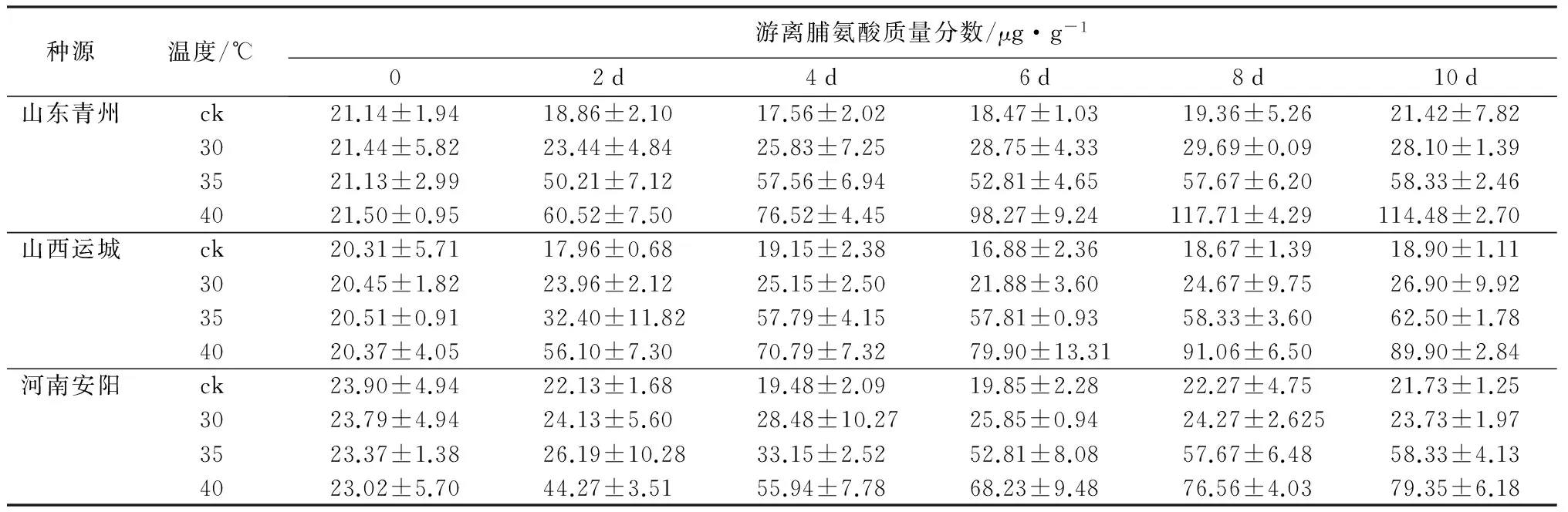
表3 不同种源流苏幼苗游离脯氨酸质量分数
注:表中数值为平均值±标准差。
2.2.3 对丙二醛质量摩尔浓度的影响
由表4可知,随着温度的增加,流苏幼苗3个种源的丙二醛的质量摩尔浓度变化不尽相同。在30 ℃时,3个种源丙二醛质量摩尔浓度均偏低,上升幅度小,说明各种源在高温胁迫程度较低时,细胞膜脂过氧化对胁迫的响应一致。在35 ℃处理的过程中,3个种源的丙二醛质量摩尔浓度呈先升高后降低的趋势,各种源到达峰值的时间不尽相同。山东种源在第2天达到最大值,为对照的1.44倍,山西和河南相继在第4天和第6天达到最大值,分别为对照的1.47和1.30倍。在40 ℃胁迫时,3个种源亦均呈先升后降的趋势,各种源之间的差异也达到显著水平(p<0.05)。相较于对照,山东、山西种源的下降幅度为55.66%、25.95%,河南种源上升了9.61%。河南种源的升降幅度比较平稳,说明河南种源细胞膜脂过氧化受到的破坏较小。
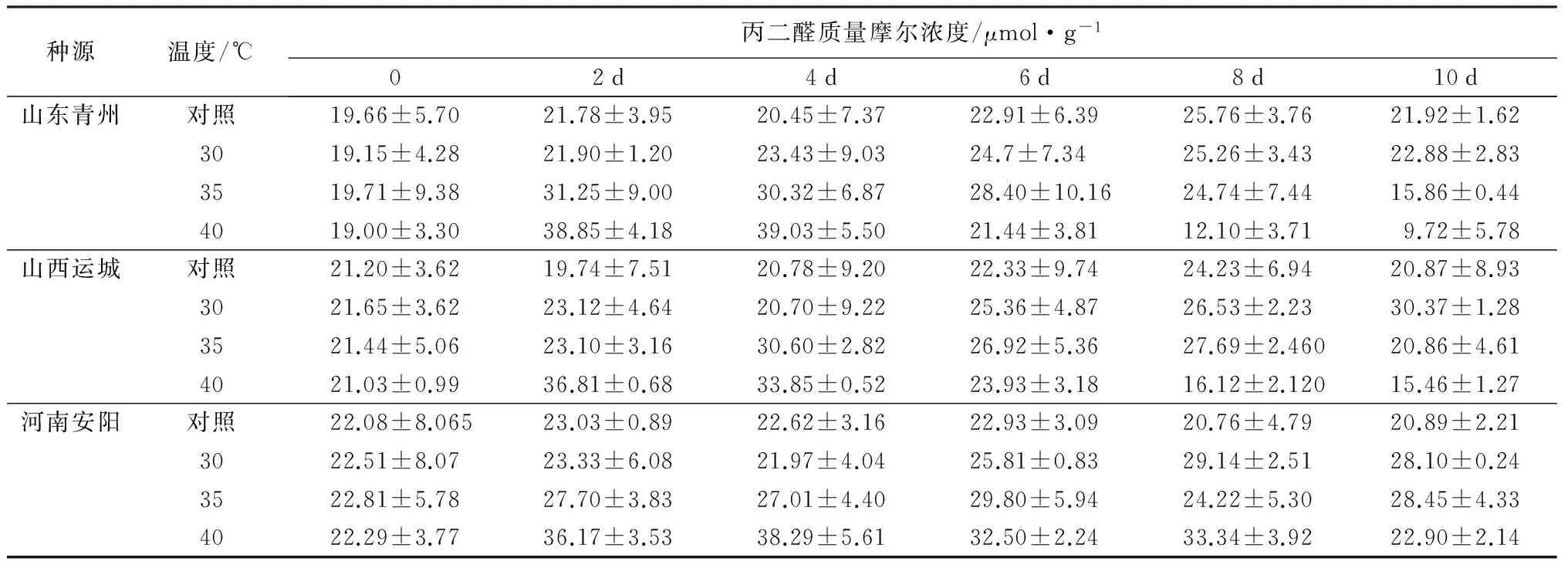
表4 不同种源流苏幼苗丙二醛质量摩尔浓度
注:表中数值为平均值±标准差。
2.2.4 对超氧化物歧化酶活性的影响
从表5可以得出,流苏幼苗3个种源随着温度的升高,超氧化物歧化酶活性随着高温胁迫的发展差异显著。30 ℃处理与对照相比,各种源超氧化物歧化酶活性变化幅度不大。在35 ℃处理时,不同种源超氧化物歧化酶活性均呈上升的趋势,说明3个种源对于高温的适应能力较为相似。40 ℃时,山东和山西种源超氧化物歧化酶活性变化随着高温胁迫的发展均呈现先升高后降低的基本势态,与对照相比,下降幅度分别为42.96%和23.82%,河南种源持续上升,升高了43.23%,各种源间差异显著(p<0.05)。3个种源地之间,山西种源的适应高温胁迫的能力次于河南种源,而山东种源表现最差。
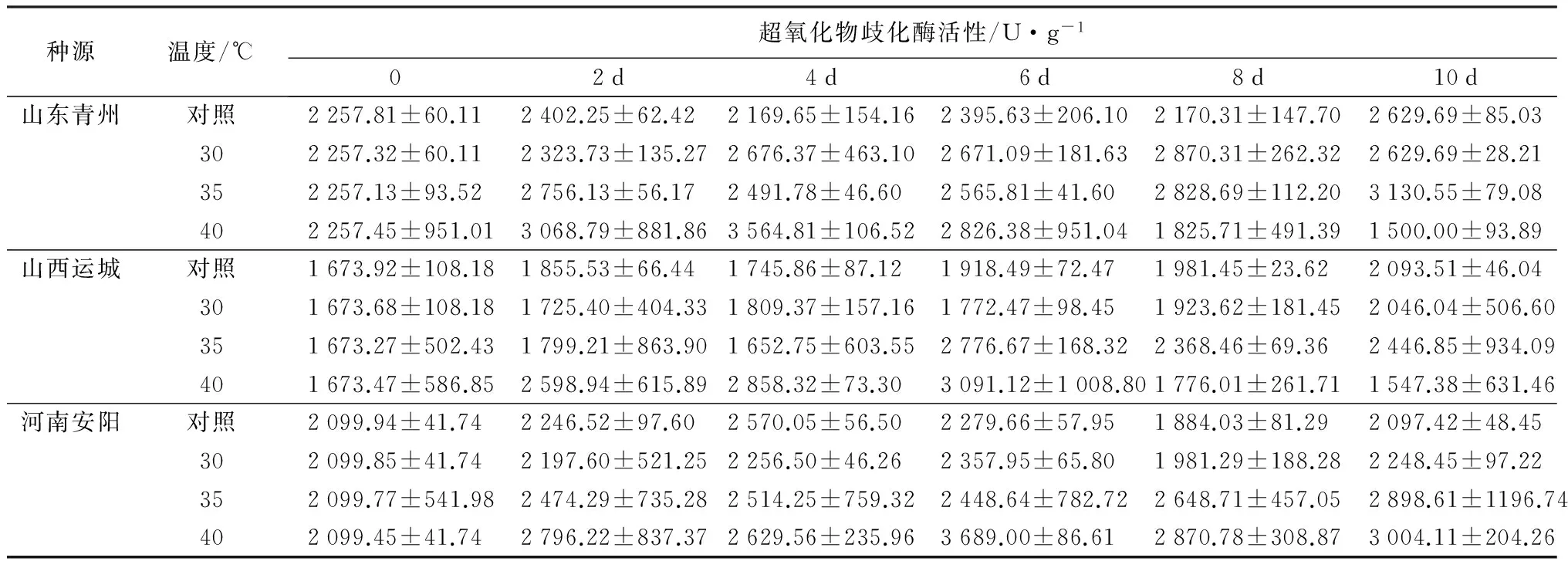
表5 不同种源流苏幼苗超氧化物歧化酶活性
注:表中数值为平均值±标准差。
2.3 不同种源流苏幼苗抗高温能力综合评定
采用隶属函数法评价流苏3个种源的耐热性,对各指标隶属函数值进行累加求其平均值。对与耐热性呈正相关的游离脯氨酸质量分数、丙二醛质量摩尔浓度和超氧化物歧化酶活性采用公式(2)计算,对与耐热性呈负相关的叶片含水量采用公式(3)计算。表6中评定序号显示,各种源耐热性由强到弱依次为河南种源、山西种源、山东种源。结合热害指数和热害的形态特征,认为综合评价的结果是合理的。

表6 不同种源耐热特性综合评定
注:表中数值为平均值±标准差。
3 结论与讨论
在高温胁迫下,热害指数可以反映高温胁迫对植物生长的综合伤害程度。3个种源地的热害指数随着温度的升高呈现增加的趋势,这与吴有根等[18]人研究菊花的耐热性结果一致。水分参与植物体内的各种代谢活动,不同温度的胁迫均会使植物体内的水分受到影响。植物在逆境胁迫下的水分含量变化直接反应了植物体的生存状态和抗逆性能。3个种源流苏幼苗的叶片含水量随着胁迫温度的升高和处理时间的延长而逐渐下降,这与杨舒婷等[19]在研究弗吉尼亚栎幼苗对高温胁迫的生理响应的结果一致。
在渗透调节物质中,游离脯氨酸是植物抵御逆境胁迫的重要调节机制[20]。当植物处于逆境中时,体内会积累大量的游离脯氨酸,以增强植物的抗逆性[21]。本试验中,各种源地随着胁迫时间的延长,叶片中的游离脯氨酸的质量分数均会提高,且呈线性增长趋势,与杨雨华等[22]研究高温胁迫对杜仲幼苗部分生理指标的影响结果一致。这表明流苏幼苗在面临不同的高温胁迫时,均会以增加游离脯氨酸质量分数的方式度过不利环境,防止细胞脱水。但在40 ℃时,山东和山西两个种源游离脯氨酸质量分数均在第8天之后略微下降,说明当胁迫超出了种源的忍耐范围,游离脯氨酸的抗逆机制就会遭到破坏,进一步说明不同种源忍耐高温胁迫的能力是有限的。而40 ℃也可能是山东和山西种源忍耐高温的临界值。
丙二醛质量摩尔浓度和超氧化物歧化酶活性都是评价植物抗逆性的指标。丙二醛是磷脂中不饱和脂肪酸过氧化的产物,可以反映细胞膜透性和受损伤的程度[23]。丙二醛的质量分数越高,说明质膜受损越严重[24]。超氧化物歧化酶能催化过氧阴离子,有助于抑制活性氧的积累,消除植物体在新陈代谢过程中产生的有害物质。在适度逆境诱导下,超氧化物歧化酶活性增加以保护植物细胞不受损害[25]。在胁迫实验中,超氧化物歧化酶活性一般随胁迫增加而增加,或者是先增后降的趋势[26]。本研究中,在30 ℃时,3个种源丙二醛质量分数和超氧化物歧化酶活性变化幅度小,说明植物受损伤较小。35 ℃处理时,3个种源的丙二醛质量摩尔浓度和超氧化物歧化酶活性随时间的增加先升后降,说明植株细胞膜和抗氧化酶系统受到一定的伤害,但通过自身的调节能够逐渐适应环境。当胁迫温度达到40 ℃时,3个种源的丙二醛质量摩尔浓度和超氧化物歧化酶活性明显下降,表明40 ℃胁迫温度加重了3个种源的膜脂过氧化程度,对植株造成了不可逆的伤害。河南种源的丙二醛质量摩尔浓度在40 ℃时升降幅度较平稳,说明植株通过自身代谢对高温胁迫形成了一定的抗逆性,使得植株受胁迫的程度得以缓和,且丙二醛的质量摩尔浓度降低到接近处理前水平,进一步说明河南种源对高温具有良好的适应性。这与曾德静等[27]研究高温胁迫对海州常山形态和生理特性的影响结果一致。河南种源的超氧化物歧化酶活性亦在第6天达到最大值,之后保持在最大值的水平,说明河南种源适应了40 ℃的高温的胁迫。
综上所述,结合高温胁迫过程中流苏幼苗的各指标变化得出,随着温度的升高,游离脯氨酸质量分数不断增加,丙二醛质量摩尔浓度和超氧化物歧化酶活性先升后降。所以,游离脯氨酸质量分数、丙二醛质量摩尔浓度和超氧化物歧化酶活性比较直观地反映3个种源的耐热性差异,可作为筛选流苏种源耐热性的直观指标。本研究使用隶属函数综合评判的方法,测定的7个参数经过综合评价,确认3个种源的耐热性从大到小依次为河南安阳种源、山西运城种源、山东青州种源。这比单个参数分析更能反映不同种源对高温环境的适应能力,亦证明了游离脯氨酸质量分数、丙二醛质量摩尔浓度和超氧化物歧化酶活性作为筛选指标的可靠性。此外,本研究对不同试验处理后的流苏幼苗在常规温度下进行了2个月的栽培观察,40 ℃胁迫的山东和山西种源没有恢复生长,说明40 ℃给其造成致命伤害,进一步确认了综合评价得出的结论是真实可靠的。
[1] 张美珍,邱莲卿,缪柏茂.中国植物志:第61卷[M].北京:科学出版社,1992.
[2] 谢建军.流苏树[J].天津农林科技,2009(4):82.
[3] 杨玉梅,胡江.流苏树的繁殖栽培与园林应用[J].山东林业科技,2005,35(1):56.
[4] 胡世才.优良饮料植物:流苏树及其枝叶泡制法[J].林业科技开发,1991,5(3):16.
[5] 刘与明,黄全能.常见园林植物·乔木[M].福州:福建科学技术出版社,2014.
[6] BOYER L, BAGHDIKIAN B, BUN S S, et al. Chionanthus virginicus L.: phytochemical analysis and quality control of herbal drug and herbal preparations[J]. Natural Product Communications,2011,6(6):753-758.
[7] 时军霞.不同浓度IBA和NAA处理流苏树茎段对扦插生根的影响[J].山东农业科学,2011(9):55-56.
[8] JUNG J W, SEO K H, OH E J, et al. Isolation and identification of triterpenoids and sterols from the flowers of chionanthus retusus lindl. & paxton[J]. Journal of Applied Biological Chemistry,2015,58(3):237-240.
[9] 邓瑞雪,张创峰,刘普,等.流苏花黄酮类化学成分的分离鉴定[J].食品科学,2014,35(1):74-78.
[10] CIPOLLINI D, RIGSBY C M. Incidence of infestation and larval success of emerald ash borer (agrilus planipennis) on white fringetree (chionanthus virginicus), chinese fringetree (chionanthus retusus), and devilwood (osmanthusa mericanus)[J]. Environmental Entomology,2015,44(5):1375-1383.
[11] SONG J, KONG M, HONG S, et al. Morphological characteristics, distribution and taxonomic consideration of Chionanthus retusus Lindl. & Paxton in Korea[J]. Korean Journal of Plant Taxonomy,2011,41(2):156-163.
[12] KIM Y. Analysis on the growth environment of chionanthusretusus community at the wansanchielbong in jeonju[J]. Journal of Korean Institute of Traditional Landscape Architecture,2010,28(4):85-97.
[13] 姚琳,张钢.NaCl胁迫下流苏的电阻抗与电导分析[J].林业科学,2011,47(12):60-68.
[14] 缴丽莉,索相敏,路丙社,等.遮光对青榨槭和流苏生长与叶片解剖结构的影响[J].河北农业科学,2013,17(6):32-35.
[15] 尹贤贵,罗庆熙,王文强,等.番茄耐热性鉴定方法研究[J]. 西南农业学报,2001,14(2):62-65.
[16] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[17] 卢纹岱.SPSS for Windows统计分析[M].北京:电子工业出版社,2000.
[18] 吴友根,林尤奋,李绍鹏,等.热胁迫下菊花生理变化及其耐热性指标的确定[J].江苏农业学报,2009,25(2):362-365.
[19] 杨舒婷,曲博,李谦盛,等.弗吉尼亚栎幼苗对高温胁迫的生理响应[J].江西农业大学学报,2015,37(1):90-95.
[20] DEKOV I, TSONEY T, YORDANOY I. Effects of water stress and high-temperature stress on the structure and activity of photosynthetic apparatus of zea mays and helianthus annuus[J]. Photosynthetica,2001,38(3):361-366.
[21] CUI L, LI J, FAN Y, et al. High temperature effects on photosynthesis, PSII functionality and antioxidant activity of two Festuca arundinacea cultivars with different heat susceptibility[J]. Botanical Studies,2006,47(1):61-69.
[22] 杨雨华,宗建伟,王健胜,等.高温胁迫对杜仲幼苗部分生理指标的影响[J].东北林业大学学报,2015,43(3):14-17.
[23] KAUSHAL N, GUPTA K, BHANDHARI K, et al. Proline induces heat tolerance in chickpea (CicerarietinumL.) plants by protecting vital enzymes of carbon and antioxidative metabolism[J]. Physiology and Molecular Biology of Plants,2011,17(3):203-213.
[24] WAHID A, GELANI S, ASHRAF M, et al. Heat tolerance in plants: An overview[J]. Environmental and Experimental Botany,2007,61(3):199-223.
[25] YUAN Y, QIAN H M, YU Y D, et al. Thermotolerance and antioxidant response induced by heat acclimation in Freesia seedlings[J]. Acta Physiologiae Plantarum,2011,33(3):1001-1009.
[26] 任安芝,高玉葆,刘爽.青菜幼苗体内几种保护酶的活性对Pb、Cd、Cr胁迫的反应研究[J].应用生态学报,2002,13(4):510-512.
[27] 曾德静,王铖,刘军,等.高温胁迫对海州常山形态和生理特性的影响[J].东北林业大学学报,2013,41(3):90-94.
Heat Resistance Evaluation of Different Provenances ofChionanthusretusus//
Ouyang Dunjun, Zhang Gexiang
(Nanjing Forestry University, Nanjing 210037, P. R. China)//Journal of Northeast Forestry University,2016,44(10):17-21.
Different provenance;Chionanthusretususseedlings; Heat resistance; Fuzzy synthetic evaluation
1)国家林业局“948”项目(2014-4-17)。
欧阳敦君,女,1991年11月生,南京林业大学风景园林学院,硕士研究生。E-mail:609859386@qq.com。
张鸽香,南京林业大学风景园林学院,副教授。E-mail:nld_zhang@njfu.com.cn。
2016年3月2日。
S718.43
责任编辑:戴芳天。

