杨树二氢黄酮醇-4-还原酶基因(DFR)的克隆及反义表达对儿茶素合成的影响1)
左涛 赵树堂 卢孟柱 孙爱东 王延伟 贺伟
(北京林业大学,北京,100083) (中国林业科学研究院林业研究所) (北京林业大学)
杨树二氢黄酮醇-4-还原酶基因(DFR)的克隆及反义表达对儿茶素合成的影响1)
左涛 赵树堂 卢孟柱 孙爱东 王延伟 贺伟
(北京林业大学,北京,100083) (中国林业科学研究院林业研究所) (北京林业大学)
为了验证二氢黄酮醇-4-还原酶基因(DFR)在杨树上的功能,明确DFR对抗病物质儿茶素合成的影响,利用抗病基因防治树木溃疡病提供候选基因。以接种欧美杨细菌性溃疡病菌后6 d的一年生中林46杨树苗干的树皮为材料, 利用RT-PCR技术克隆DFR基因的ORF序列, 并构建DFR的反义表达载体anti-pBI121-DFR。 采用农杆菌介导叶盘法转化84K杨, 获得了转反义DFR基因的84K杨4株。 用高效液相色谱法检测转基因植株叶片中的儿茶素质量分数,结果显示, 4株转反义DFR株其内源儿茶素质量分数分别为0.97、2.4、1.6和0.87 ng/g, 与84K野生型植株中儿茶素质量分数(8.9 ng/g)相比显著降低。上述结果表明DFR基因参与了杨树类黄酮生物合成途径,该基因与儿茶素的合成有关。
类黄酮;二氢黄酮醇-4-还原酶基因;反义表达载体;儿茶素
类黄酮(flavonoids)是一类重要的次生代谢物,广泛存在于整个植物界中。其功能涉及多种生物过程,如抵御紫外线、防御病原体和害虫、保持花粉活力、调节生长素运输等。二氢黄酮醇-4-还原酶(DFR)是类黄酮物质形成步骤中的一个关键酶,可将二氢黄酮醇还原为无色花色素,而无色花色素是儿茶素合成的前体。作为类黄酮代谢下游途径的酶,DFR对植物体内儿茶素合成积累起到重要作用[1]。Stafford et al[2]利用粗酶液中的DFR将二氢黄酮醇转变成无色花色素,后者进一步在无色花色素还原酶(LAR)的催化下转变成儿茶素。在对茶树的研究中发现DFR/LAR两步反应是催化儿茶酸和儿茶素形成的关键步骤,而DFR是限速步骤[2-3]。研究表明,不同茶树品种叶片发育过程中,DFR基因的表达量与总儿茶素积累量显著相关[4]。对不同茶树品种间与儿茶素合成相关的多种酶差异表达的结果显示,只有DFR和LAR基因的表达量与茶树总儿茶素质量分数呈一定的相关性[5]。体外测试儿茶素对草生欧文氏杆菌、枯草芽孢杆菌和苏云金芽孢杆菌的抑制效果,结果发现儿茶素对3种细菌均具有较强的抑制作用[6]。
84K杨是银白杨和腺毛杨(Populusalba×Populusglandulosa)杂种无性系,其抗逆性强、木材材质好、苗期生长迅速且容易生根,现已逐渐成为杨树基因工程中较为理想的受体树种。转化OsNHX1抗盐基因的研究表明,转基因84K杨能在高盐条件下正常生长[7]。李科友等[8]将CryIAc和API双价抗虫基因导入84K杨中,饲喂结果表明杨扇舟蛾幼虫的死亡率高达60%~80%。在转化抗寒基因PtFAD2和PtFAD3的研究中,转基因84K杨能在低温条件下保持较高的存活率[9]。
随着基因表达调控技术的快速发展,反义基因的转化在植物的研究中取得了显著进展。有报道将反义基因ACS导入番茄中,成功抑制了ACC合成酶的活性,使蕃茄果实中乙烯的含量被抑制了99.5%[10]。将反义的3—羟基—黄烷酮基因导入康乃馨后,其转基因植株花色逐渐变淡[11]。向毛白杨中转入反义的抗坏血酸过氧化物酶基因后,其体内的过氧化物积累量大幅升高,同时抗氧化物质的含量均低于野生型对照[12]。研究结果表明,反义基因转入植物后,会抑制相应基因的表达,使植物的生理、表型等发生变化[11]。
欧美杨细菌性溃疡病是2006年在河南濮阳、山东兖州等地的林地中观察到的一种侵害欧美杨的新型病害,其病原菌为Lonsdaleaquercinasubsp.populi[13],对多数欧美杨品种均能致病,包括目前生产上广泛栽培的中林46杨(Populus×euramericanacv.‘Zhonglin 46’)和107杨(P.×euramericanacv.‘74/76’)。感病树木受害后树皮开裂,从裂缝中流出大量汁液,枝干局部皮层坏死,耗损树木养分,严重影响到树木的生长,甚至引起杨树整株死亡[14]。对于该杨树病害,目前生产上尚无有效的防治方法。培育抗病品种是防治树木细菌性病害最根本、有效的途径之一,因而开展抗病相关基因的功能研究以加速林木抗病育种尤为重要。
在本课题组前期的研究中,发现中林46杨在受欧美杨溃疡病病原细菌侵染后的前6天杨树DFR基因表达上调[15]。这一结果表明DFR基因受到病原菌的诱导,且可能与抗病性有关,但其在抗病中的功能未经验证。先前杨树中的研究表明,DFR基因是儿茶素合成途径的上游基因[16]。若能利用转基因的方法,证明杨树中DFR基因与儿茶素的质量分数有关,可为利用抗病基因进行抗病分子育种提供候选基因。为此,本研究克隆了易感杨树中林46杨DFR基因并构建其反义表达载体,利用转基因技术转化84K杨,在验证反义的DFR基因插入到84K杨的基因组后,用HPLC法测定其相应的表达产物儿茶素的量,确定反义转基因植株的生理变化,为研究DFR基因在儿茶素合成中的功能提供科学依据。
1 材料与方法
从107杨病树组织中分离得到欧美杨细菌性溃疡病致病菌株L.quercinaN-5-1,保存于北京林业大学森林病理实验室。采集生长于河南濮阳的经此溃疡病菌菌株接种后第6天的一年生中林46杨树树干接种点的树皮组织,共3株,每株取4个接种点,接种点距地面高度分别约为170、140、110、80 cm,树皮大小为长2 cm、宽1 cm,取下的树皮用液氮速冻后-80 ℃保存备用。84K杨组培苗由中国林业科学研究院林木遗传育种国家重点实验室提供。pBI121质粒和根癌农杆菌菌株LBA4404由北京林业大学树木生长发育生化机理研究室提供。
1.1 RNA提取和cDNA合成
提取接种后第6天的中林46杨树树皮,采用RNA试剂盒改良法提取总RNA[17]。cDNA第一链合成按照Invitrogen公司生产的反转录试剂盒Superscript III Reverse Transcriptase合成cDNA的说明书进行,RNA取2 μg,反转录体系为20 μL。
1.2 DFR基因的克隆
根据 Phytozome数据库(http://www.phytozome.net/)中公布的毛果杨二氢黄酮醇-4-还原酶基因(DFR)(登录号:Potri.005G229500)序列,用特异引物[18]:
PrDFR-F:5’-GCGAGCTCGATGGGAACAGAAGCTGAAAC-3’
SacI
PrDFR-R:5’-GCGGATCCGTGGAACAATCAGGACGCAG-3’
BamHI
以中林46杨树皮cDNA为模板,进行PCR扩增,反应体系为50 μL,包括Prime STAR HS DNA Polymerase 0.5 μL,5×Prime STAR Buffer(Mg2+)10 μL,dNTP Mixture 4 μL,cDNA 1 μL(稀释100倍),上游、下游引物(10 μmol/L)各1 μL,ddH2O 32.5 μL。DFR反应条件为:94 ℃预变性5 min;94 ℃变性30 s;56 ℃退火30 s;72 ℃延伸2 min,35个循环;72 ℃延伸7 min。反应结束后,取全部反应产物于0.8%琼脂糖凝胶电泳检测扩增产物,并按照天根生化科技(北京)有限公司生产的琼脂糖凝胶DNA回收试剂盒说明书,对PCR产物进行回收,将回收后的目的片段DFR与pGEM-T(Progema)载体进行连接。取连接产物转化由天根生化科技(北京)有限公司生产的大肠杆菌Top10感受态细胞,在含100 mg/L氨苄青霉素的LB培养基上进行蓝白斑筛选。挑选阳性单克隆菌落振荡培养至浑浊,将菌液做PCR扩增鉴定阳性克隆后,送于上海英潍捷基生物公司测序。利用DNAMAN软件对克隆得到的DFR基因序列和Phytozome中公布的毛果杨DFR基因序列进行比对。
1.3 DFR反义序列载体构建
用SacI和BamHI内切酶酶切pBI121载体和pGEM-T载体上的DFR片段,将DFR片段和pBI121载体连接,16 ℃反应12 h,构建植物反义表达载体,并经菌落PCR和测序鉴定。
1.4 植物表达载体转入农杆菌
先制备农杆菌LBA4404感受态[19],用冻融法[20]将反义表达载体转化农杆菌LBA4404感受态细胞,在含有利福平50 mg/L、链霉素100 mg/L、卡那霉素50 mg/L的YEB培养基上28 ℃培养48 h,菌落PCR验证后,得到转基因工程菌。
1.5 农杆菌介导的84K杨转化及抗性植株的获得
将组培4~5周的84K杨幼嫩叶片剪下并划出伤口,在预培养基上预培养12~16 h。采用农杆菌介导法侵染84K杨叶片[21-22],侵染后的植物叶盘暗培养3 d,之后将叶盘放入筛选培养基,用质量浓度为200 mg/L的特美汀抑菌、50 mg/L的卡那霉素筛选,在25 ℃、光周期为15.5/8.5 h的组培室培养。25~30 d后分化出不定芽,待不定芽长到2 cm左右时剪下不定芽,放入含有特美汀质量浓度为200 mg/L、卡那霉素质量浓度为50 mg/L的生根培养基中,在25 ℃、光周期为15.5/8.5 h的组培室中培养,直到不定芽长出根,形成完整的抗性植株。
1.6 转基因植株的普通PCR检测
按照天根生化科技(北京)有限公司生产植物基因组DNA提取试剂盒的说明书,对转基因84K杨叶片的基因组DNA进行提取,以CaMV 35S和目的片段设计引物(dfrF:5’-TGACGCACAATCCCACTATC-3’和dfrR:5’-GCAATCAATGCCACCAAGTC-3’)。
反应条件为:95 ℃预变性3 min;95 ℃变性30 s;60 ℃退火30 s;72 ℃延伸1 min;35个循环;72 ℃延伸5 min。反应体系为25 μL,包括模板1 μL,上游、下游引物各1 μL(10 μmol/L),2×PCR Taq Mix 12.5 μL,ddH2O 9.5 μL。PCR产物用0.8%琼脂糖凝胶电泳检测。
1.7 转基因植株的qRT-PCR检测
分别提取转基因和野生型84K杨叶片中的总RNA。以84K转基因植株DFR的3’UTR和ORF序列设计引物,qRT-PCR引物(qDFRF:5’-GCAAAGAAAATGAAGTGGTCCC-3’和qDFRR:5’-GGCCATTAAGTGGGCAATAAT-3’)。
采用宝生物工程(大连)有限公司的SYBR Premix Ex Taq实时定量PCR试剂盒进行表达分析,以Ubiquitin作为内参基因,荧光染料为SYBR Green I,以转基因84K杨和野生型84K杨的cDNA为模板,检测DFR的相对表达量变化。实时荧光定量PCR反应体系含SYBR Premix Ex Taq酶10 μL、ROX dyeII 0.4 μL、10 μmol/L的上、下游引物各0.4 μL、cDNA模板2 μL,用ddH2O补充体积至20 μL。PCR反应程序为:95 ℃预变性15 min、95 ℃变性10 s、60 ℃退火32 s并采集荧光数据,共45个循环。
1.8 HPLC法测量植株中儿茶素
用HPLC法测量样品中的儿茶素[23]。称取转基因84K杨和野生型84K杨的干质量叶片粉末100 mg,加入10 mL 70%的乙醇[24],超声破碎30 min,12 000 r/min离心2 min,取出上清液,用旋转蒸发仪60 ℃旋蒸后转移到10 mL茶色容量瓶中,加入乙醇定容至刻度,然后摇匀,通过0.45 μm的微孔膜过滤后,备用,在色谱条件下进行分离测定。用甲醇溶解儿茶素标准品1 mg,定容到10 mL的棕色容量瓶中,配制成质量浓度为0.1 g/L的标准品溶液,通过0.45 μm的微孔膜过滤后,在色谱条件下进行分离测定。色谱条件:检测波长λ=280 nm;流动相为乙腈-0.1%磷酸[25];柱温为30 ℃;流速为1.0 mL/min;进样量为10 μL。
2 结果与分析
2.1 RNA的提取和琼脂糖凝胶电泳检测
利用RNA试剂盒改良法分离得到接种后第6天的中林46杨树皮总RNA。电泳检测结果表明得到的总RNA没有发生降解,也没有DNA和蛋白质污染,质量和纯度较高。
2.2 DFR基因的扩增及克隆
以提取的总RNA反转录的cDNA为模板,分别以PrDFR-F和PrDFR-R为引物,PCR扩增得到DFR约1 000 bp左右的片段(图1),片段大小与引物设计的预期结果一致。

图1 中林46杨DFR基因RT-PCR扩增电泳图
2.3 测序结果及序列分析
利用DNAMAN软件对克隆得到的DFR基因序列,与Phytozome中公布的毛果杨DFR基因序列(Potri.005G229500)进行比对(图2)。中林46中的DFR基因(GenBank登录号:KU508460)与毛果杨中的DFR基因具有98.31%的相似性,保守性较高。

图2 克隆的中林46杨DFR基因与毛果杨DFR基因序列比对结果
2.4 反义表达载体的构建
用SacI和BamHI双酶切克隆载体和pBI121载体,用T4 DNA Ligase连接目的片段和酶切后的pBI121载体,转化农杆菌LBA4404感受态后检测阳性克隆(图3),并测序验证DFR序列正确插入pBI121载体CaMV 35S启动子的下游(图4),验证正确的反义表达载体,并命名为anti-pBI121-DFR。

图3 DFR阳性克隆的菌落PCR
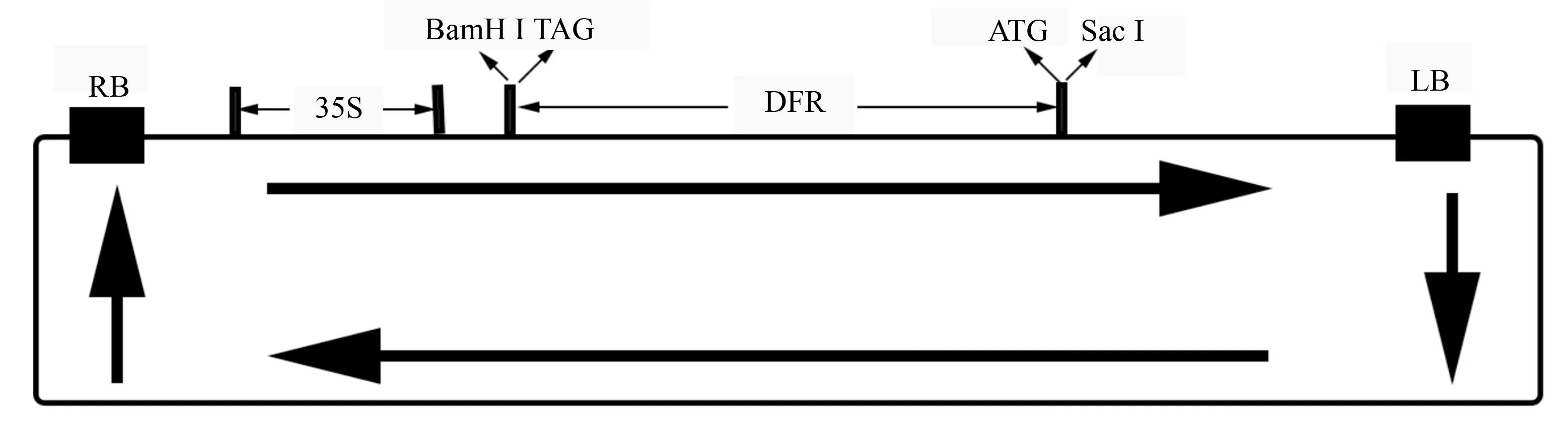
图4 anti-pBI121-DFR表达载体简图
2.5 转基因植株的普通PCR检测
农杆菌侵染后的84K杨叶片在筛选培养基上筛选,将筛选得到的抗性植株置于生根培养基中进行生根,从而得到完整的84K杨抗性苗。提取84K杨抗性植株的基因组DNA,经PCR扩增后得到特异的扩增片段,长度为597 bp,与预期大小一致(图5)。可以初步证明DFR基因已整合到84K杨的基因组中。共检测转反义DFR基因的植株4株,得到阳性植株4株。
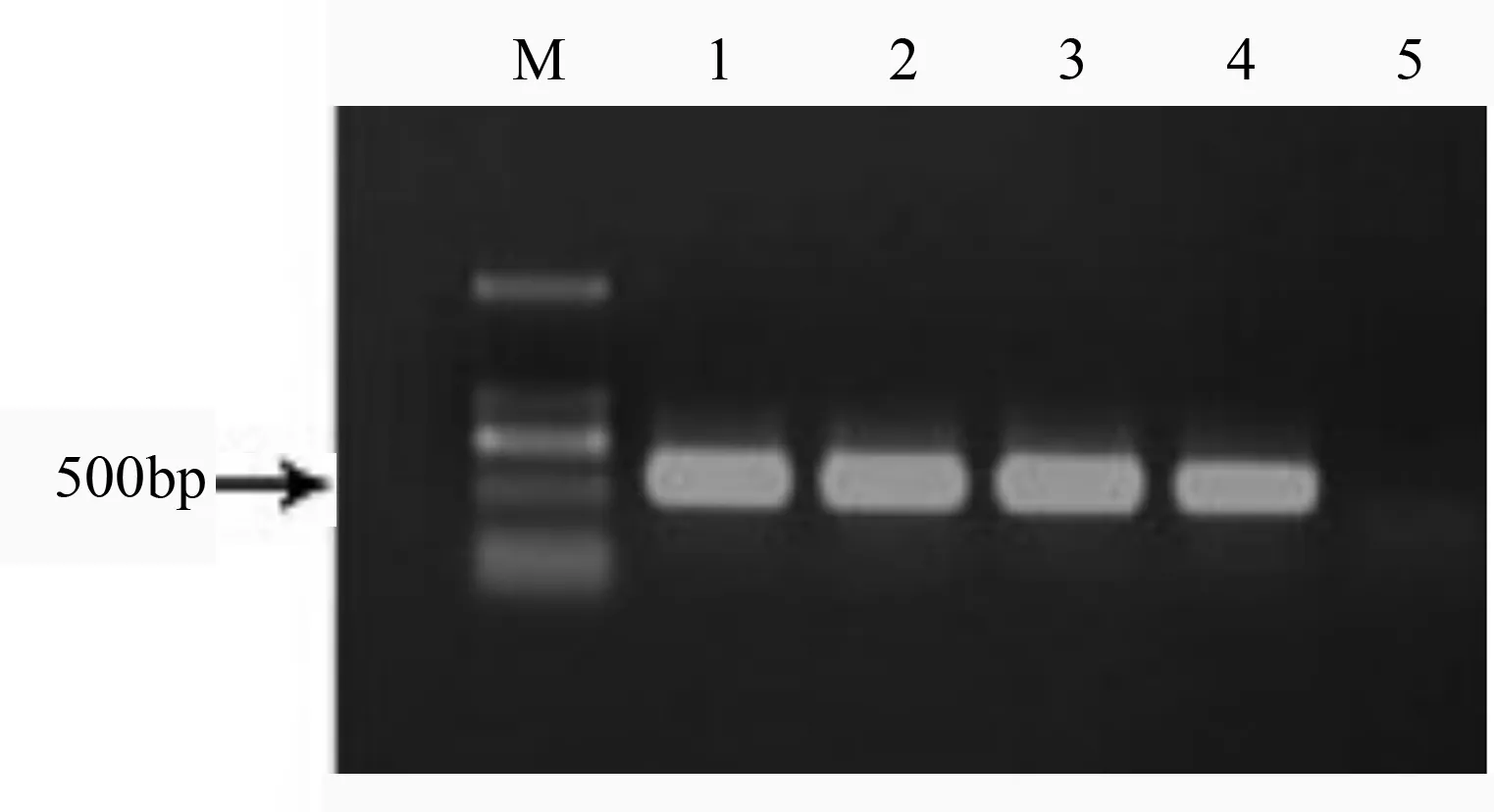
1-4.抗性植株;5.野生型植株。
2.6 转基因植株的qRT-PCR分析
分别提取4株转基因84K杨叶片和野生型84K杨叶片的总RNA,将反转录后的cDNA作为模板进行qRT-PCR的表达量分析,用2-ΔΔCT方法来进行相对定量计算。结果显示,反义表达载体anti-pBI121-DFR转入84K杨后,与野生型相比,在4株转基因植株中,84K杨的DFR基因表达量均显著上调。表明,反义DFR基因并没有对DFR基因的mRNA在转录后水平进行抑制。
2.7 转基因植株中儿茶素的质量分数测定
HPLC条件为:从0~40 min,流动相为10%,40 min以后流动相为100%。流速为1.0 mL/min,检测波长为280 nm,标准品进样量为2 μL,样品进样量为10 μL(WT为对照组,TS为转基因材料)。由图6可知,儿茶素标准品出峰的时间为9.6 min,而WT和TS在9.6 min时均有单峰(图7、图8)。标准品的峰高为540.4 mV·s-1,WT的峰高平均值为24.048 8 mV·s-1,TS的峰高平均值分别为2.632 01、6.582 68、4.524 62和2.359 85 mV·s-1。在转反义DFR的84K杨植株中,其内源儿茶素质量分数分别为0.97、2.40、1.60、0.87 ng/g,与84K野生型植株中儿茶素质量分数8.9 ng/g相比,转基因植株儿茶素质量分数显著降低,下降比例分别为89.10%、73.03%、82.02%、90.22%。用单因素方差分析和多重t检验做多重比较可知(表1,表2),4株转基因植株中儿茶素质量分数分别与野生型植株中儿茶素质量分数相比,均呈显著差异,说明反义DFR基因的导入阻碍了儿茶素的合成。

图6 儿茶素标准品HPLC分析图谱
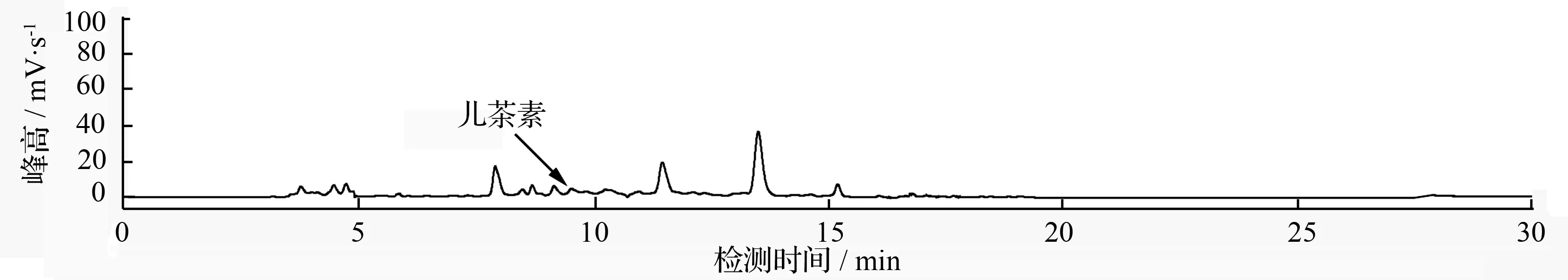
图7 84K野生型杨树对儿茶素的检测结果
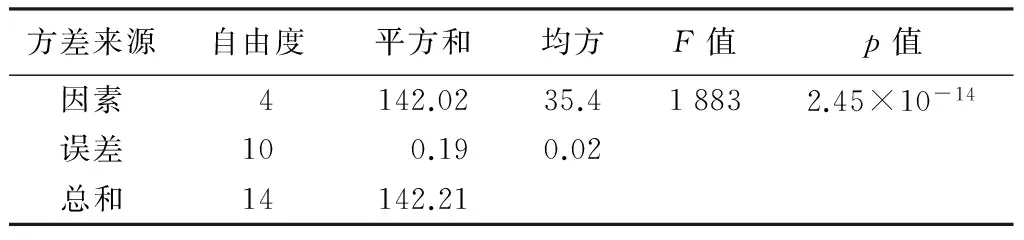
方差来源自由度平方和均方F值p值因素4142.0235.418832.45×10-14误差100.190.02总和14142.21

表2 多重t检验
3 结论与讨论
本研究用转基因的方法验证了杨树中DFR基因参与了杨树类黄酮生物合成途径,且该基因与儿茶素的合成有关。
反义基因技术作为一种遗传改良的重要工具,已经广泛的应用在植物基因工程中。反义基因可从复制、转录和翻译3个途径调控基因的表达[26]。在本研究中,4株转基因84K杨中DFR基因的表达量均未降低,而DFR调控的儿茶素的质量分数则全部降低。推测反义基因的表达并未在转录后水平切割正义基因的mRNA。根据反义基因的调控原理,推测反义基因的导入可能抑制了正义基因的翻译,即反义DFR与84K杨中特定的mRNA结合,从而抑制mRNA的翻译。在后续研究中,可采用Western杂交的方法确定DFR在蛋白水平是否降低,以做进一步研究。
值得注意的是,在先前转DFR正义基因的毛白杨中显示,DFR超量表达引起毛白杨花青素及原花色素质量分数的提高[27]。在烟草中,DFR正义转基因烟草花瓣颜色明显偏红,而反义转基因烟草中花瓣颜色趋于白色[28]。为了进一步说明DFR基因对儿茶素合成的影响,在之后的研究中可考虑转入正义的DFR基因,根据它在类黄酮合成途径中的位置和产物,可能会使儿茶素的质量分数有所升高和积累。而根据前人的研究结果可知,儿茶素在对病原物质的防御和抵抗中也发挥着重要作用。在枯萎病菌侵染后棉苗组织中儿茶素质量分数也明显升高,在抗病品种棉苗组织中,儿茶素质量分数较高[29]。研究显示,棉花体内的儿茶素可抑制枯萎病菌的菌丝生长、产孢及孢子的萌发[30]。转入正义的DFR基因后,84K杨可能增加对溃疡病菌的抑制作用,从而可全面揭示DFR基因在抗病中的作用。
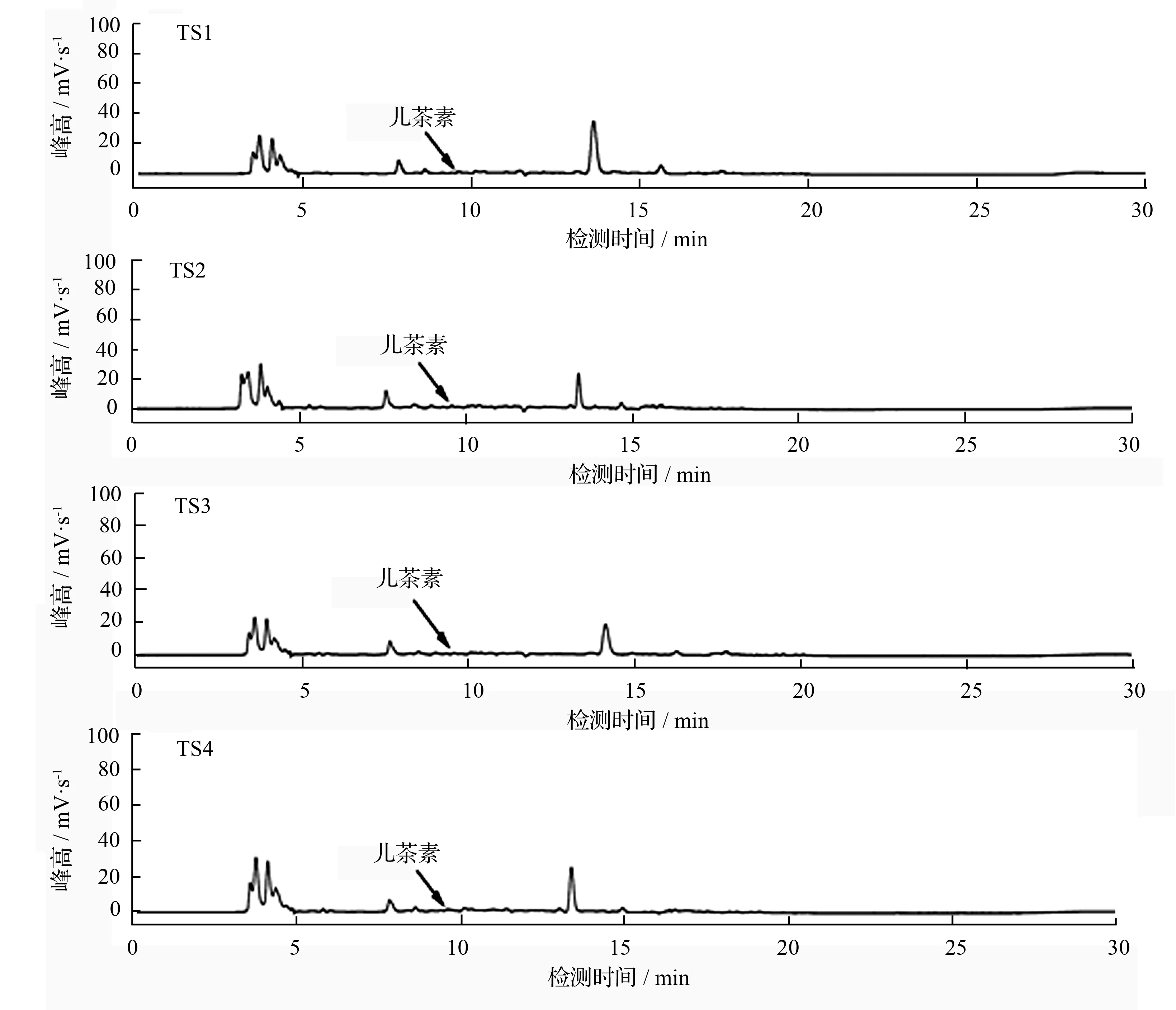
图8 转基因植株对儿茶素的检测结果
植物中类黄酮的合成涉及多种调控过程,从合成途径上看,有多种酶和基因参与其中。经前人研究发现,茶树存在DFR/LAR的酶促反应,且儿茶素和没食子酸儿茶素是DFR/LAR反应的产物[1]。DFR和LAR两步反应是催化儿茶素形成的关键步骤,而DFR和LAR都处在合成途径中的中下游,对儿茶素的合成有比较直接的作用,但儿茶素的前体物质对相应的基因和产物是否有影响还未知。所以,为了从更多前体物质中了解其对儿茶素合成的影响,在今后的研究中,可选择合成途径中的上游基因,以便验证类黄酮合成途径中更多相关基因的抗病性,从分子层面加速杨树抗病性的研究与转基因改造。
[1] 夏涛,高丽萍.类黄酮及茶儿茶素生物合成途径及其调控研究进展[J].中国农业科学,2009,42(8):2899-2908.
[2] STAFFORD H A, LESTER H H. Flavan-3-ol biosynthesis: the conversion of (L)-dihydromyricetin to its flavan--,4-diol(leucodelphinidin) and to (L)-gallocatechin by reductase extracted from tissue cultures ofGinkgobilobaandPseudotsugamenziesii[J]. Plant Physiological,1984,76(1):184-186.
[3] PUNYASINPA, ABEEYSINGHE I S, KUMAR V, et al. Flavonoid biosynthesis in the tea plantCamelliasinensis: properties of enzymes of the prominent epicatechin and catechin pathways[J]. Archives of Biochemistry Biophysics,2004,431(1):22-30.
[4] MAMATI G E, LIANG Y, LU J. Expression of basic genes involved in tea polyphenol synthesis in relation to accumulation of catechins and total tea polyphenols[J]. Journal Science of Food Agriculture,2006,86(3):459-464.
[5] 马春雷,乔小燕,陈亮.茶树无色花色素还原酶基因克隆及表达分析[J].茶叶科学,2010,30(1):27-36.
[6] 孙昊,郝再彬.茶多酚中儿茶素的抑菌效果探究[J].湖南师范大学自然科学学报,2013,36(6):62-65.
[7] 王树耀,田宗城,王云,等.OsNHX1基因转化84K杨的研究[J].湖南文理学院学报,2005,17(1):60-63.
[8] 李科友,樊军锋,赵忠,等.银腺杨转Cry I Ac和API双价抗虫基因的研究[J].林业科学研究,2007,20(5):699-704.
[9] 周洲.转脂肪酸去饱和酶基因PtFAD2和PtFAD3银腺杨84K的抗寒性研究[D].北京:中国林业科学研究院,2007.
[10] OELLER P W, LU M W, TANLOR M L, et al. Reversible inhibition of tomoto fruit senescence by antisense RNA[J]. Science,1991,254:437-439.
[11] ZUKER A, TZFIRA T, BEN-MEIR H, et al. Modification of flower color and fragrance by antisense suppression of the flavanone 3-hydroxylase gene[J]. Molecular Breeding,2002,9(1):33-41.
[12] 申晓洁.转反义APX基因杨树的获得及其抗逆性研究[D].济南:山东师范大学,2015.
[13] LI Y, HE W, REN F J, et al. A canker disease ofPopulus×euramericanain China caused byLonsdaleaquercinasubsp.populi[J]. Plant Disease,2014,98(3):368-378.
[14] 郭利民,常聚普,贺伟,等.欧美杨溃疡病田间发生规律研究初报[J].林业实用技术,2012(10):38-40.
[15] HOU J, WU Q M, ZUO T, et al. Genome-wide transcriptomic profiles reveal multiple regulatory responses of poplar to Lonsdalea quercina infection[J]. Trees Structure and Function,2016,30(1):1-14.
[16] MIRANDA M, RALPH S G, MELLWAY R, et al. The Transcriptional response of hybrid poplar (Populustrichocarpa×P.deltoids) to infection by Melampsora medusae leaf rust involves induction of flavonoid pathway genes leading to the accumulation of proanthocyanidins[J]. Molecular Plant-Microbe Interactions,2007,20:816-831.
[17] 侯佳,孙丰硕,吴秋明,等.一种高效提取杨树发病树皮总RNA的方法及应用[J].植物生理学报,2014,50(2):223-228.
[18] HUANG Y, GOU J Q, JIA Z H, et al. Molecular cloning and characterization of two genes encodinDihydroflavonol-4-Reductasefrom Populus trichocarpa[J]. PLoS One,2012,7(2):1-8.
[19] 朱锦,权军利,何玉科.根癌农杆菌感受态细胞的制备以及质粒ProkⅡ对其转化的研究[J].西北农林科技大学学报(自然科学版),2006,34(7):91-95.
[20] RHODES C A, PIERCE D A, METLLER I J. Genetically transformed maize plants from protoplasts[J]. Science,1988,240:204-207.
[21] BEVAN M W, FLAVELL R B, CHILTON M D. A chimaeric antibiotic resistance gene as a selectable marker for plant cell transformation[J]. Biotechnology,1992,24:184-187.
[22] HORSCH R B. Asimple and general method for transferring genes into plant[J]. Science,1985,227:1229-1231.
[23] HU B, WANG L, ZHOU B, et al. Efficient procedure for isolating methylated catechins from green tea and effective simultaneous analysis of ten catechins, three purine alkaloids, and gallic acid in tea by highperformance liquid chromatography with diode array detection[J]. Journal of Chromatography A,2009,1216(15):3223-3231.
[24] 姚姝凤,唐克华,刘小攀.多花勾儿茶中儿茶素的提取分离与HPLC测定[J].吉首大学学报,2015,36(3):82-93.
[25] 张戎睿,王舒雅,王富济,等.HPLC法同时检测茶叶中八种儿茶素[J].黑龙江医药,2011,24(5):681-683.
[26] 李祥,易自立,蔡能,等.反义RNA及其在植物基因工程领域的应用[J].生物技术通讯,2003,14(2):162-164.
[27] 孙一铭.PtrDFR基因的克隆与其在毛白杨中功能鉴定研究[D].重庆:西南大学,2011.
[28] 宋锋.毛白杨二氢黄酮醇-4-还原酶(DFR)基因在烟草中的功能验证[D].重庆:西南大学,2010.
[29] 宋凤鸣,郑重,童贤明,等.儿茶素对棉枯萎病菌胞壁降解酶的抑制及在棉花抗病性中的作用[J].真菌学报,1996,15(4):297-303.
[30] 宋凤鸣,郑重,葛秀春,等.儿茶素在棉苗对枯萎病抗性中的作用[J].植物病理学报,1998,28(2):139-143.
Cloning Dihydroflavonol-4-Reductase Gene (DFR) of Poplar and Its Antisense Expression Effects on Catechin Synthesis//
Zuo Tao
(Beijing Forestry University, Beijing 100083, P. R. China);
Zhao Shutang, Lu Mengzhu
(Research Institute of Forestry, Chinese Academy of Forestry);
Sun Aidong, Wang Yanwei, He Wei
(Beijing Forestry University)//Journal of Northeast Forestry University,2016,44(10):49-55.
The experiment was conducted to verify the function of Dihydro flavonol-4-reductase gene (DFR), and analyze the influence on the synthesis of disease-resistant substances catechins for the use of resistance genes resistant canker providing candidate genes. Total RNA was isolated from the infected bark ofPopulus×euramericana‘Zhonglin 46’ after inoculating 6 days withLonsdaleaquercinasubsp.populi. A specificDFRfragment of the expected size was amplified by RT-PCR and sequenced, and then successfully constructed into an expression vector with antisense-orientation driven by CaMV 35S promoter (anti-pBI121-DFR). Subsequently, anti-pBI121-DFRwas transformed intoPopulusalba×P.glandulosausingAgrobacteriumtumefaciensmediated method. Four transgenic lines was finally obtained and confirmed by PCR. High performance liquid chromatography (HPLC) was further used to detect catechin in transgenic plants and wild type plants. The contents of catechin in transgenic plants were 0.97, 2.4, 1.6, and 0.87 ng/g, respectively, significantly lower than that of wild type plants (8.9 ng/g). Therefore, DFR ofPopulus×euramericana‘Zhonglin 46’ was involved in flavonoids biosynthesis pathway, and associated with the synthesis of catechin.
Flavonoids; Dihydroflavonol-4-reductase gene; Antisense expression vector; Catechin
1)国家自然科学基金项目(31470668、31200511、J1103516);国家林业公益性行业科研专项(201104054)。
左涛,女,1989年2月生,北京林业大学林学院,硕士研究生。E-mail:zuotaot@126.com。
王延伟,北京林业大学生物科学与技术学院,副教授。E-mail:wangyanw321@126.com。
2016年3月20日。
S722.3+6
责任编辑:潘 华。

