对-香豆酸与人血清白蛋白相互作用的荧光和表面增强拉曼光谱研究
申炳俊, 金丽虹, 张佳佳, 刘荣娟, 刘占伟, 刘昱鑫, 柴 浩, 田 坚*
(1. 长春理工大学 清洁能源技术研究所, 吉林 长春 130022; 2. 长春理工大学 生命科学技术学院, 吉林 长春 130022)
对-香豆酸与人血清白蛋白相互作用的荧光和表面增强拉曼光谱研究
申炳俊1, 金丽虹2, 张佳佳2, 刘荣娟2, 刘占伟2, 刘昱鑫2, 柴 浩2, 田 坚1*
(1. 长春理工大学 清洁能源技术研究所, 吉林 长春 130022; 2. 长春理工大学 生命科学技术学院, 吉林 长春 130022)
在模拟生理条件下,应用荧光光谱和表面增强拉曼光谱法对对-香豆酸(p-CA)与人血清白蛋白 (HSA) 的结合机理进行研究。结果表明,p-CA对HSA的荧光猝灭机制为静态猝灭,并伴有非辐射能量转移。荧光光谱显示,在298,304,310 K下,p-CA与HSA的结合常数(KA)分别为3.41×104,2.09×104,1.38×104L/mol,结合位点数(n)近似为1。表面增强拉曼光谱研究揭示,p-CA的酚基与HSA有效结合。标记竞争实验指出,p-CA在HSA上的结合位点主要在SiteⅠ。反应过程热力学参数表明,二者间的作用主要为静电引力,且根据Förster能量转移理论求得p-CA与HSA间的距离为 5.11 nm。同步荧光光谱显示,p-CA的结合没有导致HSA构象发生明显变化。
荧光光谱; 表面增强拉曼光谱; 对-香豆酸; 人血清白蛋白; 反应机理
Investigation on The Interaction betweenp-Coumaric Acid and Human
1 引 言
人血清白蛋白(Haman serum albumin,HSA)是人血浆中含量最丰富的载体蛋白,担负着药物的贮存、运输等功能,常常作为研究药物与蛋白质相互作用的模型蛋白[1]。药物吸收后进入血液循环,可与血清蛋白质以非共价方式结合,其聚集状态及在机体中的分布、代谢等生理过程都受到血清白蛋白的影响。同时,药物与蛋白质的结合也会影响蛋白的构象和功能。因此,研究药物分子与HSA的结合作用,有助于深入了解药物在体内的运输、代谢机制、药代动力学及蛋白质构象,具有重要的意义。
对-香豆酸(p-Coumaric acid,p-CA)化学名称为对-羟基肉桂酸,属于酚酸类化合物,是白花蛇舌草、海金莎草、杜仲叶等中草药的主要活性成分之一。p-CA具有抗肿瘤、抗氧化、预防心血管疾病、抗菌消炎和利胆等明显的生物活性,亦对肝的诱变和氧化损伤具有保护作用[2-6],广泛应用于医药、食品、日用品和饲料等领域。近年来,对p-CA的提取、分离、分析、药效和药理的研究已有不少报道,但在分子水平研究p-CA与HSA的相互作用尚未见报道。
荧光光谱法是研究药物与HSA相互作用的最有效方法之一[7-9],该方法可对药物分子在HSA上的结合常数、结合位点数和结合力类型等非共价作用特性及药物引起的HSA构象、结构变化等方面信息进行研究。表面增强拉曼光谱法(Surface enhanced Raman scattering,SERS)对研究分子内和分子间的相互作用非常敏感,可提供有关分子构型和化学键变化方面的信息[10-12]。
本文利用荧光光谱和表面增强拉曼光谱技术研究了p-CA与HSA的相互作用信息及p-CA对HSA构象的影响,为更好地了解p-CA药理作用提供理论支持。
2 实 验
2.1 仪器及试剂
实验中使用的仪器主要有QE65000拉曼光谱仪(美国海洋公司)、F-280荧光分光光度计(天津港东公司)、320 pH计(上海梅特勒-托利多仪器公司)、DC-4006高精度恒温水浴(上海菁海仪器公司)和QL-901振荡器(江苏其林贝尔仪器公司)等。
人血清白蛋白(美国Sigma公司)配成浓度为1.0×10-4mol/L 的储备液。对-香豆酸对照品(成都普菲德公司)配成浓度为2.0×10-3mol/L 的储备液,用时适当稀释。华法林(南通飞宇公司)、布洛芬(德国Dr. Ehrenstorfer公司)和洋地黄毒苷(德国Dr. Ehrenstorfer公司)3种对照品均配成浓度为1.0×10-4mol/L的储备液。上述储备液置于4 ℃冰箱中保存。缓冲溶液是浓度为0.05 mol/L的Tris-HCl(内含0.1 mol/L的NaCl,pH=7.4),实验用水为二次去离子水,其他试剂均为分析纯。荧光值用“内滤光效应”公式[13]进行校正:
(1)
Fcor和Fobs为p-CA-HSA校正后和测量的荧光强度,Aex和Aem为p-CA在激发和发射波长处的吸光度值。
2.2 实验方法
2.2.1 荧光光谱
荧光发射谱的测定:在5 mL比色管中依次加入40 μL HSA储备液和一定量的1.0×10-4mol/Lp-CA溶液,用pH 7.4 Tris-HCl缓冲液定容,充分混合,于恒温水浴中作用30 min。固定激发波长为280 nm,入射和出射狭缝均为5 nm,记录荧光发射谱。
同步荧光测定:溶液配制同上,设置发射和激发狭缝宽度为5 nm,固定波长差Δλ=15 nm和Δλ=60 nm,扫描同步荧光光谱。
标记竞争实验:固定HSA和位点标记试剂的浓度为1.0×10-6mol/L,充分混合,于恒温水浴中作用30 min,向标记试剂-HSA体系中分别加入一定体积的p-CA溶液,混合均匀,继续在该温度水浴中反应30 min,扫描荧光光谱,参数同前。
2.2.2 拉曼光谱
理论计算:利用密度泛函理论(DFT),在B3LYP/6-311+ +(d,p)基组水平上优化p-CA几何结构,获得该分子的全部振动频率。频率修正因子为0.961 3[14],所有计算均采用Guassian 09程序完成。
NRS测定:将p-CA固体标样置于载玻片上,进行NRS测试。激发光波长为785 nm,达到样品表面功率为100 mW,光谱分析范围为0~2 000 cm-1,分辨率为2 cm-1,积分时间为10 s,累积3 次。
SERS测定:参照经典的Lee法[15]制备银溶胶。将0.5 mLp-CA溶液加入到一定体积的HSA储备液中,配制终浓度比分别为1∶0,1∶1,1∶3,1∶5的混合液,pH=7.4 条件下作用30 min进行药物与HSA识别;与0.5 mL银溶胶溶液混合,作用30 min后进行SERS测定。测试条件同NRS。
3 结果与讨论
3.1p-CA对HSA的荧光猝灭作用及机理
图1为p-CA对HSA的荧光猝灭光谱,激发波长为280 nm。可以看出,HSA在340 nm处出现最大荧光发射峰。随着药物浓度的不断增加,HSA的内源性荧光强度发生有规律的猝灭,但峰位和峰形基本保持不变。这表明p-CA能够猝灭CHSA=1.0×10-6mol/L; 1~7:Cp-CA=(0, 1.0, 3.0, 5.0, 7.0, 10.0, 15.0)×10-6mol/L; 8: Cp-CA=1.0×10-6mol/L。
图1p-CA对HSA的荧光猝灭光谱(T=298 K)
Fig.1 Fluorescence quenching spectra ofp-CA on HSA (T=298 K)
HSA的荧光,二者间存在相互作用。在280 nm激发下,p-CA分子在340 nm处无荧光产生,但是在430 nm处产生强度很弱的荧光发射峰(见图1中曲线8),其荧光强度随p-CA浓度增加逐渐下降,这进一步揭示,p-CA与HSA间可能生成复合物。
猝灭数据按动态Stern-Volmer方程处理[16]:
(2)
式中,F0、F分别为无、有p-CA时的荧光强度;τ0为分子荧光平均寿命,约为10-8s;Kq为猝灭速率常数;KSV为Stern-Volmer猝灭常数;[Q]为p-CA平衡浓度。结果列于表1。由表1可知,KSV随温度升高而减小,Kq值均大于最大扩散碰撞猝灭常数(2×1012L/(mol·s))[17],表明p-CA与HSA形成稳定的非共价复合物,其猝灭过程为静态猝灭。
3.2 p-CA与HSA的结合常数及结合位点数
对于静态猝灭过程可用公式[18]计算结合常数(KA)及结合位点数(n):
lg[(F0-F)/F]=lgKA+nlg[Q],
(3)
固定HSA浓度,改变p-CA的浓度,得到lg[(F0-F)/F] -lg[Q]曲线,拟合获得方程、结合常数和结合位点数,结果见表1。由表可知,p-CA与HSA 结合位点数n接近于1,表明HSA与p-CA相互作用只有1个结合位点。KA值随温度升高而降低,说明温度升高导致复合物稳定性降低,这进一步证明体系的猝灭过程为静态猝灭。结合常数KA值为104数量级,说明p-CA与HSA之间具有较强的结合作用。

表1 p-CA与HSA作用的猝灭常数KSV、结合常数KA、结合位点数n
3.3 p-CA与HSA结合位置
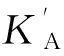
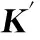
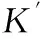
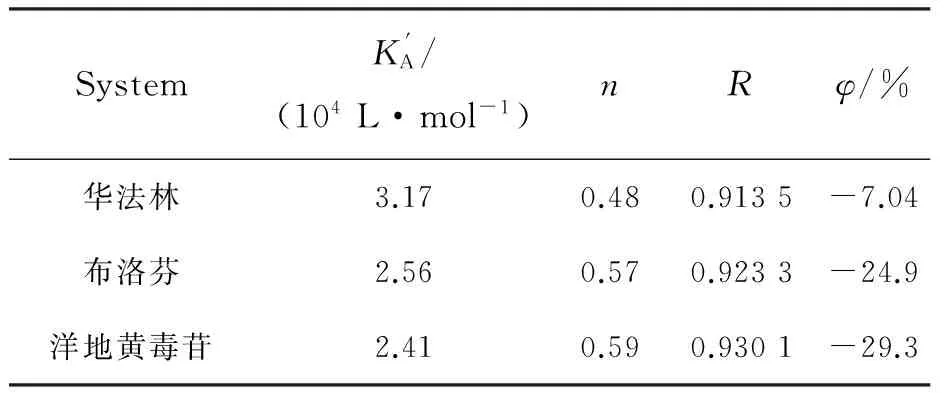
SystemK'A/(104L·mol-1)nRφ/%华法林3.170.480.9135-7.04布洛芬2.560.570.9233-24.9洋地黄毒苷2.410.590.9301-29.3
3.4 p-CA与HSA的作用力类型
氢键、疏水作用、范德华力和静电引力等是小分子与蛋白质间的主要结合力类型。由Van’t Hoff 定律[19]可计算得到反应体系的热力学参数:
(4)
(5)
当温度变化不大时,反应ΔH可看作常数,p-CA与HSA体系的热力学参数结果见表3。由热力学参数可判断p-CA与HSA作用力类型[20]。ΔH<0,ΔS>0,表明p-CA与HSA之间的作用力主要为静电引力,ΔG<0说明结合反应是自发进行。原因在于siteⅠ是一个正电荷残基包围的口袋,p-CA中含有酚基和羧基阴离子与siteⅠ空腔内碱性氨基酸残基间容易产生静电作用力。

表3 p-CA与HSA作用的热力学参数
3.5 p-CA与HSA的结合距离
根据Förster能量转移理论[16]有如下关系:
(6)
(7)
(8)
图2为HSA荧光发射光谱与p-CA吸收光谱的重叠图,结合公式(8),将光谱重叠部分分割成极小的矩形面积求和,得到J=1.84×10-14(cm3·L)/mol。取向因子K2取荧光给体与受体随机分布的平均值2/3,溶剂的折射率N取水和有机物的平均值1.336,无受体存在时能量供体的荧光量子产率Φ取0.118,计算得到R0=2.71 nm。由R0和实验测得的E=0.022,获得能量给体与受体间的距离r=5.11 nm。r>R0,进一步证明p-CA对HSA的猝灭过程为静态猝灭[18],与3.1节和3.2节结论一致。r<7 nm说明HSA与p-CA间存在非辐射能量转移[21]。
图2 HSA的荧光发射谱(a)和p-CA的吸收光谱(b) (T=298 K)
Fig.2 Fluorescence emission spectrum of HSA(a) and the absorption spectrum ofp-CA(b) (T=298 K)
3.6 p-CA对HSA构象的影响
对于蛋白质的同步荧光光谱,Δλ=15 nm 和Δλ=60 nm分别只显示酪氨酸、色氨酸残基的荧光光谱特性。图3为p-CA-HSA体系的同步荧光光谱。可以看出,随着p-CA浓度的增加,Δλ=15 nm(a)和Δλ=60 nm(b)的荧光强度均呈显著下降趋势,但最大荧光发射峰波长无显著变化。即酪氨酸和色氨酸残基周围环境无明显变化,这表明p-CA的作用没有引起HSA构象的变化。
3.7 p-CA与HSA分子间结合状态
p-CA的理论拉曼光谱、NRS和SERS的比较研究是进一步分析p-CA与HSA分子间结合状态的前提和基础。我们应用B3LYP/6-311++(d,p)对p-CA进行结构优化和频率计算,在结果中未发现虚频的存在,说明优化得到的分子结构式是稳定的。优化后的p-CA分子结构如图4所示。
CHSA=1.0×10-6mol/L; 1~7:Cp-CA=(0, 1.0, 3.0, 5.0, 7.0, 10.0, 15.0)×10-6mol/L。
图3p-CA与HSA作用的同步荧光光谱(T=298 K)。(a) Δλ=15 nm;(b) Δλ=60 nm。
Fig.3 Synchronization fluorescence spectra ofp-CA and HSA(T=298 K). (a)Δλ=15 nm. (b)Δλ=60 nm.
3.7.1p-CA的理论拉曼光谱、NRS和SERS
图5显示的是p-CA理论拉曼光谱(曲线1)、固体粉末的NRS(曲线2)和其水溶液在银溶胶中的SERS(曲线3)。可以看出,p-CA的NRS和SERS峰位与理论计算拉曼光谱基本一致,主要基团的拉曼峰都存在,只是稍有偏移或强度的变化。
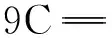
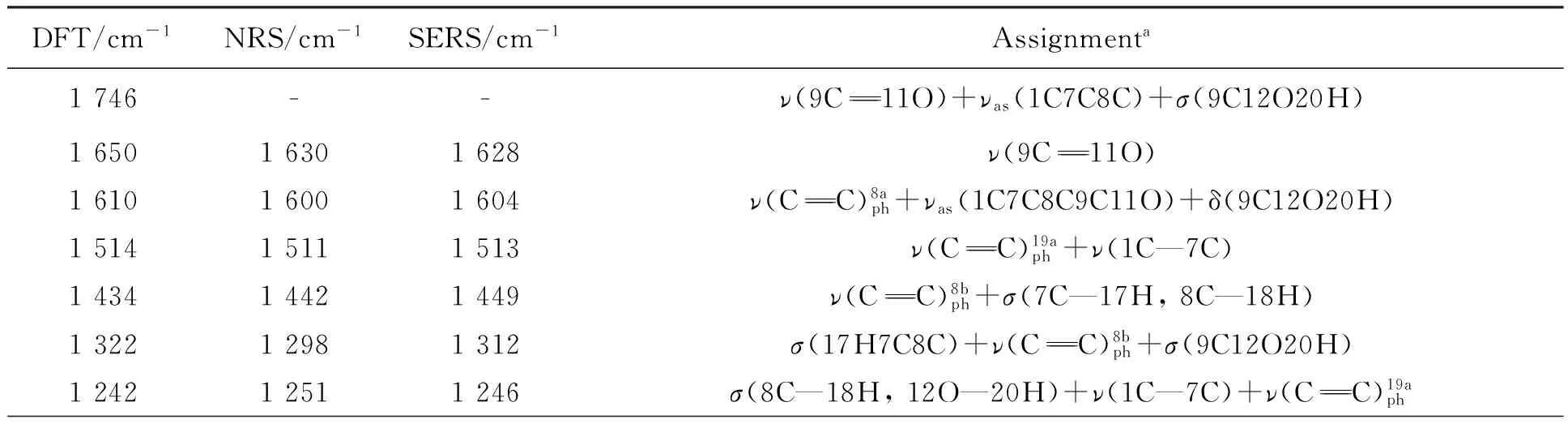
表4 p-CA的实测拉曼特征峰与理论计算值及其归属
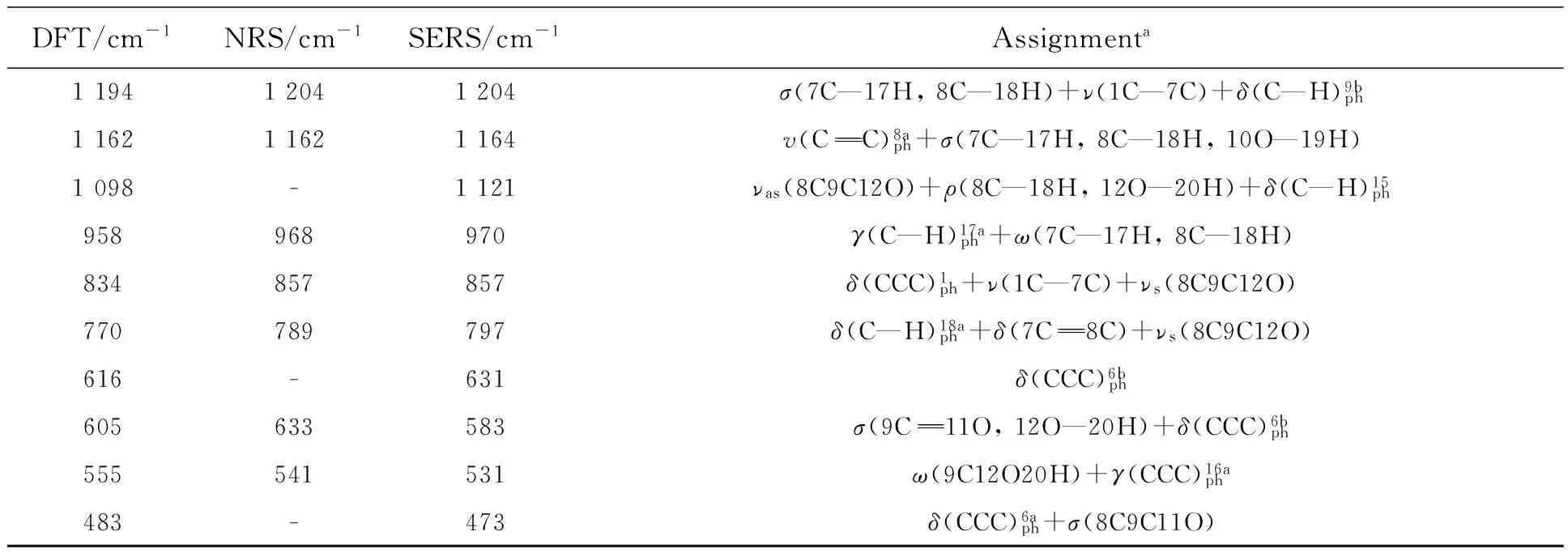
表4(续)
aν:stretching;δ:in-plan bending;γ:out-of plane bending;σ:scissoring;ρ:wagging;ω:rocking;τ:torsion; as:asymmetric.
3.7.2p-CA与HSA作用的SERS
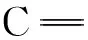
Fig.6 SERS of HSA andp-CA complexes in silver colloid with different concentration ratios
4 结 论
在模拟生理条件下,研究了不同浓度对-香豆酸(p-CA)与人血清白蛋白(HSA)作用的荧光光谱和表面增强拉曼光谱。阐明了p-CA对HSA的荧光猝灭机制为静态猝灭,并伴随有非辐射能量转移,推断p-CA分子以酚基通过静电引力方式与HSA的亚域ⅡA的SiteⅠ进行结合,两者间的结合作用较强,其结合常数为104数量级,结合位点数约为1,结合距离为5.11 nm。p-CA的加入没有导致HSA构象发生明显变化。此外,p-CA与HSA作用前后,均以—COO-与银纳米颗粒表面进行吸附,其吸附方式分别为垂直吸附和平行吸附。
[1] YAN Y, XU J, CHEN G Z. Protein conformation in solution by three-dimensional fluorescence spectrometry [J].Sci.ChinaSer. B, 1996, 39(5):527-535.
[2] CHENG J C, DAI F, ZHOU B,etal.. Antioxidant activity of hydroxy cinnamic acid derivatives in human low density lipoprotein: mechanism and structure-activity relationship [J].FoodChem., 2007, 104(1):132-139.
[3] BISWICK T, PARK D H, SHUL Y G,etal..p-Coumaric acid-zinc basic salt nanohybrid for controlled release and sustained antioxidant activity [J].J.Phys.Chem.Solids, 2010, 71(4):647-649.
[4] AAHRO J R, P STANELY M P. Preventive effects ofp-Coumaric acid on cardiac hypertrophy and alterations in electrocardiogram, lipids, and lipoproteins in experimentally induced myocardial infarcted rats [J].FoodChem.Toxicol., 2013, 60(10):348-354.
[5] AADEL-WAHAB M H, El-MAHDY M A, ABD-ELLAH M F,etal.. Influence ofp-Coumaric acid on doxorubicin-induced oxidative stress in rat’s heart [J].Pharmacol.Res., 2003, 48(5):461-465.
[6] BODINI S F, MANFREDINI S, EPP M,etal.. Quorum sensing inhibition activity of garlic extract andp-Coumaric acid [J].Lett.Appl.Microbial., 2009, 49(5):551-555.
[7] 陆从文,兰秀风,张林,等. 依巴斯汀与牛血清蛋白相互作用的荧光光谱研究 [J]. 光子学报, 2015, 44(10):1030004.
LU C W, LAN X F, ZHANG L,etal.. Interaction between ebastine and bovine serum albumin by fluorescence spectroscopy [J].ActaPhoton.Sinica, 2015, 44(10):1030004. (in Chinese)
[8] 刘保生,韩荣,李志云,等. 硝基羟乙唑与溶菌酶反应机制的荧光光谱研究 [J]. 发光学报, 2015, 36(12):1458-1463.
LIU B S, HUA R, LI Z Y,etal.. Investigation of the interaction mechanism between lysozyme and trichazol using fluorescence spectroscopic method [J].Chin.J.Lumin., 2015, 36(12):1458-1463. (in Chinese)
[9] JIANG H, CHEN R R, PU H L. Study on the interaction between tabersonine and human serum albumin by optical spectroscopy and molecular modeling methods [J].J.Lumin., 2012, 132(3):592-599.
[10] ZHANG W, WANG Y P, BAI X Y,etal.. Based on SERS conformational studies of ginsenoside Rb1 and its metabolites before and after combined with human serum albumin [J].Spectrochim.ActaPart A:Mol.Biomol.Spect., 2015, 137:116-121
[11] 张巍,赵雨,白雪媛,等. 对黄芩素和黄芩苷与人血清白蛋白相互作用的光谱研究 [J]. 高等学校化学学报, 2010, 31(9):1834-1840.
ZHANG W, ZHAO X, BAI X Y,etal.. Studies on the interaction for baicalein and baicalin with human serum albumin by spectroscopic methods [J].Chem.J.Chi.Univ., 2010, 31(9):1834-1840. (in Chinese)
[12] WANG W N, ZHANG W, DUAN Y K,etal.. Investigation of the binding sites and orientation of caffeine on human serum albumin by surface-enhanced Raman scattering and molecular docking [J].Spectrochim.ActaPart A:Mol.Biomol.Spect., 2013, 115(11):57-63.
[13] WANG Q, HE J W, YAN J,etal.. Spectroscopy and docking simulations of the interaction between lochnericine and bovine serum albumin [J].Luminescence, 2015, 30(2):240-246.
[14] SUNDARAGANESAN N, DOMINIC J B, SETTU K. Vibrational spectra and assignments of 5-amino-2-chlorobenzoic acid byabinitioHartree-Fock and density functional methods [J].Spectrochim.ActaPart A:Mol.Biomol.Spect., 2007, 66(2):381-388.
[15] LEE P C, MEISEL D. Adsorption and surface-enhanced Raman of dyes on silver and gold sols [J].J.Phys.Chem., 1982, 86(17):3391-3395.
[16] 申炳俊,金丽虹,田坚. 荧光与紫外光谱法研究柚皮素与人血清白蛋白的结合模式 [J]. 分析试验室, 2016, 35(1):41-46.
SHEN B J, JIN L H, TIAN J. Study of naringenin and its interaction with HSA by fluorescence and UV spectroscopies [J].Chin.J.Anal.Lab., 2016, 35(1):41-46. (in Chinese)
[17] PARAMAGURU G, KATHIRAVAN A, SELVARAJ S,etal., Interaction of anthraquinone dyes with lysozyme: evidences from spectroscopic and docking studies [J].J.Hazard.Mater., 2010, 175(1-3):985-991.
[18] 杜传荣,逯东伟,石康,等. 三种肉桂酰胺衍生物的制备及其与人血清白蛋白的结合 [J]. 发光学报, 2015, 36(11):1342-1352.
DU C R, LU D W, SHI K,etal.. Synthesis of three cinnamamide derivatives and their interaction mechanism with human serum albumin [J].Chin.J.Lumin., 2015, 36(11):1342-1352. (in Chinese)
[19] 郭清莲,潘凌立,杨立云,等. 吡虫啉与人血清白蛋白相互作用热力学行为 [J]. 物理化学学报, 2016, 32(1):274-282.
GUO Q L, PAN L L, YANG L Y,etal.. Thermodynamics of the interaction of imidacloprid with human serum albumin [J].ActaPhys. -Chim.Sinica, 2016, 32(1):274-282. (in Chinese)
[20] ROSS P D, SUBRAMANIAN S. Thermodynamic of protein association reactions: forces contributing to stability [J].Biochemistry, 1981, 20(11):3096-3102.
[21] WANG N, YE L, YAN F F,etal.. Spectroscopic studies on the interaction of azelnidipine with bovine serum albumin [J].Int.J.Pharm., 2008, 351(1-2):55-60.
[22] PALAFOX M A. Scaling factors for the prediction of vibrational spectra. Ⅰ. benzene molecule [J].Int.J.Quant.Chem., 2000, 77(3):661-684.
申炳俊(1977-),男,吉林通化人,助理研究员,博士研究生,2007年于长春理工大学获得硕士学位,主要从事光谱分析理论与应用的研究。
E-mail: bjshen@cust.edu.cn田坚(1956-),男,吉林长春人,教授,博士生导师,1996年于东北大学获得博士学位,主要从事激光与物质相互作用、能源科学技术与工程等的研究。
E-mail: tianjian@cust.edu.cn
Serum Albumin by Fluorescence and Surface Enhanced Raman Spectra
SHEN Bing-jun1, JIN Li-hong2, ZHANG Jia-jia2, LIU Rong-juan2, LIU Zhan-wei2, LIU Yu-xin2, CHAI Hao2, TIAN Jian1*
(1.LaboratoryofCleanEnergyTechnology,ChangchunUniversityofScienceandTechnology,Changchun130022,China; 2.SchoolofLifeScienceandTechnology,ChangchunUniversityofScienceandTechnology,Changchun130022,China)
*CorrespondingAuthor,E-mail:tianjian@cust.edu.cn
Under simulated physiological conditions, the binding mechanism betweenp-Coumaric acid (p-CA) and human serum albumin (HSA) was investigated by fluorescence spectrum and surface enhanced Raman scattering (SERS). The results show that the effect betweenp-CA and HSA is a static fluorescence quenching with Förster’s non-radioactive energy transformation. At 298, 304, 310 K, the binding constants (KA) betweenp-CA and HSA are 3.41×104, 2.09×104, 1.38×104L/mol, the binding site (n) value is approximate to 1. SERS reveals that the phenolic group ofp-CA combines with HSA. Thermodynamic data indicate that the interaction betweenp-CA and HSA is mainly electrostatic attraction. Marker competition experiments point out that the primary binding site forp-CA is located at site Ⅰ in HSA. According to Förster energy transfer theory, the binding distance betweenp-CA and HSA is 5.11 nm. Synchronous fluorescence spectra show that the conformation of HSA does not changed apparently with the addition ofp-CA.
fluorescence spectrum; surface enhanced Raman scattering;p-Coumaric acid; human serum albumin; reaction mechanism
1000-7032(2016)10-1259-08
2016-04-18;
2016-08-04
国家自然科学基金(21153003); 吉林省教育厅项目(201574); 长春理工大学博士后基金(2014年)资助项目
O657.3
A
10.3788/fgxb20163710.1259

