环尾狐猴源弓形虫的检测与鉴定
单 芬 李康信 徐春忠 陈 武* 彭仕明 李婉萍 李国清*
(1.广州动物园,广州,510070;2.华南农业大学兽医学院,广州,510642;3.上海市野生动物园有限公司,上海,201300)
环尾狐猴源弓形虫的检测与鉴定
单 芬1李康信2徐春忠3陈 武1*彭仕明1李婉萍1李国清2*
(1.广州动物园,广州,510070;2.华南农业大学兽医学院,广州,510642;3.上海市野生动物园有限公司,上海,201300)
环尾狐猴;
为了确定引起广东环尾狐猴(Lemurcatta)呼吸困难、厌食和出血性肺炎症状的病原,从2只死亡的环尾狐猴体内无菌采集心肝肺肾组织样本。通过病原形态学观察,鉴定为弓形虫(Toxoplasmasp.)后,另外采集在狐猴笼舍出现的2只老鼠和1只猫4份组织样本。所有样本分别采用荧光定量PCR及一步法PCR技术进行弓形虫的检测与529 bp重复序列分析。以弓形虫B1基因片断为扩增对象的荧光定量PCR检测显示6份样本的CT为25.84~30.29,溶解曲线中均出现明显峰值,核酸定量峰值均大于阳性对照。用一步法PCR自6份样本中均扩增出529 bp目的片段,测序和Blast分析显示,该目的片段与GenBank中登录号为KC607824和DQ779189的刚地弓形虫(Toxoplasmagondii)核苷酸序列相似性最高,均为98.7%;与国际标准强毒虫株RH的核苷酸相似性为98.5%。这些结果表明,荧光定量PCR技术可以用于环尾狐猴弓形虫病的快速诊断,本次环尾狐猴的死亡可能是由于弓形虫的感染引起的,刚地弓形虫可能由野猫与老鼠传播。
刚地弓形虫是一种细胞内寄生原虫,在分类上隶属顶复门(Apicomplexa)、孢子虫纲(Sporozoasida)、真球虫目(Eucoccidiorida)、弓形虫科(Toxoplasmatidae)、弓形虫属。弓形虫呈世界性分布,目前人和200多种动物均可感染,猫是其终末宿主,人及其他动物均为中间宿主。弓形虫病对人及动物的危害很大,孕妇感染弓形虫后导致早产、流产、胎儿发育畸形,也是免疫功能低下患者(如AIDS病人等)死亡的主要原因。动物感染很普遍,但多数呈隐性感染[6]。对于弓形虫病的诊断,国内外学者作了多方面的探索,包括病原学、免疫学和分子生物学诊断方法[7-8]。分子生物学诊断方法以其简便、快速、特异、敏感等优点,已被广泛应用于弓形体核酸的直接检测。本研究就是采用荧光定量PCR及常规PCR方法对圈养疑似感染弓形虫病急性死亡的环尾狐猴病例进行分子生物学诊断,为圈养环尾狐猴的弓形虫病的诊断、治疗和预防提供科学依据。
1 材料与方法
1.1 材料
1.1.1 病料组织
无菌采集2015年12月广东某地圈养死亡的2只环尾狐猴(1♂1♀)心肝肺肾组织,另取在环尾狐猴笼舍出现且死亡的1只猫及2只老鼠的肺和淋巴组织,-20℃保存备用。
1.1.2 主要试剂
Taq酶、Buffer、MgCl2、dNTPs为大连宝生物公司产品;AceQ qPCR SYBR Green Master Mix试剂盒为诺唯赞生物科技公司产品;TIANamp Genomic DNA Kit试剂盒为天根公司产品;TaKaRa Agarose Gel DNA Purification试剂盒为大连宝生物公司产品。pGEM-T载体质粒和感受态细胞DH5α均为天根生物技术公司产品。TaKaRa MiniBEST Plasmid Purification Kit Ver 4.0质粒提取试剂盒为大连宝生物公司的产品。
1.2 方法
1.2.1 环尾狐猴发病症状的观察、病理变化与虫体的分离鉴定
那一路日本兵过江后,就直奔沈家大院而来了。沈老七不得不开门把日本人迎进院里。那个挎着长刀的日本军官叽里咕噜几句后,几个日本兵就又出院门去了,一会儿后他们就牵来了几头大黄牛。那群日本兵将牛的腿脚绑在院门外的柳树上,就开始用军刀在牛屁股、牛腿上割肉,那牛就“哞哞”惨叫,血不断线地往下流。那些割下来的活牛肉放在砧板上还跳得老高,像是还有生命样的。他们把这些牛肉褪去皮毛,就在沈家大院架火烧烤。吃完了又去割。
观察记录环尾狐猴的发病症状。在环尾狐猴出现死亡时,解剖狐猴,观察器官的病理变化,将发病死亡动物的心、肺等脏器进行剪切并匀浆处理后加入适量盐酸胃蛋白酶溶液于37℃摇床消化1 h。经过滤、离心、中和等步骤,用灭菌生理盐水制成1∶10混悬液每1 mL加青霉素和链霉素各1 000 U,腹腔接种小白鼠5只,每只小白鼠接种1 mL。接种后观察,如小白鼠有皮毛松竖、弓背、闭目、腹部膨大、颤动或呼吸急促等症状,立即剖杀取腹水、肝、脾、脑等组织做涂片,姬姆萨染色镜检。如果接种小白鼠不发病则取小白鼠脑、心、肝、脾等组织按上法制成悬液继续盲传数代。另取病料进行细菌和病毒的分离培养。
1.2.2 病料组织的处理及DNA提取
将无菌采集的6份病料组织样品分别置于新的1.5 mL Eppendorf管中,用灭菌的微型剪刀将病变组织剪碎,然后加入200 μL的Buffer GA反复研磨,再加入20 μL的蛋白酶K,混匀后,放于54℃恒温水浴锅中消化3~4 h(每30 min震荡混匀1次)。消化好的组织悬液按TIANamp Genomic DNA Kit使用说明进行组织DNA提取,DNA样品于-20℃冰箱保存备用。
1.2.3 荧光定量PCR
根据GenBank中弓形虫各株中最为保守的B1基因设计引物,参考朱祥明等[9]设计的荧光定量引物和最佳扩增体系和反应条件,并进行优化,其中上游引物序列为P1:5′-TCCTTCGTCCGTCGTAAT-3′;下游引物序列为P2:5′-TTCTTCAGCCGTCTTGTG-3′,扩增片段预计长度为223 bp,引物由上海生工基因测序技术有限公司合成。采用AceQ qPCR SYBR Green Master Mix试剂盒进行荧光定量PCR检测,反应体系设置为:10×Buffer(with Mg2+)2.5 μL,dNTP(2.5 mmol/L)2.0 μL,P1(10 pmol/μL)0.5μL,P2(10 pmol/μL)0.5 μL,SYBR Green1(10×)0.5 μL,TaqHS(5 U/μl)0.2 μL,模板DNA 1.0 μL,补Rnase-free H2O至总体积25 μL。反应条件:95℃10 s、95℃ 5 s、60℃ 30 s,共40个循环。
1.2.4 PCR扩增及核苷酸序列比对分析
参考Homan等[10]报道的刚地弓形虫529 bp重复序列,采用TOX4/TOX5的引物扩增,上游引物TOX4序列为5′-CGCTGCAGGGAGGAAGACGAAAGTTG-3′,下游引物序列TOX5序列为:5′-CGCTGCAGACACAGTGCATCTGGATT-3′,引物由上海生工基因测序技术有限公司合成,预期扩增产物为529 bp。PCR反应采用宋慧群等提供的条件[11]进行设置:10×PCR buffer(with Mg2+)3.5 μL、dNTP(2.5 mmol/ L)2.0 μL、Taq酶(5U/μl)0.2 μL、TOX4(10 pmol/μL)0.5 μL;TOX5(10 pmol/μL)0.5 μL,模板DNA 1.0 μL,补双蒸水至25 μL,设置阴性对照和阳性对照各1个。反应参数为预变性94℃5 min、变性94℃30 s、退火57℃30 s、延伸72℃ 1 min 30 s、设置30循环,最后72℃10 min,扩增片段预计大小为530 bp。扩增产物经1.5%TBE琼脂糖凝胶电泳,将目的片段胶回收之后,在0.2 μL微量离心管中依次加入10×T4 DNA Ligation Buffer 1 μL,pGEM-T 载体(50 ng/μL)1 μL,T4 DNA Ligase 1 μl,PCR 纯化产物5 μL,ddH20补至10 μL,混匀置4℃冰箱连接过夜。将上述连接产物转化至DH5α感受态细胞,然后向每个离心管加入900 μL的无菌LB培养基(不含Amp+),混匀后置于37℃摇床振荡培养45 min(150 rpm),待菌体复苏后,吸取100 μL涂布于含Amp+、X-gal和IPTG的LB琼脂平板中,置恒温摇床中按150 rpm于37℃培养过夜。通过蓝白斑筛选法,挑选白色的菌落,置于1.5 mL的Eppendorf管,然后向每个离心管加入900 μL的无菌LB培养基(含Amp+),混匀后置于37℃摇床振荡培养过夜(150 rpm),然后进行菌液PCR进一步验证质粒连接与转化的情况。阳性菌液采用TaKaRa MiniBEST Plasmid Purification Kit Ver 4.0试剂盒抽提重组质粒。并将样本送上海生工基因测序技术有限公司测序,结果用Lasergene软件进行分析。并将序列登陆NCBI网站进行BLAST分析,并下载相关序列,进行核苷酸序列比对分析。参考虫株信息详见表1。
表1序列分析比对参考虫株
Tab.1 Reference toxoplasma strains used for sequence analysis and comparison
2 结果
2.1 环尾狐猴的发病症状、病理变化与虫体的形态学观察
环尾狐猴初期表现为精神不佳,1~4 d后出现厌食、嗜睡、呼吸困难,妊娠母猴流产,并迅速出现死亡。死亡的狐猴肺脏严重水肿、出血,肝脏和脾脏肿大、出血,其中肝脏表面呈土黄色(图1,图2),淋巴结高度肿胀,切面呈干酪样变化。将狐猴组织接种小白鼠盲传5代,在感染死亡小鼠腹水中可见到大量新月形的弓形虫速殖子,细菌和病毒培养阴性。初步判断发病死亡环尾狐猴为弓形虫感染。

图1 环尾狐猴肺部严重水肿、出血Fig.1 Pulmonary edema and hemorrhage in ring-tailed lemur
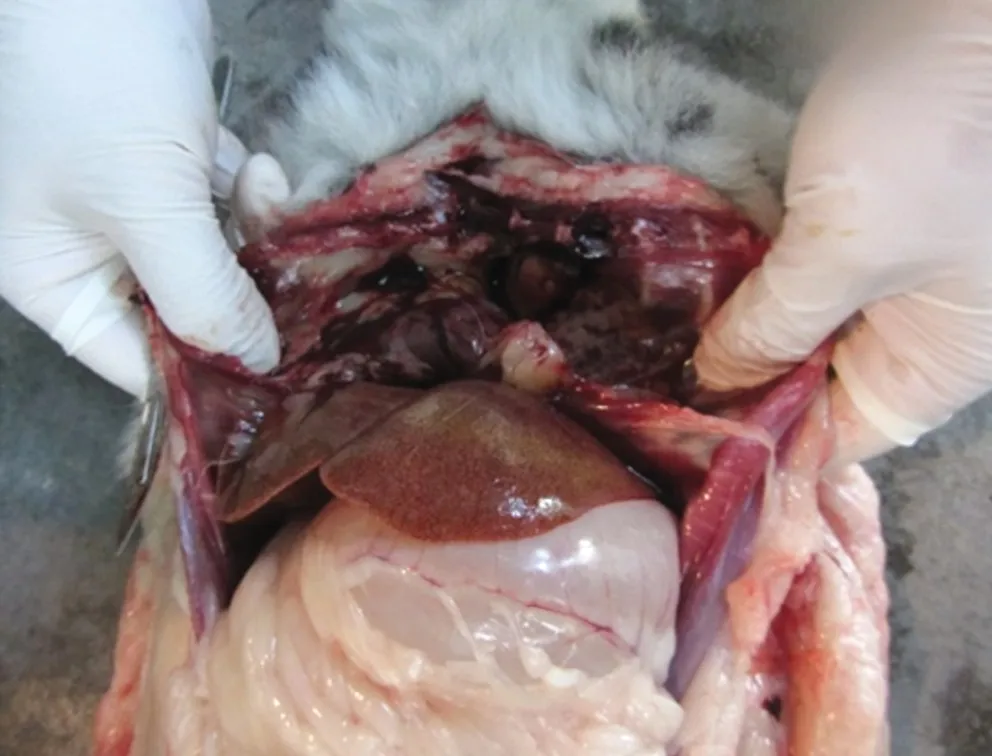
图2 环尾狐猴肝脏肿大、出血Fig.2 Liver became swelling,hemorrhage in ring-tailed lemur

图3 小鼠腹水涂片可见弓形虫速殖子Fig.3 Toxoplasma gondii trophozoites at ascitic fluid smears of mouse
2.2 荧光定量PCR
荧光定量PCR检测6份样品,通过分析PCR产物溶解曲线(图1),可见阴性对照在编号83的位置消失,而6份样品及阳性对照均在编号87的位置形成峰值,由此可知所有检测样本均为阳性。表2所示为弓形虫荧光定量PCR检测中部分峰值所对应的核酸定量值,阴性对照中最大峰值为78.5,若峰值大于此值则为阳性。可知所检样本均出现大于78.5的核酸定量值,其中脑组织和肺组织中的最大为86,最低为心肝肺肾混合组织中的85.7,高于阳性对照中的85.5(表2)。荧光定量PCR检测样本的CT值详见表3,由图1和表2、表3综合分析此次6份样本荧光定量PCR检测均为阳性。
2.3 PCR扩增及序列分析
PCR产物经琼脂糖凝胶电泳,可见片段大小约为529 bp左右,与预期目的片段大小一致,结果详见图2。由图可见环尾狐猴肠、肺、心肝肾混合物以及同笼舍中鼠的淋巴结圴呈现强阳性,而猫的肺和淋巴结组织中呈现弱阳性。胶回收产物经基因公司测序后,12份样品序列全长均为529 bp,相互之间核苷酸相似性为100%,命名为RTL01。将序列登陆NCBI进行Blast比对,与登录号KC607824、DQ779189等刚第弓形虫序列相似性最高达到98.7%。经过比对分析后可知此序列为刚到弓形虫的B1基因片段与弓形虫标准毒株RH株(登录号:DQ779191)核苷酸相似性为98.5%;与其他相关虫株的序列核苷酸相似性在97.9%~98.7%之间(图3),核苷酸序列详细差异情况见图6。

图4 弓形虫荧光定量PCR检测溶解曲线Fig.4 The dissolution curves of fluorescent quantitative PCR method for detecting Toxoplasma B1 Gene fragment
表2 弓形虫荧光定量PCR检测核酸定量峰值
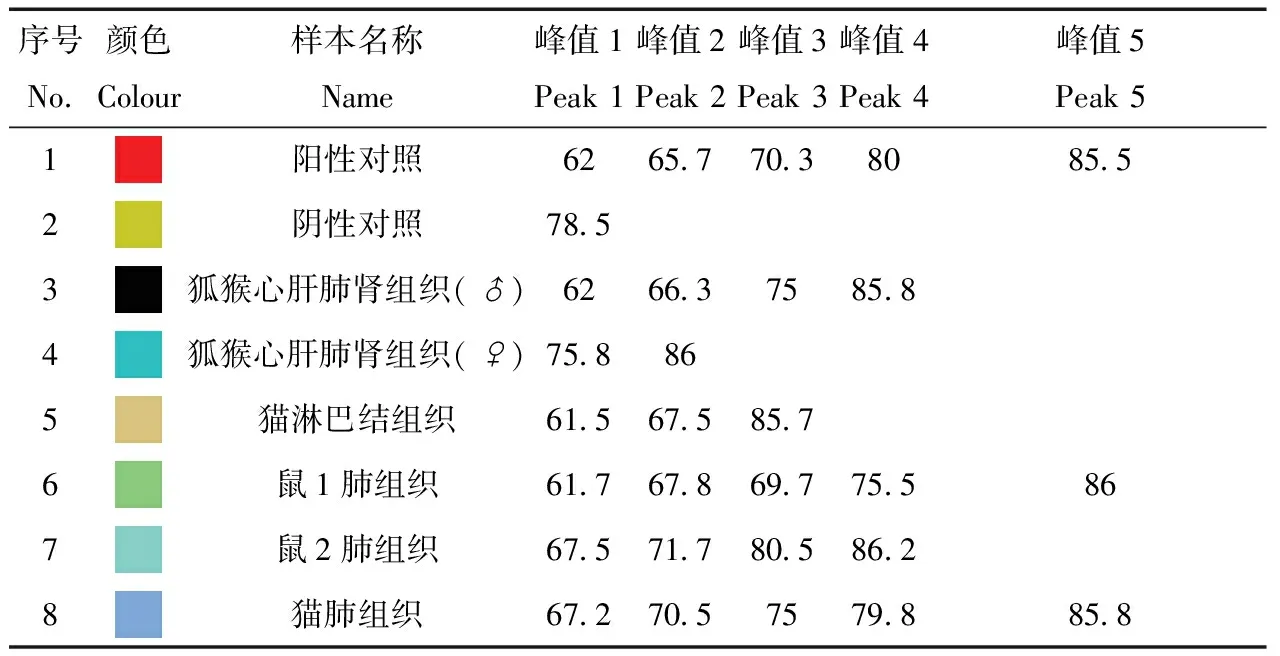
Tab.2 Quantitative nucleic acid peak values of fluorescent quantitative PCR method for detecting Toxoplasma B1 Gene fragment
表3 弓形虫荧光定量PCR检测CT值
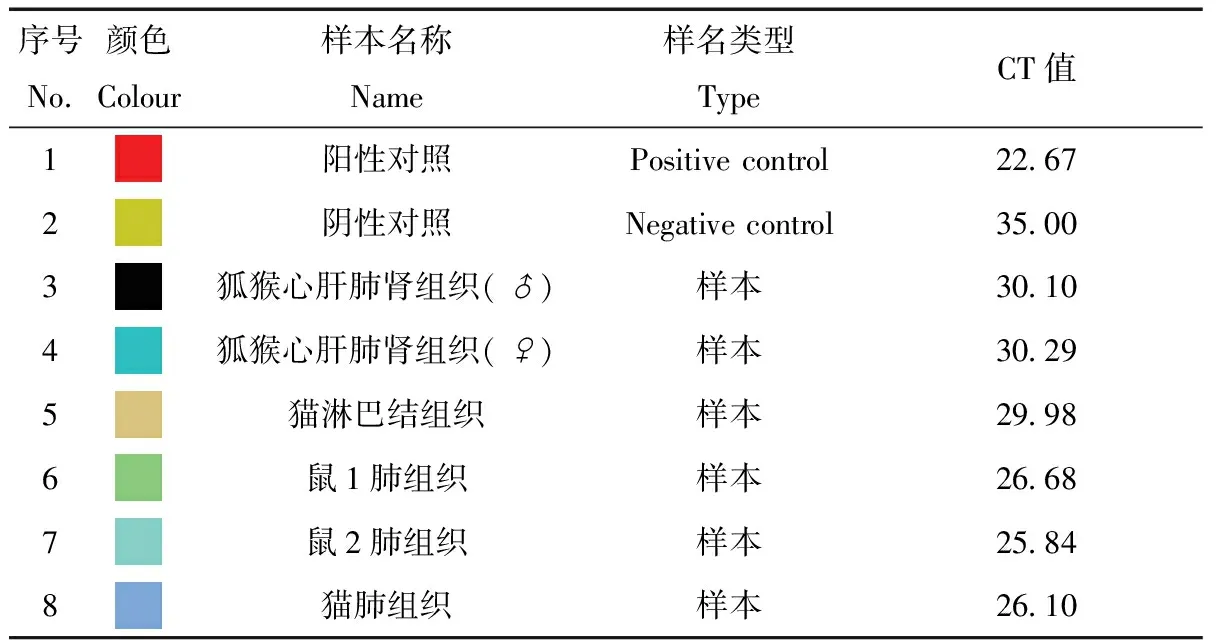
Tab.3 The CT values of fluorescent quantitative PCR method for detecting Toxoplasma B1 Gene fragment

图5 弓形虫529 bp DNA 片段的PCR 扩增产物琼脂糖胶电泳Fig.5 Agarose gel electrophoresis of PCR products of 529 bp DNA fragment from Toxoplasma gondii注:M:DNA标准(DL 2 000);1、2:环尾狐猴(♂)肠系膜;3、4:环尾狐猴(♂)心肝肾混合组织;5、6:环尾狐猴(♀)心肝肺肾混合组织;7、 8:猫肺组织;9、10:猫淋巴结组织;11:鼠1淋巴结组织;12:鼠2淋巴结组织;13:阳性对照;14:阴性对照Note:M:DL-2000 DNA Marker;1,2:the male ring-tailed lemur mesentery;3,4:the male ring-tailed lemur mixed tissues of heart,liver and kidney;5,6:the female ring-tailed lemur mixed tissues of heart,liver,lung and kidney;7,8:lung tissue of cat;9,10:lymph node tissue of cat;11:lymph node tissue of rat 1;12:lymph node tissue of rat 2;13:positive control;14:negative control
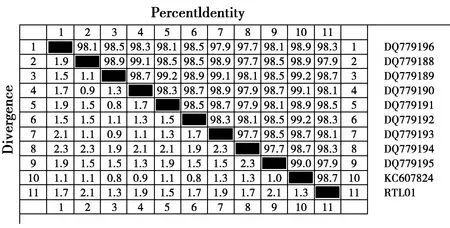
图7 不同虫株529 bp DNA片断碱基序列相似性比较Fig.7 Similarity comparison of the 529 bp DNA fragment sequences among different Toxoplasma gondii strains注:RTL01代表环尾狐猴源弓形虫序列,DQ779196,DQ779188, DQ779189,DQ779190,DQ779191,DQ779192,DQ779193, DQ779194, DQ779195,KC607824分别代表不同的弓形虫株(参见表1)Note:RTL01 represents the sequence of Toxoplasma gondii from ring-tailed lemur,DQ779196,DQ779188, DQ779189,DQ779190,DQ779191,DQ779192,DQ779193, DQ779194, DQ779195,KC607824 represent different Toxoplasma gondii strains(cf Table 1)


图6 不同虫株529 bp DNA片断碱基序列比较Fig.6 Comparison of the 529 bp DNA fragment sequences among different Toxoplasma gondii strains注:“.”表示与A位置的碱基相同,“-”表示此位置缺失1个碱基。RTL01代表环尾狐猴源弓形虫序列,DQ779196,DQ779188, DQ779189,DQ779190,DQ779191,DQ779192,DQ779193, DQ779194, DQ779195,KC607824分别代表不同的弓形虫株(参见表1)Note:“.” represents the same base as in the ITS sequence of the sample A;“-” represents the alignment gap.RTL01 represents the sequence of Toxoplasma gondii from ring-tailed lemur.DQ779196,DQ779188, DQ779189,DQ779190,DQ779191,DQ779192,DQ779193, DQ779194, DQ779195,KC607824 represent different Toxoplasma gondii strains(cf Table 1)
3 讨论
3.1 2015年广东某地圈养弓形体感染死亡的环尾狐猴发病初期症状主要表现为:精神沉郁、食欲缺乏、部分母兽出现流产,发病初期体温升高至39℃以上而后迅速下降至濒死期的35℃以下。感染死亡的雄性环尾狐猴主要表现中度肺炎、轻度肝炎症状,雌性环尾狐猴主要表现坏死性肠系膜淋巴结炎、肝炎、间质性肺炎、肺水肿等病理变化。这些症状与Spencer等报道的环尾狐猴弓形虫感染主要临床症状(呼吸困难、倦怠、食欲缺乏等)和病理变化(肺炎、肝炎等特征性病变)基本吻合[4]。
3.2 近年来国内外关于人和动物弓形虫病特异PCR诊断、检测方法的研究很多[7-8]。由于PCR方法的敏感性主要取决于目的DNA片段在基因组的拷贝数,因此可采用不同的目的DNA片段,包括35个拷贝数的BI基因[12-13],ITS-1[14-16]及200~300个拷贝的529 bp重复序列[10]等。本研究中采用的荧光定量PCR以B1基因作为扩增对象,一步法PCR则采用弓形虫的529 bp重复序列作为扩增对象,两者的检测结论一致并由形态学鉴定确认。荧光定量PCR由于高灵敏、高特异、低污染和实时检测的特点,已广泛应用于多种病原体的检测。但是由于其过高的敏感性,可能会存在假阳性的情况,所以我们把它作为本病原检测的初筛,然后再采用一步法PCR检测进行确诊。本研究中无菌采集的6份样品无论采用荧光定量PCR还是一步法PCR进行弓形虫检测,其结果均为阳性,荧光定量PCR检测中强阳性的猫肺组织和淋巴结组织,在使用常规PCR中扩增529 bp片段阳性并不明显,此正好印证了荧光定量PCR的高灵敏性。
3.3 从发病死亡的环尾狐猴、在猴舍内出现的猫和老鼠的组织样本中均检测到弓形虫,且529 bp序列完全一致,这说明本次环尾狐猴发生弓形虫感染可能是由野猫将弓形虫传播给老鼠,再由携带弓形虫的老鼠通过接触狐猴的日粮或排泄粪尿至狐猴食盆等处,导致狐猴接触弓形虫而感染(野猫与狐猴没有直接接触)。测序与blast分析结果表明,该虫株其与刚地弓形虫529 bp重复序列(GenBank中登录号为KC607824、DQ779189)的核苷酸相似性为98.7%,这说明环尾狐猴感染的虫株为刚地弓形虫。
3.4 弓形虫可以感染多种哺乳动物,猫科动物是弓形体的终末宿主,其他动物采食到猫科动物随粪便排除的虫卵囊而感染[6]。目前动物园圈养条件的非洲狮(PantheraLeo)、猞猁(Lynxlynx)、山猫等动物均是弓形虫的易感动物[17]。1962年以来多次报道圈养环尾狐猴死于弓形体感染,说明环尾狐猴对弓形虫高度易感[1-5]。加强环尾狐猴的饲养管理,有效切断传染源是防控该病的关键。如建立严格的卫生防疫体系,让猫科动物、鼠、鸟等可能携带弓形虫的动物和环尾狐猴相隔离。某些动物园将环尾狐猴饲养在一个封闭独立的岛上,远离其他动物并且不直接和公众接触,但是有时水果、蔬菜可能被弓形体卵囊污染,在岛上自由采食的麻雀(Passermontanus)、乌鸫(Turdusmerula)等野鸟也可能会携带污染了弓形虫卵囊的水果蔬菜而造成环尾狐猴的感染。本次案例中发病的环尾狐猴饲养环境中多有老鼠、野猫等出没,周围也时有野鸟停留,这为刚地弓形虫的传播提供了条件。某些携带弓形虫的动物并不会出现明显发病症状,但是在一定条件下诸如发生应激或其他病原微生物感染等则会导致弓形虫从局部感染发展至全身性感染,造成动物的死亡。因此,饲养环尾狐猴等动物时应尽量减少更换笼舍、捕捉等操作避免动物出现应激的行为。
[1] Sureau P,Raynaud J P,Lapeire C,et al.Premier isolement deToxoplasmagondiia Madagascar.Toxoplasmose spontanée et expérimentale duLemurcatta[J].Bulletin de la Société de Pathologie Exotique,1962,55:357-362.
[2] Nigi H,Itakura C.Spontaneous toxoplasmosis inLemurcatta[J].Primates,1968,9(1):155-160.
[3] Brack M,Wohlsein P,Minnemann D,et al.Toxoplasmosis outbreak in ring-tailed lemurs(Lemurcatta)and squirrel monkeys(Saimirisciureus)[J].Primate Report,1998,50:71-82.
[4] Spencer J A,Joiner K S,Hilton C D,et al.Disseminated toxoplasmosis in a captive ring-tailed lemur(Lemurcatta)[J].Journal of Parasitology,2004,90(4):904-906.
[5] Juan-Sallés C,Mainez M,Marco A,et al.Localized toxoplasmosis in a ring-tailed lemur(Lemurcatta)causing placentitis,stillbirths,and disseminated fetal infection[J].Journal of Veterinary Diagnostic Investigation,2011,23(5):1041-1045.
[6] Dubey J P.Toxoplasmosis of animals and humans[M].2nd.ed.Boca Raton:CRC Press inc,2009:1-313.
[7] Remington J S,Thulliez P,Montoya J G.Recent developments for diagnosis of toxoplasmosis[J].Journal of Clinical Microbiology,2004,42(3):941-945.
[8] Switaj K,Master A,Skrzypczak M,et al.Recent trends in molecular diagnostics forToxoplasmagondiiinfections[J].Clinical Microbiology and Infection,2005,11(3):170-176.
[9] 朱祥明,杨通汉,杨国庆,等.弓形虫SYBR-Greenl荧光定量PCR检测方法的建立及应用[J].中国病原生物学杂志,2007,2(6),428-432.
[10] Homan W L,Vercammen M,De Braekeleer J,et al.Identification of a 200-to 300-fold repetitive 529 bp DNA fragment inToxoplasmagondii,and its use for diagnostic and quantitative PCR[J].International Journal for Parasitology,2000,30(1):69-75.
[11] 宋慧群,张德林,廖申权,等.中国弓形虫虫株 529 bp 重复序列的 PCR 扩增,克隆及分析[J].中国农业科学,2007,40(9):2114-2118.
[12] Burg J L,Grover C M,Pouletty P,et al.Direct and sensitive detection of a pathogenic protozoan,Toxoplasmagondii,by polymerase chain reaction[J].Journal of Clinical Microbiology,1989,27(8):1787-1792.
[13] Pelloux H,Guy E,Angelici M C,et al.A second European collaborative study on polymerase chain reaction forToxoplasmagondii,involving 15 teams[J].FEMS Microbiology Letters,1998,165(2):231-237.
[14] Homan W L,Limper L,Verlaan M,et al.Comparison of the internal transcribed spacer,ITS 1,fromToxoplasmagondiiisolates andNeosporacaninum[J].Parasitology Research,1997,83(3):285-289.
[15] Hurtado A,Aduriz G,Moreno B,et al.Single tube nested PCR for the detection ofToxoplasmagondiiin fetal tissues from naturally aborted ewes[J].Veterinary Parasitology,2001,102(1):17-27.
[16] Jauregui L H,Higgins J,Zarlenga D,et al.Development of a real-time PCR assay for detection ofToxoplasmagondiiin pig and mouse tissues[J].Journal of Clinical Microbiology,2001,39(6):2065-2071.
[17] Sobrino R,Cabezón O,Millán J,et al.Seroprevalence ofToxoplasmagondiiantibodies in wild carnivores from Spain[J].Veterinary Parasitology,2007,148(3):187-192.
Ring-tailed lemur;Toxoplasmagondii;Fluorogenic quantitative PCR;Polymerase Chain Reaction
DetectionandIdentificationofToxoplasmafromRing-TailedLemur(Lemurcatta)
ShanFen1LiKangxin2XuChunzhong3ChenWu1*PengShiming1LiWanping1LiGuoqing2*
(1.GuangzhouZoo,Guangzhou,510070,China;2.CollegeofVeterinaryMedicine,SouthChinaAgriculturalUniversity,Guangzhou,510642,China;3.ShanghaiWildAnimalParkCompanyLimited,Shanghai,201300,China)
We sampled tissues of heart,liver,lung and kidney from two dead Ring-tailed lemurs(Lemurcatta)to identify the pathogens of lemurs that showed symptoms of dyspnea,anorexia and hemorrhagic pneumonia in Guangdong.After the pathogen was identified by morphological observation asToxoplasma,4 tissue samples from one cat and two rats which appeared in the enclosure of the dead lemurs were collected.All samples were examined by fluorescent quantitative PCR and one step PCR that were specific for Toxoplasma. We conducted sequence analysis of 529 bp fragments that was amplified using one step PCR. The CT values of six samples were 25. 84-30. 29 as determined by the fluorescent quantitative PCR method for detecting the Toxoplasma B1 Gene fragment. There were significant peaks in the dissolution curves of six samples whose quantitative nucleic acid peak values were greater than those of a positive control. The 529 bp DNA fragments were amplified and cloned from all six samples by one step PCR. The target DNA fragment was sequenced and analyzed using BLAST in GenBank. The result showed that the fragment had the highest similarity( 98. 7%) with 2 Toxoplasma gondii sequences( accession numbers: KC607824 and DQ779189) and with the international standard virulent strain of Toxoplasma gondii the RH was 98. 5%. Generally,the fluorescent quantitative PCR can be considered a rapid diagnostic technique for detecting toxoplasmosis of ring-tailed lemur. The death of ring-tailed lemur might be caused by Toxoplasma gondii which might be spread by cat and rat.
稿件运行过程
2016-02-11
修回日期:2016-02-27
发表日期:2016-05-10
刚地弓形虫;
荧光定量PCR;
PCR
S858.9
A
2310-1490(2016)02-118-08
共同第一作者简介:单芬,女,33岁,兽医师;主要从事圈养野生动物保育与疾病防控工作。 李康信,男,25岁,硕士研究生;主要从事兽医寄生虫研究。
*
陈武,E-mail:guangzhouchenwu@sina.com;李国清,E-mail:gqLi@scau.edu.cn

