PbCl2-ZnCl2-H2O和CaCl2-PbCl2-H2O三元体系373 K相平衡
张学平,崔瑞芝,刘乾,桑世华, 2
PbCl2-ZnCl2-H2O和CaCl2-PbCl2-H2O三元体系373 K相平衡
张学平1,崔瑞芝1,刘乾1,桑世华1, 2
(1成都理工大学材料与化学化工学院,四川成都610059;2矿产资源化学四川省高校重点实验室,四川成都610059)
采用等温溶解平衡法研究了两个三元体系PbCl2-ZnCl2-H2O和CaCl2-PbCl2-H2O在373 K时的相平衡,测定了平衡溶液的溶解度和密度,并根据溶解度数据和对应的平衡固相绘制了相图和密度-组成图,根据相图对单变量曲线和结晶区进行了讨论。研究发现,两个三元体系均为简单共饱和型,均无复盐和固溶体生成,有一个共饱点,两条单变量曲线,两个结晶区。平衡液相对应的固相由XRD确定,并对实验结果进行了简要的讨论。
相平衡;溶解度;氯化铅;氯化锌;氯化钙
引 言
电解质溶液的热力学研究对于理解热液成矿和湿法冶金过程有很大的作用[1]。氯化锌是无机盐工业的重要产品之一,具有很广泛的应用。氯化锌溶液在工业上可用作聚丙烯腈的溶剂,可以清除金属表面的氧化物。氯化锌溶液的密度相对很大[2-5],并且氯化锌在水中具有很强的溶解性。而氯化铅在水中的溶解度较小。氯化铅在储能电池和矿物加工领域具有很重要的经济意义,其在稀溶液中的溶液热力学已经得到了较为广泛的研究[6]。
溶解度法是研究水盐体系相平衡的主要实验方法,其中最常用的是等温法和变温法[7-9]。昆明冶金研究所的杜澍芝[10]对氯化铅在锑盐中的溶解度进行了研究,该研究对于锑铅共生矿锑铅的分离有一定的意义。西北大学王惠等[11]研究了四元体系KCl-ZnCl2-HCl-H2O体系在298 K下的相图,并从体系中发现并得到了未见文献报道的5:4型新化合物5KCl·4ZnCl2·3H2O。乔占平等[12]对四元体系NaCl-ZnCl2-HCl-H2O的研究表明,通过NaCl与ZnCl2在HCl-H2O介质中相化学反应,发现了具有特殊组成比的新化合物(5NaCl·ZnCl2·0.5H2O),并在体系中得到了较纯的该化合物。Blidin[13]对ZnCl2-LiCl-H2O在298、313 K下的相平衡进行了研究。PbCl2在NaCl、HCl和CaCl2溶液中的溶解度已经得到研究[14-16]。三元体系CaCl2-ZnCl2-H2O在273.15、298.15 K下的相图已见报道[17]。Vedat等[18]研究了三元体系NaCl-ZnCl2-H2O在273.15 K下的溶解度。Felmy等[19]运用溶液热力学模型研究了Pb2+-Na+-K+-Ca2+-Mg2+-H+-Cl--SO42--H2O体系的热力学。但是373 K下两个体系的相平衡研究均未见文献报道。
铅在氯化物溶液中的溶解度研究对于湿法冶金工艺具有非常重要的意义[20]。铅工业住往利用富含钠、铁、钾、铜的氯化物溶液。但是在这种溶液中只有温度大于60℃时铅的化合物才能达到较高的溶解度。因此,研究氯化铅在氯化钙、氯化锌等溶液中较高温度下的溶解度,能够应用于铅锌矿的湿法炼铅中。在铅锌矿的热液成矿过程中,铅、锌等金属离子与氯、硫等配体形成配合物,在热液中迁移。成矿流体包裹体一般含Na+、K+、Mg2+、Ca2+、F-、Cl-、SO42−等离子。成矿流体中的NaCl、KCl、MgCl2、CaCl2等盐都会对铅锌在热液中的溶解、迁移产生影响。因此,铅锌在热液中特别是含氯含硫体系中的溶解度研究有助于认识铅锌等在热液中的活化、迁移、沉淀规律,共生和分离的原因;有助于更好理解铅锌矿的热液成矿过程。
采用等温溶解平衡法研究了两个三元体系PbCl2-ZnCl2-H2O和CaCl2-PbCl2-H2O在373 K时的相平衡,绘制了相图和密度-组成图。这两个三元体系相图的研究能够为盐类在较高温度下的溶解度研究提供基础数据,能够有助于理解铅锌矿的热液成矿和铅锌的湿法冶金过程。
1 实 验
1.1 实验药品与仪器
ZnCl2(分析纯,纯度98%),PbCl2(分析纯,纯度98%),CaCl2(分析纯,纯度96%)等,均产自成都市科龙化工试剂厂。去离子水(电导率<1·10-5S·m-1, pH =6.6)。
AL104型电子天平(1级标准校正);HZ-9613Y型高温油浴振荡器(温度精度±0.1 K);101-0AB型电热鼓风干燥箱;DX-500型X射线粉晶衍射仪。
1.2 实验方法
在磨口玻璃瓶中进行等温溶解平衡实验,从二元体系饱和点开始逐渐加入第2种盐直至过饱和,将配好的样品放入磨口玻璃瓶中,置于恒温油浴振荡器。恒温油浴振荡器的温度控制在(373±0.1) K,不断振荡以达到平衡,期间定期取上层清液进行化学分析,以液相化学组成恒定作为体系达到平衡的标志,测得平衡时间为3 d,平衡后静置2 d。待固液分离澄清后,取液相进行化学滴定,分析其含量。平衡液相密度使用密度瓶法测定。根据实验数据绘制相应的等温溶解度图和密度-组成图,并对溶解度数据和密度-组成图进行分析,得出共饱点组成和各结晶区的大小。平衡固相的确定采用XRD。
1.3 分析方法
Pb2+和Zn2+总量:采用EDTA络合滴定法,pH 5.4~5.9,以乙酸-乙酸钠作为缓冲溶液,二甲酚橙作为指示剂。
单Pb2+:加入硫酸使铅锌分离后,采用EDTA络合滴定法,pH 5.4~5.9,以乙酸-乙酸钠作为缓冲溶液,二甲酚橙作为指示剂。
Pb2+和Ca2+总量:采用EDTA络合滴定法,以氯化铵-氨水作为缓冲溶液,铬黑T作为指示剂。
单Pb2+:采用EDTA络合滴定法,pH 5.4~5.9,以乙酸-乙酸钠作为缓冲溶液,二甲酚橙作为指示剂。
每组样品平行测定3次,3次平行实验的误差不超过0.5%。
2 实验结果与讨论
2.1 三元体系PbCl2-ZnCl2-H2O
三元体系PbCl2-ZnCl2-H2O 373 K 相平衡和平衡溶液的物化性质列于表1中。图1为该三元体系373 K时的相图。图2为三元体系在373 K下的局部放大相图。由图1和图2可见,该三元体系为简单共饱和型,无复盐和固溶体生成。该三元体系有一个共饱点E,E点所对应的平衡固相为PbCl2和ZnCl2。共饱点E的液相组成(质量分数)为(ZnCl2)= 76.93%,(PbCl2)=3.35%。两条单变量曲线,分别为AE和BE。从图1、图2可以看出,氯化锌对氯化铅有一定的增溶作用,但增溶作用不明显。在溶解度曲线AE上,氯化铅的溶解度随氯化锌含量的增加先减小后增大,在E点达到最大值,质量分数为3.35%。两个结晶区,分别为PbCl2的结晶区ACE和ZnCl2的结晶区BDE。结晶区的大小顺序为:PbCl2的结晶区ACE大于ZnCl2的结晶区BDE。由结晶区可见,氯化铅的溶解度小于氯化锌。图3为三元体系在373 K 时的共饱点E点的XRD谱图。由图3可知,共饱点E点对应的平衡固相为PbCl2和ZnCl2。
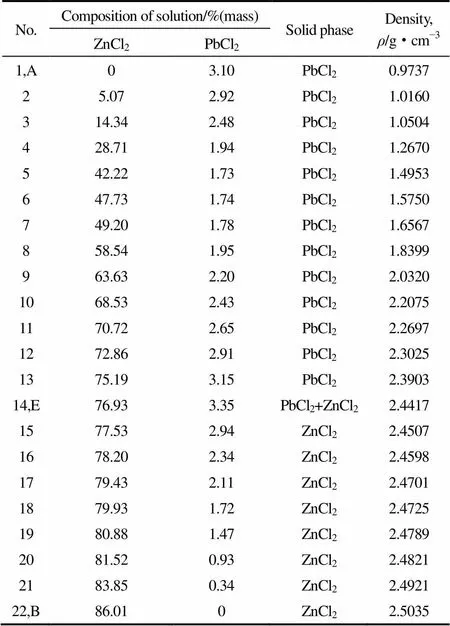
表1 三元体系PbCl2-ZnCl2-H2O在373 K下的溶解度和密度数据
图4为三元体系PbCl2-ZnCl2-H2O的密度-组成图。由图可见,密度随氯化锌含量的增加而增大。氯化锌的溶解度比氯化铅的溶解度大,对溶液密度的影响较大。密度在B点达到最大值,为2.5035 g·cm-3。
2.2 三元体系CaCl2-PbCl2-H2O
三元体系CaCl2-PbCl2-H2O 373 K相平衡和平衡溶液的物化性质列于表2中。图5为该三元体系373 K时的相图。图6为三元体系在373 K下的局部放大相图。由图5、图6可见,该三元体系为简单共饱和型,无复盐和固溶体生成。该三元体系有一个共饱点E1,E1点为CaCl2·2H2O和PbCl2的共饱点。共饱点E1的液相组成(质量分数)为(CaCl2)=44.16%,(PbCl2)=8.91%。两条单变量曲线,分别为A1E1和B1E1。从图5、图6可以看出,氯化钙对氯化铅有较为明显的增溶作用。在溶解度曲线A1E1上,氯化铅的溶解度随氯化钙含量的增加先减小后明显增大,在E1点达到最大值,质量分数为8.91%。两个结晶区,分别为PbCl2的结晶区A1C1E1和CaCl2·2H2O的结晶区B1D1E1。结晶区的大小顺序为:PbCl2的结晶区A1C1E1大于CaCl2·2H2O的结晶区B1D1E1。由结晶区的大小可见,氯化铅的溶解度小于氯化钙。图7为三元体系共饱点E1点的XRD谱图。由图7可知,共饱点E1点的固相为CaCl2·2H2O和PbCl2。
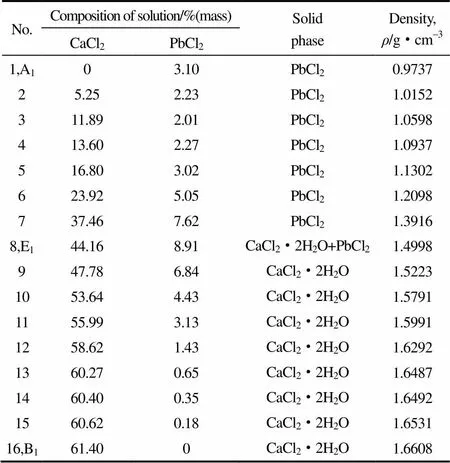
表2 三元体系CaCl2-PbCl2-H2O在373 K下的溶解度和密度数据
图8为三元体系CaCl2-PbCl2-H2O的密度-组成图。由图可见,密度随氯化钙含量的增加而增大。氯化钙的溶解度比氯化铅的溶解度大,对溶液密度的影响较大。密度在B1点达到最大值,为1.6608 g·cm-3。
3 结 论
(1)采用等温溶解平衡法,研究了两个三元体系PbCl2-ZnCl2-H2O和CaCl2-PbCl2-H2O在373 K时的相平衡,同时测定了平衡液相的物化性质(密度)。根据实验数据绘制了相图和密度-组成图。
(2)确定了两个三元体系无变量点的液相组成和对应的平衡固相的存在形式。
(3)两个三元体系均属于简单体系,无复盐和固溶体生成,均有一个共饱点,两条单变量曲线,两个结晶区。在三元体系PbCl2-ZnCl2-H2O中,ZnCl2对PbCl2有一定的增溶作用,但增溶作用不明显。而在三元体系CaCl2-PbCl2-H2O中,CaCl2对PbCl2有明显的增溶作用。
References
[1] WANG P M, ANDERKO A, SPRINGER R D,. Modeling chemical and phase equilibria in geochemical systems using a speciation-based model [J]. J. Geochem. Explor., 2010, 106(1/2/3): 219-225.
[2] HERRINGTON T M, ROFFEY M G, SMITH D P. Densities of aqueous electrolytes MnCl2, CoCl2, NiCl2, ZnCl2and CdCl2from 25 to 72℃ at 1 atm [J]. J. Chem. Eng. Data, 1986, 31(2): 221-225.
[3] POGUE R F, ATKINSON G. Solution thermodynamics of first-row transition elements (Ⅱ): Apparent molal volumes of aqueous ZnCl2and Zn(ClO4)2from 15 to 55℃ and an examination of solute-solute and solute-solvent interactions [J]. J. Sol. Chem., 1989, 18(3): 249-264.
[4] RARD J A, MILLER D G. Densities and apparent molal volumes of aqueous manganese, cadmium, and zinc chlorides at 25℃[J]. J. Chem. Eng. Data, 1984, 29(2): 151-156.
[5] WEINGARTNER H, MULLER K J, HERTZ H G,. Unusual behavior of transport coefficients in aqueous solutions of zinc chloride at 25℃[J]. J. Phys. Chem., 1984, 88(10): 2173-2178.
[6] SCHOCK M R. Response of lead solubility to dissolved carbonate in drinking water [J]. J. Am. Water Works Assoc., 1980, 72(12): 695-704.
[7] 牛自得, 程芳琴. 水盐体系相图及其应用[M]. 天津: 天津大学出版社, 2002: 172-225 NIU Z D, CHENG F Q. Phase Diagram of Salt-Water System and Its Application [M]. Tianjin: Tianjin University Press, 2002: 172-225.
[8] YU G L, ZHANG Y, ZHANG S L,. Extraction of arsenic from arsenic-containing cobalt and nickel slag and preparation of arsenic-bearing compounds [J]. Transaction of Nonferrous Metals Society of China, 2014, 24(6): 1918-1927.
[9] CHEN A L, ZHU W X, CHEN X Y,. Decomposition of sodium zincate in alkaline solution by dilution [J].Hydrometallurgy, 2014, 149(10): 82-86.
[10] 杜澍芝. 氯化铅在锑盐溶液中溶解度的研究[J]. 云南冶金, 1989, 18(6): 42-44. DU S Z. The study on the solubility of the lead chloride in the antimony solution [J]. Yunnan Metallurgy, 1989, 18(6): 42-44.
[11] 王惠, 高世扬, 张浩永, 等. 四元体系KCl-ZnCI2-HCl(~10.6%)-H2O 25℃的相平衡及其固相化合物[J]. 无机化学学报, 2002, 18(9): 945-948. WANG H, GAO S Y, ZHANG H Y,. Study on phase diagram of KCl-ZnCI2-11%HCl-H2O system at 25℃ and its solid-liquid compounds [J]. Chinese Journal of Inorganic Chemistry, 2002, 18(9): 945-948.
[12] 乔占平, 张仁改, 卓立宏, 等. 四元体系NaCl-ZnCl2-HCl (1~9%)-H2O (25℃)的相平衡[J]. 化学研究与应用, 2006, 18(3): 299-301. QIAO Z P, ZHANG R G, ZHUO L H,. Study on phase diagram of NaCl-ZnCl2-HCl (l%~9%)-H2O system at 298.15 K [J]. Chemical Research and Application, 2006, 18(3): 299-301.
[13] BLIDIN V P. Heterogeneous equilibria in systems containing lithium chloride and chlorides of group Ⅱ metals [J]. Russian Chemical Bulletin, 1954, 3(3): 337-345.
[14] WINAND R. Chloride hydrometallurgy [J]. Hydrometallurgy, 1991, 27(3): 285-316.
[15] HOLDICH R G, LAWSON G J. The solubility of aqueous lead chloride solution [J]. Hydrometallurgy, l987, 19(2): 199-208.
[16] 刘云霞. PbCl2在不同盐酸浓度、Sb3+浓度和温度条件下溶解度的研究[J]. 稀有金属, 2000, 24(4): 270-273. LIU Y X.Study on PbCl2solubility under different conditions of HCl concentration, Sb3+concentration and temperature [J]. Chinese Journa1 of Rare Metals, 2000, 24(4): 270-273.
[17] HUDGINS C M. Solubility and density studies of the CaCl2-ZnCl2-H2O system at 0℃ and 25℃[J]. J. Chem. Eng. Data, 1964, 9(3): 434-436.
[18] VEDAT A, HASAN E, VAHIT A,. Study of the solubility, viscosity and density in Na+, Zn2+/Cl--H2O, Na+-Zn2+-(H2PO2)--H2O, Na+, Cl-/(H2PO2)--H2O, and Zn2+, Cl-/(H2PO2)--H2O ternary systems, and in Na+, Zn2+/Cl-, (H2PO2)-//H2O reciprocal quaternary system at 273.15 K [J]. J. Chem. Thermodynamics., 2014, 75: 35-44.
[19] FELMY A R, ONISHI L M, FOSTER N S,. An aqueous thermodynamic model for the Pb2+-Na+-K+-Ca2+-Mg2+-H+-Cl-–SO42−-H2O system to high concentration: application to WIPP brines [J]. Geochim. Cosmochim. Acta, 2000, 64(21): 3615-3628.
[20] TAN K G, BARTELS K, BEDARD P L. Lead chloride solubility and density data in binary aqueous solutions [J]. Hydrometallurgy, 1987, 17(3): 335-356.
Phase equilibria in ternary systems PbCl2-ZnCl2-H2O and CaCl2-PbCl2-H2O at 373 K
ZHANG Xueping1, CUI Ruizhi1, LIU Qian1, SANG Shihua1, 2
(1College of Materials and Chemistry & Chemical Engineering, Chengdu University of Technology, Chengdu 610059, Sichuan, China;2Mineral Resources Chemistry Key Laboratory of Sichuan Higher Education Institutions, Chengdu 610059, Sichuan, China)
In this work, the solubilities of the salt minerals and the densities of solution in two ternary systems of lead chloride-zinc chloride-water and calcium chloride-lead chloride-water were measured at 373 K by using an isothermal solution saturation method.Based on the determined equilibrium solubility data and the corresponding equilibrium solid phase, the phase diagrams and density diagrams of the two systems were plotted. According to the phase diagrams, univariant solubility curves and solid crystalline areas were discussed. The results showed that the two ternary systems were simple without any double salt or solid solution. The phase diagrams of two ternary systems were constituted of one invariant point, two univariant solubility curves and two solid crystalline phase regions. The solid phase was determined by the XRD. And the results of the experiment were simply discussed.
equilibrium; solubility; lead chloride; zinc chloride; calcium chloride
2016-07-05.
Prof. SANG Shihua, sangsh@cudt.edu.cn
10.11949/j.issn.0438-1157.20160932
O 642
A
0438—1157(2016)11—4552—06
张学平(1992—),男,硕士研究生。
国家自然科学基金项目(41373062);四川省科技厅计划支撑项目(2014GZ0189)。
2016-07-05收到初稿,2016-07-26收到修改稿。
联系人:桑世华。
supported by the National Natural Science Foundation of China (41373062).

