人胚胎骨髓间充质干细胞和单个核细胞静脉移植治疗大鼠脑梗死疗效的比较
黄爱华,张萍萍,张 斌,马步青,关云谦,周逸丹
1浙江省杭州市第三人民医院急诊科,杭州 3100002首都医科大学宣武医院细胞生物室,北京 100053
·论 著·
人胚胎骨髓间充质干细胞和单个核细胞静脉移植治疗大鼠脑梗死疗效的比较
黄爱华1,张萍萍1,张 斌1,马步青1,关云谦2,周逸丹1
1浙江省杭州市第三人民医院急诊科,杭州 3100002首都医科大学宣武医院细胞生物室,北京 100053
目的 比较人胚胎骨髓间充质干细胞(MSC)和单个核细胞(MNC)经静脉移植后对脑梗死的疗效。方法 采用大脑中动脉远端凝断法制造大鼠脑梗死模型。将大鼠分为假手术组、缺血对照组(造模后经尾静脉给予生理盐水)、MSC组(造模后经尾静脉给予MSC)和MNC组(造模后经尾静脉给予MNC)。移植后2 d,取脑进行梗死体积测定;移植后1、3、5、7 d,采用肢体放置测验和平衡木实验进行行为学评价;移植后7 d,采用免疫荧光法测量梗死周边纹状体区激活的小胶质细胞Iba- 1的染色丰度;移植后3、7 d,采用ELISA检测移植后梗死灶周边纹状体区胶质源性神经营养因子(GDNF)和脑源性神经营养因子(BDNF)的蛋白水平。结果 缺血对照组、MSC组和MNC组的相对梗死体积分别为(37.85±4.40)%、(33.41±3.82)%和(30.23±3.63)%,其中,MSC组(t=2.100,P=0.034)和MNC组(t=2.109,P=0.0009)显著低于缺血对照组,MNC组显著低于MSC组(t=1.743,P=0.043)。移植后1 d,缺血对照组的肢体放置成功率为(4.32±0.71)%,明显低于假手术组的(9.73±0.36)%(t=2.178,P=8.61×10-11);MSC组和MNC组分别为(5.09±0.62)%(t=2.1009,P=0.024)和(5.90±0.68)%(t=2.1008,P=0.0001),明显高于缺血对照组;MNC组又明显高于MSC组(t=2.1009,P=0.0165)。MSC组和MNC组损伤对侧前肢错步数占总步数的百分比分别为(5.56±0.86)%(t=2.120,P=0.020)和(5.13±0.95)%(t=2.131,P=0.003),明显低于缺血对照组的(6.47±0.61)%。移植后3 d,MNC组的肢体放置成功率为(6.91±1.10)%,明显高于缺血对照组的(5.80±0.82)%(t=2.110,P=0.027);MSC组为(6.30±0.77)%,与缺血对照组差异无统计学意义(t=2.101,P=0.199)。MNC组损伤对侧前肢错步数占总步数的百分比为(4.34±0.58)%,明显低于缺血对照组的(5.31±0.65)%(t=2.100,P=0.006)和MSC组的(4.92±0.53)%(t=2.100,P=0.041),MSC组与缺血对照组差异无统计学意义(t=2.109,P=0.139)。假手术组、缺血对照组、MSC组和MNC组的Iba- 1相对丰度分别为1.00+0.00、1.72±0.21、1.23±0.08和1.48±0.06,其中,缺血对照组显著升高,为假手术组的(1.72±0.21)倍(t=2.262,P=2.9×10-6),MSC组则降低至假手术组的(1.23±0.08)倍,比缺血对照组显著降低(t=2.178,P=3.91×10-5),MNC组降低至假手术组的(1.48±0.06)倍,比缺血对照组显著降低(t=2.200,P=0.007),MSC组和MNC组间差异也有统计学意义(t=2.120,P=7.09×10-6)。移植后3 d,MSC组的BDNF和GDNF分别为(531.127±73.176)pg/mg蛋白(t=2.109,P=0.003)和(127.780±16.733)pg/mg蛋白(t=2.100,P=2.76×10-5),均明显高于缺血对照组的(401.988±89.006)pg/mg蛋白和(86.278±14.832) pg/mg;MNC组分别为(627.429±65.646)pg/mg蛋白(t=2.144,P=0.017)和(153.117±20.443)pg/mg蛋白(t=2.144,P=0.017),均明显高于MSC组。移植后7 d,MSC组的BDNF和GDNF分别为(504.776±83.282)pg/mg蛋白(t=2.101,P=0.005)和(81.641±11.019)pg/mg蛋白(t=2.100,P=0.002),均明显高于缺血对照组的(389.257±70.440)pg/mg蛋白和(64.322±9.855) pg/mg;MNC组分别为(589.068±63.323)pg/mg蛋白(t=2.100,P=0.027)和(102.161±19.932)pg/mg蛋白(t=2.144,P=0.017),也均明显高于MSC组。结论 脑梗死后1 h静脉移植人骨髓MSC和MNC都能够减小梗死体积、改善动物行为。二者的疗效产生机制可能均与抑制脑内炎症反应,促进脑内神经营养因子的产生有关。MNC减小梗死体积和改善动物行为比MSC更有效,推测可能与MNC诱导脑内产生的细胞因子GDNF和BDNF的量比MSC更高有关。
脑梗死;间充质干细胞;单个核细胞;炎症;小胶质细胞;移植
ActaAcadMedSin,2016,38(5):497-506
细胞移植治疗神经系统疾病是有可能取得突破的新方法,人间充质干细胞(mesenchymal stem cell,MSC)和单个核细胞(mononuclear cell,MNC)是常用的两种细胞类型。MSC是体内广泛存在的一种具有多向分化潜能的干细胞,因其自身的低免疫原性和高效免疫调节作用而受到重视。MSC只表达主要组织相容性复合体(major histocompatibility complex,MHC)Ⅰ类分子,不表达MHCⅡ类分子,同种异体移植后不会引起显著的免疫排斥反应,所以MSC可以实现异体移植。虽然出于避免免疫排斥和伦理学的考虑,自体细胞移植是临床试验的理想方式,但对于年老或患有严重疾病的个体来说,同种异体移植相比自体移植更具有可行性。MSC可产生多种营养性的细胞因子,达到保护受损神经细胞的作用[1]。近年来,MSC的抗炎作用受到越来越多的关注。MSC细胞体外共培养可有效抑制淋巴细胞增殖和促炎性因子释放,在体内可有效减弱移植物抗宿主病(graft versus host disease,GVHD),减轻体内非特异的炎症反应,例如减少脑内淋巴细胞浸润,减轻小胶质细胞激活等。这些特性使MSC具有参与临床治疗免疫相关疾病的可能[2]。近年来,MSCs在疾病动物模型和临床研究中被尝试应用于治疗慢性炎症和免疫紊乱相关疾病[3]。
由于自体骨髓MSC在采集后需要经过较长时间才能够生长到一定数量,因此可能错过最佳治疗时机。相对而言,MNC则不需要体外培养,可在任何需要的时间移植。骨髓MNC中含有成熟细胞(如淋巴细胞、单核细胞、粒细胞等),还有多种干、祖细胞(如CD34+造血干细胞的含量约2%~3%),这些干、祖细胞具有分化成为心肌、血管内皮等细胞类型的能力,甚至具有一定程度分化成为神经元的能力。此外,MNC还具有很强的旁分泌能力,可为损伤或新生的组织细胞提供多种重要的营养物质和保护因子,促进缺血区组织的修复[4];而且有报道MNC也具有一定的免疫调节能力[5]。目前尚未见关于MSC和MNC经静脉移植后疗效和疗效产生机制的比较,本研究采用来自相同标本的MSC和MNC,比较了其移植后的疗效和抑制脑内炎症反应,以及促使大鼠产生营养因子两方面的差别,以期为今后的临床应用提供参考。
材料和方法
标本来源 人骨髓来自产科外伤致流产的胎儿,周龄18~20周,本研究经杭州市第三人民医院伦理委员会批准,获得产妇知情同意书。
实验动物及分组 SPF级雄性SD大鼠160只,体质量280~300 g,由北京维通利华实验动物技术有限公司提供,动物许可证号:SYXK(京)2014- 0014,大鼠自由进水进食。动物实验分4部分,每部分40只大鼠,再随机分为4组,具体为:(1)假手术组;(2)缺血对照组:在缺血后经尾静脉给予生理盐水;(3)MSC组:缺血后经尾静脉给予MSC;(4)MNC组:缺血后经尾静脉给予MNC;每组10只。第1部分实验对比移植后2 d的梗死体积,第2部分实验采用免疫组织化学染色鉴定移植后7 d小胶质细胞激活;第3、4部分实验检测移植后3、7 d各组动物脑内营养性细胞因子的含量。 动物行为学评价在第3、4部分实验进行。
主要试剂及仪器 DMEM低糖、DMEM Alpha、胎牛血清、青链霉素、谷氨酰胺、0.05%胰酶、DPBS购自美国Life Technology公司;淋巴细胞分离液购自天根公司;人MSC流式鉴定抗体试剂盒,MNC 流式鉴定抗体CD3、CD19和CD56抗体均购自美国BD公司;大鼠胶质源性神经营养因子(glial cell derived neurotrophic factor,GDNF)、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)的ELISA检测试剂盒购自美国BD公司;抗小胶质细胞Iba- 1抗体购自美国Cell signaling公司;刀豆蛋白A、2,3,5一氯化三苯基四氮唑(2,3,5-triphenyl-tetrazolium chloride,TTC)购自美国Sigma公司;脑组织匀浆液购自美国Invitrogen公司。超净工作台、培养箱购自美国Thermo公司,FACS Calibur 流式细胞仪购自美国BD公司,TS100型相差显微镜购自日本Nikon公司,白洋离心机购自白杨公司,3500全波长酶标仪购自美国Bio-Rad公司,小动物麻醉机购自美国Surgivet公司,手术显微镜、4000B荧光显微镜购自德国Leica公司。
胎儿骨髓MSC的提取 无菌条件下分离自然流产胎儿的肱骨、股骨和胫骨,用DMEM低糖冲洗到培养皿中,过200目筛网,去除残渣和组织块并且细胞计数,1200 r/min(r=14.5 cm)离心3 min;完全培养基(DMEM 低糖+10%FBS)重悬细胞,细胞浓度大约为1×106/ml培养基,37 ℃、5% CO2培养48 h后,轻轻晃动培养皿,去掉未贴壁细胞,DPBS清洗2次,加入完全培养基;以后每天半换液,待细胞长到90% 融合度时,用0.05%胰酶传代。取生长状态良好,第3~5代生长状态稳定的MSC进行表面抗原流式细胞仪鉴定,按照流式抗体操作说明进行。
人骨髓MSC的流式鉴定 取生长状态良好,第3~5代生长状态稳定的MSC。用胰酶消化成单细胞并计数,接种1×104细胞到12孔板,正常生长培养基(αMEM+10%FBS)培养2~3 d,按照MSC表面标志抗体检测试剂盒的说明进行检测。
人骨髓MNC分离和鉴定 取流产胚胎的四肢骨,用6 ml DPBS冲出骨髓血,缓慢叠加在淋巴细胞分离液上面,使两者之间形成清晰的界面,2000 r/min(r=14.5 cm)离心20 min。离心完毕后,离心管中会出现数个液体层,红细胞和粒细胞沉积于管底,中间是淋巴细胞分离液层,最上层是血浆层,MNC密集在血浆层和分离液的交界处,为白色云雾状。用吸管将这些云雾状细胞吸取到15 ml离心管中,加入15 ml PBS,1500 r/min(r=14.5 cm)离心10 min后去掉上清,用完全培养基(DMEM 1640+10%FBS+刀豆蛋白A)重悬培养。本实验计数后不经过培养直接移植。为对MNC进行鉴定,培养1周内的MNC用流式细胞仪检测其中表达CD3、CD19和CD56的细胞比例。为进一步确定流式细胞仪鉴定的有效性,我们选择抗CD3流式抗体对MNC进行免疫荧光染色鉴定。培养1周内的MNC接种于0.01%多聚鸟氨酸铺底的24孔板,次日多聚甲醛固定,免疫荧光染色方法与Iba- 1抗体染色相同。
动物模型的制备 采用远端大脑中动脉梗阻(distal middle cerebral artery occlusion,dMCAO)模型[6],具体为:开颅电凝大脑中动脉远端使其闭合,并夹闭双侧颈总动脉30 min。假手术组不对大脑中动脉远端进行凝断操作,也不夹闭双侧颈总动脉,其余步骤与模型组相同。缺血对照组在梗死后1 h经尾静脉输注生理盐水,细胞治疗组于脑缺血后1 h经尾静脉注入106个人类骨髓MSC或MNC。
梗死体积测定 于脑梗死后48 h将大鼠麻醉后直接取脑,去除小脑和嗅球,将大脑放在冰预冷的平皿上从前向后每隔2 mm切1片,通常切成6~7片。将切片置于2% TTC中染色,37 ℃ 20 min后拍照。染色完成后采用Image J图像分析软件计算大鼠脑梗死体积,具体为:首先计算出每个脑片的梗死面积,为避免因脑水肿产生数据误差,采用如下公式:梗死体积=(对侧半球面积-患侧正常脑组织面积)×脑片厚度,然后计算相对梗死体积,相对梗死体积=梗死总体积/对侧半球总体积。
行为学测试
肢体放置实验:采用触觉诱发肢体放置以评测实验动物的运动感觉完整性,具体方法为:实验者握住大鼠躯干,使其前爪悬空。此时动物位于桌子侧方,自桌面上方10 cm处向桌面下方10 cm缓慢垂直移动,经过桌面时大鼠胡须触及桌面,大鼠正常反应为前肢即刻搭向桌面,损伤大鼠则表现为肢体反应延迟甚至无反应[7-8]。各组动物损伤对侧前肢测试10次,正常反应次数所占比例作为统计依据。
平衡木实验:平衡木为1根,截面为2 cm宽的正方形,长1.2 m,离地面30 cm高度。平衡木一端放置强光源,另一端放置鼠笼,大鼠由光源端向对侧行走。正式实验前需对大鼠进行2~4 d的行为学训练,使每只大鼠均可在20 s内顺利通过平衡木。各组间的差异对比根据为损伤对侧前肢的滑落步数/四肢总步数[9]。
大鼠小胶质细胞Iba- 1染色和定量分析 大鼠脑梗死模型细胞移植后7 d,深麻醉后4%多聚甲醛灌注固定,40 μm厚度连续冰冻切片;切片用0.01 mol/L PBS缓冲液清洗2次,使用含有0.3% Triton X- 100的PBS孵育30 min,封闭液(含有1.5%山羊血清和1% BSA的0.01 mol/L PBS缓冲液)室温孵育1 h,含有Anti-Iba-1抗体的封闭液4 ℃孵育过夜;次日,用0.01 mol/L PBS缓冲液清洗3次,含有Cy3荧光标记二抗(1∶200)的封闭液室温孵育1 h,0.01 mol/L PBS缓冲液清洗3次,100 ng/ml DAPI的PBS溶液做细胞核染色15 min,0.01 mol/L PBS缓冲液清洗3次,含10%甘油的0.01 mol/L PBS溶液封片。
本研究采用的dMCAO模型梗死灶在顶叶皮层,选择皮层下方的纹状体区用以检测梗死灶周边小胶质细胞的激活。用Image J 软件标记损伤侧侧脑室外侧200 μm范围,并计算检测范围内Iba- 1染色的丰度。梗死后输注盐水的对照组、梗死后移植组分别和假手术组的丰度值比较所得的比值为相对丰度[10- 11]。
大鼠脑梗死周边区GDNF、BDNF的ELISA检测 大鼠脑梗死模型细胞移植后7 d,深麻醉后立即取脑,再取梗死区皮层下方纹状体区脑组织,4 ℃预冷的PBS洗掉血渍,用滤纸吸掉PBS,加入组织匀浆液充分匀浆,4 ℃ 15 000 r/min(r=14.5 cm)离心1 h,取上清。按照ELISA试剂盒的要求检测脑组织中GDNF、BDNF的含量。
统计学处理 采用SPSS 10.0统计软件,计量数据以均数±标准差表示,组间比较采用t检验和单因素方差分析,P<0.05为差异有统计学意义。
结 果
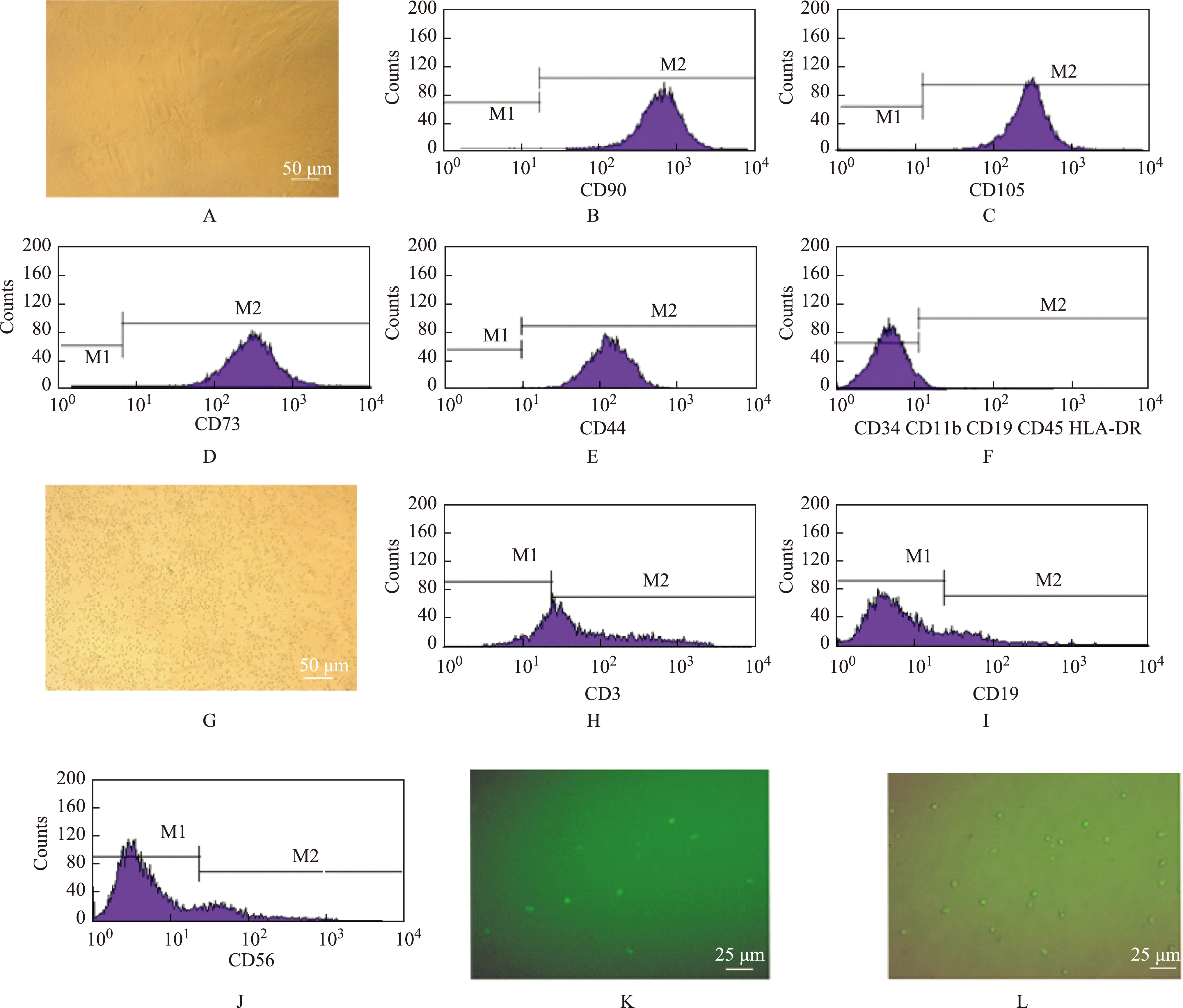
体外原代培养人骨髓MSC生长状况 分离的原代人骨髓MSC培养3~5 d,可见有梭形、多角形细胞贴壁。去除非贴壁细胞后,进一步增殖成为形态相对均一的梭形细胞。原代培养第10~12天,细胞达80%融合,此时即可进行0.05%胰酶消化并按1∶3传代,之后每3~5 d需要传代1次(图1A)。一般传至4~6代后细胞总量可达3×107个,能满足成批移植实验需要。
人骨髓MNC的状况 从骨髓中分离得到MNC,存活率均大于90%。分离出的MNC的形态和淋巴细胞类似,为圆形或者近似纺锤形,透光度较好(图1G)。 本实验所用的MNC不经过培养,分离完毕后直接输注给大鼠。
人骨髓MSC和MNC细胞表面标志抗原检测结果 流式细胞仪检测第3代人骨髓MSC结果显示,培养出的骨髓MSC细胞表面可表达CD90、CD73、CD44、CD105(图1 B~E),检测细胞的阳性率都高于95%;不表达CD34、CD19、CD45、CD11b和主要组织相容性复合体(major histocompatibility complex,MHC)-Ⅱ类分子—人类白细胞抗原DR(human leukocyte antigen-antigen D related,HLA-DR)(图1F)。MNC中含有约70% CD3阳性淋巴细胞,15% CD19阳性B细胞和15% CD56阳性NK细胞(图1 H~J)。CD3 抗体染色结果显示,贴壁的MNC中部分为CD3阳性细胞 (图1 K),与光镜图合并后计数可见CD3阳性细胞比例接近70%(图1 L)。
各组大鼠脑梗死体积的变化情况 术后48 h,处死大鼠取脑并立即进行TTC染色,结果显示,假手术组没有明显脑梗死(图2A),缺血对照组、MSC组和MNC组均出现顶颞叶白色梗死灶(图2B~D),其相对梗死体积分别为(37.85±4.40)%、(33.41±3.82)%和(30.23±3.63)%,其中,MSC组(t=2.100,P=0.034)和MNC组(t=2.109,P=0.0009)显著低于缺血对照组,MNC组显著低于MSC组(t=1.743,P=0.043)。
各组大鼠早期运动功能的恢复情况
肢体放置实验检测结果:移植后1 d,缺血对照组的肢体放置成功率为(4.32±0.71)%,明显低于假手术组的(9.73±0.36)%(t=2.178,P=8.61×10-11);MSC组和MNC组分别为(5.09±0.62)%(t=2.1009,P=0.024)和(5.90±0.68)%(t=2.1008,P=0.0001),明显高于缺血对照组;MNC组又明显高于MSC组(t=2.1009,P=0.0165)。移植后3 d,MNC组的肢体放置成功率为(6.91±1.10)%,明显高于缺血对照组的(5.80±0.82)%(t=2.110,P=0.027);MSC组为(6.30±0.77)%,与缺血对照组差异无统计学意义(t=2.101,P=0.199)(表1)。
MSC:间充质干细胞;MNC:单个核细胞
MSC:mesenchymal stem cell;MNC: mononuclear cell
A. 培养第3~5代的人骨髓MSC呈现纺锤形;B~F.流式细胞仪检测结果显示培养的第3~5代人骨髓MSC为CD90、CD73、CD44、CD105阳性,而CD34、CD19、CD45、CD11b、HLA-DR阴性;G.分离后的MNC光镜下形态;H~J.MNC中CD3阳性淋巴细胞、CD19阳性B细胞、CD56阳性NK细胞的百分率分别为70%、14%、15%;K.贴壁培养的MNC的CD3抗体染色;L.光镜和CD3 抗体免疫荧光染色的合并图
A.the spindle morphology of MSC at passages 3- 5;B-F. the cytometry test shows that human MSC are positive for CD90,CD73,CD44,and CD105 and negative for CD34,CD19,CD45,CD11b,and HLA-DR; G. the MNC culture after isolation;H-J.in the population of MNC,the percentages of CD3+lymphocyte,CD19+B cell,and CD56+NK cell are 70%,14%,and 15%;K. CD3 staining(green) of cultured MNC;L. merged image of phase contrast and CD3 staining
图 1 人骨髓MSC、MNC培养及鉴定
Fig 1 Culture and identification of human bone marrow MSC and MNC

A.假手术组;B.缺血对照组;C.MSC组;D.MNC组A.Sham group; B.ischemia control group; C. MSC group; D.MNC group
图 2 各组大鼠脑梗死体积的变化情况
Fig 2 Change of the volume of cerebral ischemia in each groups
平衡木实验检测结果:假手术组手术前后都能正确无误地走完平衡木。移植后1 d,MSC组和MNC组损伤对侧前肢错步数占总步数的百分比分别为(5.56±0.86)%(t=2.120,P=0.020)和(5.13±0.95)%(t=2.131,P=0.003),明显低于缺血对照组的(6.47±0.61)%;MSC组和MNC组间差异无统计学意义(t=2.101,P=0.320)。移植后3 d,MNC组损伤对侧前肢错步数占总步数的百分比为(4.34±0.58)%,明显低于缺血对照组的(5.31±0.65)%(t=2.100,P=0.006)和MSC组的(4.92±0.53)%(t=2.100,P=0.041),MSC组与缺血对照组差异无统计学意义(t=2.109,P=0.139)(表1)。
Iba- 1阳性小胶质细胞检测结果 Iba- 1染色结果显示,纹状体区Iba- 1抗体识别的小胶质细胞,除偶有散在的阿米巴样细胞外,更大量的是枝杈状染色阳性细胞,假手术组纹状体区有散在Iba- 1染色(图3A),缺血对照组则显著增强(图3B),给予细胞移植的治疗组的Iba- 1染色都明显减弱(图3C、D)。
假手术组、缺血对照组、MSC组和MNC组的Iba- 1相对丰度分别为1.00±0.00、1.72±0.21、1.23±0.08和1.48±0.06,其中,缺血对照组显著升高,为假手术组的(1.72±0.21)倍(t=2.262,P=2.9×10-6),MSC组则降低至假手术组的(1.23±0.08)倍,比缺血对照组显著降低(t=2.178,P=3.91×10-5),MNC组降低至假手术组的(1.48±0.06)倍,比缺血对照组显著降低(t=2.200,P=0.007),MSC组和MNC组间差异也有统计学意义(t=2.120,P=7.09×10-6)。
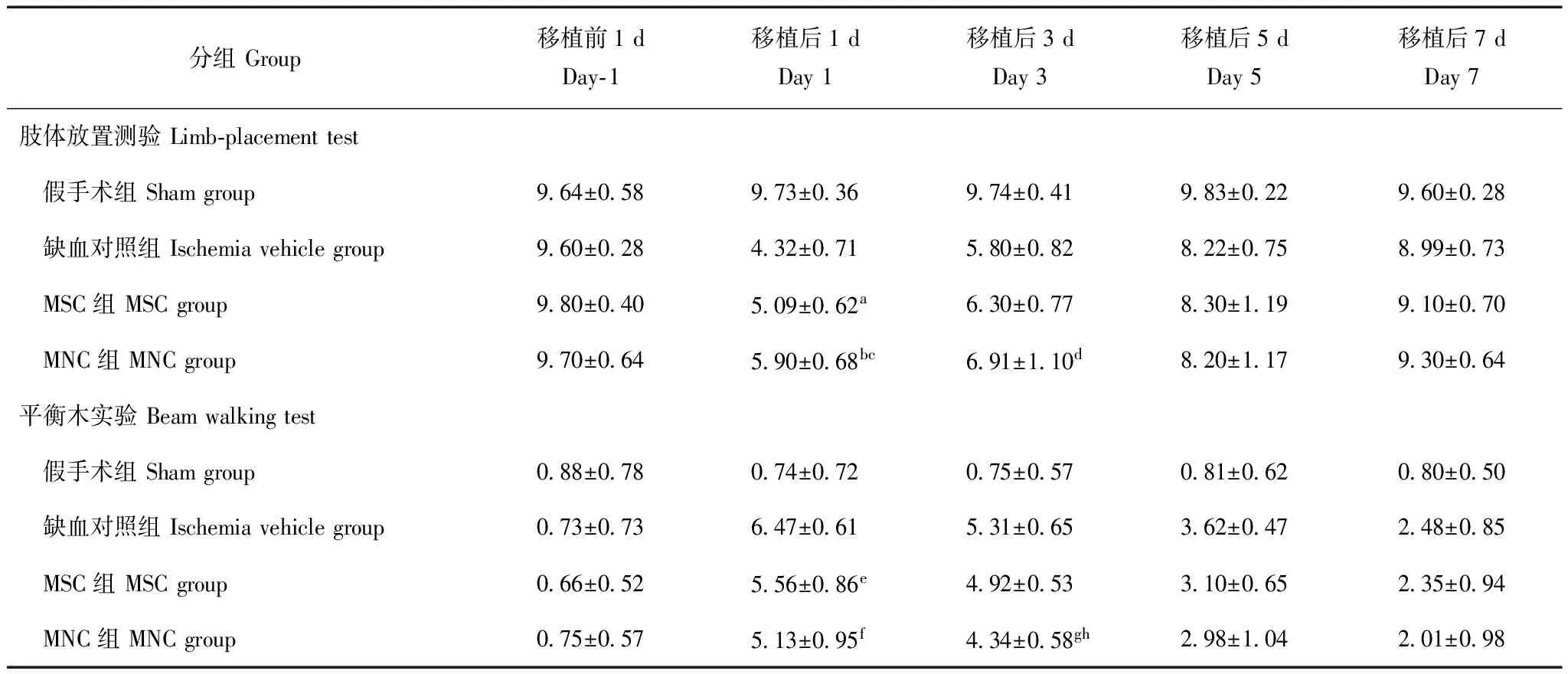
表 1 大鼠行为学测试检测结果(n=10,x-±s,%)
MSC:间充质干细胞;MNC:单个核细胞;与缺血对照组比较,at=2.1009,P=0.024;bt=2.1008,P=0.0001;dt=2.110,P=0.027;et=2.120,P=0.020;ft=2.131,P=0.003;gt=2.100,P=0.006;与MSC移植组比较,ct=2.1009,P=0.0165;ht=2.100,P=0.041
MSC:mesenchymal stem cell;MNC:mononuclear cell;at=2.1009,P=0.024;bt=2.1008,P=0.0001;dt=2.110,P=0.027;et=2.120,P=0.020;ft=2.131,P=0.003;gt=2.100,P=0.006 compared with ischemia vehicle group;ct=2.1009,P=0.0165;ht=2.100,P=0.041 compared with MSC group
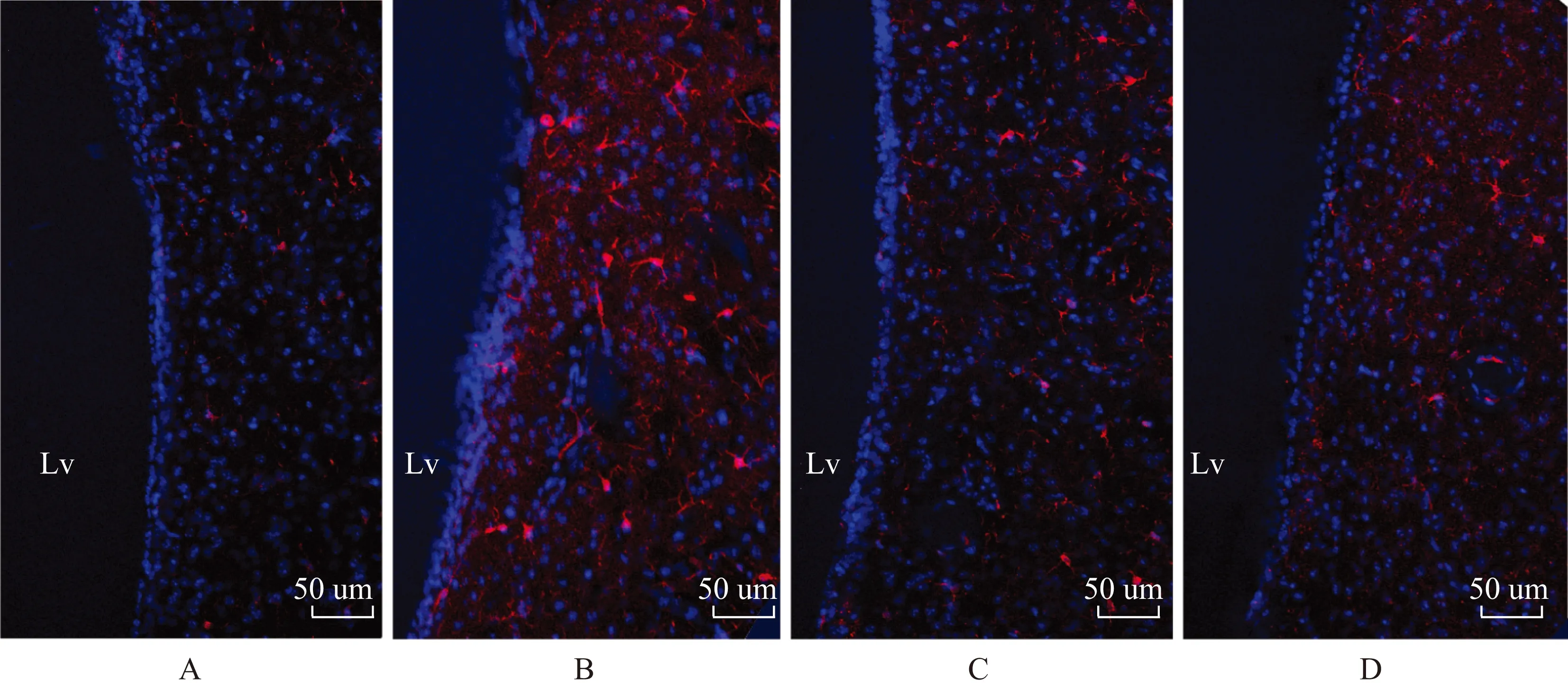
Lv: 侧脑室;移植后第7天,纹状体Lv周边红色为大鼠小胶质细胞Iba- 1染色,蓝色为细胞核DAPI染色
Lv: lateral ventricle;the red staining around lateral ventricle was Iba- 1 and blue was DAPI
A.假手术组;B.缺血对照组;C.MSC组;D.MNC组
A.sham group; B.ischemia control group; C.MSC group; D.MNC group
图 3 小胶质细胞Iba- 1染色结果
Fig 3 Staining of microglia specific Iba- 1
各组GDNF和BDNF的检测结果 移植后3 d,MSC组的BDNF和GDNF分别为(531.127±73.176)pg/mg蛋白(t=2.109,P=0.003)和(127.780±16.733)pg/mg蛋白(t=2.100,P=2.76×10-5),均明显高于缺血对照组的(401.988±89.006)pg/mg蛋白和(86.278±14.832)pg/mg;MNC组分别为(627.429±65.646)pg/mg蛋白(t=2.109,P=0.010)和(153.117±20.443)pg/mg蛋白(t=2.144,P=0.017),均明显高于MSC组。移植后7 d,MSC组的BDNF和GDNF分别为(504.776±83.282)pg/mg蛋白(t=2.101,P=0.005)和(81.641±11.019)pg/mg蛋白(t=2.100,P=0. 002),均明显高于缺血对照组的(389.257±70.440)pg/mg蛋白和(64.322±9.854) pg/mg;MNC组分别为(589.068±63.323)pg/mg蛋白(t=2.100,P=0.027)和(102.161±19.932)pg/mg蛋白(t=2.144,P=0.017),也均明显高于MSC组(表2)。
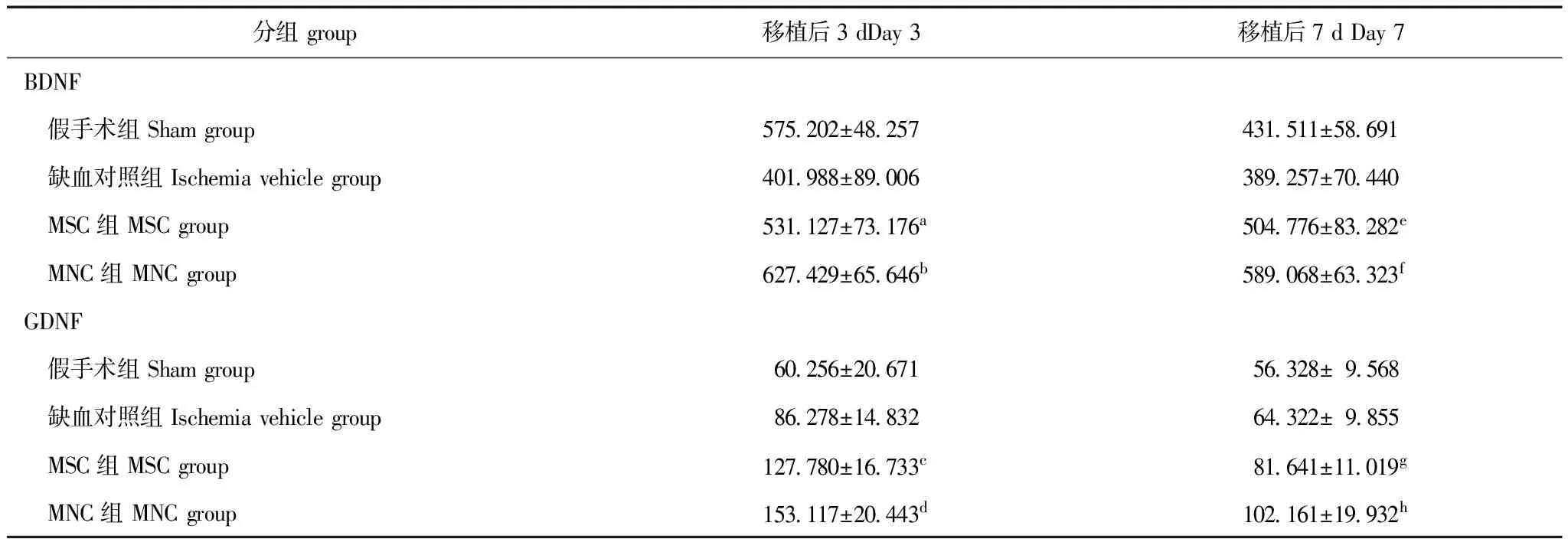
表 2 各组BDNF和GDNF检测结果的比较(n=10,x-±s,pg/mg蛋白)
BDNF:脑源性神经营养因子;GDNF:胶质源性神经营养因子;与缺血对照组比较,at=2.109,P=0.003;ct=2.100,P=2.76×10-5;et=2.101,P=0.005;gt=2.100,P=0.002;与MSC组比较,bt=2.109,P=0.010;dt=2.144,P=0.017;ft=2.100,P=0.027;ht=2.144,P=0.017
BDNF:brain derived neurotrophic factor;GDNF:glia derived neurotrophic factor;at=2.109,P=0.003;ct=2.100,P=2.76×10-5;et=2.101,P=0.005;gt=2.100,P=0.002 compared with ischemia vehicle group;bt=2.109,P=0.010;dt=2.144,P=0.017;ft=2.100,P=0.027;ht=2.144,P=0.017 compared with MSC group
讨 论
脑内炎症反应是脑梗死后脑内组织损伤的重要机制之一,化合物抗炎药物的作用不能受到反馈调节,而且会有心血管意外发生率升高等不良反应。向梗死区域补充细胞因子则能有效保护受到缺血缺氧损伤的神经细胞,但通过静脉向患者脑内补充细胞因子面临血脑屏障的阻碍,而且无法实现持续不断的供应。
现已经明确MSC具有抗炎作用,可降低脑内炎症反应,且MSC的抗炎作用可受到体内炎症反应强度的调节,因为MSC需要被体内一定水平的炎症因子,如肿瘤坏死因子α(tumor necrocis factorα,TNFα)、干扰素γ等激活才能发挥抑制淋巴细胞增殖、抑制小胶质细胞等产生促炎症因子的作用,当脑内炎症因子浓度下降,MSC不会无限制地抑制宿主的免疫功能[12]。此外,MSC和MNC都具有持续产生营养性细胞因子的能力[13],可以在体内持续促进宿主脑内产生营养因子。MSC和MNC移植治疗大鼠脑梗死都已有相关研究[14],但两者的直接比较还鲜有报道。本研究结果显示,两种细胞都有减小dMCAO大鼠梗死体积的作用,但MNC在减小梗死体积方面效果更好。
本研究采用的dMCAO模型与线栓法模型相比动物行为学损害较轻,所以用数种常用的行为学评价方法都不能发现细胞移植的疗效。例如,根据Feeney等[15]的平衡木实验方法,按照大鼠在平衡木上是否能够保持平衡和走过平衡木来评分,损伤最重为1分:未尝试在平衡木上平衡而直接跌落;最轻为7分:顺利走过平衡木,瘫痪侧肢体完全起作用。本研究观察到的大鼠评分在6~7分 (能走过平衡木,瘫痪侧肢体起作用大于50%),经过统计检验不能发现各组间的差异,所以我们采用了更加敏感的行为学测试方法,包括肢体放置实验[7]和改良的平衡木实验[9]。结果显示,移植后1 d,MNC组和MSC组均显示出明显的行为改善,MNC组的改善效果显著优于MSC组;移植后3 d,仅MNC组显示出明显的行为改善;移植后5、7 d,MNC组和MSC组均未显示出明显的行为改善;提示虽然MSC 和MNC对脑梗死大鼠的行为改善能力仅仅局限在梗死后1~3 d,但MNC对行为的改善强于MSC。
脑内炎症是脑梗死后脑内组织损伤的重要机制之一,小胶质细胞的激活程度在一定程度上可代表脑内炎症反应的强弱程度。小胶质细胞通常在脑缺血后几分钟激活,同时增多促炎症因子,如白细胞介素- 1β与TNFα等,可导致小胶质细胞的进一步活化[16]。在脑缺血再灌注期,抑制小胶质细胞活性,可减少脑梗死体积,对脑组织起保护作用[17]。本研究采用小胶质细胞免疫荧光评估了脑内炎症反应强弱,结果显示,缺血对照组的Iba- 1丰度显著升高,为假手术组的(1.72±0.21)倍;MSC组降低至假手术组的(1.23±0.08)倍,MNC组降低至假手术组的(1.48±0.06)倍,MSC组和MNC组间差异也有统计学意义;提示MSC和MNC均可显著降低梗死周边区的小胶质细胞激活,MSC的效果优于MNC。
研究显示,GDNF[1]和BDNF[18]是脑卒中发生后起到神经保护作用的重要细胞因子。植入细胞可产生或诱导宿主产生营养性细胞因子。目前研究更倾向于认为是大鼠源性的营养性细胞因子在发挥减轻梗死后脑组织损伤的作用。Karlupia等[11]将5×106个人类脐带来源的MSC细胞或者MNC经动脉植入大鼠,结果未检测到明显的人类来源细胞因子。本研究移植的细胞数量更少,故直接检测了大鼠源性细胞因子,结果发现MNC组的BDNF和GDNF水平显著高于MSC组,提示这些因子的升高很可能是MNC疗效比MSC更高的基础,另外其他哪些细胞因子也参与了疗效产生过程,还有待于进一步的实验说明。
MNC是一个混合体,包括MSC、造血干细胞、淋巴细胞、内皮祖细胞等,其中MSC含量约占全部细胞的1%,造血干细胞比例约占有核细胞的1%~2% 。本研究显示MNC的疗效好于MSC,也有实验发现相同数量MNC比造血干细胞治疗脑梗死的效果更好[11];所以MNC的疗效可能并非由于其中的MSC或造血干细胞等单一细胞类型造成。MNC中究竟是什么细胞发挥了促使宿主产生细胞因子或者调节炎症反应的作用,还需要进一步的实验研究说明。
[1]Crigler L,Robey RC,Asawachaicharn A,et al. Human mesenchymal stem cell subpopulations express a variety of neuro-regulatory molecules and promote neuronal cell survival and neuritogenesis[J]. Exp Neurol,2006,198(1):54- 64.
[2]Le Blanc K,Frassoni F,Ball L,et al. Mesenchymal stem cells for treatment of steroid-resistant,severe,acute graft-versus-host disease: a phase ii study[J]. Lancet,2008,371(9624):1579- 1586.
[3]Joyce N,Annett G,Wirthlin L,et al. Mesenchymal stem cells for the treatment of neurodegenerative disease[J]. Regenerat Med,2010,5(6):933- 946.
[4]Sharma S,Yang B,Strong R,et al. Bone marrow mononuclear cells protect neurons and modulate microglia in cell culture models of ischemic stroke[J]. J Neurosci Res,2010,88(13):2869- 2876.
[5]Hoetzenecker K,Zimmermann M,Hoetzenecker W,et al. Mononuclear cell secretome protects from experimental autoimmune myocarditis[J]. Eur Heart J,2015,36(11):676- 685.
[6]Bernaudin M,Marti HH,Roussel S,et al. A potential role for erythropoietin in focal permanent cerebral ischemia in mice[J]. J Cereb Blood Flow Metab,1999,19(6): 643- 651.
[7]Hua Y,Schallert T,Keep RF,et al. Behavioral tests after intracerebral hemorrhage in the rat[J]. Stroke,2002,33(10): 2478- 2484.
[8]Geng X,Ren C,Wang T,et al. Effect of remote ischemic postconditioning on an intracerebral hemorrhage stroke model in rats[J]. Neurol Res,2012,34(2): 143- 148.
[9]Zhao CS,Puurunen K,Schallert T,et al. Effect of cholinergic medication,before and after focal photothrombotic ischemic cortical injury,on histological and functional outcome in aged and young adult rats[J]. Behavioural Brain Res,2005,156(1): 85- 94.
[10]Chen Z,Phillips LK,Gould E,et al. Mhc mismatch inhibits neurogenesis and neuron maturation in stem cell allografts[J]. PLoS One,2011,6:e14787.doi: 10.1371/journal. pone.0014787.
[11]Karlupia N,Manley NC,Prasad K,et al. Intraarterial transplantation of human umbilical cord blood mononuclear cells is more efficacious and safer compared with umbilical cord mesenchymal stromal cells in a rodent stroke model[J]. Stem Cell Res Ther,2014,5(2):45. doi: 10.1186/scrt434.
[12]Ren G,Zhang L,Zhao X,et al. Mesenchymal stem cell-mediated immunosuppression occurs via concerted action of chemokines and nitric oxide[J]. Cell Stem Cell,2008,2(2): 141- 150.
[13]Boomsma RA,Geenen DL. Mesenchymal stem cells secrete multiple cytokines that promote angiogenesis and have contrasting effects on chemotaxis and apoptosis[J]. PLoS One,2012,7:e35685.doi:10.1371/journal.pone.0035685.
[14]Harting MT,Jimenez F,Xue H,et al. Intravenous mesenchymal stem cell therapy for traumatic brain injury[J]. J Neurosurg,2009,110(6):1189- 1197.
[15]Feeney DM,Boyeson MG,Linn RT,et al. Responses to cortical injury: I. Methodology and local effects of contusions in the rat[J]. Brain Res,1981,211(1): 67- 77.
[16]Wen YD,Zhang HL,Qin ZH. Inflammatory mechanism in ischemic neuronal injury[J]. Neurosci Bulletin,2006,22(3): 171- 182.
[17]Ekdahl CT,Kokaia Z,Lindvall O. Brain inflammation and adult neurogenesis: The dual role of microglia[J]. Neuroscience,2009,158(3):1021- 1029.
[18]Chen A,Xiong LJ,Tong Y,et al. The neuroprotective roles of bdnf in hypoxic ischemic brain injury[J]. Biomed Rep,2013,1(2): 167- 176.
Comparsion between Intravenous Delivered Human Fetal Bone Marrow Mesenchymal Stromal Cells and Mononuclear Cells in the Treatment of Rat Cerebral Infarct
HUANG Ai-hua1,ZHANG Ping-ping1,ZHANG Bin1,MA Bu-qing1,GUAN Yun-qian2,ZHOU Yi-dan1
1Department of Emergency,the Third People’s Hospital of Hangzhou,Hangzhou 310000,China2Department of Cell Biology,Xuanwu Hospital,Capital Medical University,Beijing 100053,China
ZHOU Yi-dan Tel: 0571- 87823131,E-mail: zhouyidanf@163.com
Objective To compare the effecacy of human mesenchymal stromal cell (hMSC) with human mononuclear cell (hMNC) in treating rat cerebral infarct.Methods The SD rat models of cerebral infarct were established by distal middle cerebral artery occlusion (dMCAO). Rats were divided into four groups: sham,ischemia vehicle,MSC,and MNC transplantation groups. For the transplantation group,1×106hMSCs or hMNCs were intravascularly transplanted into the tail vein 1 hour after the ischemia onset. The ischemia vehicle group received dMCAO surgery and intravascular saline injection 1,3,5,and 7 days after the ischemia onset,and then behavioral tests were performed. At 48 h after the ischemia onset,the abundance of Iba- 1,the symbol of activated microglia,was evaluated in the peri-ischemia striatum area; meanwhile,the neurotrophic factors such as glial cell line-derived neurotrophic factor (GDNF) and brain-derived neurotrophic factor (BDNF) in ipsilateral peri-ischemia striatum area were also measured. Results The relative infarct volume in ischemia vehicle group,hMSC group,and hMNC transplantation group were (37.85±4.40)%,(33.41±3.82)%,and (30.23±3.63)%,respectively. The infarct volumes of MSC group (t=2.100,P=0.034) and MNC group (t=2.109,P=0.0009) were significantly smaller than that of ischemia vehicle group,and that of MNC group was significantly smaller than that of MSC group (t=1.743,P=0.043). One day after transplantation,the score of ischemia vehicle group in limb placing test was (4.32±0.71)%,which was significantly lower than that in sham group (9.73±0.36)% (t=2.178,P=8.61×10-11). The scores of MSC and MNC group,which were (5.09±0.62)% (t=2.1009,P=0.024) and (5.90±0.68)% (t=2.1008,P=0.0001),respectively,were significantly higher than that of ischemia vehicle group; also,the score of MNC group was significantly higher than that of MSC group(t=2.1009,P=0.0165). The contralateral forelimb scores of MSC and MNC groups in beam walking test were (5.56±0.86)% (t=2.120,P=0.020) and (5.13±0.95)% (t=2.131,P=0.003),were both significantly lower than that of ischemia vehicle group [(6.47±0.61)%]. Three days after the transplantation,the limb placing test score of MNC group [(6.91±1.10)%] was significantly higher than that of ischemia vehicle group (5.80±0.82)% (t=2.110,P=0.027). The score of MSC group [(6.30±0.77)%] showed no statistic difference with that of ischemia vehicle group(t=2.101,P=0.199).The contralateral forelimb scores of MNC group in beam walking test [(4.34±0.58)%] was significantly lower than that of ischemia vehicle group [(5.31±0.65)%] (t=2.100,P=0.006) and MSC group [(4.92±0.53)%] (t=2.100,P=0.041); there was no statistic difference between MSC group and ischemia vehicle group (t=2.109,P=0.139). The relative abundance of Iba- 1 in sham,ischemia vehicle,MSC,and MNC groups was 1.00+0.00,1.72±0.21,1.23±0.08,and 1.48±0.06,respectively. The Iba-1 relative abundance of ischemia vehicle group was significantly higher than that of sham group (t=2.262,P=2.9×10-6). The Iba-1 relative abundances of both MSC (t=2.178,P=3.91×10-5)and MNC (t=2.200,P=0.007)groups were significantly lower than that of ischemia vehicle group. It was also significantly lower in MNC group than in MSC group also (t=2.120,P=7.09×10-6). Three days after transplantation,the BDNF and GDNF levels of MSC group,which were (531.127±73.176)pg/mg (t=2.109,P=0.003)and(127.780±16.733)pg/mg(t=2.100,P=2.76×10-5),respectively,were significantly higher than those of ischemia vehicle group,which were (401.988±89.006)pg/mg and (86.278±14.832) pg/mg,respectively. The BDNF and GDNF levels of MNC group,which were (627.429±65.646)pg/mg (t=2.144,P=0.017) and (153.117±20.443)pg/mg (t=2.109,P=0.010),respectively,were all significantly higher than that of MSC group. At day 7,the BDNF and GDNF levels of MSC group,which were (504.776±83.282)pg/mg (t=2.101,P=0.005) and (81.641±11.019)pg/mg (t=2.100,P=0.002),respectively,were significantly higher than those of ischemia vehicle group,which were (389.257±70.440)pg/mg and (64.322±9.855) pg/mg,respectively. The BDNF and GDNF levels of MNC group,which were (589.068±63.323)pg/mg (t=2.100,P=0.027) and (102.161±19.932)pg/mg (t=2.144,P=0.017),respectively,were all significantly higher than that of MSC group. Conclusions Both hMSC and hMNC are beneficial to the ischemia-damaged brain when they are intravascularly transplanted within 1 h after the onset of ischemia. The anti-inflammation ability and secretion of neurotrophic factors are the underlying mechanisms of the therapeutic effects. MNC is more effective than MSC in reducing infarct area and improving behaviors,which might be explained by the fact that MNC induces more GDNF and BDNF in brain than MSC.
cerebral infarct; mesenchymal stromal cell; mononuclear cell; inflammation; microglia; transplantation
杭州市卫生局重点项目(2011Z007)和北京市科委健康培育项目(Z111107067311033)Supported by the Hangzhou Health Bureau of Key Projects (2011Z007) and the Beijing Municipal Science and Technology Commission Health Cultivation Project (Z111107067311033)
周逸丹 电话:0571- 87823131,电子邮件: zhouyidanf@163.com
R392.2+8
A
1000- 503X(2016)05- 0497- 10
10.3881/j.issn.1000- 503X.2016.05.002
2015- 08- 29)

