分子印迹固相萃取-超高效液相色谱-串联质谱法测定鸡肉中9种氟喹诺酮药物残留
杨艳菲, 曹旭敏, 李雪莲, 宋建德, 孙晓亮,王淑婷, 王晓茵, 李 琳, 赵思俊*
(1. 安徽农业大学动物科技学院, 安徽 合肥 230000; 2. 中国动物卫生与流行病学中心, 山东 青岛 266032;3. 农业部畜禽产品质量安全风险评估实验室(青岛), 山东 青岛 266032;4. 青岛易邦生物工程有限公司, 山东 青岛 266032)
研究论文
分子印迹固相萃取-超高效液相色谱-串联质谱法测定鸡肉中9种氟喹诺酮药物残留
杨艳菲1,2, 曹旭敏2,3, 李雪莲4, 宋建德2, 孙晓亮2,3,王淑婷2,3, 王晓茵2,3, 李 琳1*, 赵思俊2,3*
(1. 安徽农业大学动物科技学院, 安徽 合肥 230000; 2. 中国动物卫生与流行病学中心, 山东 青岛 266032;3. 农业部畜禽产品质量安全风险评估实验室(青岛), 山东 青岛 266032;4. 青岛易邦生物工程有限公司, 山东 青岛 266032)
建立了分子印迹固相萃取(MISPE)-超高效液相色谱-串联质谱(UPLC-MS/MS)同时测定鸡肉中9种氟喹诺酮药物残留的分析方法。样品经均质处理后,采用磷酸盐缓冲液提取,提取液经MISPE柱净化后,采用BEH C18柱分离,以乙腈-0.1%(v/v)甲酸水溶液为流动相,梯度洗脱,采用电喷雾正离子多反应监测模式,外标法定量。考察了MISPE柱对9种氟喹诺酮药物的吸附特异性;9种药物在0.25~100 μg/L范围内线性关系良好,相关系数(r)>0.996 5;检出限和定量限分别为0.08 μg/kg和0.25 μg/kg;在0.25、2.5、5.0 μg/kg添加水平下,9种药物的回收率为65.8%~112.2%,批内、批间RSD分别为0.6%~13.5%和0.5%~14.9%; MISPE的最大柱容量为464.7~932.4 μg/L。该方法灵敏度好、操作简单、快速。
超高效液相色谱-串联质谱;分子印迹固相萃取;氟喹诺酮;鸡肉
氟喹诺酮(fluoroquinolones, FQs)药物是一类人工合成的广谱抗菌药,因其具有抗菌谱广、杀菌能力强、半衰期长等特点而广泛用于动物和人类感染性疾病的预防和治疗[1]。该类药物容易在动物组织中蓄积而导致药物残留,长时间使用还会使致病菌产生耐药性,对人类健康危害较大[2,3]。因此,基于保护消费者健康安全的目的,许多国家都制定了氟喹诺酮类药物在动物性食品中的最高残留限量[4,5]。为更好地保障人类健康安全,我国农业部于2015年发布了第2292号公告[6]:禁止在动物饲养中使用洛美沙星、培氟沙星、氧氟沙星、诺氟沙星4种药物。目前我国已对9种氟喹诺酮类药物的使用进行了明确规定,因此,亟需开展动物性食品中上述9种药物残留检测技术的研究,以满足日常监管的需要。
动物性食品样品的基质与组成相当复杂,目标物易被干扰,因此,样品前处理成为动物性食品残留检测分析的关键步骤。液液萃取法[7,8]、基质固相分散萃取法[9]、固相萃取法[10-13]等是目前最常用的样品前处理方法,液液萃取法通常需大量的化学试剂,且操作复杂;固相萃取技术具有操作简单、价格低廉、易于自动化的优点,但常规的固相萃取吸附剂为非特异性吸附,吸附性和选择性较差,对复杂样品的净化和富集较难。因此,开发免疫亲和色谱[2,14,15]、分子印迹聚合物(molecularly imprinted polymer, MIPs)[16-18]等具有高选择性的吸附剂具有重要意义。免疫亲和色谱柱需大量高质量的抗体,价格昂贵且不易制备,因而在实际监管时,大批量的使用受到限制。MIPs作为一种新型材料,俗称“塑料抗体”,能够特异性的识别与吸附目标物及其结构类似物,具有稳定性好、耐酸碱等特点,适于分离、富集复杂样品中的痕量分析物[17-19]。MIPs作为固相萃取的吸附剂在动物性食品安全监测中受到越来越多的关注[19,20]。Urraca等[21]建立了分子印迹固相萃取(molecularly imprinted solid phase extraction, MISPE)结合液相色谱-串联质谱测定鸡肉中FQs残留的方法,但其仅能对恩诺沙星、环丙沙星、洛美沙星、单诺沙星、诺氟沙星、沙拉沙星6种FQs药物进行检测。本研究基于MISPE的特异性,通过优化上样、淋洗、洗脱及液相色谱分离、质谱检测等条件,建立了一种MISPE-超高效液相色谱-串联质谱(UPLC-MS/MS)测定鸡肉中9种FQs残留的分析方法。
1 实验部分
1.1 仪器与试剂
Acquity UPLC-Xevo TQ MS超高效液相色谱-串联质谱仪、固相萃取装置(美国Waters公司); 5804R台式高速冷冻离心机、微量移液器(德国Eppendorf公司); SupelMIPTMSPE(FQs, 25 mg/3 mL,美国Sigma公司); GHP针式滤膜(0.22 μm,美国Pall公司)。
甲醇、乙腈均为色谱纯(德国Merck公司);甲酸为色谱纯(北京迪马科技有限公司);乙酸、氨水为分析纯(国药集团化学试剂有限公司)。
环丙沙星(ciprofloxacin,纯度>94%)、达氟沙星(danofloxacin,纯度>93.5%)、恩诺沙星(enrofluxacin,纯度>99%)、沙拉沙星(sarafloxacin,纯度>97%)、二氟沙星(difloxacin,纯度>98%)、诺氟沙星(norfloxacin,纯度>99.1%)、氧氟沙星(ofloxacin,纯度>99%)、洛美沙星(lomefloxacin,纯度>97.6%)、培氟沙星(pefloxacin,纯度>99%)标准品均购自德国Dr. Ehrenstorfer公司。喹诺酮母核及9种氟喹诺酮药物的化学结构式见图1。

图 1 喹诺酮母核及9种氟喹诺酮的化学结构式Fig. 1 Chemical structures of mother nucleus of quinolones and the nine fluoroquinolones
1.2 标准溶液的配制
分别准确称取9种FQs标准物质于25 mL容量瓶中,用甲醇溶解并定容至刻度,配制质量浓度为1 000 mg/L的标准储备液,于-20 ℃避光保存;分别移取适量标准储备液,根据需要用流动相逐级稀释,配制适当质量浓度的9种FQs混合标准工作液,现用现配。
1.3 液相色谱-质谱条件
色谱柱:Acquity UPLC BEH C18柱(100 mm×2.1 mm, 1.7 μm,美国Waters公司);柱温:35 ℃;流动相:(A)乙腈和(B)0.1%(v/v)甲酸水溶液。梯度洗脱程序:0~2.0 min, 10%A; 2.0~3.0 min, 10%A~15%A; 3.0~4.0 min, 15%A~55%A; 4.0~5.0 min, 55%A~80%A; 5.0~5.5 min, 80%A~10%A; 5.5~7.0 min, 10%A。流速:0.3 mL/min;进样量:5.0 μL。
离子源:电喷雾离子(ESI)源;正离子模式;离子源温度:150 ℃;检测方式:多反应监测模式(MRM);毛细管电压:2 700 V;雾化室温度:450 ℃;雾化气(氮气)流量:1 000 L/h;锥孔气(氮气)流量:50 L/h;碰撞气(氩气)流量:0.24 L/h。
1.4 样品前处理
取鸡肉样品,匀浆,于-20 ℃保存。参照文献[11],准确称取2.0 g均质后的鸡肉样品于50 mL离心管中,加入8 mL 0.5 mol/L磷酸二氢钾溶液(pH 5.0),涡旋混合,以8 000 r/min离心5 min,收集上清液于50 mL离心管中,用8 mL 0.5 mol/L磷酸二氢钾溶液溶解残渣,合并上清液,待净化。
依次用2 mL甲醇和水活化MISPE柱,取上清液上样,分别经2 mL水、甲醇和 0.1%(v/v)氨水溶液淋洗,用洗耳球挤干,用3 mL 5%(v/v)氨化甲醇溶液洗脱,将洗脱液于50 ℃水浴下氮气吹至近干,用1 mL 0.1%(v/v)甲酸-乙腈(9∶1, v/v)复溶,过0.22 μm滤膜,供检测。
2 结果与讨论
2.1 质谱条件的优化
FQs的分子结构中含有羧基和叔氨基,具有酸碱两性,在酸性溶液的条件下呈阳离子状态,在电喷雾正离子模式下,极易形成[M+H]+准分子离子;通过优化各药物的特征离子对、毛细管电压、雾化室温度、碰撞电压等质谱条件,选取相对丰度强、干扰小的离子对作为9种FQs药物的定性、定量离子。9种待测物的保留时间、母离子、子离子、锥孔电压、碰撞能量见表1。为提高方法的灵敏度,降低基质干扰,本研究采用分段扫描的方式进行数据采集,9种FQs药物的MRM色谱图见图2。
2.2 MISPE柱的吸附特征
MISPE柱在净化基质中的痕量目标物时,除特异性地吸附目标物外,还存在非特异性吸附,需通过优化MISPE柱的淋洗和洗脱条件,最大限度地提高MIPs结合位点与目标物间的选择性吸附,降低非特异性吸附和基质效应[16,18,19]。因此,本实验对3种镇静剂(地西泮、劳拉西泮、阿扎哌隆)、3种磺胺类(磺胺噻唑、磺胺间甲氧嘧啶、磺胺对甲氧嘧啶)及3种喹诺酮类(氟甲喹、恶喹酸、萘啶酸)药物进行了MISPE特异性吸附试验,分别比较了水、甲醇、0.1%(v/v)氨水、0.5%(v/v)乙酸乙腈溶液对MISPE柱进行淋洗及2%(v/v)氨化甲醇和5%(v/v)氨化甲醇进行洗脱时,9种FQs药物及非目标物的回收率。

表 1 9种氟喹诺酮药物的保留时间、母离子、子离子及其他质谱参数
* Quantitative ion.

图 2 空白鸡肉样品和加标鸡肉样品(0.25 μg/kg)中9种氟喹诺酮类药物的色谱图Fig. 2 Chromatograms of the nine fluoroquinolones in blank chicken samples and chicken samples spiked with 0.25 μg/kg
将含有镇静剂、磺胺类、喹诺酮类药物及9种目标物的磷酸二氢钾溶液加入MISPE柱,分别收集上样液、淋洗液和洗脱液,测定各药物的回收率。结果表明,上样液流经MISPE柱后,镇静剂、磺胺类、喹诺酮类药物不能被有效保留,有26.4%~87.5%直接流出;经水、甲醇、0.1%(v/v)氨水溶液淋洗后,残留的非目标物均被淋洗下来,而目标物的回收率极低;经淋洗液淋洗后,采用5%(v/v)氨化甲醇溶液洗脱时,仅9种FQs药物被洗脱,且回收率均高于65%,而未发现非目标物。其原因可能是镇静剂和磺胺类药物的化学结构(见图3)与FQs药物相差较大,且不具有FQs侧链中的羧基、哌嗪基等活性官能团,不易与MIPs相互作用,在上样、淋洗过程中直接被淋洗下来;3种喹诺酮类药物虽具有与FQs药物共同的母核结构(见图1),但侧链R7位无哌嗪环,缺少与MIPs特异性结合的位点。本方法采用的MISPE柱对镇静剂、磺胺类及喹诺酮类药物无特异性吸附,对9种氟喹诺酮药物具有良好的特异性。
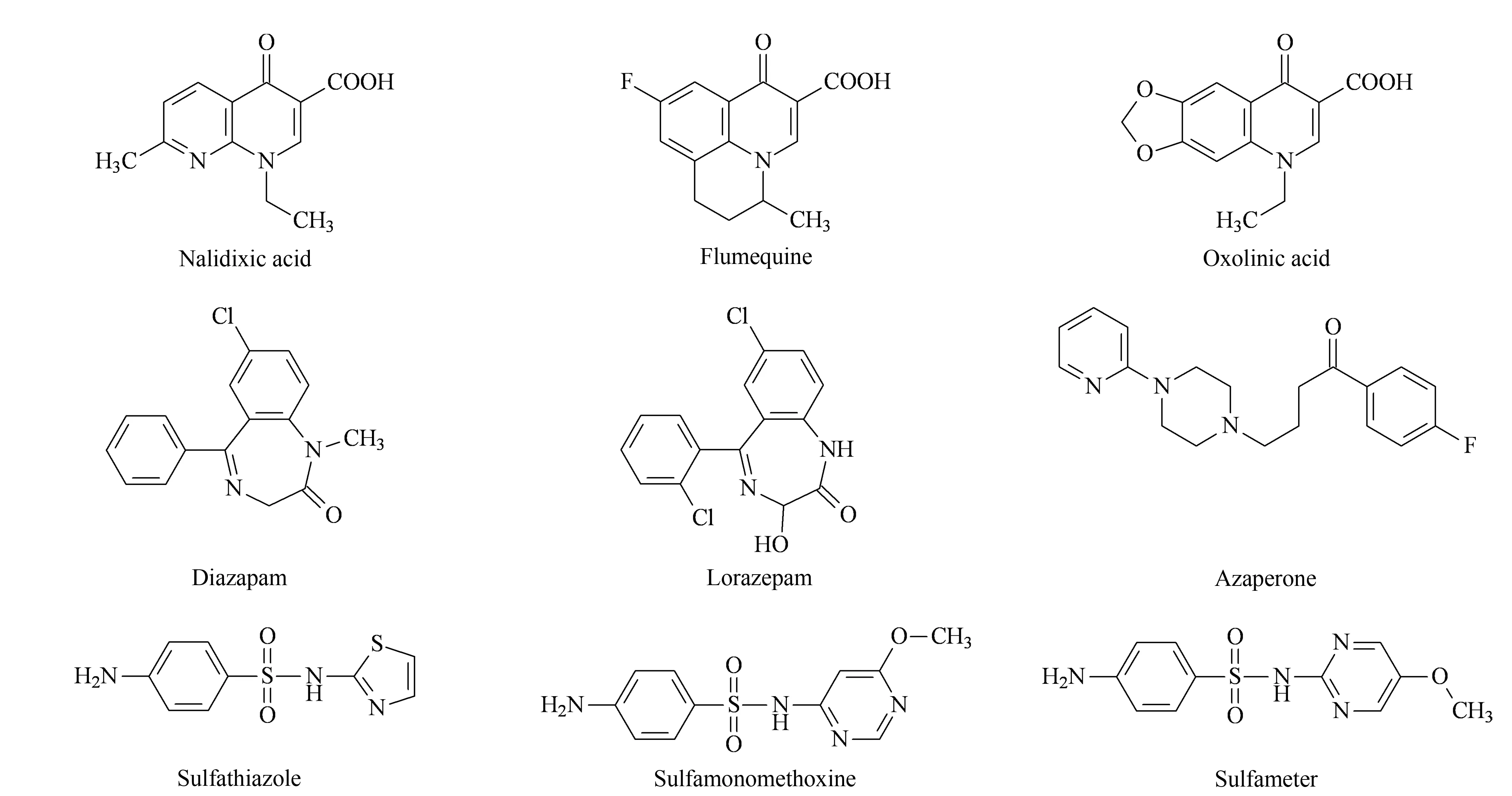
图 3 喹诺酮类、镇静剂和磺胺类药物的化学结构Fig. 3 Chemical structures of quinolones, sedatives and sulfonamides
2.3 MISPE柱柱容量的测定
柱容量是指MISPE柱的活性功能基团能够吸附待测物的最大容量,是考察MISPE柱的重要参数之一。称取2.0 g鸡肉样品,分别添加系列质量浓度的FQs混合标准溶液,检测各药物的回收率,从而计算MISPE柱的最大柱容量。结果表明,该MISPE柱对9种目标物的最大柱容量为464.7~932.4 μg/L(见表2)。

表 2 MISPE柱对9种氟喹诺酮药物的最大柱容量
MISPE: molecularly imprinted solid phase extraction.
2.4 基质效应
在空白鸡肉样品中添加不同质量浓度的混合标准溶液,以各药物的峰面积对质量浓度绘制标准曲线,9种FQs的基质标准曲线与试剂标准曲线的斜率比为85.3%~113.8%。程志等[22]、Matuszewski等[23]的研究表明,基质标准曲线与试剂标准曲线的斜率比为80%~120%时,基质效应对各药物的影响不明显。说明本方法采用基质加标标准曲线对加标回收率进行定量时,基质效应对检测结果几乎无影响。
2.5 线性关系、检出限和定量限
将空白鸡肉样品按1.4节处理后,添加不同质量浓度(0.25、0.5、1.0、2.0、5.0、10、20、50、100 μg/L)的混合标准溶液,以各药物定量子离子的峰面积(Y)为纵坐标,基质标准溶液的质量浓度(X, μg/L)为横坐标,绘制标准曲线(见表3)。各药物在0.25~100 μg/L范围内线性关系良好,相关系数(r)均>0.996 5。分别以3倍和10倍信噪比(S/N)确定检出限(LOD)和定量限(LOQ),分别为0.08 μg/kg和0.25 μg/kg。
2.6 准确度和精密度
分别在空白鸡肉样品中添加LOQ、10倍LOQ、20倍LOQ 3个水平(0.25、2.5、5.0 μg/kg)的标准物质,每个水平做6个平行试验,重复3次,考察方法的准确度和精密度。9种FQs的平均回收率为65.8%~112.2%,批内和批间RSD分别为0.6%~13.5%和0.5%~14.9%(见表4)。
2.7 实际样品测定
采用本研究建立的方法和GB/T20366-2006方法分别对山东省某屠宰场采集的60份鸡肉样品进行检测。结果表明,有2份鸡肉样品中含有诺氟沙星,其余样品均未检出FQs药物残留。本方法检测出的残留值为3.78 μg/kg和6.27 μg/kg, GB/T 20366-2006方法的检测值为3.05 μg/kg和6.73 μg/kg。两种方法检测结果基本一致,RSD<15.1%。

表 3 9种氟喹诺酮类药物的回归方程及相关系数(r)
Y: peak area;X: mass concentration, μg/L; linear range: 0.25-100 μg/L.
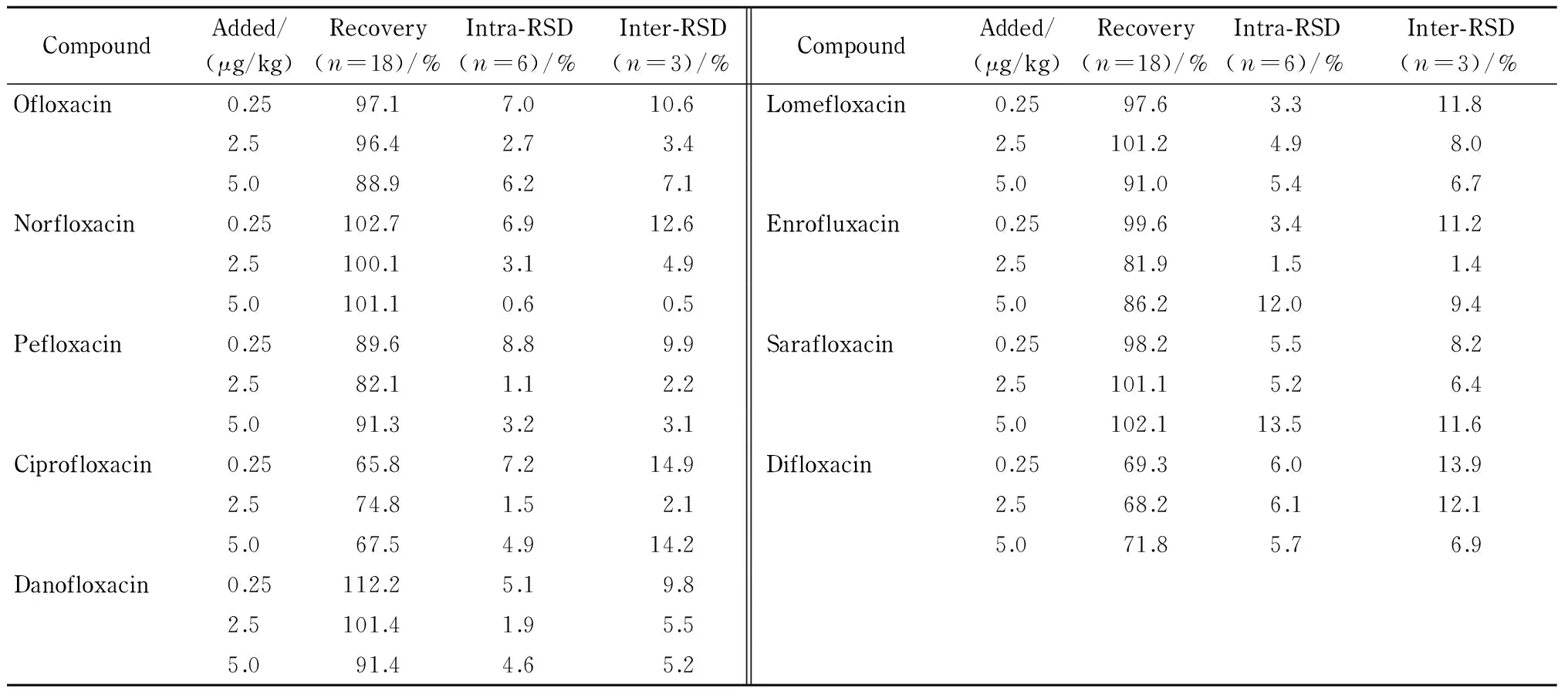
表 4 空白鸡肉样品中9种氟喹诺酮类药物的加标回收率、批内和批间相对标准偏差
3 结论
本研究基于MIPs特异性吸附的特点,有效降低了样品基质的干扰,并通过优化MISPE柱的上样、淋洗和洗脱条件,建立了UPLC-MS/MS测定鸡肉中9种FQs残留的分析方法。该方法选择性好、灵敏度高、重复性好且操作简单、快速,可以用于畜禽产品质量安全监测时大批量样品中FQs药物残留的筛查和确证。
[1] Chen Z L. Veterinary Pharmacology. 3rd ed. Beijing: China Agricultural Press, 2009: 272
陈杖榴. 兽医药理学. 第3版. 北京: 中国农业出版社, 2009: 272
[2] Zhao S J, Jiang H Y, Li X L, et al. J Agric Food Chem, 2007, 55: 3829
[3] Chai M J, Xiao Y, Zhang M, et al. Food Research and Development, 2013, 34(6): 129
柴铭骏, 肖妍, 张曼, 等. 食品研究与开发, 2013, 34(6): 129
[4] European Commission. Regulation 99/508/EEC of 9 March 1999. Off J Eur Communities. 1999, L60: 305
[5] Ministry of Agriculture. No. 235 Bulletin of the Ministry of Agriculture of the People’s Republic of China
农业部. 中华人民共和国农业部第235公告
[6] Ministry of Agriculture. No. 2292 Bulletin of the Ministry of Agriculture of the People’s Republic of China
农业部. 中华人民共和国农业部第2292公告
[7] Liu Y, Xie M X, Ding L, et al. Chinese Journal of Analytical Chemistry, 2004, 32(3): 352
刘媛, 谢孟峡, 丁岚, 等. 分析化学, 2004, 32(3): 352
[8] Gajda A, Posyniak A, Zmudzki J, et al. Food Chem, 2012, 135: 430
[9] Cao P, Mou Y, Gao F, et al. Chinese Journal of Chromatography, 2013, 31(9): 862
曹鹏, 牟妍, 高飞, 等. 色谱, 2013, 31(9): 862
[10] Liu P Y, Shen J, Liu L. Chinese Journal of Analytical Chemistry, 2012, 40(5): 693
刘芃岩, 申杰, 刘磊. 分析化学, 2012, 40(5): 693
[11] Zhao S J, Li C, Jiang H Y, et al. Chinese Journal of Analytical Chemistry, 2007, 35(6): 786
赵思俊, 李存, 江海洋, 等. 分析化学, 2007, 35(6): 786
[12] Wang J Q, Ma J M, Xia X, et al. Journal of Chinese Mass Spectrometry Society, 2014, 35(2): 185
王金秋, 马建民, 夏曦, 等. 质谱学报, 2014, 35(2): 185
[13] Hermo M P, Barron D, Barbosa J. J Chromatogr A, 2008, 1201: 1
[14] Yao K, Zhang W, Yang L Y, et al. J Chromatogr B, 2015, 1003: 67
[15] Wang Y, Xu Y, Zhang X, et al. J Chromatogr B, 2011, 879: 2149
[16] Cristina B, Yolanda P. J Agric Food Chem, 2012, 60: 11005
[17] Martin P D, Jones G R, Stringer F, et al. J Pharm Biomed Anal, 2004, 35: 1231
[18] Wang L J, Cao X M, Sun X L, et al. Chinese Journal of Chromatography, 2016, 34(3): 240
王丽君, 曹旭敏, 孙晓亮, 等. 色谱, 2016, 34(3): 240
[19] Liu S T, Yan H Y, Wang M Y, et al. J Agric Food Chem, 2013, 61: 11974
[20] Yan H Y, Wang F, Wang H, et al. J Chromatogr A, 2012, 1256: 1
[21] Urraca J L, Castellari M, Barrios C A, et al. J Chromatogr A, 2014, 1343: 1
[22] Cheng Z, Zhang R, Liu W H, et al. Chinese Journal of Chromatography, 2014, 32(1): 57
程志, 张蓉, 刘韦华, 等. 色谱, 2014, 32(1): 57
[23] Matuszewski B K. J Chromatogr B, 2006, 830: 293
National Livestock Quality and Safety Risk Assessment Project (No. GJFP201600706); Innovation Fund of China Animal Health and Epidemiology Center (No. 2014IF-0003FF).
Determination of nine fluoroquinolone residues in chicken by ultra performance liquid chromatography-tandem mass spectrometry coupled with molecularly imprinted solid phase extraction
YANG Yanfei1,2, CAO Xumin2,3, LI Xuelian4, SONG Jiande2, SUN Xiaoliang2,3, WANG Shuting2,3, WANG Xiaoyin2,3, LI Lin1*, ZHAO Sijun2,3*
(1. College of Animal Science and Technology, Anhui Agriculture University, Hefei 230000, China; 2. China Animal Health and Epidemiology Center, Qingdao 266032, China; 3. Livestock and Poultry Products Quality and Safety Risk Assessment Laboratory, Ministry of Agriculture (Qingdao), Qingdao 266032, China; 4. Qingdao Yebio Biological Engineering Co., Ltd., Qingdao 266032, China)
An ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) method coupled with molecularly imprinted solid phase extraction (MISPE) for the determination of nine fluoroquinolone residues in chicken was developed. The samples were extracted with phosphate buffer solution, and cleaned up with MISPE columns. Then the drugs were analyzed on a BEH C18column by gradient elution with acetonitrile and 0.1% (v/v) formic acid solution as mobile phase. The samples were analyzed in electrospray positive ion mode and multiple reaction monitoring (MRM) mode. The analytes were quantified by external standard method. The specific adsorption of MISPE for the nine fluoroquinolones in chicken samples was investigated. The linear ranges were 0.25-100 μg/L with correlation coefficients (r) greater than 0.996 5. The limits of detection (LODs,S/N=3) and the limits of quantification (LOQs,S/N=10) were 0.08 μg/kg and 0.25 μg/kg, respectively. At the spiked levels of 0.25, 2.5, 5.0 μg/kg, the recoveries were 65.8%-112.2% with the intra-RSDs of 0.6%-13.5% and inter-RSDs of 0.5%-14.9%, respectively. The maximum capacities of the MISPE column were 464.7-932.4 μg/L. The method is sensitive, simple and rapid for the simultaneous determination of the nine fluoroquinolone residues.
ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS); molecularly imprinted solid phase extraction (MISPE); fluoroquinolones; chicken
10.3724/SP.J.1123.2016.07024
2016-07-24
国家畜禽质量安全风险评估项目(GJFP201600706);中国动物卫生与流行病学中心创新基金项目(2014IF-0003FF).
O658
A
1000-8713(2016)11-1063-07
* 通讯联系人.E-mail:lilinah@126.com(李琳);E-mail:zhsjun@126.com(赵思俊).

