气相色谱测定牦牛骨中脂肪酸的甲酯化方法比较
刘文媛, 贾 伟, 吴 婷, 张春晖*, 李 侠, 陈雪峰
(1. 陕西科技大学食品与生物工程学院, 陕西 西安 710021; 2. 中国农业科学院农产品加工研究所, 北京 100193)
研究论文
气相色谱测定牦牛骨中脂肪酸的甲酯化方法比较
刘文媛1,2, 贾 伟2, 吴 婷2, 张春晖2*, 李 侠2, 陈雪峰1*
(1. 陕西科技大学食品与生物工程学院, 陕西 西安 710021; 2. 中国农业科学院农产品加工研究所, 北京 100193)
利用气相色谱(GC)技术,采用酸水解提取脂质,比较了6种甲酯化法(乙酰氯-甲醇法、H2SO4-甲醇法、HCl-甲醇法、KOH-甲醇法、KOH-甲醇+H2SO4-甲醇法和KOH-甲醇+HCl-甲醇法)对脂肪酸测定的影响,优选牦牛骨中脂肪酸测定的最佳方法。37种脂肪酸标准样品在0.28~250.00 mg/L范围内线性关系良好,相关系数均大于0.99(除C4∶0外)。碱酯化法和酸碱结合法几乎无法测出牦牛骨中的脂肪酸,其测得的总脂肪酸含量小于0.20 g/100 g。乙酰氯-甲醇法测得的总脂肪酸含量(13.61 g/100 g)显著高于H2SO4-甲醇法(总脂肪酸含量为11.68 g/100 g)和HCl-甲醇法(总脂肪酸含量为3.18 g/100 g)测得的结果。乙酰氯-甲醇法和H2SO4-甲醇法的日内和日间精密度分别为0.27%~8.60%和0.34%~2.64%,两种方法中脂肪酸的回收率为83.06%~105.54%。结果表明,酸水解-乙酰氯-甲醇法是牦牛骨中脂肪酸测定的最佳方法。C18∶1n9c、C16∶0、C18∶0和共轭亚油酸(CLA)是牦牛骨的主要脂肪酸,其总和达脂肪酸总量的85%以上,饱和脂肪酸与不饱和脂肪酸含量比值约为1∶2。牦牛骨中脂肪酸的研究为骨资源脂质的有效利用提供了重要依据。
气相色谱;甲酯化;脂肪酸;牦牛骨;方法验证
骨由骨髓和矿化骨组织组成,富含蛋白质、矿物质和脂肪[1],随着畜禽养殖规模和肉类消费量的逐年增长,骨资源的开发利用逐渐引起人们的关注。牦牛是唯一一种可生活在海拔3 000 m以上高寒地带的牛种,约有92%的牦牛分布在中国[2],而牦牛骨作为可食性副产物未被有效利用。近年来对牦牛骨的研究多集中在蛋白质及微量元素上,对其脂肪酸的研究鲜见报道[3,4]。
气相色谱法是检测脂肪酸的有效方法[5],测定分析前需将脂肪酸衍生为脂肪酸甲酯。甲酯化方法有酸催化法、碱催化法、酸碱结合法和乙酰氯-甲醇催化法等[6,7]。酸催化法适用于酯化总脂肪酸,反应时间取决于酸浓度和反应温度。碱催化法的反应条件相对温和且耗时较短,但不适用于酯化游离脂肪酸,且对体系中水分含量要求严格[8-10]。乙酰氯-甲醇在催化过程中释放足量的盐酸,促进酯化反应的进行[11]。前人使用不同的酯化剂对不同骨样中的脂肪酸进行了分析,如Humphrie等[12]使用H2SO4-甲醇法研究了女性骨关节炎和脆性骨折之间的脂肪酸指纹图谱的差异;Everts等[13]采用HCl-甲醇法对鲸鱼骨化石中的脂肪酸进行了分析;刘金凯等[14]使用乙酰氯-甲醇对氧化及未氧化的羊骨油中脂肪酸进行了测定。但酯化试剂多作为一种单纯的甲酯化手段用于脂肪酸的测定,尚未有骨中脂肪酸检测方法特性及适用性的研究。本研究综合比较了脂肪酸检测方法,优选牦牛骨中脂肪酸测定的最佳方法,为今后牦牛骨中脂肪酸的检测提供了方法依据,牦牛骨中脂肪酸组成分析为其脂质的应用研究提供了思路和依据。
1 实验部分
1.1 仪器、试剂与材料
Allegra X-12R型冷冻离心机(美国Beckman Coulter有限公司);配有氢火焰离子化检测器的气相色谱仪(GC-FID, Varian 450)、自动进样器CP 8400、CP-Sil 88毛细管柱(100 m×0.25 mm×0.2 μm)购自安捷伦科技中国有限公司。
乙酰氯(质量分数为99%)、硫酸(质量分数为98%)、盐酸(质量分数为37%)、氢氧化钾、氯化钠、无水硫酸钠和碳酸钠均为分析纯,购自国药集团化学试剂有限公司;甲醇(色谱纯)购自赛默飞世尔科技公司;正己烷(色谱纯)购自北京迈瑞达科技有限公司。
37种脂肪酸甲酯混合标准品(FAME Mix 37)、C4~C24各脂肪酸甲酯标准品(纯度≥99%)、十一碳酸甘油三酯(glyceryl triundecanoate,纯度≥98%)购自美国Sigma公司;共轭亚麻油酸甲酯(conjugated methyl octadecadienoate, CLA,纯度为99%)购自美国Nu-Check-Prep公司。
随机选取西藏拉萨地区自然放牧条件下2~3岁发育正常的公牛6头,屠宰后取后股骨(不含软骨),剔除碎肉、筋等杂质,晾干后粉碎,得到3~5 mm的骨颗粒,保存于-80 ℃备用。
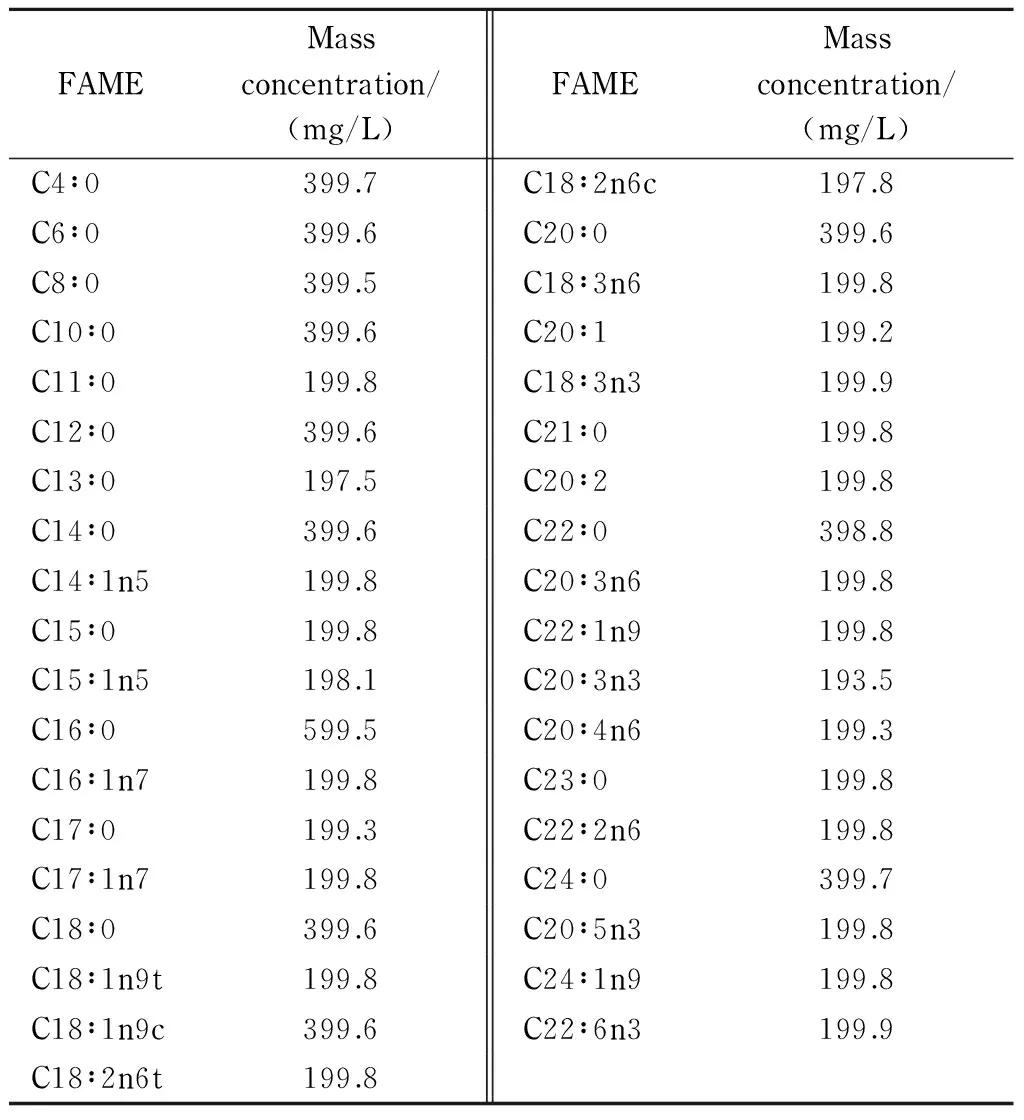
表 1 37种脂肪酸甲酯混合标准品中各脂肪酸的质量浓度
1.2 标准溶液的配制
37种脂肪酸甲酯混合标准品的配制:原液(质量浓度见表1)用正己烷梯度稀释2.5、5、10、15、20倍用于绘制标准曲线。十一碳酸甘油三酯内标液的配制:称取500 mg十一碳酸甘油三酯,用甲醇定容至500 mL,配制成质量浓度为1 g/L的溶液。共轭亚麻油酸甲酯外标液的配制:取50 mg共轭亚麻油酸甲酯,用正己烷定容至100 mL,配制成质量浓度为0.5 g/L的溶液,用正己烷稀释为10、20、30、40倍的梯度工作液,用以绘制标准曲线。
1.3 实验方法
1.3.1 脂肪的提取
采用酸水解提取牦牛骨中的脂质。称取0.10 g牦牛后股骨,加入0.5 mL 1 g/L十一碳酸甘油三酯内标液和10.0 mL 8.3 mol/L HCl溶液。将水解管于80 ℃水浴中水解40 min(每10 min振荡一次)。水解完成后,取出试管冷却至室温,加入2 mL正己烷,涡旋振荡1 min,静置2 min,将有机层收集到另一水解管中,同样的操作重复4次。

图 1 (a)37种脂肪酸甲酯混合标准品和(b)CLA甲酯标准品的色谱图Fig. 1 Chromatograms of (a) the 37 fatty acid methyl ester mixed standard solution and (b) conjugated linoleic acid (CLA) standard solution
1.3.2 脂肪甲酯化
采用6种不同的酯化剂对水解提取的脂质进行甲酯化处理。6种甲酯化方法分别为M1:乙酰氯-甲醇法[14](酯化剂:10%(体积分数,下同)乙酰氯-甲醇); M2: H2SO4-甲醇法[12](酯化剂:5% H2SO4-甲醇); M3: HCl-甲醇法[15](酯化剂:5% HCl-甲醇); M4: KOH-甲醇法[16]酯化剂:2 mol/L KOH-甲醇); M5: KOH-甲醇+H2SO4-甲醇法[17](酯化剂:2 mol/L KOH-甲醇,5% H2SO4-甲醇)和M6: KOH-甲醇+HCl-甲醇法[18](酯化剂:2 mol/L KOH-甲醇,5% HCl-甲醇)。
M1~M4甲酯化处理:试管中加入6 mL各方法下相应的酯化剂,在N2流下充气1 min后旋紧螺旋盖,振荡2 min,混匀,于80 ℃水浴2 h(每20 min振荡一次)。
M5~M6甲酯化处理:试管中加入6 mL KOH-甲醇,在N2流下充气1 min后旋紧螺旋盖,振荡2 min,混匀后于80 ℃水浴1 h,于冰浴中冷却至4 ℃后加入6 mL 5% H2SO4-甲醇(M5)或6 mL 5% HCl-甲醇(M6),在N2流下充气1 min后旋紧螺旋盖,振荡2 min,混匀后于80 ℃水浴中再次酯化1 h。水浴过程中每15 min振荡一次。
M1~M6甲酯化反应完成后,取出试管冷却至室温。将反应后的样液转移至50 mL离心管中,分别用3.0 mL饱和NaCl溶液(M1使用60 g/L Na2CO3溶液)清洗试管3次,合并清洗液,混匀,以4 500 r/min的转速离心10 min。离心完成后收集上清液于储藏瓶中,加入约2 g无水硫酸钠干燥,振摇混匀静置,于-80 ℃保存。取1 mL上清液过0.2 μm有机相滤膜,于气相小瓶中进行GC分析。
1.4 色谱条件
色谱柱:CP-Sil 88毛细管柱;进样量:1 μL,分流比为20∶1。检测器温度:300 ℃;进样温度:200 ℃;载气为氦气,纯度≥99.999%;载气流速为30 mL/min。升温程序如下:初始柱温80 ℃,以2 ℃/min的速度升温至200 ℃,于200 ℃保持2 min,再以5 ℃/min的速度升温至230 ℃,于230 ℃保持15 min。
2 结果与讨论
2.1 甲酯化方法的比较
37种脂肪酸甲酯混合标准品和CLA标准品的GC谱图见图1。可以看出在本研究所建立的GC-FID条件下,各脂肪酸甲酯均能被有效分离和检出。图2分别为6种甲酯化方法处理后样品的GC谱图,与乙酰氯-甲醇法(M1)和酸酯化法(M2和M3)相比,碱酯化法(M4)和酸碱结合法(M5和M6)的出峰数极少且峰高极低。乙酰氯-甲醇法、H2SO4-甲醇法和HCl-甲醇法分别检测出20、20和16种脂肪酸(不包括内标),而在重复测定过程中稳定存在的脂肪酸分别为15、15和12种。本研究只对稳定存在的脂肪酸进行了定量分析比较,结果见表2。
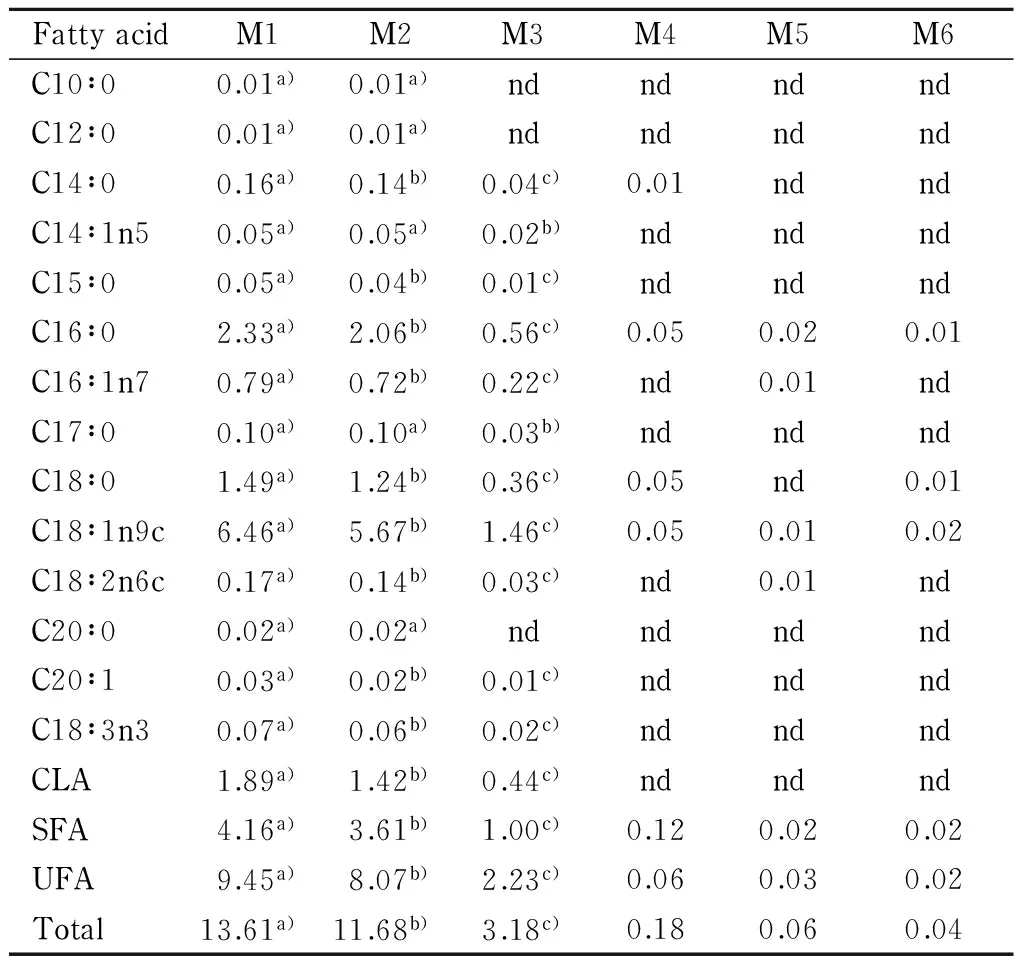
表 2 6种甲酯化方法测定的牦牛骨脂肪酸含量(g/100 g)
M1-M6 are the same as those in Fig. 2. CLA: conjugated linoleic acid; SFA: saturated fatty acid; UFA: unsaturated fatty acid. nd: not detected. a)-c): significant difference (p<0.01) in M1-M3. Results were obtained from the means of nine determinations.
2.1.1 碱酯化法和酸碱结合法
碱酯化法(测得总脂肪酸含量<0.20 g/100 g)和酸碱结合法(测得总脂肪酸含量<0.10 g/100 g)几乎无法测出牦牛骨中的脂肪酸(见表2)。KOH-甲醇易与游离脂肪酸反应生成脂肪酸钾和水,水会导致氢氧根自由基的生成,这些氢氧根自由基会使骨样中的酯和新生成的脂肪酸甲酯发生水解反应,从而削弱碱酯化效果[19-21]。牦牛骨中游离脂肪酸及体系中水的存在导致碱酯化法和酸碱结合法最终只能测出微量的脂肪酸。而在Juárez等[22]对肉中脂肪酸检测方法的研究中,HCl-甲醇法、皂化法、经典法和结合法均测得相应的脂肪酸含量,且使用KOH-甲醇催化的皂化法和经典法测得的脂肪酸含量均较高。可能是由于肉和骨中脂肪酸组成形式不同,适用于肉中脂肪酸检测的碱酯化法和酸碱结合法却几乎无法测得牦牛骨中的脂肪酸。
2.1.2 乙酰氯-甲醇法和酸酯化法
由表2可知HCl-甲醇法测定的总脂肪酸含量(3.18 g/100 g)显著低于乙酰氯-甲醇法(13.61 g/100 g)和H2SO4-甲醇法(11.68 g/100 g)测定的总脂肪酸含量。酸催化过程需要较高的催化剂浓度和温度,且反应时间较长[21]。HCl-甲醇不稳定,HCl易与甲醇发生亲核反应生成氯甲烷和水[23],水会削弱酯化效果[24]。在本研究试验条件下,HCl-甲醇法可能未使脂肪酸完全酯化,从而造成其结果偏低。Juárez等[22]比较了肉中脂肪酸的检测方法,发现与皂化法、经典法相比,HCl-甲醇法由于反应条件不足导致脂肪酸不能被完全提取,只能测得较低的脂肪酸含量。
H2SO4-甲醇作为酯化剂时,脂肪酸与甲醇在酸性条件下发生酯化反应[8]。但反应体系中的水会抑制反应的进一步进行[25],且可能存在甲醇脱水生成甲基醚的副反应。这些反应将影响H2SO4-甲醇的酯化效果。而乙酰氯在作用过程中释放的盐酸实现了酸原位催化反应,且乙酰氯可以消化酯化过程中产生的水从而促进酯化反应的进行[26]。由于酯化过程中水的产生,除C10∶0、C12∶0、C14∶1n5、C17∶0和C20∶0用两种方法测得的含量没有显著差异外,乙酰氯-甲醇法测得的饱和脂肪酸(saturated fatty acid, SFA, 4.16 g/100 g)、不饱和脂肪酸(unsaturated fatty acid, UFA, 9.45 g/100 g)、总脂肪酸(13.61 g/100 g)和其他10种脂肪酸含量均显著高于H2SO4-甲醇法测得的含量(见表2)。
2.2 工作曲线、检出限和定量限
使用正己烷梯度稀释脂肪酸甲酯混合标准溶液,根据质量浓度(mg/L)与峰面积关系绘制标准曲线。方法的检出限(LOD)和定量限(LOQ)以3倍和10倍信噪比计算得出,部分脂肪酸甲酯的线性关系见表3。各脂肪酸甲酯标准品在0.28~250.00 mg/L范围内线性关系良好,相关系数R2均大于0.99(C4∶0除外,其R2为0.987 8)。基于表3中的LOD和LOQ值,对样液进行稀释使其脂肪酸浓度处于线性范围内。
2.3 精密度与回收率
使用相对标准偏差(RSD)计算方法的日内精密度(n=9)和日间精密度(n=3),乙酰氯-甲醇法和H2SO4-甲醇法的精密度见表4。相较于乙酰氯-甲醇法和H2SO4-甲醇法的日内精密度(0.34%~1.90%),其日间精密度范围(0.27%~8.60%)较大,但均小于9%。取约0.10g牦牛后股骨添加高、中、低3个水平的脂肪酸标准品,并按1.3节方法处理样品,进行加标回收试验,根据回收率评估乙酰氯-甲醇法和H2SO4-甲醇法的准确性(见表5)。各脂肪酸3个添加水平的回收率均在81%~106%之间,且牦牛骨中含量较高的C18∶1n9c、C16∶0和C18∶0在3个浓度水平和CLA中浓度水平的回收率均在90%~97%之间。结果表明乙酰氯-甲醇法和H2SO4- 甲醇法准确可靠。
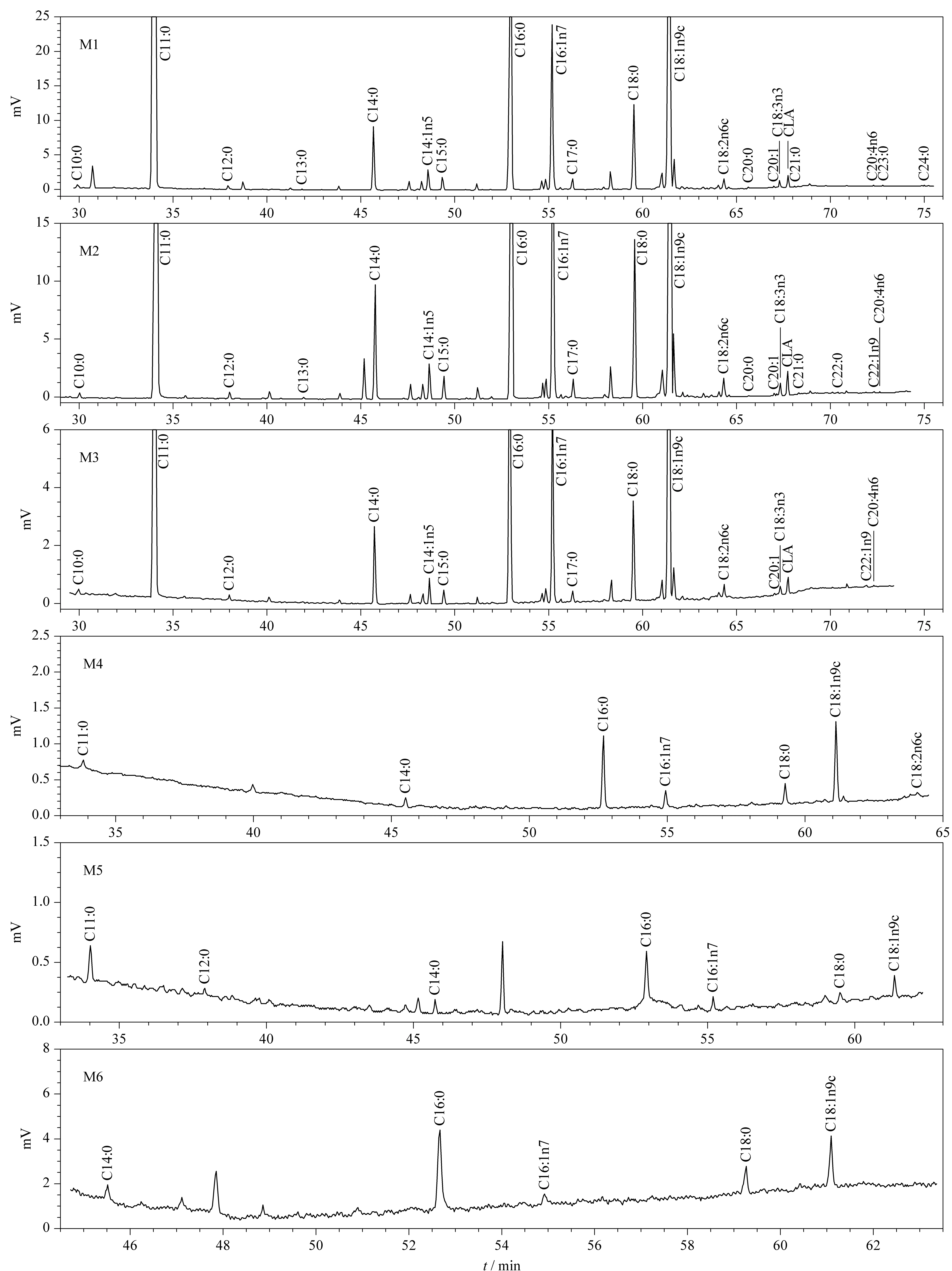
图 2 M1~M6方法处理的脂肪酸色谱图Fig. 2 Chromatograms of fatty acids by M1-M6 methods M1: acetyl chloride-methanol method; M2: H2SO4-methanol method; M3: HCl-methanol method; M4: KOH-methanol method; M5: KOH-methanol+H2SO4-methanol method; M6: KOH-methanol+HCl-methanol method.

FattyacidLinearrange/(mg/L)R2LOD/(mg/L)LOQ/(mg/L)C10∶00.57-166.500.99150.0770.258C11∶00.29-83.250.99170.0830.277C12∶00.57-166.500.99140.0880.293C14∶00.57-166.500.99160.1270.422C14∶1n50.29-83.250.99220.1280.426C15∶00.29-83.250.99200.1740.579C16∶00.86-249.790.99340.2420.806C16∶1n70.29-83.250.99360.2290.765C17∶00.28-83.040.99500.5241.748C18∶00.57-166.500.99560.6472.155C18∶1n9c0.57-166.500.99670.5601.866C18∶2n6c0.28-82.420.99730.5491.832C20∶00.57-166.500.99661.6135.376C20∶10.28-83.000.99871.8996.329C18∶3n30.29-83.290.99420.6322.105CLA0.50-250.000.99990.9523.175

表 4 M1和M2的日内精密度、日间精密度
M1 and M2 are the same as those in Fig. 2.

表 5 M1和M2方法中3个加标水平下脂肪酸的回收率
M1 and M2 are the same as those in Fig. 2.
2.4 牦牛骨脂肪酸分析
分析比较牦牛骨中的脂肪酸,SFA约占总脂肪酸的1/3, C16∶0、C18∶0是主要脂肪酸,两者含量之和达SFA的90%以上。C18∶1n9c是最主要的单不饱和脂肪酸(含量达UFA的85%以上),含量约为总脂肪酸的一半。这一结果与Kagawa等[27]的研究结果相似,表明C18∶1n9c(含量约为总脂肪酸的34%~50%)是人和动物骨组织的主要脂肪酸。CLA是主要的多不饱和脂肪酸,含量达总脂肪酸的14%。C18∶1n9c、C16∶0、C18∶0和CLA是牦牛骨的主要脂肪酸,这一结果与Mello等[28]得出的C18∶1n9c、C16∶0和C18∶0是牛骨髓主要脂肪酸的结论相似。
3 小结
通过对6种甲酯化方法的分析比较发现,碱酯化法和酸碱结合法几乎无法测出牦牛骨中的脂肪酸,乙酰氯-甲醇法和H2SO4-甲醇法的测定效果显著优于HCl-甲醇法测得的结果(总脂肪酸含量为3.18 g/100 g),乙酰氯-甲醇法测得的总脂肪酸含量(13.61 g/100 g)显著优于H2SO4-甲醇法测得的结果(总脂肪酸含量为11.68 g/100 g)。结合验证试验结果综合比较,酸水解-乙酰氯-甲醇法是牦牛骨中脂肪酸检测的最佳方法。C18∶1n9c、C16∶0、C18∶0和CLA是牦牛骨的主要脂肪酸,其含量分别为总脂肪酸的47%、17%、10%和13%, SFA与UFA的含量比值约为1∶2。对牦牛骨中脂肪酸的深入研究为牦牛骨资源的深层次利用提供可靠详实的基础数据,对牦牛产业的发展具有重要意义。
[1] Ward A G, Cours A. The Science and Technology of Gelatin, London: Academic Press, 1977: 31
[2] Ma J, Cai J, Ma J, et al. Vet Parasitol, 2014, 202(3/4): 113
[3] Qu Y, Li C, Cheng L T, et al. Chinese Journal of Science and Technology of Food Industry, 2016, 37(3): 271
瞿瑗, 李诚, 程乐涛, 等. 食品工业科技, 2016, 37(3): 271
[4] Zhou L B. Acta Agriculturae Boreali-Occidentalis Sinica, 2011, 20(5): 59
周利兵. 西北农业学报, 2011, 20(5): 59
[5] Li B, Qiu L Q, Song S F, et al. Chinese Journal of Analysis Laboratory, 2014, 33(5): 528
李斌, 裘立群, 宋少芳, 等. 分析试验室, 2014, 33 (5): 528
[6] Shao S P, Xiang D P, Li S, et al. Chinese Journal of Chromatography, 2015, 33(11): 1214
邵仕萍, 相大鹏, 李双, 等. 色谱, 2015, 33(11): 1214
[7] Lin Q, Li G B, Ge P, et al. Chinese Journal of Chromatography, 2016, 34(5): 520
林麒, 李国波, 葛品, 等. 色谱, 2016, 34(5): 520
[8] Carrapiso A I, Garcia C. J Lipids, 2000, 35(11): 1167
[9] Suter B, Grob K, Pacciarelli B. Z Lebensm Unters Forsch A, 1997, 204(4): 252
[10] Long A R, Massie S J, Tyznik W J. J Food Sci, 1988, 53: 940
[11] Ecker J, Scherer M, Schmitz G, et al. J Chromatogr B, 2012, 897(4): 98
[12] Humphrie J M, Kuliwaba J S, Gibson R J, et al. J Bone, 2012, 51(2): 218
[13] Everts J M, Doberenz A R, Wyckoff R W G. J Comp Biochera Physiol, 1968, 26(3): 955
[14] Liu J K, Gao Y, Wang Z Y, et al. Chinese Journal of Modern Food Science and Technology, 2014, 30(11): 240
刘金凯, 高远, 王振宇, 等. 现代食品科技, 2014, 30(11): 240
[15] Sheng J, Vannela R, Rittrnann B E. J Bioresour Technol, 2011, 102(2): 1697
[16] Zhu W X, Yuan P, Zhang L, et al. Chinese Journal of Analysis Laboratory, 2015, 34(11): 1276
祝伟霞, 袁萍, 张丽, 等. 分析试验室, 2015, 34(11): 1276
[17] Or-Rashid M M, Fisher R, Karrow N, et al. J Anim Sci, 2010, 88(6): 2092
[18] Fowler M A, Debier C, Mignolet E, et al. J Comp Physiol B, 2014, 184(1): 125
[19] Christie W W. Advances in Lipid Methodology. 2nd ed. Dundee: Oily Press, 1993: 69
[20] Bannon C D, Breen G J, Craske J D, et al. J Chromatogr A, 1982, 247: 71
[21] Liu K S. J Am Oil Chem Soc, 1994, 71(11): 1179
[22] Juárez M, Polvillo O, Contò M, et al. J Chromatogr A, 2008, 1190: 327
[23] Kishimoto Y, Radin N S. J Lipid Res, 1965, 6(6): 435
[24] Jham G N, Teles F F F, Campos L G. J Am Oil Chem Soc, 1982, 59(3): 132
[25] Stofel W, Chu F, Ahrens E H. J Anal Chem, 1959, 31(2): 307
[26] Nudelman A, Bechor Y, Falb E, et al. J Synth Commun, 1998, 28(3): 471
[27] Kagawa M, Matsubara K, Kimura K, et al. J Forensic Sci In, 1996, 79(3): 215
[28] Mello J R, Field R A, Forenza S, et al. J Food Sci, 2001, 49(41): 226
“948” Program of Ministry of Agriculture (No. 2016-X31).
Comparison of the methylation methods for the determination of fatty acids in Yak bones by gas chromatography
LIU Wenyuan1,2, JIA Wei2, WU Ting2, ZHANG Chunhui2*, LI Xia2, CHEN Xuefeng1*
(1. School of Food and Biological Engineering, Shaanxi University of Science & Technology, Xi’an 710021, China; 2. Institute of Food Science and Technology, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
The acid hydrolysis-esterification system with six methylation methods (acetyl chloride-methanol method, H2SO4-methanol method, HCl-methanol method, KOH-methanol method, KOH-methanol+H2SO4-methanol method and KOH-methanol+HCl-methanol method) were compared for the fatty acids (FAs) profiling of Yak bones by gas chromatography (GC) in this study. Good linearities were obtained in the range of 0.28-250.00 mg/L with correlation coefficientR2>0.99, except for C4∶0 (R2=0.987 8). FAs can hardly be detected by the base-catalytic method and the combined acid-base method (the content of total FAs was less than 0.20 g/100 g) in the present study. The FAs determined by the acetyl chloride-methanol method (content of total FAs was 13.61 g/100 g) was superior to the H2SO4-methanol method (content of total FAs was 11.68 g/100 g) and the HCl-methanol method (content of total FAs was 3.18 g/100 g). The precisions for intra-day and inter-day of acetyl chloride-methanol method and H2SO4-methanol method were 0.27%-8.60% and 0.34%-2.64%, respectively. And the recoveries for the FAs of these two methods were in the range of 83.06%-105.54%. This study suggested that the acid hydrolysis-acetyl chloride-methanol method was the best method in the six methods. It was convenient for the accurate determination of FAs in Yak bones. C18∶1n9c, C16∶0, C18∶0 and conjugated linoleic acid (CLA) were the mainly FAs in Yak bones, and the sum of the four FAs was more than 85% of the total FAs. The ratio of the contents of the saturated and unsaturated FAs in Yak bones was about 1∶2. The study of fatty acids in Yak bones provides an important basis for the effective utilization of bone resources.
gas chromatography (GC); methylation; fatty acids; Yak bones; method validation
10.3724/SP.J.1123.2016.07009
2016-07-07
农业部“948”项目(2016-X31).
O658
A
1000-8713(2016)11-1113-07
* 通讯联系人.Tel:(029)86168293,E-mail:chenxf@sust.edu.cn(陈雪峰);Tel:(010)62819469,E-mail:dr_zch@163.com(张春晖).

