改良QuEChERS方法快速测定果蔬中8种新型琥珀酸脱氢酶抑制剂类杀菌剂
杨 欢, 孙伟华, 曹赵云, 马有宁, 柴爽爽, 秦美玲, 陈铭学
(中国水稻研究所, 农业部稻米及制品质量监督检验测试中心,
农业部稻米产品质量安全风险评估实验室, 浙江 杭州 310006)
研究论文
改良QuEChERS方法快速测定果蔬中8种新型琥珀酸脱氢酶抑制剂类杀菌剂
杨 欢, 孙伟华, 曹赵云, 马有宁, 柴爽爽, 秦美玲, 陈铭学*
(中国水稻研究所, 农业部稻米及制品质量监督检验测试中心,
农业部稻米产品质量安全风险评估实验室, 浙江 杭州 310006)
建立了一种同时测定果蔬中啶酰菌胺、吡噻菌胺、吡唑萘菌胺、氟唑菌酰胺、联苯吡菌胺、氟唑环菌胺、氟唑菌苯胺和氟吡菌酰胺8种新型琥珀酸脱氢酶抑制剂类杀菌剂残留量的液相色谱-串联质谱方法。通过比较乙二胺-N-丙基硅烷(PSA)和十八烷基键合硅胶吸附剂(C18)两种分散固相萃取剂不同添加剂量下的吸附作用和净化效果,优化QuEChERS方法净化过程,以乙腈-0.1%(体积分数)甲酸水溶液为流动相进行梯度洗脱,使8种目标化合物在Poroshell 120 EC-C18色谱柱上分离,经电喷雾正/负双离子扫描、多反应监测模式质谱检测,外标法定量。8种目标化合物在0.5~500.0 μg/L范围内线性关系良好,相关系数均大于0.998,方法检出限为0.2~1.7 μg/kg,定量限为0.5~5.0 μg/kg。各种目标化合物在8种基质中3个添加水平(5.0、25.0和125.0 μg/kg)下的回收率为71.4%~121.3%,相对标准偏差(RSD,n=6)为0.8%~17.2%。该方法操作简单、净化效果好,适用于果蔬中新型琥珀酸脱氢酶抑制剂类杀菌剂的快速检测。
液相色谱-串联质谱;QuEChERS;新型琥珀酸脱氢酶抑制剂类杀菌剂;蔬菜;水果
琥珀酸脱氢酶抑制剂(succinate dehydrogenase inhibitors, SDHIs)是一类通过抑制病原菌内的琥珀酸脱氢酶活性,阻碍呼吸作用,从而抑制病原菌生长的新型杀菌剂[1]。目前,该类杀菌剂主要应用于蔬菜、水果、粮食等经济作物的杀菌和防霉[2]。近年来国内外已开发出结构新颖、活性高的新一代SDHI类杀菌剂[3]。虽然该类杀菌剂毒性较低,但因其使用日益广泛,SDHI类杀菌剂及代谢物残留对农产品质量安全造成严重影响。欧盟规定啶酰菌胺、吡噻菌胺、吡唑萘菌胺、氟唑菌酰胺在西红柿中的限量为3 mg/kg[4],我国规定啶酰菌胺在草莓和苹果中的限量分别为3 mg/kg和2 mg/kg[5]。因此有必要开展快速分析新型SDHI类杀菌剂方法的研究,为该类杀菌剂的使用、监管提供技术依据。
目前,国内外公开报道的关于啶酰菌胺等SDHI类杀菌剂的分析方法主要有免疫分析法[6,7]、气相色谱(GC)法[8]、液相色谱(LC)法[9]、气相色谱-质谱(GC-MS/MS)法[10,11]和液相色谱-质谱(LC-MS/MS)法[12-16]。免疫分析法中抗原合成困难,检测结果可靠性低;气相色谱和液相色谱法对样品纯度要求较高,耗时长;而液相色谱-质谱法分离能力高、抗干扰性强,能有效进行多组分定性与定量检测[17]。孙亚米等[14]建立了用乙腈提取、氯化钠盐析分层后直接稀释、LC-MS检测果蔬中啶酰菌胺等16种新型酰胺类杀菌剂的方法;Abad-Fuentes等[18]利用超高效液相色谱-串联质谱技术测定果蔬中吡唑萘菌胺等7种新型SDHI类杀菌剂的残留量;Wu等[19]建立了固相萃取与LC-MS联合同时检测联苯吡菌胺等16种新型SDHI类杀菌剂的分析方法。而有关吡唑萘菌胺、吡噻菌胺等新一代SDHI类杀菌剂在果蔬中残留的检测方法至今还鲜有报道。
QuEChERS方法因其经济、简便、易操作的特点,一直被广泛应用于果蔬中农药的多残留测定。因此,本文将QuEChERS前处理方法与液相色谱-串联质谱技术结合,建立快速检测8种新型SDHI类杀菌剂的方法。
1 实验部分
1.1 仪器与设备
Survryor系列液相色谱仪、TSQ Quantum Access MaX三重四极杆质谱仪、Primo R离心机(美国Thermo Fisher公司);高速匀浆机(德国IKA公司)。
1.2 试剂与材料
乙腈(色谱纯,德国Merck公司);甲酸(色谱纯,美国Tedia公司);氯化钠(NaCl,分析纯,上海试四赫维化工有限公司);乙二胺-N-丙基硅烷(PSA)和十八烷基键合硅胶吸附剂(C18)填料(粒径40.0 μm,美国瓦里安公司);无水硫酸镁(MgSO4,分析纯,美国Sigma-Aldrich公司);啶酰菌胺(boscalid,纯度98.0%)、氟苯吡菌胺(fluxapyroxad,纯度99.0%)、联苯吡菌胺(bixafen,纯度98.5%)、氟吡菌酰胺(fluopyram,纯度99.0%)、萘吡菌胺(isopyrazam,纯度99.7%)标准品(上海安谱实验科技股份有限公司);氟唑菌苯胺(penflufen,纯度98.4%)、氟唑环菌胺(sedaxane,纯度99.1%)、吡噻菌胺(penthiopyrad,纯度98.4%)标准品(北京北纳创联生物技术研究院);实验用水为由Milli-Q超纯水仪(美国Milipore公司)制备的超纯水。
菠菜、黄瓜、花菜、西红柿、白萝卜、苹果、梨和橙子均购于本地综合超市。将水果和蔬菜样品粉碎后密封放置于-20 ℃冰箱中保存。
1.3 溶液的配制
分别准确称取10.00 mg(精确至0.01 mg)8种化合物标准品,分别用乙腈溶解并定容至10.0 mL,配制成质量浓度为l.0 g/L的单标准储备液。再将8种单标准储备液分别稀释,配制成质量浓度均为10.0 mg/L的混合标准工作液,保存于-20 ℃冰箱中。
1.4 样品前处理方法
1.4.1 样品提取
准确称取25.0 g样品于250 mL聚乙烯离心管中,加入25.0 mL乙腈,置于高速匀浆机中,在10 000 r/min的速度下匀浆2.0 min后,依次加入10.0 g MgSO4和1.0 g NaCl,再在5 000 r/min的速度下匀浆1.0 min,以3 800 r/min的转速离心3.0 min,取上层乙腈相。
1.4.2 样品净化
取上述5.0 mL上层乙腈相于15 mL离心管中,加入1.2 g MgSO4、50.0 mg PSA和100.0 mg C18,于涡旋混合器上振荡1.0 min,混匀,待充分富集净化后再以3 800 r/min的转速离心3.0 min,取1.0 mL上清液过0.22 μm有机滤膜,滤液供HPLC-MS/MS检测。
1.5 色谱条件
色谱柱:Poroshell 120 EC-C18柱(150 mm×2.1 mm×2.7 μm);柱温:30.0 ℃;进样量:2.0 μL;流动相由0.1%(体积分数)甲酸水溶液(A相)和乙腈(B相)组成;流速:200 μL/min。梯度洗脱程序:0~15.0 min, 50.0%B~100.0%B; 15.0~18.0 min, 100.0%B; 18.0~18.1 min, 100.0%B~50.0%B; 18.1~22.0 min, 50.0%B。
1.6 质谱条件
ESI(electrospray ionization)源正/负双离子模式电离;离子源温度:350.0 ℃;检测方式:多反应监测(MRM);喷雾电压:3 000 V(ESI+), 2 200 V(ESI-);鞘气(N2)流速:15.0 L/min;鞘气压力:243.3 kPa;辅助气(N2)压力:45.0 kPa;毛细管温度:380.0 ℃。其他质谱参数见表1。
2 结果与讨论
2.1 质谱条件的优化
为获得最佳的灵敏度和分离效果,对质量浓度为1.0 mg/L的8种化合物单标准溶液依次采用蠕动泵注射的方式在电喷雾正离子模式下进行一级质谱扫描,试验结果显示啶酰菌胺、吡噻菌胺等7种化合物均可形成稳定的[M+H]+峰。而吡唑萘菌胺在正离子扫描模式下灵敏度低,在负离子扫描模式下可以形成响应值较高的[M-H]-峰。同时,通过对喷雾电压、碰撞电压、鞘气压力等质谱参数进行优化后,对各化合物进行子离子扫描,可得到响应值高、稳定性好的子离子。结合标准溶液和基质标准溶液的子离子扫描图,确定8种目标化合物的质谱参数和相应的定性定量离子信息。优化后的质谱参数见表1。
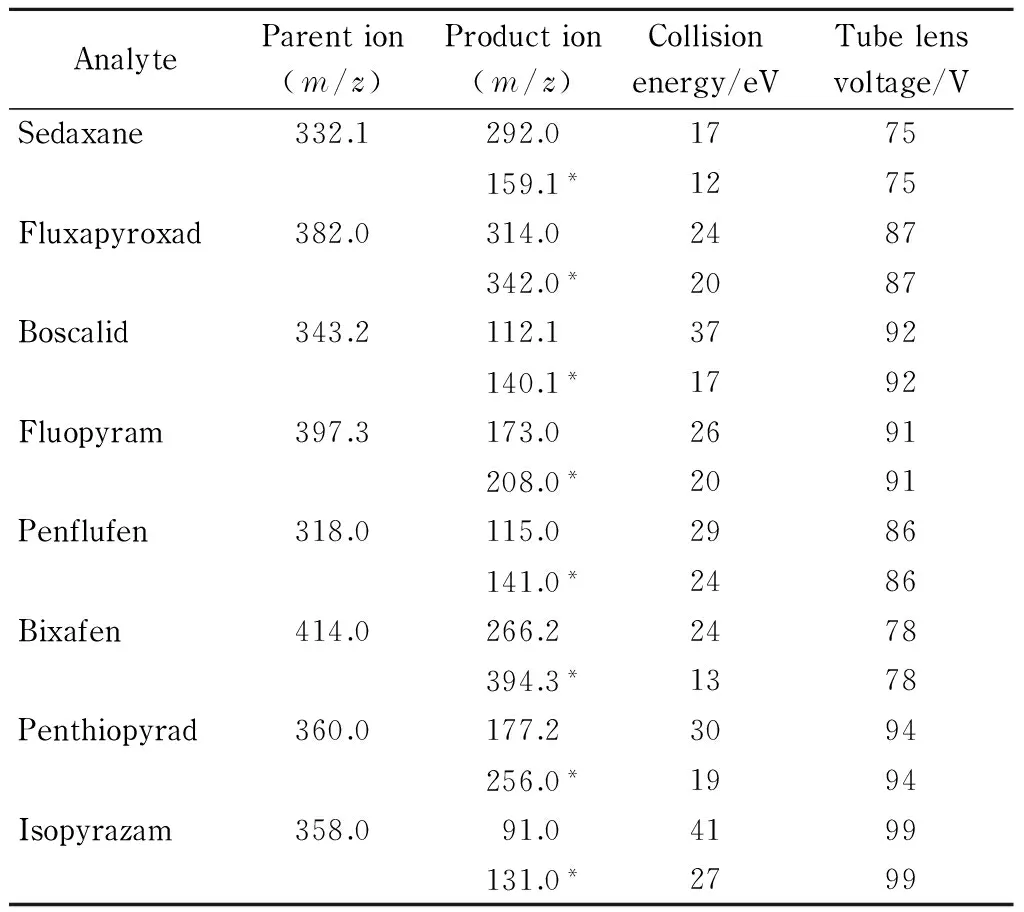
表 1 分析物的质谱采集离子信息
* Quantitative ion.
2.2 吸附剂作用的比较
分散固相萃取法是一种迅速发展的样品前处理净化方法,具有操作简单、快速、回收率高等特点[20,21]。但分散固相萃取剂在提高净化效果的同时也可能影响方法的回收率。如过量使用PSA和C18会对多杀霉素等农药和酸性化合物产生吸附作用,使回收率降低,影响测定结果的准确性[22,23]。 本试验考察了PSA及C18的不同添加量对8种杀菌剂的吸附作用。以25 g水为空白基质,8种杀菌剂添加水平均为50.0 μg/kg,按照1.4.1节方法处理后,分别加入不同量的PSA(0、50.0、100.0、150.0和200.0 mg)、C18(0、50.0、100.0、150.0和200.0 mg)与无水MgSO4组合净化,并测定8种目标化合物的回收率,试验结果见图1。PSA的添加量为0~200.0 mg时,8种目标化合物的回收率为90.8%~101.0%,基本不吸附目标化合物。C18的添加量为0~100.0 mg时,8种目标化合物的回收率为95.4%~102.0%,无明显吸附作用;随着C18加入量不断增加,对氟唑环菌胺、联苯吡菌胺等化合物产生较强吸附作用,C18对吡噻菌胺的吸附率达到27.0%,使回收率明显降低。因此,为满足回收率要求,应使C18的添加量控制在0~100.0 mg范围内。

图 1 (a) PSA和(b) C18添加量对8种新型SDHI 类杀菌剂回收率的影响Fig. 1 Influence of the additive amounts of (a) PSA and (b) C18 on the recoveries of the eight novelsuccinate dehydrogenase inhibitor (SDHI) fungicides

图 2 吸附剂质量比(PSA∶C18/(mg/mg))对花菜和橙子 中8种新型SDHI类杀菌剂基质效应的影响Fig. 2 Effects of the sorbent mass ratios (m(PSA)∶ m(C18)/(mg/mg)) on the matrix effects of the eight novel SDHI fungicides in the cauliflowers and oranges
2.3 净化效率的优化
选取基质效应较强的花菜和橙子样品为实验对象,各称取样品25 g,参照1.4.1节的前处理方法进行提取,加入不同质量比(0∶0、50∶50、50∶100、100∶50、100∶100,mg∶mg)的PSA和C18吸附剂与1.2 g MgSO4净化,制备空白基质溶液。分别用乙腈和空白基质溶液配制相同质量浓度(50.0 μg/L)的标准溶液,在相同的色谱条件下测定。按照ME(matrix effect)=B/A×100%计算样品基质溶液的基质效应[24],其中B为目标化合物在空白基质溶液中的响应值,A为目标化合物在乙腈中的响应值。通过基质效应强弱来评价方法的净化效果。
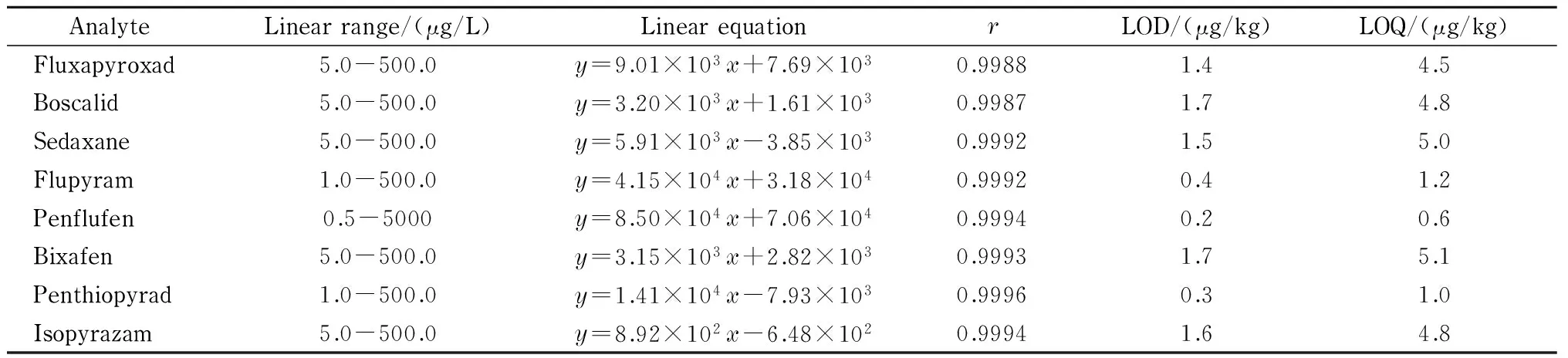
表 2 8种新型SDHI类杀菌剂的线性范围、线性方程、相关系数、检出限与定量限
y: peak area;x: mass concentration, μg/L.
结果(见图2)表明,当向提取液中加入无水硫酸镁时,只能有效去除其中的水分,与赵肖华等[25]报道的结果相同。氟唑菌酰胺和啶酰菌胺在花菜和橙子中均表现出较强的基质效应。随着PSA和C18的加入,各基质中8种新型SDHI类杀菌剂的基质效应明显减小,ME均在85.0%~115.0%。主要原因是PSA和C18能有效去除基质中大部分的极性(糖类、脂肪酸)和非极性(脂肪、脂溶性色素和甾醇类)杂质[26]。为使前处理方法的最佳净化效率和回收率保持平衡,减少试剂用量,降低成本,确定当样品称取量为25 g时,加入50.0 mg PSA、100.0 mg C18与1.2 g MgSO4。
2.4 线性范围与检出限
如表2所示,利用外标法对8种新型SDHI类杀菌剂定量,将8种目标化合物用乙腈配制成系列质量浓度混合标准溶液,在优化的色谱和质谱条件下进行测定,以目标化合物质量浓度为横坐标(x, μg/L)、定量离子对的峰面积为纵坐标(y)绘制标准曲线,得到线性方程和相关系数。结果表明,目标化合物在0.5~500.0 μg/L范围内具有良好的线性关系,相关系数均大于0.998。在空白样品中添加8种新型SDHI类杀菌剂标准溶液,以S/N=3确定方法的检出限(LOD),以S/N=10确定方法的定量限(LOQ),结果如表2所示,样品中8种目标化合物的LOD为0.2~1.7 μg/kg, LOQ为0.5~5.0 μg/kg。8种目标化合物在橙子样品中添加水平为5 μg/kg时的定量离子色谱图见图3。

图 3 橙子中8种目标化合物在添加水平为5 μg/kg 时的定量离子色谱图Fig. 3 Quantitative ion chromatograms of the eight compounds spiked at 5 μg/kg in the oranges
2.5 方法的回收率和精密度
参考各杀菌剂的MRL(maximum residue limit)值,对菠菜、黄瓜、花菜、西红柿、白萝卜、苹果、梨和橙子8种不同基质样品进行回收率试验,对方法的回收率及精密度进行考察。在空白基质中添加5.0、25.0和125.0 μg/kg 3个水平的混合标准溶液,每个水平进行6次平行试验,得到的平均回收率和精密度(n=6)见表3。结果表明8种目标化合物的平均回收率为71.4%~121.3%,相对标准偏差(RSD)为0.8%~17.2%,可以满足农药残留分析的要求。
2.6 实际样品测定
利用本方法对从超市和农贸市场随机购买的20份蔬菜和20份水果样品进行测定,检测结果显示,在西红柿和苹果样品中均检出氟吡菌酰胺和啶酰菌胺,检出量分别为4.6~25.5 μg/kg和9.4~238.9 μg/kg,部分样品检测结果见图4。两种杀菌剂均未超过国家规定限量[5]。其余样品中均未检出目标化合物。

图 4 氟吡菌酰胺和啶酰菌胺在西红柿和苹果样品中的提取离子色谱图Fig. 4 Selected ion chromatograms of fluopyram and boscalid in tomato and apple samples

SampleSpiked/(μg/kg)FluxapyroxadR/%RSD/%BoscalidR/%RSD/%SedaxaneR/%RSD/%FluopyramR/%RSD/%PenflufenR/%RSD/%BixafenR/%RSD/%PenthiopyradR/%RSD/%IsopyrazamR/%RSD/%Spinage 5.081.84.796.26.993.91.678.16.494.03.787.111.081.56.8119.311.625.082.14.693.58.490.94.893.54.191.42.186.87.887.13.873.27.3125.093.73.594.02.984.73.486.13.383.94.991.25.487.74.696.45.3Tomatos5.088.210.780.45.487.46.287.27.382.67.889.26.576.413.2102.511.925.082.32.492.45.491.15.099.36.190.00.882.94.180.17.788.13.9125.083.34.785.23.384.31.4107.95.180.82.392.83.987.35.791.89.2Cauliflowers5.073.53.696.58.090.63.274.12.982.93.973.813.471.47.3121.39.125.078.24.382.16.787.24.693.63.483.12.078.84.781.04.179.77.7125.086.63.485.53.993.44.281.24.483.02.183.65.486.36.495.94.2Cucumbers5.088.27.497.48.598.61.498.22.190.21.580.411.381.82.999.48.825.084.88.285.611.091.13.285.43.291.34.482.86.380.74.589.49.4125.083.23.4107.75.489.61.392.22.683.63.381.23.782.53.686.55.1Radishes5.085.75.483.47.692.52.675.35.489.16.485.86.580.76.289.14.525.084.77.491.66.591.54.490.52.695.21.681.97.886.98.775.77.2125.082.33.883.32.379.81.384.12.581.11.284.83.686.34.389.85.8Pears5.087.58.489.44.495.67.092.05.999.05.584.912.593.06.296.712.225.086.38.792.56.090.73.194.24.896.31.684.17.384.58.594.612.5125.084.84.683.42.282.92.086.13.485.63.085.97.085.13.186.84.1Apples5.083.15.983.08.097.13.984.44.493.93.184.216.485.44.591.49.325.085.55.591.67.295.33.799.84.794.82.886.64.583.32.574.95.8125.084.11.981.82.184.03.482.71.882.33.385.74.883.72.781.85.2Oranges5.079.011.089.96.086.02.080.94.585.73.187.78.678.32.994.817.225.082.78.488.86.885.94.177.43.586.22.997.63.578.53.9102.78.8125.083.24.588.84.690.52.387.83.384.33.381.83.687.13.086.92.6
3 结论
本文建立了液相色谱-串联质谱同时分析果蔬中8种新型SDHI类杀菌剂残留的方法。该方法灵敏度高、重现性好,可进行准确的定性定量分析。通过优化QuEChERS方法中的分散固相萃取剂(PSA和C18)的添加剂量,实现了果蔬中8种新型杀菌剂的有效提取和净化,同时减小了基质效应。结果表明,该方法不仅可以满足当前国际上对果蔬中这8种新型SDHI类杀菌剂最大残留限量的要求,也可为农产品领域的农药残留检测提供技术依据。
[1] Li L K, Yuan S K, Pan H Y, et al. Pesticides, 2011, 50(3): 165
李良孔, 袁善奎, 潘洪玉, 等. 农药, 2011, 50(3): 165
[2] Wang Y F, Wang W, Qin H J, et al. Food Research and Development, 2010, 31(1): 113
王云凤, 王伟, 秦洪健, 等. 食品研究与开发, 2010, 31(1): 113
[3] Qiu S S, Bo Y L. Modern Agrochemicals, 2014, 13(6): 1
仇是胜, 柏亚罗. 现代农药, 2014, 13(6): 1
[4] European Commission. EU-Pesticides database. (2005-02-23) [2016-04-30]. http://ec.europa.eu/sanco_pesticides/
[5] GB 2763-2012
[6] Abad-Fuentes A, Esteve-Turrillas F A, Agulló C, et al. Food Chem, 2012, 135: 276
[7] Esteve-Turrillas F A, Agulló C, Abad-Somovilla A, et al. Food Chem, 2016, 196: 1279
[8] Zhang W, Li E H, Zhang G, et al. Pesticide Science and Administration, 2015, 36(4): 36
张武, 李二虎, 张耕, 等. 农药科学与管理, 2015, 36(4): 36
[9] Dong F S, Xiu C, Liu X G, et al. Chirality, 2013, 25: 904
[10] Lagunas-Allué L, Sanz-Asensio J, Martinez-Soria M T. J Chromatogr A, 2012, 1270: 62
[11] Lagunas-Allué L, Sanz-Asensio J, Martinez-Soria M T. Anal Bioanal Chem, 2010, 398: 1509
[12] Chen X L, Li Z X, Cao Z Y, et al. Chinese Journal of Chromatography, 2013, 31(10): 954
陈小龙, 李正翔, 曹赵云, 等. 色谱, 2013, 31(10): 954
[13] Xie W, Yu Z R, Huang C Q, et al. Journal of Food Safety & Quality, 2015, 6(3): 886
谢文, 于卓然, 黄超群, 等. 食品质量检测学报, 2015, 6(3): 886
[14] Sun Y M, Lü Y, Wu Y L, et al. Food Science, 2015, 36(12): 230
孙亚米, 吕燕, 吴银良, 等. 食品科学, 2015, 36(12): 230
[15] Dong F S, Chen X, Liu X G. J Chromatogr A, 2012, 1262: 98
[16] Gulkowska A, Buerge I J, Poiger T. Anal Bioanal Chem, 2014, 406: 6419
[17] Ma L, Chen J B, Zhao L, et al. Chinese Journal of Chromatography, 2015, 33(10): 1019
马琳, 陈建波, 赵莉, 等. 色谱, 2015, 33(10): 1019
[18] Abad-Fuentes A, Ceballos-Alcantarilla E, Josep V, et al. Anal Bioanal Chem, 2015, 407: 4207
[19] Wu Y L, Chen R X, Zhu Y, et al. J Chromatogr B, 2015, 989: 11
[20] Panla P, Anastassiades M, Mack D, et al. Anal Bioanal Chem, 2007, 389(6): 1697
[21] Lehotay S J, Mastovska K, Lightfield A R. J AOAC Int, 2005, 88(3): 615
[22] Cao Z Y, Mou R X, Ying X H, et al. Journal of Instrumental Analysis, 2010, 29(10): 1030
曹赵云, 牟仁祥, 应兴华, 等. 分析测试学报, 2010, 29(10): 1030
[23] Zhu P P, Yue Z F, Zheng Z K, et al. Chinese Journal of Chromatography, 2015, 33(5): 494
朱萍萍, 岳振峰, 郑宗坤, 等. 色谱, 2015, 33(5): 494
[24] Trufelli H, Palma P, Famiglini G, et a1. Mass Spectrom Rev, 2011, 30(3): 491
[25] Zhao X H, Cao Z Y, Mou R X, et al. Journal of Instrumental Analysis, 2012, 31(10): 1266
赵肖华, 曹赵云, 牟仁祥, 等. 分析测试学报, 2012, 31(10): 1266
[26] Dong J, Pan Y X, Zhu L P, et al. Journal of Instrumental Analysis, 2008, 27(1): 66
董静, 潘玉香, 朱莉萍, 等. 分析测试学报, 2008, 27(1): 66
National Agricultural Product Quality Safety Risk Assessment Project (No. GJFP2016001001); Central Public Welfare Scientific Research Basic Business Expenses Special Funds for Scientific Research Projects (No. 2014RG006).
Determination of eight novel succinate dehydrogenase inhibitor fungicides in vegetables and fruits by modified QuEChERS
YANG Huan, SUN Weihua, CAO Zhaoyun, MA Youning, CHAI Shuangshuang, QIN Meiling, CHEN Mingxue*
(Rice Product Quality Inspection and Supervision Center, Ministry of Agriculture, Laboratory of Quality and Safety Risk Assessment for Rice, Ministry of Agriculture, China National Rice Research Institute, Hangzhou 310006, China)
A method was developed for the simultaneous determination of eight novel succinate dehydrogenase inhibitor fungicides (boscalid, penflufen, bixafen, sedaxane, fluopyram, penthiopyrad, isopyrazam, fluxapyroxad) residues in vegetables and fruits by liquid chromatography-tandem mass spectrometry (LC-MS/MS) coupled with modified QuEChERS. The amount of the two solid phase extraction agents (octadecyl bonded silica (C18) and primary secondary amine (PSA)) in QuEChERS method was optimized according to their adsorption and purification capacities. The eight compounds were extracted from samples by acetonitrile and purified by solid phase extraction agents. The eight compounds were separated on a Poroshell 120 EC-C18column by the gradient elution using acetonitrile-0.1% (v/v) formic acid aqueous solution as mobile phases, detected by MS/MS with positive/negative electrospray ionization (ESI+/ESI-) in multiple reaction monitoring (MRM) mode, and finally quantified by external standard method. The correlation coeffcients (r) of the eight compounds were all above 0.998 in the mass concentration ranging from 0.5 to 500.0 μg/L. The limits of detection and the limits of quantification of the method were 0.2-1.7 μg/kg and 0.5-5.0 μg/kg, respectively. The recoveries of the eight analytes spiked at three levels (5.0, 25.0 and 125.0 μg/kg) in eight matrices ranged from 71.4% to 121.3% with the relative standard deviations (RSDs,n=6) from 0.8% to 17.2%. The method is easy to operate and with good purification effect. It can be applied to the rapid determination of the novel succinate dehydrogenase inhibitor fungicides in vegetables and fruits.
liquid chromatography-tandem mass spectrometry (LC-MS/MS); QuEChERS; novel succinate dehydrogenase inhibitor (SDHI) fungicides; vegetables; fruits
10.3724/SP.J.1123.2016.07005
2016-07-04
国家农产品质量安全风险评估项目(GJFP2016001001);中央级公益性科研院所基本科研业务费专项资金项目(2014RG006).
O658
A
1000-8713(2016)11-1070-07
* 通讯联系人.Tel:(0571)63370275,E-mail:cmingxue@163.com.

