梯度淋洗-电导抑制离子色谱法同时测定果汁中26种有机酸和阴离子
宋卫得, 袁晓鹰, 吕 宁, 陈太法, 惠希东,苏 征, 金 伟, 刘 冰
(1. 日照出入境检验检疫局, 山东 日照 276826; 2. 山东出入境检验检疫局, 山东 青岛 266002)
研究论文
梯度淋洗-电导抑制离子色谱法同时测定果汁中26种有机酸和阴离子
宋卫得1*, 袁晓鹰1, 吕 宁2, 陈太法1, 惠希东1,苏 征1, 金 伟1, 刘 冰1
(1. 日照出入境检验检疫局, 山东 日照 276826; 2. 山东出入境检验检疫局, 山东 青岛 266002)
通过对色谱柱类型、流速、柱温、pH值、淋洗液浓度等影响因素的研究,建立了多级梯度淋洗-电导抑制离子色谱同时测定果汁中26种有机酸和阴离子的分析方法。结果表明,当流速为1.00 mL/min、柱温为30 ℃、pH值为5.5~6.8时,26种组分的测定结果更准确。26种组分在0.02~10.0 mg/L范围内具有良好的线性关系(r均大于0.995),检出限(S/N=3)为0.17~52.0 μg/L;在0.20~2.00 mg/L添加水平下的回收率为85.58%~108.86%,相对标准偏差为0.15%~7.65%(n=6)。该方法简便快速、灵敏度好、准确度高,适于果汁中26种组分的痕量分析。
离子色谱;抑制电导检测;梯度淋洗;有机酸;阴离子;果汁

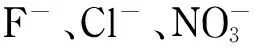
目前有机酸的检测方法主要有气相色谱法[7]、液相色谱法[8,9]、离子色谱法[10,11]等分析方法。气相色谱法需要衍生等前处理步骤,操作繁琐;液相色谱法测定有机酸的研究较多,具有快速、准确、选择性好等特点,但不能同时检测有机酸和阴离子。离子色谱法具有简便、快速、灵敏、准确等优点[12-15],是多种有机酸和阴离子同时测定的理想方法。目前离子色谱法同时测定果汁中有机酸和阴离子的研究较少,且同时测定的组分数量不足10种[16],说明离子色谱法在果汁中多组分的检测技术还有很大的发展空间。

1 实验部分
1.1 仪器和试剂
Dionex ICS2100离子色谱仪(美国ThermoFisher公司),配备电导检测器和自动进样器(AS-DV)、ASRS 300电化学自动再生抑制器;Rotina 380R高速离心机(德国Hettich公司); ML802/02电子天平(瑞士梅特勒公司); Milli-Q超纯水仪(美国Millipore公司)。
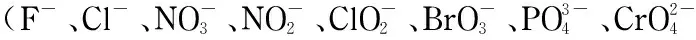
1.2 色谱条件
阴离子分离柱:Dionex IonPacTMAS11-HC(250 mm×4 mm),保护柱:Dionex IonPacTMAG11-HC(50 mm×4 mm);抑制器再生模式:外加水电导抑制检测器检测;流动相:KOH梯度淋洗液;流速:1.00 mL/min;柱温:30 ℃;进样量:50 μL;初始淋洗浓度:1.25 mmol/L;抑制器电流:174 mA。多级梯度淋洗条件见表1。
表 1 离子色谱多级梯度淋洗条件
Table 1 Gradient elution conditions of ion chromatography

No.Time/minEluentconcentration/(mmol/L)Slopeofconcentrationgradient/(mmol/min)10-8.01.250 28.0-18.01.25-15.01.375318.0-29.015.0-28.01.182429.0-40.028.0-70.03.818540.0-41.070.0-1.25-68.75641.0-48.01.250
1.3 样品前处理
采用浓度为4.0 mol/L的KOH溶液调节果汁样品的pH值至5.5~6.8,取调节过pH值的果汁样品(10 mL)于50 mL离心管中,以10 000 r/min离心15 min,取上清液1.0 mL至100 mL容量瓶中,用超纯水定容至刻度,摇匀、静置10 min,取10.0 mL溶液,过0.22 μm水相滤膜,弃去前3 mL,收集后面的清液,待上机检测。
1.4 标准溶液配制
称取适量标准物质用超纯水配制质量浓度为1 000 mg/L的标准混合储备液;采用超纯水将标准混合储备液稀释成一定质量浓度的标准混合工作液,于4 ℃避光冷藏保存,现配现用。
2 结果与讨论
2.1 色谱条件的选择
2.1.1 色谱柱的选择
本实验分别考察了AS11、AS11-HC、AS19色谱柱(250 mm×4 mm)对分离效果的影响。采用AS11-HC色谱柱时,多数组分的色谱峰峰形尖锐、灵敏度高,综合分离效果最好。因为AS11-HC是强亲水性、高柱容量色谱柱,对复杂基质中有机酸和阴离子具有较好的保留作用,尤其适合多种有机酸和阴离子的同时分析。因此本实验最终选择AS11-HC色谱柱。
2.1.2 流速的选择
本实验考察了不同流速(0.50、0.75、1.00、1.25 mL/min)对目标物组分分离效果的影响。当流速为0.50 mL/min和0.75 mL/min时,26种目标物的整体分离度较流速为1.00 mL/min时有所增大,但总出峰时间由39 min增至50 min,且随流速降低,色谱峰峰宽增大,灵敏度下降;当流速为1.25 mL/min时,色谱峰的出峰时间减少,但色谱系统压力达到了17.86 MPa,已接近色谱系统的压力上限(20.68 MPa),且较流速为1.00 mL/min时的压力(13.51 MPa)大幅升高,系统压力过大易造成色谱柱塌陷,进而影响色谱柱的使用寿命,也易造成色谱系统漏液,不利于整个色谱系统运行的稳定性。综合考虑分离效果、检测时间、色谱系统稳定性等因素,最终将流速设为1.00 mL/min。

图 1 混合标准溶液(0.50 mg/L)的色谱图Fig. 1 Chromatogram of mixed standard solution (0.50 mg/L) 1. D-quinic acid; 2. fluorin ion (F-); 3. lactic acid; 4. acetic acid; 5. propionic acid; 6. formic acid; 7. butyric acid; 8. pyruvic acid; 9.d.
2.1.3 梯度淋洗条件的选择

2.1.4 柱温的选择
柱温能够影响色谱柱的柱效、选择性、灵敏度和稳定性,柱温的改变直接影响分离效果和分析速率。升高柱温,色谱柱内离子交换速率随之提高,有利于提高柱效、缩短分析时间,但降低了分离选择性,不利于组分间的分离。本文分别考察了在20、25、30、35 ℃柱温条件下26种组分的分离效果。结果表明,当柱温为20 ℃和25 ℃时,前7种组分无法有效分离,总分析时间较长;当柱温为35 ℃时,离子交换速率提高,柱效提高,分析时间缩短,但分离选择性降低,特别是组分14~21的分离度明显减小,无法确保定量的准确性。当柱温为30 ℃时,分析速率适宜,26种组分的总体分离效果最好。因此本实验将柱温设为30 ℃。
2.1.5 pH值对检测的影响



图 2 溶液pH值对6种组分测定的影响Fig. 2 Effect of pH value of the solution on the determination of the six components
2.2 方法学考察
2.2.1 线性范围与检出限
配制系列质量浓度的混合标准工作溶液,以待测组分的峰面积(Y)为纵坐标,质量浓度(X, mg/L)为横坐标,绘制校准曲线;通过色谱峰信噪比计算待测组分的检出限(S/N=3)。结果表明,26种组分在0.02~10.0 mg/L范围内线性关系良好,相关系数均大于0.995(见表2)。25种组分的检出限为0.17~14.4 μg/L,苯甲酸的检出限为52.0 μg/L,远低于液相色谱法[17]中苯甲酸的LOD(1 800 μg/kg)。
2.2.2 回收率与精密度
分别选取苹果汁、葡萄汁、橙汁各5个样品,依次添加质量浓度为0.10、0.20、0.50、1.00、2.00 mg/L的混合标准溶液,每个浓度水平进行6次平行试验,计算检测不同果汁基质时方法的回收率和精密度(见表3)。
在0.10 mg/L添加水平下,24种组分的回收率为85.17%~109.30%,苯甲酸和顺乌头酸的回收率分别为62.23%和64.27%,但仍满足食品理化检验技术要求[18](测定含量小于0.10 mg/L,回收率应为60%~120%),说明在低于0.10 mg/L添加水平时,苯甲酸和顺乌头酸不够稳定、易受基质干扰,检测时应通过改变稀释倍数等方法在高于0.20 mg/L水平下进行分析。在质量浓度为0.20~2.0 mg/L水平下,26种组分的回收率为85.58%~108.86%, RSD为0.15%~7.65%,说明该检测方法准确性高、精密度好。
2.2.3 准确度
向苹果汁中添加质量浓度为0.20 mg/L的标准溶液,分3天进样,每天进行3次平行样品测定,计算回收率,进而计算测定值和真值的相对偏差。结果表明,26种组分的9次平行结果与理论真值的相对偏差在-13.82%~9.57%范围内,符合食品理化检测规范中的准确度要求[18],说明该方法稳定性好、准确度高。

表 2 26种组分的线性范围、线性方程、相关系数(r)及检出限
Y: peak area;X: mass concentration, mg/L.
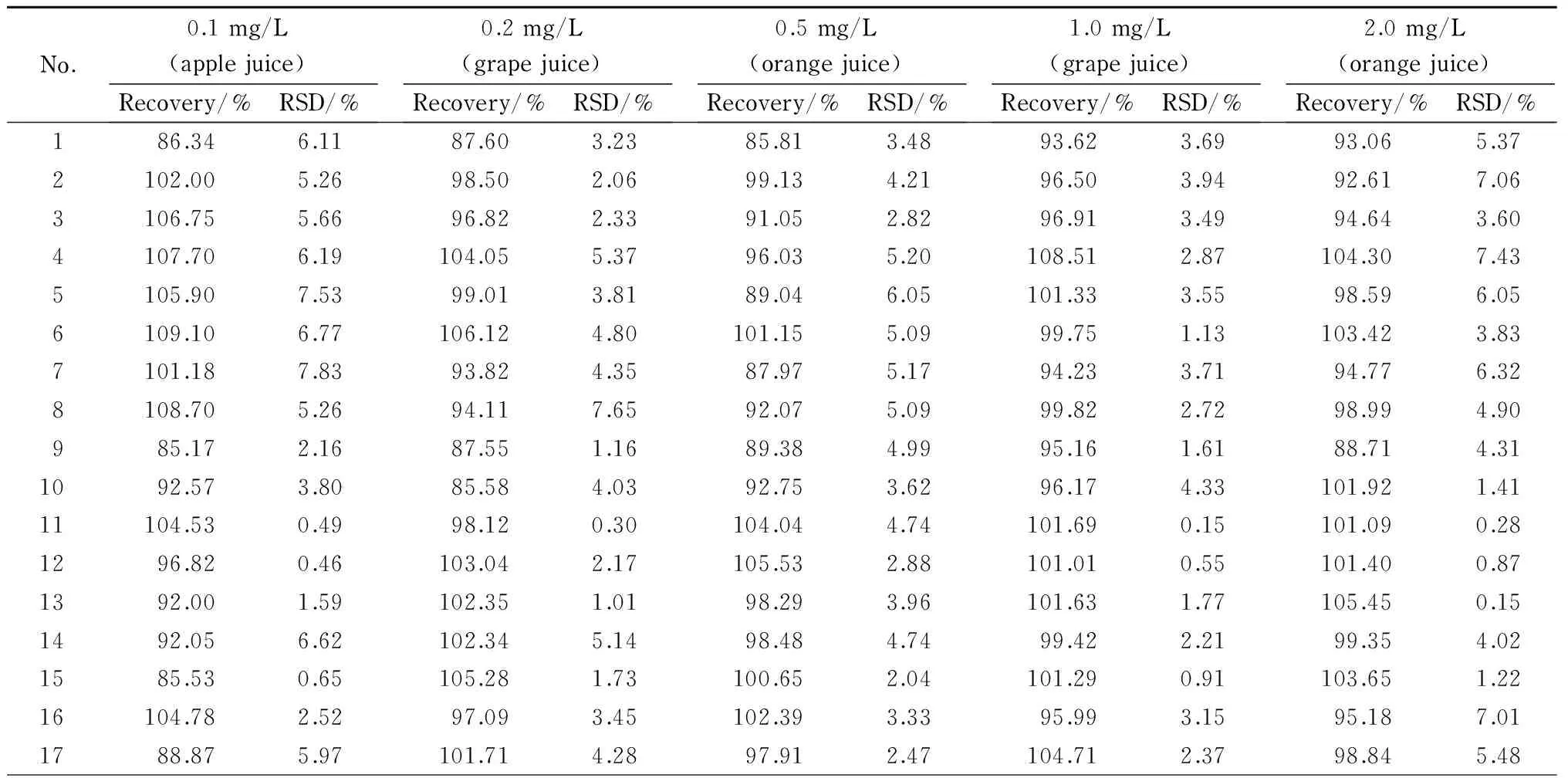
表 3 26组分在不同添加水平下的回收率及精密度(n=6)

表 3 (续)
Nos. 1-26 are the same as in Table 2.
2.3 实际样品测定
对6种果汁样品中的有机酸和阴离子进行含量测定(见表4)。3种代表性果汁的色谱图见图3。

表 4 6种果汁样品中有机酸和阴离子的含量
-: not detected.
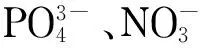

图 3 3种果汁样品的色谱图Fig. 3 Chromatograms of the three fruit juice samples Nos. 1-24 are the same as in Table 2.
3 结论
本文通过对流速、柱温、溶液pH值、淋洗浓度等多种实验影响因素的分析讨论,建立了梯度淋洗-电导抑制离子色谱同时测定果汁中26种有机酸和阴离子的分析方法。在优化选择的条件下,26种组分的分离测定结果令人满意,完全适于果汁中26种有机酸和阴离子的痕量分析。作为一种绿色联合检测技术,梯度淋洗-电导抑制离子色谱法实现了有机酸、防腐剂、阴离子、添加剂等多类组分共同检测的目标。但是在多种实验因素和多种基质的交互影响
下,如何进一步提高多组分同时检测时的分离度、准确度以及方法适用性必将成为该项色谱技术研究和发展的重要方向之一。
[1] Gheibi S, Karimi M H, Khalilzadeh M A, et al. J Food Sci Tech, 2015, 52(1): 276
[2] Sdiri S, Bermejo A, Aleza P, et al. Food Res Inter, 2012, 49(1): 462
[3] Han H F, Wang Q, Liu X, et al. Chinese Journal of Chromatography, 2012, 30(5): 538
韩海峰, 王庆, 刘霞, 等. 色谱, 2012, 30(5): 538
[4] Aydogan C, Karakoc V, Denizli A. Food Chem, 2015, 187(11): 130
[5] Qi Z W, You Q, Chen Y. Analy Chim Acta, 2016, 902: 168
[6] Qiu M Q, Xiong S Y. Advan J Food Sci Tech, 2015, 7(7): 548
[7] Zhong Y, Yu C L, Peng P A. Chinese Journal of Chromatography, 2010, 28(10): 923
钟颖, 于赤灵, 彭平安. 色谱, 2010, 28(10): 923
[8] Kola O, Simsek M, Duran H, et al. Chem Natur Comp, 2015, 51(1): 132
[9] Turker G, Kizilkaya B, Arifoglu N. Asian J Chem, 2014, 26(8): 2443
[10] Chen A L, Ding H, Fang L M, et al. Chinese Journal of Chromatography, 2015, 33(12): 1333
陈爱连, 丁卉, 方琳美, 等. 色谱, 2015, 33(12): 1333
[11] Zhu B H, Zhang P M, Guo W Q, et al. Chinese Journal of Chromatography, 2016, 34(5): 498
朱彬和, 张培敏, 郭伟强, 等. 色谱, 2016, 34(5): 498
[12] Teh H B, Li S F Y. J Chromatogr A, 2015, 1383: 112
[13] Liu Y Q, Yu H. Journal of Instrumental Analysis, 2015, 34(6): 734
刘永强, 于泓. 分析测试学报, 2015, 34(6): 734
[14] Dolgonosov A M, Kolotilina N K. J Analy Chem, 2015, 70(11): 1322
[15] Daraei H, Maleki A, Mahvi A H, et al. J Water Chem Tech, 2015, 37(5): 253
[16] Lou B, Li Y, Lü J F, et al. Food Research and Development, 2012, 33(1): 115
娄斌, 李阳, 吕金凤, 等. 食品研究与开发, 2012, 33(1): 115
[17] GB/T 23495-2009
[18] GB/T 27404-2008
Research Project of Shandong Entry-Exit Inspection & Quarantine Bureau (No. SK201619).
Simultaneous determination of 26 organic acids and anions in fruit juice by ion chromatography with suppressed conductivity detection using gradient elution
SONG Weide1*, YUAN Xiaoying1, LÜ Ning2, CHEN Taifa1, HUI Xidong1, SU Zheng1, JIN Wei1, LIU Bing1
(1. Rizhao Entry-Exit Inspection & Quarantine Bureau, Rizhao 276826, China; 2. Shandong Entry-Exit Inspection & Quarantine Bureau, Qingdao 266002, China)
A method for simultaneous determination of 26 organic acids and anions in fruit juice by ion chromatography (IC) with suppressed conductivity detection using gradient elution was established. The effects of selection of columns, flow rates, column temperatures, pH values of solution, and eluent concentrations were studied, and then the suitable gradient elution conditions were found for the determination. The testing results of the 26 components in fruit juice were accurate under the conditions that the flow rate was 1.00 mL/min, column temperature was 30 ℃ and pH values of the solution were in the range of 5.5-6.8. As a result, the linear relationships of the 26 components were good in the range of 0.02-10.0 mg/L and the correlation coefficients (r) were greater than 0.995, the limits of detection (S/N=3) of the 26 components were in the range of 0.17-52.0 μg/L. In the added levels of 0.20-2.00 mg/L, the recoveries of the 26 components in fruit juice ranged from 85.58% to 108.86%, and the relative standard deviations (RSDs) were in the range of 0.15%-7.65% (n=6). The method is simple, quick, sensitive and accurate, and it is absolutely suitable for the trace analysis and determination of the 26 organic acids and anions in fruit juice.
ion chromatography (IC); suppressed conductivity detection; gradient elution; organic acids; anions; fruit juice
10.3724/SP.J.1123.2016.06057
2016-06-30
山东出入境检验检疫局科研项目(SK201619).
O658
A
1000-8713(2016)11-1084-07
* 通讯联系人.E-mail:woxinyh2006@163.com.

