减量训练通过不同亚型的PI3K对心肌的影响机制
张 军
减量训练通过不同亚型的PI3K对心肌的影响机制
张 军
目的:探讨在减量训练过程中,不同亚型的PI3K影响心肌的机制。方法:72只雄性SD大鼠随机分为:3周安静对照组(C3)和3周大运动量训练组(E3);3天对照组(C4)和3天减量训练组(E4);6天对照组(C5)和6天减量训练组(E5);2周对照组(C6)和2周减量训练组(E6)。3周大运动量训练和2周的减量训练后取左心室肌组织,测定PI3K p85、PI3K p110α和PI3K p110γ蛋白采用Western blotting方法。心肌组织形态学采用HE染色在光镜下观察。结果:3周大运动量训练和2周减量训练后,心肌组织形态没有显著变化,未发现心肌组织损伤。6天减量训练后,心肌PI3K p110α蛋白表达显著增加(P<0.05)。2周减量训练后,心肌PI3K p110α/PI3K p85显著增加(P<0.05)。3周大运动量训练和减量训练后,心肌PI3K p110γ蛋白表达没有显著变化(P>0.05)。结论:本研究制定的运动训练和减量训练方案未造成心肌损伤。减量训练通过不同亚型的PI3K影响心肌。
减量训练;心肌;PI3K p85;PI3K p110α;PI3K p110γ
在临床医学和基础医学领域,研究发现在病理性心肌肥大、心肌病和心衰时,心肌损伤和保护过程中伴随着一些分子信号的改变。在运动训练期间,不同病理条件下的心肌PI3K p110α活性对保护心脏起重要作用。竞技体育经常采用大运动量训练,而长期大运动量训练怎样影响心肌?减量训练怎样影响心肌?磷脂酰肌醇-3激酶等分子信号蛋白在运动训练和减量训练过程中是否有显著改变?不同亚型的PI3K在心肌中有哪些作用?这一系列问题亟需运动人体科学和运动医学领域的研究来回答,本研究深入探讨这些问题。
1 研究对象与方法
1.1 研究对象
72只7周龄雄性SD大鼠,体重(260±20)g,从维通利华实验动物中心购买,许可证号:SCXK(京)2012,每笼6只,自由饮食、饮水,光照12h/d,室温(24±1)℃,相对湿度50%±10%。
1.2 研究方法
1.2.1 实验分组
72只雄性SD大鼠随机分为:3周安静对照组(C3)和3周大运动量训练组(E3);3天对照组(C4)和3天减量训练组(E4);6天对照组(C5)和6天减量训练组(E5);2周对照组(C6)和2周减量训练组(E6)。
1.2.2 实验动物训练方案
训练组的大鼠1周适应性训练后,进行3周大运动量训练和2周减量训练。大运动量训练采用中等强度和大强度交替进行的方式在跑台上训练,运动时间逐渐延长,中等强度运动采用上坡跑,坡度10%,速度20m/min;大强度运动采用上坡跑,坡度10%,速度26m/min。根据Bedford经验公式,大鼠在跑台上的上坡跑,坡度10%,速度20m/min,相当于75%最大摄氧量(VO2max);坡度 10%,速度26m/min,相当于85%VO2max。中等强度运动时,运动时间增加;大强度运动时,运动时间减少。大运动量训练期间,每周训练6天,周1休息,训练3周。减量训练的运动强度不变,运动时间逐渐减少。3天减量训练后,训练量降低50%;6天和2周减量训练后,训练量降低67%-75%。
1.2.3 主要试剂和方法
测定PI3K p85、PI3K p110α和PI3K p110γ蛋白采用Western blotting方法。心肌组织形态学采用HE染色在光镜下观察。主要试剂有:PI3K p85、PI3K p110α和PI3K p110γ抗体从Cell Signaling公司购买,GAPDH抗体从Santa Cruz公司购买,PhosSTOP蛋白磷酸酶抑制剂、Complete mini EDTA-free蛋白酶抑制剂从Roche公司购买,苏木素伊红染色试剂盒、RIPA裂解液、PMSF等从碧云天公司购买,多聚甲醛、切片石蜡从国药集团化学试剂北京有限公司购买。不同抗体的一抗稀释比例分别为:PI3K p85为1:500、PI3K p110α为1:400、PI3K p110γ为1:500。PI3K p85二抗为抗兔,PI3K p110α二抗为抗兔,PI3K p110γ二抗为抗羊。一般二抗的稀释比例为1:10 000,室温振荡孵育1 h。
1.2.4 数据的统计学分析
数据处理应用SPSS 13.0软件,实验结果用均数±标准差(±s)表示,使用Sigma Plot 11.0软件生成图形。采用独立样本T检验,显著性检验水平用P<0.05表示。运动训练组与各自的安静对照组相比,P<0.05表明具有显著性差异。
2 结果与分析
2.1 减量训练后大鼠体重、心脏重量和心系数的变化
与3周安静对照组比较,3周大运动量训练后,大鼠体重显著降低(P<0.05);与3天对照组比较,3天减量训练后,大鼠体重显著降低(P<0.05)。与6天对照组相比,6天减量训练后,心脏重量显著降低(P<0.05)。减量训练组与安静对照组比较,心系数没有显著变化(P>0.05)(表1)。
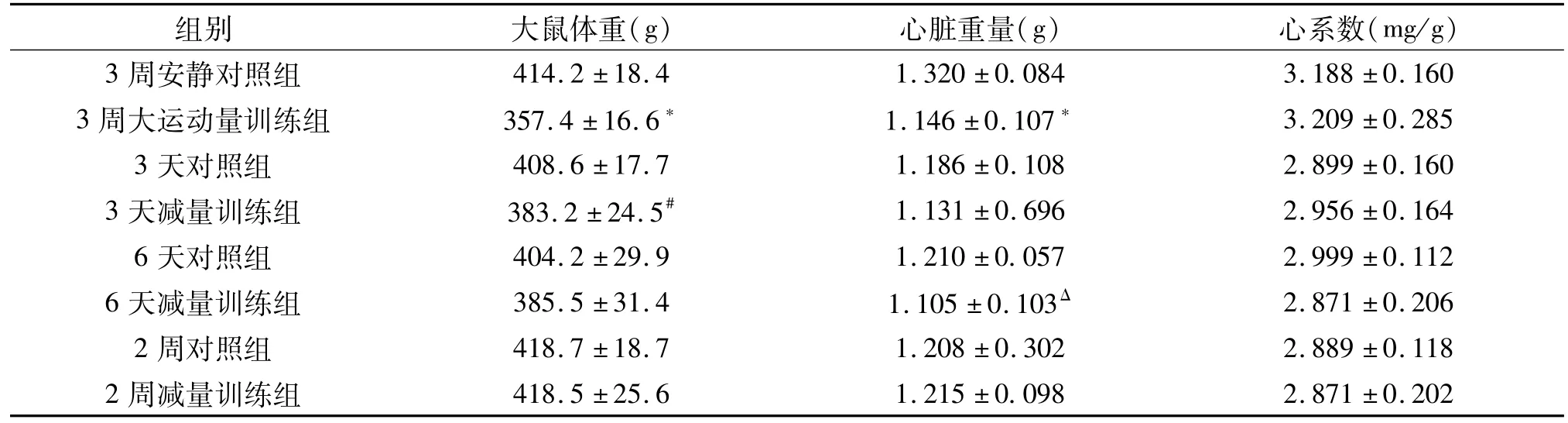
表1 各组大鼠的体重、心脏重量和心系数Table 1 The weight,heart weight and heart coefficient
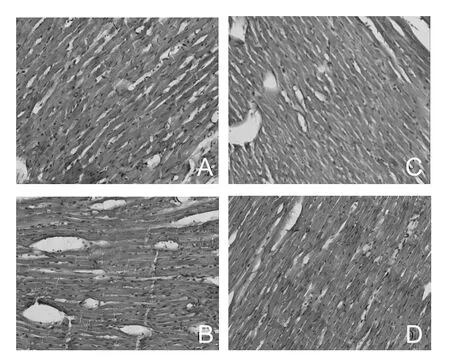
图1 大鼠心肌组织HE染色结果(×200)Figure 1 HE results of the myocardium of rats(×200)
2.2 大运动量和减量训练对大鼠心肌组织形态的影响
HE染色显示各组心肌细胞为红色,并且排列规则,从纵切面看心肌呈长圆柱状,相互连接,互连成网。核蓝染,呈长卵圆形,多核,位于细胞中央。细胞间可见毛细血管。大运动量训练和2周的减量训练后,心肌组织形态没有显著变化,未发现心肌组织损伤的形态学改变(图1)。
2.3 减量训练对大鼠心肌PI3K p85的影响
与安静对照组相比,各减量训练组的心肌PI3K p85蛋白表达无显著性变化(P>0.05)。与3周安静对照组相比,3周大运动量训练组的心肌PI3K p85蛋白表达无显著性变化(P>0.05)(图2)。
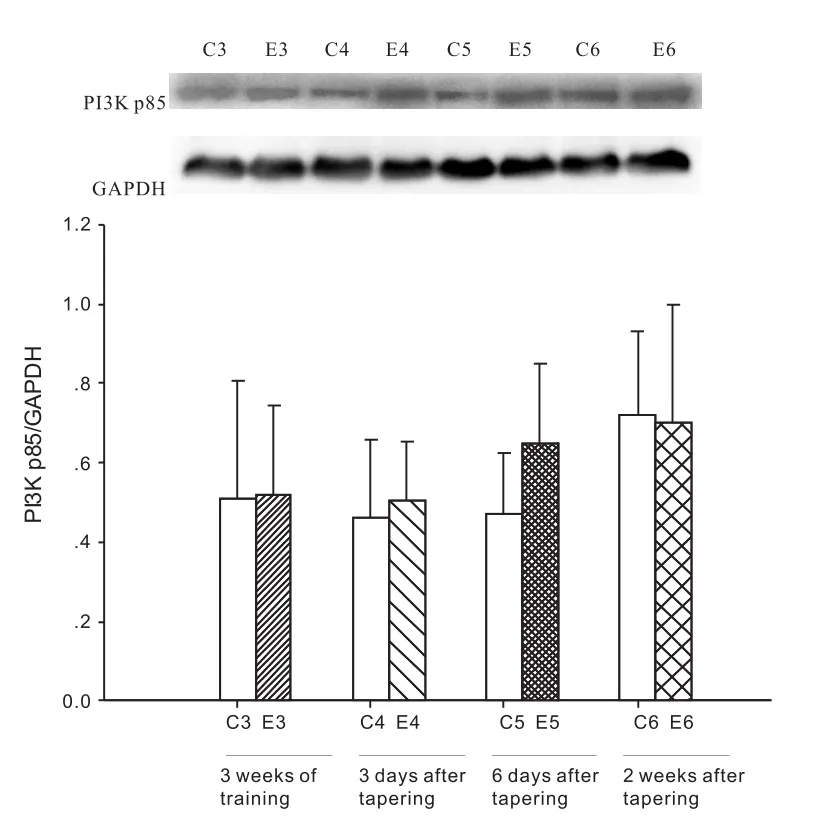
图2 3周大运动量训练和减量训练后大鼠心肌PI3K p85的变化Figure 2 The change of the myocardium PI3K p85 of rats after 3 weeks of intensive training and tapering training
2.4 减量训练对大鼠心肌PI3K p110α的影响
与3周安静对照组相比,3周大运动量训练后,心肌 PI3K p110α蛋白表达无显著性变化(P>0.05)。与6天对照组相比,6天减量训练后,心肌PI3K p110α蛋白表达显著增加(P<0.05)(图3)。
2.5 减量训练对大鼠心肌PI3K p110α/PI3K p85的影响
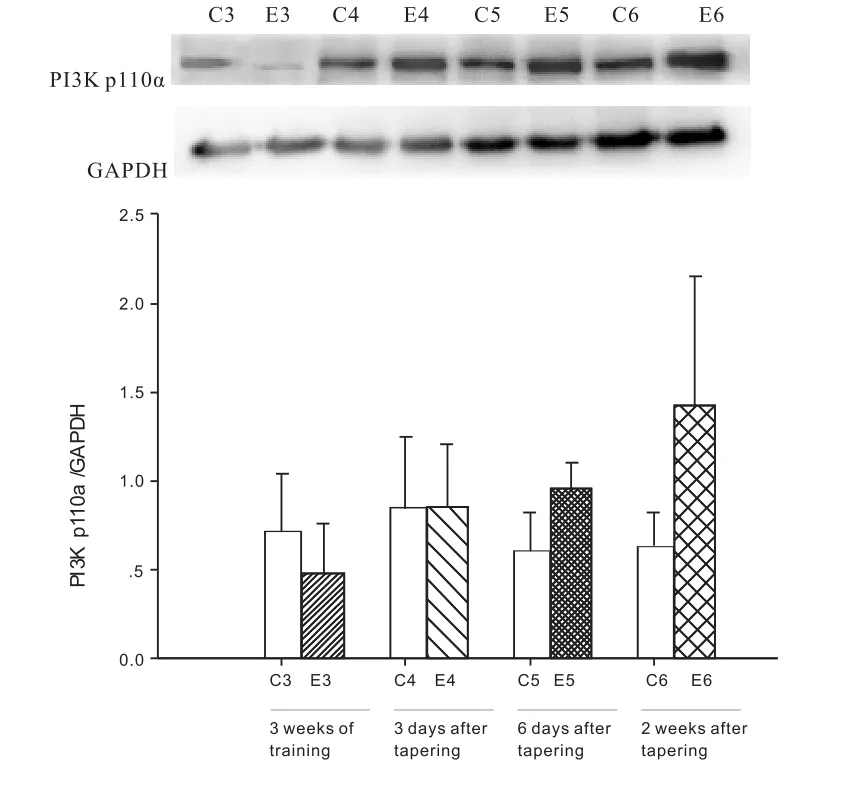
图3 3周大运动量训练和减量训练后大鼠心肌PI3K p110α的变化Figure 3 The change of the myocardium PI3K p110α of rats after 3 weeks of intensive training and tapering training
与2周安静对照组比较,2周减量训练后,心肌PI3K p110α/PI3K p85显著增加(P<0.05)。与3周安静对照组比较,3周大运动量训练后,心肌PI3K p110α/PI3K p85没有显著变化(P>0.05)(图4)。
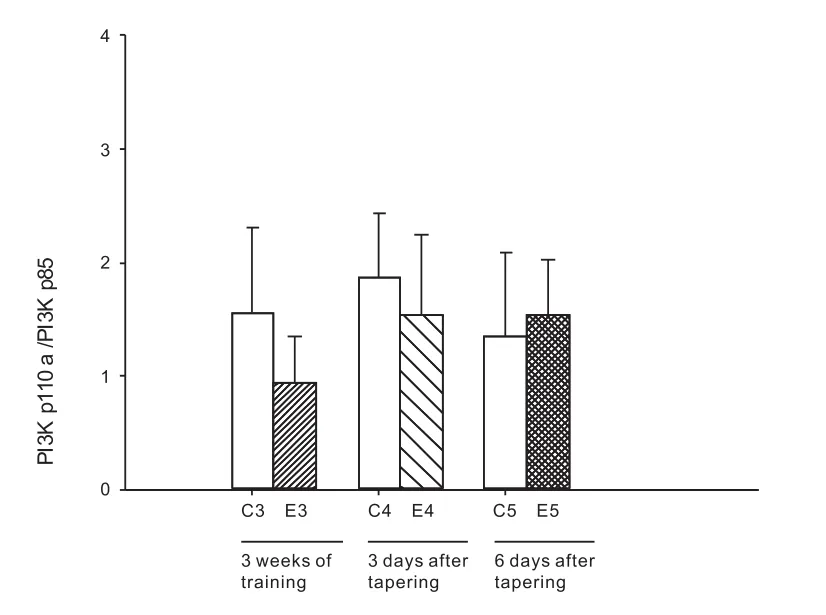
图4 3周大运动量训练和减量训练后大鼠心肌PI3K p110α/PI3K p85的变化Figure 4 The change of the myocardium PI3K p110α/ PI3K p85 of rats after 3 weeks of intensive training and tapering training
2.6 减量训练对大鼠心肌PI3K p110γ的影响
与3周安静对照组相比,3周大运动量训练后,PI3K p110γ蛋白表达无显著变化(P>0.05);与相应的安静对照组相比,减量训练后,心肌 PI3K p110γ蛋白表达无显著变化(P>0.05)(图5)。

图5 3周大运动量训练和减量训练后大鼠心肌PI3K p110γ的变化Figure 5 The change of the myocardium PI3K p110γ of rats after 3 weeks of intensive training and tapering training
3 讨论
3.1 PI3K的生物学特性
PI3K有蛋白激酶活性和脂激酶活性。在一些细胞活动中,PI3K具有重要作用,如细胞的生存、增殖、分化、迁移、代谢和NO的生成以及Ca2+流通等[1-2]。哺乳动物的PI3K可分为三种类型:I型、II型和III型。只有I型PI3K能产生 PI(3,4,5)P3,并且在心肌细胞的活性和功能上起重要作用。I型PI3K能被受体酪氨酸激酶或 G蛋白耦联受体激活。I型PI3K有IA和IB亚型,IA型PI3K由催化亚基(p110α、p110β和p110γ)和调控亚基 (p85/ p55)组成异源二聚体;催化亚基(p110γ)和调控亚基(p101)组成IB型PI3K(PI3Kγ)[2]。IA型PI3K由受体酪氨酸激酶(RTKs)和细胞因子受体激活,如IGF-1受体属于RTKs;而IB型PI3K的唯一成员PI3Kγ位于GPCR下游[3],主要通过G-蛋白耦联受体激活,如α肾上腺素受体、β2肾上腺素受体。PI3Kα和PI3Kβ在心脏和血管中表达[4],而PI3Kγ在心肌、血管平滑肌、心脏成纤维细胞和内皮细胞中表达[5]。
3.2 运动训练和减量训练对心肌PI3K的影响
PI3K p110α是 I型 PI3K的催化亚基。PI3K p110α能在长期运动训练过程中激活,在各种病理条件下,PI3K p110α对于维持心脏结构和功能很重要。在长期运动训练期间,不同病理条件下的心肌PI3Kα激活对保持心脏结构和功能起重要作用,可以很好地解释运动对心衰病人有利[6]。本论文研究发现:大鼠进行3周大运动量训练后,心肌PI3K p110α蛋白的表达无显著变化;而6天减量训练后,PI3K p110α蛋白的表达显著增加。在减量训练的过程中,心肌PI3K p110α蛋白的表达有升高趋势。大鼠进行3周大运动量训练和2周减量训练后,心肌PI3K p85蛋白的表达都没有显著变化。而在减量训练的过程中,大鼠心肌PI3K p85蛋白的表达有升高的趋势。3周大运动量训练后,心肌 PI3K p110α/PI3K p85没有显著变化;2周减量训练后,心肌PI3K p110α/PI3K p85显著增加。在减量训练的过程中,心肌PI3K p110α/PI3K p85逐渐升高。大鼠进行3周大运动量训练和减量训练没有引起心肌PI3K p110γ蛋白表达发生显著变化;在减量训练的过程中,心肌PI3K p110γ蛋白表达逐渐降低。研究发现:长期游泳训练能延长扩张型心肌病(DCM)小鼠模型的生存期。运动的DCM小鼠寿命延长取决于心脏PI3K p110α的活性。DCM小鼠心脏中PI3K p110α活性增加,与游泳训练有相同的效应。相比而言,降低心脏PI3K p110α活性,能显著加速心衰的发展。证明DCM时,PI3K p110α对保持心脏结构和功能很重要。运动训练和心肌PI3K p110α活性增加能使扩张型心肌病模型存活时间延长。相反,降低PI3K p110α活性使生存期显著缩短。增加PI3K p110α活性对压力过负荷模型的心脏功能和纤维化起重要作用。PI3K p110α信号能负性调节G蛋白偶联受体,刺激离体心肌细胞中的Akt活性。这些结果表明运动和增加PI3K p110α活性能延迟或阻止心脏疾病的发展,对生理过程有益[7]。
运动时,PI3K p110α激活。PI3K p110α对出生后心脏生长和运动诱导的生理性肥大很重要。显性负相(dn)PI3K p110α表达的变异体或调节亚基p85丧失,小鼠心脏PI3K p110α活性下降,心脏变小,而游泳训练后,肥大反应减弱[8]。有活性的(ca)PI3K p110α变异体表达,转基因(Tg)小鼠的心脏PI3K p110α活性增加,在基础状态下有生理性心肌肥大[9]。PI3K p110α位于受体酪氨酸激酶如IGF-1受体的下游。运动过程中,肽类激素释放,通过IGF-1刺激IGF-1受体,PI3K p110α激活,诱导生理性心肌肥大[10]。一些分子改变与运动的心肌保护有关,包括抗氧化物酶、热休克蛋白(Hsp70)、NO代谢物和心肌细胞增殖调节物,PI3K与运动诱导的保护相关[11-13]。在基础状态下,ca-PI3K小鼠的抗氧化过氧化氢酶、Hsps和细胞增殖标记物表达改变。很多研究表明,运动后,心脏中的Hsp70上调,Hsp70与心肌保护有关。
3.3 PI3Kα和PI3Kγ在心脏中的作用
最近的研究发现,PI3K p110α在运动诱导心肌保护上是必不可少的[14]。本论文研究发现:大鼠进行3周大运动量训练后,心肌PI3K p110α蛋白表达无显著变化;而进行6天减量训练后,心肌PI3K p110α蛋白表达显著增加。在减量训练的过程中,心肌PI3K p110α蛋白表达有升高趋势。此外,在3周大运动量训练和2周减量训练后,心肌组织形态没有显著变化,3周大运动量训练和减量训练过程中没有发现心肌组织损伤。笔者认为减量训练时,PI3K p110α对心肌有一定的作用。PI3Kα能调控心脏肥大[15]。PI3Kα活性的改变可影响心脏的大小,但不能显著影响心肌收缩力[9]。小鼠的心脏中持续表达活化型PI3Kα(ca-PI3Kα),可引起心肌细胞增大,心脏的体积增大;而在小鼠的心脏中表达显性负相的PI3Kα(dn-PI3Kα),可引起心脏的体积减小[4]。此外,表达显性负相的PI3Kα能完全阻断运动引起的心脏肥大,更进一步地说明了PI3Kα对调节心脏大小的作用。去除PI3K p110α基因,心肌细胞表面的电压依从性L型Ca2+通道数量减少,心肌收缩障碍,心脏功能下降[16]。在维持心脏的结构上和在病理情况下保持心脏的功能上,PI3Kα都起重要作用。最近,研究报道一种转基因小鼠模型能可控地过表达心肌PI3Kα,暂时性过表达PI3Kα不引起心脏肥大或心肌病,但能引起心肌收缩力增强[17]。1周压力过负荷后,dnPI3K小鼠有严重的肺充血和LV功能紊乱,而caPI3K小鼠保持良好的心脏功能。小鼠肥大反应增加伴随着心肌PI3K p110α活性降低,而抑制肥大反应伴随着心脏PI3K p110α活性升高。表明在疾病时,PI3K p110α激活能通过减弱病理性心脏生长保持心脏功能。组织学分析显示,小鼠心脏PI3K p110α活性降低,间质纤维化水平更高[18]。心血管疾病时,PI3K p110α激活对于保持心脏结构和功能很重要。PI3K p110α通过减弱LV重塑过程,如病理性心脏肥大、心肌纤维化和凋亡,保护心脏[19]。
进一步地研究显示,运动训练后,PI3Kα在心脏生理性生长中是必需的。在压力过负荷后,而非运动训练后,转基因小鼠心脏中表达显性负相PI3Kα,心脏肥大显著[20]。研究基因敲除 PI3Kγ(PI3Kγ KO)小鼠和表达无催化活性的PI3Kγ(PI3Kγ KD)小鼠,发现心脏大小没有异常改变,但激活PI3Kγ对心脏有损伤作用,心肌收缩力降低[4,17,21,22]。 在肾上腺素等刺激时,PI3Kγ KO小鼠心脏中的cAMP显著增加,心肌收缩力显著增强[4];而PI3Kγ KD小鼠心脏中的cAMP水平正常,心肌收缩力不显著改变。研究表明,PI3Kγ能调控cAMP水平,并且调控能力与其催化活性无关。本论文研究发现:3周大运动量训练和减量训练后,PI3K p110γ蛋白的表达没有显著变化。笔者认为在运动训练和减量训练过程中,心肌PI3K p110γ没有显著变化也反映了制定的运动训练和减量训练方案未造成心肌损伤。此外,从心肌形态学上看,运动训练和减量训练后,心肌组织也没有损伤的表现。
此外,PI3K-Akt信号通路在生理性心肌肥厚和病理性心肌肥厚中都能发挥作用,但是它们由不同的PI3K亚基介导。生长因子引起的生理性心肌肥厚由PI3Kα介导,并能激活Akt和下游信号;而神经、内分泌因素引起的病理性心肌肥厚由Gq/G11介导,激活 PI3Kγ。阻断 Gq/G11蛋白能使 PI3K P110γ失活,阻止心肌肥厚发展。PI3Kγ还能通过抑制受磷蛋白磷酸化引起β2AR下调,cAMP降低,SERCA-2a功能减弱,Ca2+的摄取和释放受到影响,心脏的收缩功能降低[23]。有学者认为,在病理性心肌肥大时,压力过负荷能选择性地激活PI3K p110γ,而不影响PI3K p110α[24]。研究表明,病理性心肌肥大时,PI3Kγ选择性激活,在由心肌肥大向心力衰竭转变的过程中,PI3Kγ起重要作用[25]。在活体或单个心肌细胞中,没有发生病理性心肌肥大或心肌纤维化的情况下,PI3Kγ的丧失与心肌收缩和舒张的持续增加有关[26]。由于PI3Kα和PI3Kγ在调节心脏的功能上有不同作用,因此治疗时应针对不同的PI3K亚型选择性地使用兴奋剂或抑制剂。PI3Kα对心肌细胞的生理性生长有促进作用,并能保护心肌,因此激活PI3Kα对心力衰竭有治疗作用;而抑制PI3Kγ可使病理性心肌肥厚发生逆转,有利于改善心功能。在病理性心肌肥大的情况下,运动引起的PI3Kα活化对维持心脏结构和功能十分重要,可能是心力衰竭病人通过长期锻炼使心脏功能获得改善的原因[27]。总之,无论在生理条件下,还是在病理情况下,PI3K在心脏中都起重要的作用。
4 结论
本研究制定的运动训练和减量训练方案未造成心肌损伤。减量训练通过不同亚型的PI3K影响心肌。
[1] Cantley LC.The Phosphoinositide 3-kinase pathway[J].Science,2002,296(5573):1655-1657.
[2] Vanhaesebroeck B,Guillermet-Guibert J,Graupera M,et al. The emerging mechanisms of isoform-specific PI3K signalling[J].Nat Rev Mol Cell Biol,2010,11(5):329-341.
[3] Hialmarson A,Goldstein S,Fagerberg B,et al.Effects of controlled-release metoprolol on total mortality,hospitalizations,and well-being in Patients with heart failure:the Metoprolol CR/XL Randomized Intervention Trial in congestive heart failure(MERIT -HF).MERIT-HF Study Group[J].JAMA,2000,283(10):1295-1302
[4] Crackower MA,Oudit GY,Kozieradzki I,et al.Regulation of myocardial contractility and cell size by distinct PI3K-PTEN signaling pathways[J].Cell,2002,110(6):737-749.
[5] Chavakis E,Carmona G,Urbich C,et al.Phosphatidylinositol-3-kinase-gamma is integral to homing functions of Progenito:cells[J].Circ Res,2008,102(8):942-949.
[6] McMullen JR,Amirahmadi F,Woodcock EA,et al.Protective effects of exercise and phosphoinositide 3-kinase(p110alpha)signaling in dilated and hypertrophic cardiomyopathy[J].Proc Natl Acad Sci USA,2007,104(2):612-617.
[7] Julie R.McMullen,Fatemeh Amirahmadi,Elizabeth A.Woodcock,Protective effects of exercise and phosphoinositide 3-kinase(p110α)signaling in dilated and hypertrophic cardiomyopathy[J].PNAS,2007,1(9):612-617
[8] McMullen JR,Shioi T,Zhang L,et al.Phosphoinositide 3-kinase(p110alpha)plays a critical role for the induction of physiological,but not pathological,cardiac hypertrophy[J].Proc Natl Acad Sci USA,2003,100(21):12355-12360.
[9] Shioi T,Kang PM,Douglas PS,et al.The conserved phosphoinositide 3-kinase pathway determines heart size in mice[J]. EMBO J,2000,19(11):2537-2548
[10] McMullen,J.R.,Shioi,T.,Huang,W.Y.et al.The insulin -like growth factor 1receptor induces physiological heart growth viathe phosphoinositide 3-kinase(p110α)pathway[J].J.Biol.Chem,2004,279(6):4782-4793
[11] Calvert JW.Cardioprotective effects of nitrite during exercise[J].Cardiovasc Res,2011,89(3):499-506.
[12] Melling CW,Thorp DB,Milne KJ,Krause MP,Noble EG.Exercise-mediated regulation of Hsp70 expression following aerobic exercise training[J].Am J Physiol Heart Circ Physiol,2007,293(6):H3692-H3698.
[13] Calvert JW,Condit ME,Aragón JP,Nicholson CK,Moody BF,Hood RL,Sindler AL,Gundewar S,Seals DR,Barouch LA,Lefer DJ.Exercise protects against myocardial ischemia-reperfusion injury via stimulation of S(3)-adrenergic receptors and increased nitric oxide signaling:role of nitrite and nitrosothiols[J].Circ Res,2011,108(12):1448-1458.
[14] Kate L.Weeks,BSc(Hons);Xiaoming Gao,Xiao-Jun Du,et al.Phosphoinositide 3-Kinase p110α Is a Master Regulator of Exercise-Induced Cardioprotection and PI3K Gene Therapy Rescues Cardiac Dysfunction[J].Circ Heart Fail,2012,5(4):523-534.
[15] McMullen JR,Shioi T,Zhang L.3-kinase(P110alpha)Plays a critical role for the induction of physiological,but not pathological,cardiac hypertrophy[J].Proc Natl Acad Sci USA,2003,100(21):12355-12360.
[16] Zhongju Lu,Ya-Ping Jiang,Wei Wang,et al.Loss of Cardiac Phosphoinositide 3-kinase p110α Results in Contractile Dysfunction[J].Circulation,2009,120(4):318-325
[17] Yano N,Tseng A,Zhao TC,et al.Temporally controlled overexpression of cardiac specific PI3Kalpha induces enhanced myocardial contractility-a new transgenic model[J].Am J Physiol Heart Circ Physiol,2008,295(4):H1690-1694.
[18] McMullen JR,Amirahmadi F,Woodcock EA,et al.protective effects of exercise and Phosphoinositide 3-kinase(110alpha)signaling in dilated and hypertrophic cardiomyopathy[J].Proc Natl Acad Sci USA,2007,104(2):612-617.
[19] Kate L.Owen,Lynette Pretorius,Julie R.Mcmullen.The protective effectsofexercise and phosphoinositide3 - kinase(p110alpha)in the failing heart[J].Clinical Science,2009,116(5),365-375.
[20] Cinzia Perrino,Howard A.Rockman,Massimo Chiariello.Targeted inhibition of phosphoinositide 3-kinase activity as a novel strategy to normalize beta-adrenergic receptor function in heart failure[J].Vascular Pharmacology,2006,45(2):77-85
[21] Damilano F,Perino A,Hirseh E.PI3K kinase and scaffold functions in heart[J].Ann N Y Acad Sci,2010,2(1188):39 -45.
[22] Patrucco E,Notte A,Barberis L,et al.PI3Kgamma modulates the cardiac response to chronic pressure overload by distinct kinase-dependent and -independent effects[J].Cell,2004,118(3):375-387.
[23] Le Blanc C,Mironneau C,Barbot C,et al.Regulation of vascular L-type Ca2+channels by phosphatidylinositol 3,4,5-trisphosphate[J].Circulation research,2004,95(3):300-308.
[24] Naga Prasad SV,Esposito G,MaoL,et al.G beta gamma dependent phosphoinositide 3-kinase activation in hearts with in vivo pressure overload hypertrophy[J].J Biol Chem,2000,275(7):4693-8.
[25] Esposito,G.,Rapacciuolo,A.,Naga Prasad,S.V.,et al. Genetic alterations that inhibit in vivo pressure-overload hypertrophy prevent cardiac dysfunction despite increased wall stress[J].Circulation,2002,105(1):85-92.
[26] Oudit GY,Kassiri Z.Role of PI3 kinase gamma in excitationcontraction coupling and heart disease[J].Cardiovasc Hematol Disord Drug Targets,2007,7(4):295-304.
[27] Owen KL,Pretorius L,McMullen JR.The Protective effects of exercise and phosphoinositide 3-kinase(p110alpha)in the failing heart[J].Clin Sci(Lond),2009,116(5):365-375.
The Mechanism of Tapering Influencing Cardiac Muscles Through PI3K of Different Subtypes
ZHANG Jun
Objective:To explore the cardiac muscle be affected by PI3K in the course of tapering and its mechanism. Methods:72 male SD rats were randomly divided into 8 groups after one week of adaptability training:the group that rest for 3 weeks(C3),the group that receive large amount of training for 3 weeks(E3);the group that rest for 3 days(C4)and the group that receive 3 days of tapering(E4);the group that rest for 6 days(C5)and the group that receive 6 days of tapering(E5);the group that rest for 2 weeks(C6)and the group that receive 2 weeks of tapering(E6).After 3 weeks of large amount of training and 2 weeks of tapering,the cardiac muscle of left ventricle was sampled.PI3K p85,PI3K p110α and PI3K p110γ protein was tested through Western blotting.The morphological structure of cardiac muscle organization was HE colored and observed under light microscope.Results:After 3 weeks of large amount of training and 2 weeks of tapering,no significant change occurred in the conformation of cardiac muscle organizations.No injuries were observed in the cardiac muscles. PI3K p110α protein expression increased significantly in cardiac muscles after 6 days of tapering(P<0.05). PI3K p110γ didn’t change significantly after 3 weeks of large amount of training and after tapering(P>0.05).Conclusions:The training and tapering in the project didn’t result in any injuries of the cardiac muscles.Cardiac muscles can be affected by tapering through PI3K.
Tapering,Cardiac Muscle,PI3K p85,PI3K p110α,PI3K p110γ
G804.2 Document code:A Article ID:1001-9154(2016)05-0107-06
G804.2
A
1001-9154(2016)04-0107-06
10.15942/j.jcsu.2016.05.018
(编辑 邓文骞,孙君志)
燕山大学博士基金项目“大运动量和减量训练对心肌mTOR信号通路的影响”(B920);燕山大学青年教师自主研究计划课题“运动训练和减量训练对心肌的影响机制”(15SKB009)。
张军,博士,讲师,研究方向:运动生理学,E-mail:zhangjun040140@163.com。
燕山大学,河北秦皇岛066004 Yanshan University,Qinhuangdao Hebei 066004
2015-12-26
2016-03-11

