CD4+CD25+CD127low/-调节性T细胞在1型糖尿病中表达及功能分析
刘西凤,王 勇,王芝涛,翟志敏
CD4+CD25+CD127low/-调节性T细胞在1型糖尿病中表达及功能分析
刘西凤1,王 勇1,王芝涛1,翟志敏2
目的 检测1型糖尿病(T1DM)患者外周血中调节性T细胞(Tregs)的表达及功能变化,探讨Tregs在1型糖尿病发生、发展中的作用。方法 收集36例初诊T1DM患者(T1DM组)和20例青年健康志愿者(对照组)外周血,留取血浆,密度梯度离心法分离出单个核细胞(PBMCs)。以CD4+CD25+CD127low/-作为Tregs的分子标记,分别应用流式细胞术、RT-PCR法及ELISA法检测外周血中Tregs的比例、FoxP3 mRNA表达水平及血浆细胞因子白细胞介素-10(IL-10)、转化生长因子-β(TGF-β)浓度。采用CCK-8法检测Tregs对效应性T细胞(Teffs)的增殖抑制作用。结果 初诊T1DM患者外周血Tregs比例、FoxP3 mRNA表达水平及血浆细胞因子IL-10浓度较对照组均显著降低(P<0.05)。T1DM患者外周血Tregs对Teffs的增殖抑制作用较对照组显著减弱(P<0.05)。结论 Tregs的表达和调控功能降低可能是T1DM发生和发展的重要原因。
1型糖尿病;调节性细胞;免疫耐受
1型糖尿病(type 1 diabetes mellitus,T1DM)是由自身T淋巴细胞过度活化产生的一种以胰岛β细胞进行性免疫损伤为表现的自身免疫性疾病。在其发病过程中有多种免疫细胞参与,其中自身反应性T淋巴细胞过度活化起重要作用[1]。
调节性T细胞(regulatory T cells,Tregs)是一类具有免疫调节功能的细胞亚群,于1995年Sakaguchi et al[2]在对小鼠自身免疫性疾病的研究中被首次发现。近年研究[3]显示,Tregs在维持自身免疫耐受、避免自身免疫性疾病的发生中具有重要作用。该细胞亚群可以通过细胞间直接接触或分泌抑制性细胞因子如转化生长因子-β(transforming growth factor β,TGF-β)以及白细胞介素-10(interleukin-10,IL-10)等,调控自身反应性T细胞的过度活化,防止自身免疫性疾病的发生。当其数量降低或功能缺陷时,会诱发多种自身免疫性疾病[3]。该研究旨在通过检测分析T1DM患者外周血Tregs的数量以及功能状况,探讨该细胞亚群在T1DM发生和发展中所起的作用,为该疾病的临床诊治提供新的思路。
1 材料与方法
1.1 病例资料 选择2014年12月~2015年8月于解放军第105医院初次诊断的36例T1DM患者(T1DM组),年龄12~36(22.25±6.64)岁;男20例,女16例;均符合1999年WHO糖尿病诊断及分型标准。筛选标准:①空腹血糖(FPG)≥7.0 mmol/ L(126 mg/dl);② 有糖尿病症状,并且任意时间血浆葡萄糖≥11.1 mmol/L(200 mg/dl);典型的糖尿病症状是多尿、多饮和难以解释的体重减轻;③口服葡萄糖耐量试验(OGTT)2 h血浆葡萄糖(PG)≥11.1 mmol/L(200 mg/dl)。符合上述标准之一的患者,在次日复诊仍符合3条标准之一者即诊断为糖尿病,且空腹C-肽<0.4 nmol/L,谷氨酸脱羧酶抗体(GAD-Ab)阳性。排除标准:凡伴急慢性感染、肿瘤、严重器质性疾病、妊娠以及其他自身免疫性疾病者均予排除。对照组(healthy control,HC组)20例,均为解放军第105医院健康体检中心志愿者,男10例,女10例;年龄14~33(21.45±6.94)岁,OGTT排除糖尿病,且无糖尿病家族史,无其他急、慢性疾病。两组受检者的性别、年龄差异无统计学意义。研究方案经中国人民解放军第105医院伦理委员会批准,所有受试者签署书面知情同意书。
1.2 外周血Tregs测定 抽取T1DM组患者和对照组志愿者静脉血5 ml加入肝素抗凝管,2 000 r/ min离心15 min,留存血浆2 ml于-80℃冰箱中备用。离心后剩余细胞采用Ficoll淋巴细胞分离液,密度梯度离心法分离人外周血单个核细胞(peripheral blood mononuclear cells,PBMCs),并计细胞总数。取100 μl细胞悬液(1×106)加入CD4-PE、CD25-FITC、CD127-PC5单克隆抗体各20 μl,室温避光孵育30 min后,洗涤2次,加入500 μl染色缓冲液混匀,使用流式细胞仪(FC500 MPL,美国Beckman Coulter公司)收集10 000个细胞/管,Flowjo软件获取数据,分析CD4+CD25+CD127low/-Tregs占CD4+细胞百分比。
1.3 RT-PCR法检测外周血 PBMCs中 FoxP3 mRNA表达水平 采用TRIzol试剂提取上述剩余外周血PBMCs中总mRNA,反转录为cDNA,加入25 μl Real-time PCR反应体系中。扩增条件为:95℃预变性30 s;95℃变性5 s;64℃退火45 s;72℃延伸60 s;40个循环。反应结束后根据扩增曲线和溶解曲线判断反应质量,采用2-ΔΔCt法计算T1DM组和对照组间FoxP3 mRNA的差异表达倍数,检测FoxP3 mRNA的相对表达量。人GAPDH作为管家基因,各引物序列见表1。
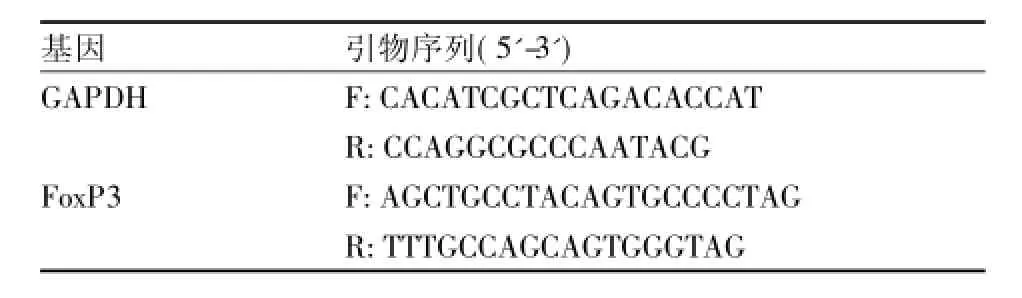
表1 人FoxP3和GAPDH引物序列
1.4 细胞因子检测 在分离T1DM组和对照组PBMCs同时,预留的血浆放置于-80℃冰箱中保存,集中待测。血浆细胞因子 IL-10、TGF-β检测采用ELISA法,试剂盒购于美国 R&D公司,并严格按照说明书进行操作。
1.5 Tregs免疫抑制功能测定 因 CD4+CD25+CD127low/-Tregs仅占PBMCs约1%,难以获取足够数量的 Tregs。细胞功能测定中,以 CD4+CD25+Tregs为研究对象。选取3例初诊T1DM患者和3例健康对照者,抽取15 ml静脉血,密度梯度离心法分离PBMCs,经CD4+CD25+Tregs细胞分离纯化试剂盒(德国Mihenyi公司)分离,并严格按照说明书操作,分离出CD4+CD25+Tregs和CD4+CD25-效应性T细胞(Teffs)。经流式细胞仪检测提示细胞纯度均在90%以上。
以10 mmol/L无菌磷酸盐缓冲液(PBS,pH 7.4)将抗人CD3单克隆抗体稀释成1 mg/L溶液,包被96孔微孔板,100 μl/孔4℃过夜,弃去反应板内液体,PBS洗板3次,每次3 min,备用。
将上述分离的Teffs与Tregs用PBS洗涤,Teffs单独培养以及按照1∶1、1∶2、1∶4、0∶1的比例接种于抗CD3包被的96孔板中,用含有10%胎牛血清的RPMI 1640培养基调至终体积为200 μl,细胞总数为1×105。再加入终浓度为1 mg/L的抗CD28抗体,每组设3孔。置于37℃、5%CO2细胞培养箱中孵育,培养5 d,加入CCK-8溶液,酶标仪测定吸光度(optical delnsity,OD)值。细胞增殖抑制率(%)=[100-(OD实验-OD本底)]/(OD对照-OD本底)。
1.6 统计学处理 采用SPSS 17.0软件进行分析,数据以表示。两组间数据的比较采用t检验。
2 结果
2.1 外周血中Tregs定量检测结果 T1DM患者和健康对照者外周血中CD4+T细胞数量差异无统计学意义(t=1.16,P>0.05);而T1DM组患者CD4+CD25+CD127low/-Tregs所占CD4+T细胞百分比较对照组显著降低,差异有统计学意义(t=-6.81,P<0.01)。见表2。
表2T1DM组和对照组外周血CD4+T细胞及Tregs百分比(%,)

表2T1DM组和对照组外周血CD4+T细胞及Tregs百分比(%,)
项目 对照组(n=20)T1DM组(n=36) t值 P值CD4+T细胞 35.97±1.21 37.71±0.84 1.16 0.252 Tregs 4.51±1.44 2.23±0.72-6.81 0.001
2.2 外周血中 Foxp3 mRNA定量检测结果Foxp3作为Tregs特异性的转录因子,对于Tregs分化发育及发挥功能具有重要作用。本实验中,T1DM组患者外周血中Foxp3 mRNA表达水平为(0.61± 0.07),与对照组(0.99±0.08)比较显著降低(t=-18.68,P<0.01)。
2.3 外周血中IL-10、TGF-β浓度定量检测结果T1DM组患者血浆IL-10浓度为(1.17±0.13)ng/ ml,对照组为(1.87±0.72)ng/ml;与对照组比较,T1DM组患者 IL-10浓度显著降低(t=13.67,P<0.01)。T1DM组患者血浆TGF-β浓度为(13.76± 3.47)ng/ml,对照组为(16.86±7.35)ng/ml。T1DM组患者血浆中TGF-β浓度虽有所降低,但差异无统计学意义。
2.4 T1DM患者外周血中Tregs免疫抑制功能分析 T1DM组患者Teffs与Tregs按照1∶1、1∶2、1∶4、0∶1的比例培养的平均抑制率分别为(50.2± 4.3)%、(26.4±3.6)%、(17.5±5.3)%、0%;对照组的平均抑制率分别为(68.5±3.9)%、(46.3± 5.1)%、(28.6±4.5)%、0%。T1DM组与对照组相比平均抑制率均明显降低,差异有统计学意义(t=-2.147,P<0.05)。
3 讨论
T1DM的发病机制较复杂,涉及遗传、免疫、年龄等多种因素,但普遍认为Teffs/Tregs细胞功能失衡可能在1型糖尿病的发病过程中起较为关键的作用。Teffs主要功能为增加胰腺免疫反应,介导对β细胞的破坏而致1型糖尿病的发生;而Tregs则发挥免疫调节、保护胰岛细胞的作用。既往研究[4]表明,Tregs过度累积、功能亢进会导致宿主产生恶性肿瘤等疾病的风险大大增加;而Tregs数量降低及功能缺陷又会诱发多种自身免疫性疾病。
研究[5-7]显示,在Graves病、类风湿关节炎、系统性红斑狼疮等自身免疫性疾病患者外周血中,Tregs数量较对照组明显降低。与先前Michalek et al[8]结果类似,本研究显示,T1DM患者外周血Tregs的数量显著降低,导致Tregs对Teffs抑制功能不足,持续激活患者体内的自身反应性T细胞,进而无法保护正常胰岛细胞受到免疫攻击,可能是1型糖尿病发病的一种起始因素。最近一项研究[9]指出,1型糖尿病患者接受直接输注Tregs的干预后,其C肽水平升高,胰岛细胞功能得到改善。
一直以来,FoxP3是较公认的Tregs的特异性标志,也是Tregs发育过程中必不可少的调控基因[10]。但是由于FoxP3在细胞内表达,只有破膜后才得以测定。而且,CD127与FoxP3相关性良好,也是反映Tregs比较理想的分子标记[11]。因此本研究中采用CD4+CD25+CD127low/-作为Tregs的免疫标记。
研究[12]表明,在多种自身免疫性疾病患者中均发现Tregs表达FoxP3 mRNA水平减少,可能导致在一定程度上对于自身反应性T细胞抑制能力降低,不足以维持自身免疫耐受,是自身免疫性疾病发病的重要因素。另有研究[13]显示,NOD鼠转导TGF-β使Foxp3 mRNA水平高表达后,胰岛内Tregs数目增多,糖尿病的发生延迟。本研究中,T1DM患者外周血FoxP3 mRNA水平较对照组显著降低,可能是1型糖尿病发病的重要原因之一。
Tregs可以通过产生具有负向调节作用的细胞因子IL-10和TGF-β,抑制Teffs过度活化,其中IL-10占主要作用[14]。IL-10作为一种负性调节因子,具有较强的免疫调控作用,主要抑制Teffs的增殖和抑制Teffs产生细胞因子如IL-2等。已有研究[15]证实,用IL-10干预NOD鼠,IL-10可上调Tregs水平,减少糖尿病的发生。本研究中,T1DM组患者细胞因子IL-10水平显著降低,从另一方面也反映了T1DM组患者Tregs存在数量降低或者功能缺陷。此外,T1DM组患者细胞因子TGF-β水平较对照组有所降低,但无统计学差异,可能与本研究中样本量偏少有关,并有待进一步研究证实。
Tregs不仅数量上降低会导致自身免疫性疾病的发生,其功能上的缺陷亦是不可忽略的重要因素[16]。Ferreira et al[17]发现,在 NOD鼠体内存在Tregs数量减少,且在发生自身免疫糖尿病之前,就已出现Tregs功能异常,表现为体外不能抑制多克隆活化的CD25+细胞增殖。本实验中,T1DM患者外周血Tregs抑制功能较对照组存在明显缺陷,Teffs的增殖活化能力增强,可能是T1DM发病的重要因素之一。
综上所述,初诊T1DM患者外周血Tregs不仅数量明显降低,其对Teffs的抑制作用亦存在明显缺陷。此外,T1DM患者外周血IL-10浓度和FoxP3 mRNA水平降低从另一方面也反映T1DM患者Tregs存在数量降低和功能缺陷。深入研究T1DM患者Tregs表达及功能状况,有可能为研究T1DM的发病机制提供新的思路。
[1] Zheng C,Zhou Z,Yang L,et al.Fulminant type 1 diabetes mellitus exhibits distinct clinical and autoimmunity features from classical type 1 diabetes mellitus in Chinese[J].Diabetes Metab Res Rev,2011,27(1):70-8.
[2] Sakaguchi S,Sakaguchi N,Asano M,et al.Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains(CD25).Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases[J].J Immunol,1995,155(3):1151-64.
[3] Brusko T M,Putnam A L,Bluestone J A.Human regulatory T cells:role in autoimmune disease and therapeutic opportunities [J].Immunol Rev,2008,223:371-90.
[4] Arpaia N,Green J A,Moltedo B,et al.A distinct function of regulatory T cells in tissue protection[J].Cell,2015,162(5):1078 -89.
[5] Pan D,Shin Y H,Gopalakrishnan G,et al.Regulatory T cells in Graves'disease[J].Clin Endocrinol(Oxf),2009,71(4):587-93.
[6] Lawson C A,Brown A K,Bejarano V,et al.Early rheumatoid arthritis is associated with a deficit in the CD4+CD25high regulatory T cell population in peripheral blood[J].Rheumatology(Oxford),2006,45(10):1210-7.
[7] Lee J H,Wang L C,Lin Y T,et al.Inverse correlation between CD4+regulatory T-cell population and autoantibody levels in paediatric patients with systemic lupus erythematosus[J].Immunology,2006,117(2):280-6.
[8] Michalek J,Vrabelova Z,Hrotekova Z,et al.Immune regulatory T cells in siblings of children suffering from type 1 diabetes mellitus[J].Scand J Immunol,2006,64(5):531-5.
[9] Marek-Trzonkowska N,Mysliwiec M,Dobyszuk A,et al.Therapy of type 1 diabetes with CD4(+)CD25(high)CD127-regulatory T cells prolongs survival of pancreatic islets-results of one year follow-up[J].Clin Immunol,2014,153(1):23-30.
[10]Yagi H,Nomura T,Nakamura K,et al.Crucial role of FOXP3 in the development and function of human CD25+CD4+regulatory T cells[J].Int Immunol,2004,16(11):1643-56.
[11]王会平,翟志敏,张爱梅,等.CD4+CD25+CD127low识别人外周血CD4+CD25+调节性T细胞的优势[J].中国免疫学杂志,2008,24(12):1059-62.
[12]Pop S M,Wong C P,Culton D A,et al.Single cell analysis shows decreasing FoxP3 and TGFbeta1 coexpressing CD4+CD25+regulatory T cells during autoimmune diabetes[J].J Exp Med,2005,201(8):1333-46.
[13]Jaeckel E,von Boehmer H,Manns M P.Antigen-specific FoxP3-transduced T-cells can control established type 1 diabetes[J].Diabetes,2005,54(2):306-10.
[14] Kaser T,Gerner W,Saalmuller A.Porcine regulatory T cells:mechanisms and T-cell targets of suppression[J].Dev Comp Immunol,2011,35(11):1166-72.
[15]Yi S,Ji M,Wu J,et al.Adoptive transfer with in vitro expanded human regulatory T cells protects against porcine islet xenograft rejection via interleukin-10 in humanized mice[J].Diabetes,2012,61(5):1180-91.
[16]孙伟莉,申 勇,李卫鹏,等.Graves'病患者CD4+CD25+调节性T细胞功能初探[J].安徽医科大学学报,2015,50(2):202-5.
[17]Ferreira C,Palmer D,Blake K,et al.Reduced regulatory T cell diversity in NOD mice is linked to early events in the thymus[J].J Immunol,2014,192(9):4145-52.
Quantitation and functional analysis of CD4+CD25+CD127low/-regulatory T cells in patients with type 1 diabetes mellitus
Liu Xifeng,Wang Yong,Wang Zhitao,et al
(Dept of Endocrinology,The 105th Hospital of PLA,Hefei 230031)
Objective To investigate the role of regulatory T cells(Tregs)in type 1 diabetes mellitus(T1DM). Methods 36 newly diagnosed T1DM patients and 20 healthy controls were involved in this study.Plasma was collected,then density gradient centrifugation was used for separation of peripheral blood mononuclear cells(PBMCs). CD4+CD25+CD127low/-was used as molecular marker for Tregs.Flow cytometry(FCM),RT-PCR and ELISA were used for detecting the Tregs frequency,FoxP3 mRNA expression and concentrations of plasma cytokines IL-10 and TGF-β.The inhibitory effect of Tregs on T effector cells(Teffs)was assayed by CCK-8 proliferation experiment.Results The expression of Tregs,FoxP3 mRNA expression and concentration of plasma cytokine IL-10 were significantly decreased in comparison with that in the healthy controls(P<0.05).The inhibitory function of Tregs from T1DM patients was decreased significantly compared with the healthy controls(P<0.05).Conclusion The decrease quantitation and function of Tregs may play an important role in the occurrence and development of type 1 diabetes mellitus.
type 1 diabetes mellitus;regulatory T cells;immune tolerance
R 587.1
A
1000-1492(2016)09-1316-04
时间:2016-8-1 14:07
http://www.cnki.net/kcms/detail/34.1065.R.20160801.1407.036.html
2016-05-04接收
国家自然科学基金(编号:81141104)
1解放军第105医院内分泌科,合肥 2300312安徽医科大学第二附属医院血液内科,合肥 230022
刘西凤,女,主治医师,责任作者,E-mail:woaiwojia0506@ 126.com

