二甲双胍对2型糖尿病模型大鼠TNF-α表达的影响
李业琼,叶山东,翟丽敏,胡 闻
二甲双胍对2型糖尿病模型大鼠TNF-α表达的影响
李业琼1,叶山东1,翟丽敏1,胡 闻2
目的 观察不同剂量二甲双胍对2型糖尿病(T2DM)模型大鼠肾组织及血清肿瘤坏死因子-α(TNF-α)表达的影响,探讨二甲双胍对糖尿病肾病的保护机制。方法 从53只SD大鼠中随机选取8只作为正常对照组(NC组),其余大鼠给予高脂饲料喂养结合链脲佐菌素(STZ)腹腔小剂量注射,建立T2DM大鼠模型。模型大鼠随机分组,分别为糖尿病模型组(T2DM组);二甲双胍干预治疗组:M1组[150 mg/(kg·d)]、M2组[300 mg/(kg·d)]、M3组[500 mg/(kg·d)];格列本脲组[GLY,5 mg/(kg·d)]。干预组给药8周后,观察各组大鼠血糖(BG)、糖化血红蛋白(HbA1c)、尿素氮(BUN)、尿白蛋白肌酐比(UACR);采用免疫组化法检测肾小球TNF-α蛋白表达,ELISA法检测血清中TNF-α的水平。结果 各剂量二甲双胍及GLY干预组BG、HbA1c、UACR和BUN明显低于T2DM组,但高于NC组(P<0.05),且M2、M3组低于M1组(P<0.05);GLY组与各剂量二甲双胍组BG、HbA1c水平比较差异无统计学意义(P>0.05);GLY与M2、M3组UACR、BUN水平比较差异有统计学意义(P<0.05)。各剂量二甲双胍及GLY干预组血清TNF-α表达水平较T2DM组明显降低(P<0.05),但高于NC组(P<0.05),M3组低于M1组(P<0.05);GLY与M2、M3组差异有统计学意义(P<0.05)。二甲双胍干预组肾脏TNF-α蛋白的含量明显下降,但高于NC组,且各干预组之间差异有统计学意义(P<0.05);GLY与M2、M3组差异有统计学意义(P<0.05)。结论 二甲双胍可减轻T2DM大鼠肾组织TNF-α的表达及血清中TNF-α的含量,并呈一定的剂量依赖性,可能与二甲双胍的肾脏保护作用有关。
2型糖尿病;糖尿病肾病;二甲双胍;TNF-α
糖尿病肾病(diabetic nephropathy,DN)是糖尿病的常见并发症之一,也是糖尿病死亡的主要原因,其基本病理改变为系膜细胞增生和细胞外基质增多、肾小球基底膜增厚与肾小球硬化。二甲双胍作为治疗2型糖尿病(type 2 diabetes,T2DM)的一线首选药物[1],近年来一些研究[2-3]显示其在降低血糖的同时具有抗炎作用且对糖尿病慢性并发症有一定益处,但具体机制尚不明确。该研究观察二甲双胍对T2DM大鼠肾组织肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的表达及血清TNF-α水平的影响,初步探讨二甲双胍对T2DM模型大鼠肾脏的保护作用及其机制。
1 材料与方法
1.1 材料
1.1.1 试剂与主要仪器 二甲双胍(上海施贵宝公司,批号:H20023370);格列本脲(glyburide,GLY)(天津太平洋公司,批号:H12020790);白蛋白放射免疫试剂盒(天津市协和公司);尿肌酐(urine creatinine,Ucr)(苦味酸法)、血尿素氮(blood urea nitrogen,BUN)(脲酶法)试剂(南京建成科技公司);胰岛素放射免疫试剂盒(北京原子高科公司);TNF-α免疫组化试剂盒(武汉博士德生物工程有限公司);血清TNF-α ELISA试剂盒(上海艾来萨生物科技公司);链脲佐菌素(streptozotocin,STZ)(美国Sigma公司)。DG-3022A型酶联免疫检测仪(江苏南京国营华东电子管厂);DS-5型糖化血红蛋白检测仪(英国DREW公司);DFM-96型10管放射免疫计数仪(安徽合肥众成机电公司)。
1.1.2 实验动物 健康清洁级SD大鼠53只,雄性,180~200 g,2月龄,购自安徽医科大学实验动物中心。在饲养期间,12 h周期规律,相对湿度48%,室温(19±1)℃,大鼠自由饮水,摄食。
1.2 方法
1.2.1 T2DM大鼠模型的制备 健康雄性SD大鼠53只随机分成两组:正常对照组(NC组,n=8)大鼠正常饲养;模型组(T2DM组,n=45)大鼠高脂饮食(常规饲料加10%猪油、2%胆固醇)。模型组给予高脂饮食4周后,经尾静脉采血测血浆胰岛素水平(fasting insulin,FINS)及空腹血糖(fasting peripheral blood glucose,FBG),并且计算胰岛素抵抗指数(ho-
1.2.2 动物分组及给药方法 去除造模失败和死亡的大鼠,将剩余42只大鼠随机分为五组:T2DM 组9只;低剂量二甲双胍组9只[M1,150 mg/(kg· d)];中等剂量二甲双胍组8只[M2,300 mg/(kg· d)];高剂量二甲双胍组8只[M3,500 mg/(kg· d)]大鼠;GLY组8只[5 mg/(kg·d)],于每日清晨灌胃,共8周。T2DM组及NC组给予等量的生理盐水。二甲双胍干预治疗后8周末,最终各组大鼠分别为:T2DM组8只;M1组9只;M2组8只;M3 组8只;GLY组8只。
1.2.3 实验指标观察 以代谢笼收集12 h尿液并且准确计量,混合均匀后留取尿液5 ml,置于-40℃冰箱冻存,测尿蛋白(urinary albumin,UAlb)、Ucr含量。尿标本收集后,进行腹腔注射麻醉(10%的水合氯醛)后,经腹主动脉采血,测血糖(blood glucose,BG)、糖化血红蛋白(hemoglobin A1c,HbA1c)、BUN和血清TNF-α。摘取双侧肾脏经生理盐水反复灌洗去除被膜,左肾组织置于液氮冻存;右肾制作石蜡切片,用来观察肾组织的病理改变。
1.3 各指标检测及方法
1.3.1 肾组织TNF-α的表达 载玻片防脱片处理;石蜡切片脱蜡水化;微波抗原修复;灭活内源性酶,滴加封闭液;滴加经稀释的一抗(兔IgG 1∶200),4℃过夜,PBS洗2 min,共3次;再滴加聚合HRP标记抗兔IgG(SV-0002)二抗,室温孵育30 min。DAB显色,苏木精轻度复染,脱水,透明,封片,观察。于400倍下,每张切片取3个视野进行拍照,图像中的阳性反应部位的累积光密度(integral optegral density,IOD)用全自动图像分析系统(Image pro plus 6.0)测定,得出每张切片阳性物质的相对含量,用TNF-α IOD表示。
1.3.2 生化指标的检测 血清TNF-α采用 ELISA法检测;BUN采用尿酶法检测;UAlb采用放射免疫分析法检测;Ucr采用苦味酸比色法检测。UAlb尿白蛋白排泄采用其与Ucr的比值表示,简称尿白蛋白肌酐比(urinary albumin/urine creatinine,UACR)。
1.4 统计学处理 采用SPSS 22.0软件进行分析,数据用表示,多组间比较采用方差分析,方差齐采用SNK检验进行两两比较;方差不齐者用Dunnett's T3检验。
2 结果
2.1 各组大鼠一般生化指标比较 8周末,各T2DM组大鼠与NC组比较,BG、HbA1c、BUN及UACR水平明显增高,差异有统计学意义(P<0.05);各剂量二甲双胍及GLY干预组与T2DM组比较,上述指标明显降低(P<0.05);M1、M2、M3三组间BG、HbA1c、BUN和UACR水平差异有统计学意义(P<0.05);GLY组与各剂量二甲双胍组BG、HbA1c差异无统计学意义;GLY组与M2、M3组UACR、BUN差异有统计学意义(P<0.05)。见表1。
2.2 各组大鼠血清TNF-α比较 8周末,各T2DM组大鼠与NC组比较,血清TNF-α水平明显增高,差异有统计学意义(P<0.05);各剂量二甲双胍及GLY干预组与T2DM组比较,血清TNF-α显著降低(P<0.05);M3组低于M1组,差异有统计学意义(P<0.05);但M2与M1、M3两组间血清TNF-α水平差异无统计学意义;GLY组与M2、M3组之间差异有统计学意义(P<0.05)。见表2。
2.3 各组大鼠肾组织TNF-α蛋白表达的变化 8周末,T2DM组、各二甲双胍组及GLY组肾组织TNF-α IOD相对表达量均较NC组增加,差异有统计学意义(P<0.05);各二甲双胍组及GLY组与T2DM组比较,肾组织TNF-α IOD水平显著降低,差异有统计学意义(P<0.05);且M1、M2、M3三组之间差异有统计学意义(P<0.05),GLY与M2、M3组之间差异有统计学意义(P<0.05)。见表2、图1。
表1 8周末各组大鼠生化指标比较()
与NC组比较:*P<0.05;与T2DM组比较:#P<0.05;与M1组比较:△P<0.05;与M2组比较:▽P<0.05
项目 n BG(mmol/L) FINS(mU/L) HbA1c(%) BUN(mmol/L) UACR(mg/g)NC组 8 4.45±1.07 17.53±3.42 4.13±0.89 6.91±2.52 0.25±0.66 T2DM组 8 15.60±1.56* 28.16±4.98* 12.41±0.61* 18.95±0.98* 2.86±0.10*M1组 9 14.44±0.70* 25.24±3.80* 11.57±0.38* 13.23±2.20*# 2.39±0.17*#M2组 8 11.75±0.98*# 22.08±2.61*# 8.78±0.32*#△ 11.30±2.02*#△ 1.80±0.08*#△M3组 8 10.58±1.03*#△ 21.55±2.29*# 8.24±0.33*#△ 10.27±1.15*#△ 1.37±0.17*#△▽GLY组 8 11.78±1.43*# 22.89±0.15*# 8.85±1.07*#△ 14.03±2.55*#△▽ 2.37±0.12*#△▽F值 76.49 6.25 153.91 24.55 278.69
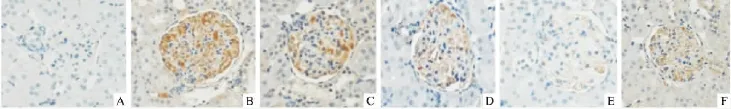
图1 各组大鼠肾组织TNF-α的表达 ×400
表2 8周末各组大鼠血清及肾组织TNF-α含量比较()
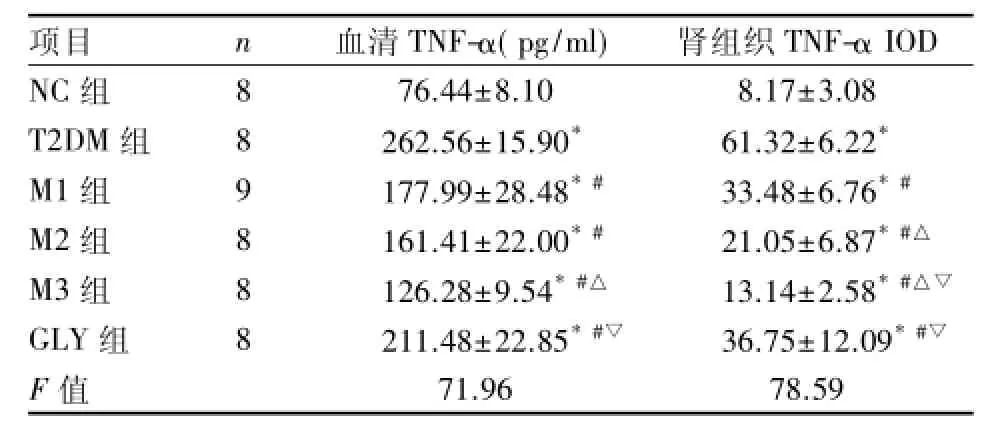
表2 8周末各组大鼠血清及肾组织TNF-α含量比较()
与NC组比较:*P<0.05;与T2DM组比较:#P<0.05;与M1组比较:△P<0.05;与M2组比较:▽P<0.05
项目 n 血清TNF-α(pg/ml) 肾组织TNF-α IOD NC组 8 76.44±8.10 8.17±3.08 T2DM组 8 262.56±15.90* 61.32±6.22*M1组 9 177.99±28.48*# 33.48±6.76*#M2组 8 161.41±22.00*# 21.05±6.87*#△M3组 8 126.28±9.54*#△ 13.14±2.58*#△▽GLY组 8 211.48±22.85*#▽ 36.75±12.09*#▽F值 71.96 78.59
3 讨论
TNF-α是一种主要由单核巨噬细胞等分泌产生的细胞因子,是机体炎症反应的重要调节因子,也是DN病情进展的强预测因子之一[4-5]。TNF-α是在糖尿病患者中最早升高的炎性因子,且在DN过程中起到关键作用[6]。研究[7]显示持续高血糖能刺激肾小球系膜细胞TNF-α、单核细胞趋化蛋白-1(MCP-1)等炎症因子合成,导致肾慢性炎症。Navarro et al[8]报道在T2DM患者肾小球微血管病变的初期血清及尿液TNF-α水平已明显升高,提示TNF-α过度表达参与了肾小球病变的发生并促进尿UAlb的产生。本研究结果显示正常组大鼠肾组织和血清中TNF-α有低度表达,而T2DM组大鼠肾组织和血清TNF-α表达明显上调,进一步证实高糖状态下糖尿病大鼠体内和肾组织局部TNF-α表达增强。
二甲双胍作为T2DM的首选抗糖尿病药物[9],近来一些研究[3]指出其对糖尿病肾脏损害尚有一定的保护作用,部分可能与其减轻体内TNF-α表达有关。Hyun et al[10]报道二甲双胍能降低巨噬细胞TNF-α的分泌。本动物实验结果显示:经不同剂量二甲双胍和GLY干预8周后,干预组BG、HbA1c、BUN及UACR水平明显低于T2DM组,两干预组BG和HbA1c水平无明显差异,但二甲双胍干预组UACR及BUN水平明显低于GLY组,提示二甲双胍在相似降血糖的情况下其肾脏保护作用优于GLY。提示二甲双胍在降糖同时对肾脏存在一定的保护作用。进一步观察显示二甲双胍及GLY组糖尿病大鼠血清TNF-α及肾组织TNF-α蛋白表达水平明显下调,呈一定的剂量依赖性,且二甲双胍的作用优于GLY,提示二甲双胍在相似降血糖的情况下可更好地降低糖尿病大鼠体内和肾组织局部TNF-α表达,进而减轻肾脏损害。二甲双胍降低糖尿病肾组织TNF-α表达的机制尚不明确。范梅琳 等[3]研究显示二甲双胍在体外可剂量依赖性地降低THP-1细胞相关炎症因子如TNF-α的分泌,提示其具有一定的直接抗炎作用,而并非完全依赖控制血糖。有研究者指出二甲双胍可剂量依赖地激活腺苷酸活化蛋白激酶(AMPK)[11-12],进而抑制NF-κB抑制因子(inhibitory NF-κB,IκB)激酶的活性,降低IκB的磷酸化和降解,从而降低 TNF-α以及 NF-κB的激活[1]。Alhaider et al[13]在转录水平证实二甲双胍可显著恢复氧化应激相关基因mRNA的表达,并抑制TNF-α和IL-6等促炎基因的表达和分泌,对糖尿病大鼠肾脏发挥保护作用。
综上所述,本实验初步结果显示二甲双胍可降低糖尿病大鼠肾组织TNF-α蛋白的表达和降低血清TNF-α的水平,并且呈一定的剂量依赖性,该作用可能与其肾脏保护部分有关,具体机制还有待进一步研究。
[1] Zhou X,Wang B,Zhu L,et al.A novel improved therapy strategy for diabetic nephropathy:targeting AGEs[J].Organogenesis,2012,8(1):18-21.
[2] Hyun B,Shin S,Lee A,et al.Metformin down-regulates TNF-α secretion via suppression of scavenger receptors in macrophages[J].Immune Netw,2013,13(4):123-32.
[3] 范梅琳,刘云峰,章 毅,等.二甲双胍对脂多糖诱导的THP-1细胞相关炎症因子及凋亡的影响[J].中华内分泌代谢杂志,2013,29(9):801-5.
[4] Niewczas M A,Gohda T,Skupien J,et al.Circulating TNF receptors 1 and 2 predict ESRD in type 2 diabetes[J].J Am Soc Nephrol,2012,23(3):507-15.
[5] Yeo E S,Hwang J Y,Park J E,et al.Tumor necrosis factor(TNF-alpha)and C-reactive protein(CRP)are positively associated with the risk of chronic kidney disease in patients with type 2 diabetes[J].Yonsei Med J,2010,51(4):519-25.
[6] 张 颖.二甲双胍联合阿卡波糖对T2DM患者炎症因子和稳态模型胰岛素抵抗指数的作用研究[J].医药论坛杂志,2013,34(12):28-9.
[7] Yamagishi S,Takeuchi M,Inagaki Y,et al.Role of advanced glycation end products(AGEs)and their receptor(RAGE)in the pathogenesis of diabetic microangiopathy[J].Int J Clin Pharmacol Res,2003,23(4):129-34.
[8] Navarro J F,Mora C,Gómez M,et al.Influence of renal involvement on peripheral blood mononuclear cell expression behaviour of tumour necrosis factor-alpha and interleukin-6 in type 2 diabetic patients[J].Nephrol Dial Transplant,2008,23(3):919-26.
[9] Viollet B,Guigas B,Sanz G N,et al.Cellular and molecular mechanisms of metformin:an overview[J].Clin Sci(Lond),2012,122(6):253-70.
[10]Hyun B,Shin S,Lee A,et al.Metformin down-regulates TNF-α secretion via suppression of scavenger receptors in macrophages[J]. Immune Netw,2013,13(4):123-32.
[11]Hattori Y,Suzuki K,Hattori S,et al.Metformin inhibits cytokine-induced nuclear factor kappaB activation via AMP-activated protein kinase activation in vascular endothelial cells[J].Hypertension,2006,47(6):1183-8.
[12]Kim S A,Choi H C.Metformin inhibits inflammatory response via AMPK-PTEN pathway in vascular smooth muscle cells[J].Biochem Biophys Res Commun,2012,425(4):866-72.
[13]Alhaider A A,Korashy H M,Sayed-Ahmed M M,et al.Metformin attenuates streptozotocin-induced diabetic nephropathy in rats through modulation of oxidative stress genes expression[J].Chem Biol Interact,2011,192(3):233-42.
Effects of metformin on expression of renal tissue and serum level of TNF-α in type 2 diabetic rats
Li Yeqiong,Ye Shandong,Zhai Limin,et al
(Dept of Endocrinology,Affiliated Provincial Hospital of Anhui Medical University,Hefei 230001)
Objective To observe the effects of different doses of metformin on the expression of renal tissue tumor necrosis factor-α(TNF-α)and serum levels of TNF-α in Type 2 diabetes(T2DM)model rats and discuss the mechanism of the metformin in the protection against diabetic renal injury.Methods 8 rats were randomly selected in 53 SD rats as the normal control group(NC).The remaining rats were fed with high fat-diet and intraperitoneal injection of low dose of streptozotocin(STZ)to establish the model rats of T2DM.All model rats were randomly divided into T2DM model group(group T2DM),metformin groups[M1,150 mg/(kg·d);M2,300 mg/(kg·d);M3,500 mg/(kg·d)]and glyburide group[GLY,5mg/(kg·d)].The rats of metformin and GLY groups continuously received treatment fro eight weeks.After 8 weeks,blood glucose(BG),glycated hemoglobin(HbA1c),BUN and urinary albumin/urine creatinine(UACR)were detected.The expression of renal tissue TNF-α was detected by using immunohistochemistry assay.The levels of serum TNF-α was tested by ELISA.Results The levels of BG,HbA1c,UACR and BUN in Metformin and GLY groups were significantly decreased than those of T2DM group,while higher than those of NC group(P<0.05).The levels of BG and HbA1c were not statistically significant between GLY and MET groups;the levels of UACR and BUN in Metformin groups were significantly lower than GLY group.The levels of serum TNF-α in Metformin and GLY groups were significantly decreased compared with that of T2DM group(P<0.05),but higher than that of NC group(P<0.05),which in M3 were lower than that in M1 group(P<0.05),the levels of serum TNF-α in MET groups were significantly lower than GLY group(P<0.05).The expression of renal tissue TNF-α protein was significantly decreased compared with that of T2DM group,which also had significant differences among different doses of metformin groups(P<0.05),and the expression of renal tissue TNF-α protein in MET groups was significantly lower than GLY group(P<0.05).Conclusion Metformin can suppress the expression of renal tissue TNF-α and reduce the serum TNF-α level of type 2 diabetic rats with a dose-dependent manner,which may partly contribute to its reno-protection.
type 2 diabetes;diabetic nephropathy;metformin;TNF-α
R 977.15;R 587.24
A
1000-1492(2016)09-1312-04
时间:2016-8-1 14:07
http://www.cnki.net/kcms/detail/34.1065.R.20160801.1407.034.htmlmeostasis model assessment-insulin resistance,HOMAIR)[HOMA-IR=(FBG×FINS)/22.5]。给予30 mg/ kg的STZ(溶解于现配的0.1 mmol/L枸橼酸缓冲液中,pH 4.4)腹腔注射,正常对照组大鼠注射等量枸橼酸缓冲液。稳定72 h后测随机血糖≥16.7 mmol/L,且伴胰岛素抵抗者为2型糖尿病模型成功大鼠。
2016-05-04接收
安徽高校省级自然科学研究项目(编号:KJ2011A157);安徽省自然科学基金(编号:1508085SMH227)
安徽医科大学附属省立医院1内分泌科、2病理科,合肥
230001
李业琼,女,硕士研究生;叶山东,男,主任医师,教授,博士生导师,责任作者,E-mail:ysd196406@163.com

